INTRODUCTION
식이요법이 동물의 다양한 조직에서 유전자 발현을 조절할 수 있다는 연구가 보고되고 있다[1, 2]. 사료는 육계 생산 비용의 약 70%를 차지하기 때문에 사료를 통해 육계의 성장 효율을 개선할 필요가 있다[3]. 실제로 사료 효율의 개선은 육계의 성장 기간이 단축되고 생산 비용이 낮아진다[4]. 이때 사료 주성분 중 하나인 조단백질의 다량 섭취는 암모니아와 혈액 내 요소 질소를 증가시킨다[5, 6]. 또한, 높은 조단백질 수치는 간 해독 메커니즘을 활용하고 요소 합성을 위한 에너지 수요를 증가시킴으로써 가축의 추가적인 스트레스를 야기한다[7]. 특히, 조단백질 감소 식단은 대두박 함유량이 감소함에 따라 피테이트 함량이 낮아지는 반면 피타아제(인산분해효소)는 아미노산 소화율과 흡수를 향상시키는 것으로 보고되었다. 따라서 식이 기질의 감소에도 불구하고 인산분해효소는 단백질-피테이트 복합체 형성을 감소시켜 단백질 결합 아미노산의 소화율을 향상시키고 아미노산 흡수도 향상시킨다[8, 9]. 사료 주성분의 최적 사용은 가축의 영양 및 환경 문제를 극복하는 데 도움이 되고, 사람이 안전하게 섭취할 수 있도록 한다.
육계 사료는 외인성 효소를 사용하기 위하여 다양한 연구가 되어왔다[9–12]. 비전분 다당류는 어린 가금의 소화에 문제를 일으키며[13], 인산(P)은 정상적인 성장과 대사에 관여하는 가금류의 필수 다량 영양소이다[14]. 인산의 소화율을 향상시키기 위해 상업용 가금류 사료의 사료 주성분으로 사용된다. 가금사료 내 인산분해효소의 첨가는 지방, 단백질 및 전분의 소화율 증가로 나타난다. 이외에도 사료효율을 증가시켜 분변 내 질소와 인의 배출을 감소시킨다. 특히, 에너지 이용성에 대한 인산분해효소 첨가 효과는 육계에서 사료의 대사에너지를 증가시킨다[14–17]. 가금사료 내 조단백질 감소는 대두박의 감소와 사료 곡물(옥수수 또는 밀) 함량의 증가와 요구사항을 충족하기 위한 비결합(결정성 및 합성) 아미노산의 함유량 증가를 기반한다. 더 적은 자원을 사용하여 지속 가능한 육계 생산에 대한 실질적인 이점은 질소 및 암모니아 배출 감소, 깔짚 품질 개선, 조류 복지 강화에 있다[18].
본 연구는 육계 1주령 48수의 혈액으로부터 조단백질과 인산분해효소 급여에 따른 차등 발현 유전자군을 발굴하고 그 기능을 살펴봄으로써 육계의 에너지 대사를 이해하고자 한다.
따라서 본 연구에서는 다음과 같은 가설을 설정하였다. 가설: 1주령 육계에서 사료 내 조단백질 및 인산분해효소(phytase) 수준을 감소시키면 혈액 전사체에서 에너지 및 질소 대사, 면역·염증 조절과 관련된 유전자 발현이 체계적으로 변화한다. 이 가설을 검증하기 위한 구체적인 연구목적은 다음과 같다. (1) 1주령 육계 48수를 대상으로 조단백질(22% vs. 20%)과 인산분해효소(1,000 vs. 500 ppm) 수준을 조합한 4개 사료 처리구를 설정하고 각 처리구 혈액 전사체를 비교하여 차등 발현 유전자(DEGs)를 규명한다. (2) 각 처리구(인산분해효소만 감소, 조단백질만 감소, 두 성분 동시 감소)에 특이적인 혈액 DEGs를 선별하고 Gene Ontology와 KEGG pathway 분석을 통해 대사·면역 관련 생물학적 기능을 규명한다. (3) 조단백질 및 인산분해효소 수준 변화에 따라 나타나는 주요 대사·면역 경로의 변화를 기존 연구 결과(특히 조단백질 사료 및 인산분해효소 관련 최신 연구)와 비교·고찰함으로써, 초기 생육 단계 육계의 영양 전략 수립과 환경부하 저감에 대한 분자생물학적 근거를 제시한다.
MATERIALS AND METHODS
실험에 이용된 1주령 닭의 시료 채취는 국립축산과학원 동물실험위원회 운영 규정에 따라, 동물실험 계획승인 심사를 받아 실행하였다(동물실험승인번호: 2022-548). 육계 1주령 48수 영양수준 4개 그룹(각 그룹별 12수)의 각 개체별 혈액 샘플로부터 RNA를 추출해서 Illumina TruseqTM RNA sample preparation kit(Illumina, San Diego, CA, USA)를 사용하여 cDNA 합성 후 RNA-seq 라이브러리를 구축하였다(Table 1). 구축된 라이브러리는 Illumina Hiseq 2000 플랫폼을 사용하여 2 × 150 bp로 RNA 시퀀싱하였다. 육계 1주령 48수의 혈액 샘플마다 6.0 Gb 이상, 총 288 Gb의 RNA-seq raw data를 생성하여 전장 전사체 서열 분석을 실행하였다.
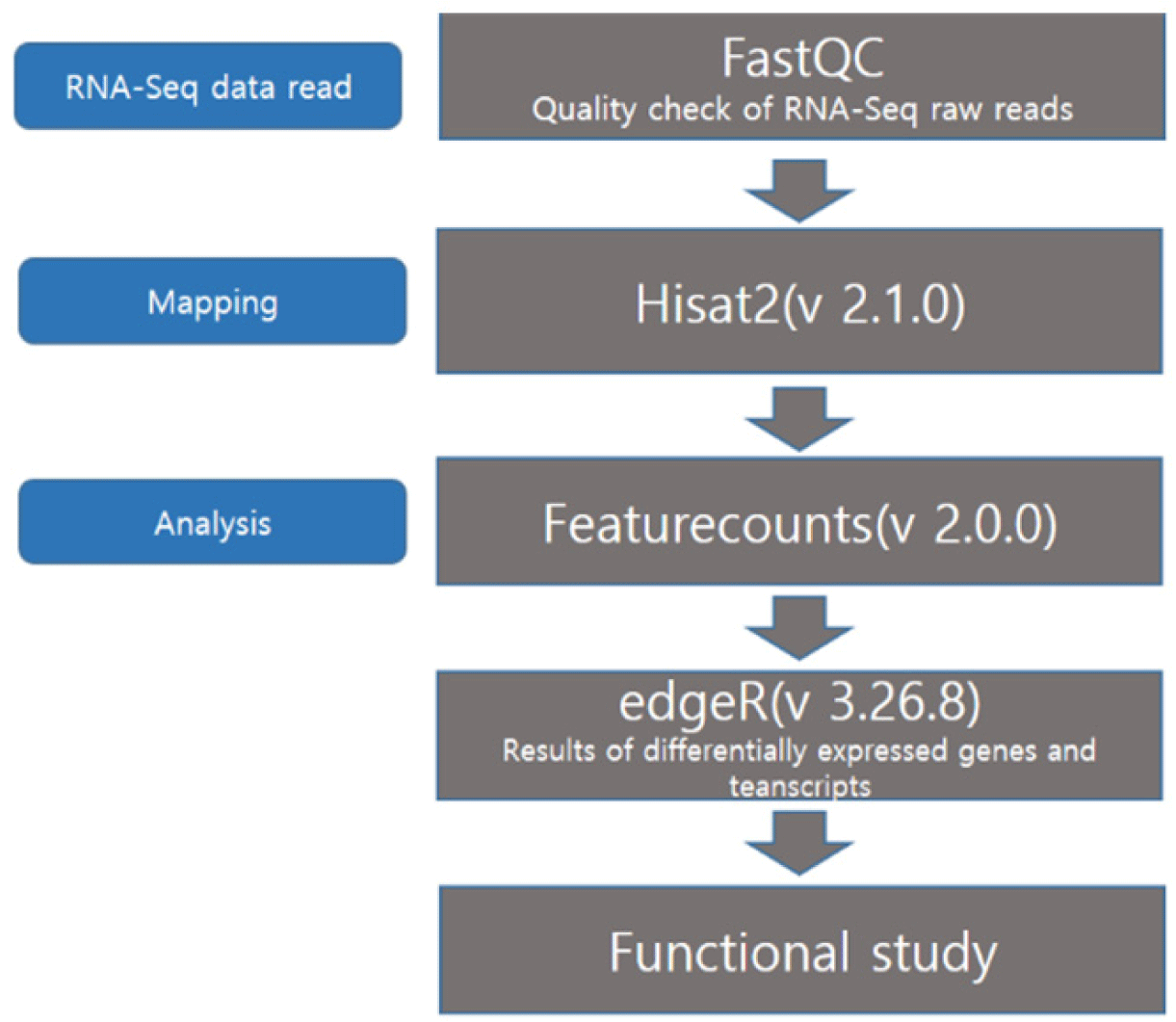
전장 전사체 서열 분석에 의하여 생성된 RNA-seq read의 전처리 과정으로 FASTQC version 0.11.8(www.bioinformatics.babraham.ac.uk/projects/fastqc), Trimmomatic 프로그램(version 0.39)을 사용하여 trimming을 수행하였다. 전처리 과정을 통과한 cleaned read를 HISAT2(version 2.1.0)(10)를 통해 닭 참조 서열(Gallus gallus 6.0)에 서열정렬(mapping)하였다. 정렬된 read는 samtools 프로그램(version 1.9)과 FeatureCounts(version 2.0.0)를 통해 유전자 발현 정도(log2 CPM, log2-transformed normalized counts for million)를 계산하였다.
다음으로 그룹 간의 차등 발현 유전자는 edgeR(version 3.26.8)을 이용하여 비교하였다. 맹장에서 영양수준에 따른 4개 그룹의 유전자 발현 정도를 TMM(trimmed means of M valuses)으로 정량하여 수치화하였다(Fig. 1). 각각의 처리군 2개 그룹을 대조군 그룹 간 비교하여 통계적으로 의미가 있는(p-value<0.05) 차등 발현 유전자를 선별하였다. 그 후, 차등 발현량 비교 결과를 ggplot2(version 3.3.6)과 R(version 3.6.0)을 이용하여 시각화하였다. Fig. 1은 분석 순서와 분석 과정에서 사용된 프로그램 및 버전을 정리한 순서도이다.
RESULTS
육계 1주령에서 영양수준(조단백질과 인산분해효소의 함량)에 따른 혈액으로부터 추출한 RNA를 이용하여 전사체 분석을 Illumina Hiseq을 수행하였다. 육계 1주령 48수의 혈액 샘플마다 6.0 Gb 이상, 총 288 Gb의 paired end read들을 얻었다. 전처리 과정을 진행한 후, 닭의 참조서열에 맵핑한 결과는 94.96%–95.85%로 Table 2와 같다. 대조군(HH)을 기준하여 처리군1(HL), 처리군2(LH), 처리군3(LL) 총 4개의 그룹을 구성했다. 대조군 사료의 조단백질 함량은 CP 22%, 인산분해효소 함량은 1,000 ppm이다. 처리군1(HL)은 인산분해효소 함량이 감소(1,000 ppm에서 500 ppm으로 총 500 ppm 감소)한 사료를 급여한 그룹, 처리군2(LH)는 조단백질 함량이 감소(22%에서 20%로 총 2% 감소)한 사료를 급여한 그룹, 처리군3(LL)는 조단백질과 인산분해효소가 모두 감소한 사료(조단백질 함량은 CP22 %에서 CP20%로 총 2% 감소, 인산분해효소의 경우 1,000 ppm에서 500 ppm으로 총 500 ppm 감소)를 급여한 그룹이다.
A control group of HH (dietary crude protein 22 %, added phytase 1,000 ppm) and two treatment groups of HL (dietary crude protein 22%, added phytase 500 ppm) and LL (dietary crude protein 20%, added phytase 500 ppm) according to the nutritional level in the feed as Table 1.
육계 1주령의 RNAseq-reads는 주석 정보를 이용하여 전체 유전자 영역에 맵핑하여 총 20,974개 전사체를 선별했다. 선별한 전사체는 TMM으로 보정하여 다차원 적도법(multidimeninal scaling, MDS) 방법으로 다차원 공간상에 있는 각 개체의 거리를 최대한 보존하면서 각 그룹 내 개체들 사이의 유사성/비유사성을 측정하였다. 2차원 공간으로 표현한 결과, 이용하였을 때 두 그룹간 사이의 개체들이 명확하게 구분되지 않았지만 두 그룹 내의 개체 간의 근접 영역에 분포해 있다(Fig. 2).

1주령 육계의 혈액에서 처리군1(HL) 영양수준에 따른 731개 차등 발현 유전자를 확인하였다 (p-value<0.05). 인산분해효소만이 감소했을 때 501개 유전자의 발현이 증가했고, 230개 유전자의 발현이 감소했다(Fig. 3A).
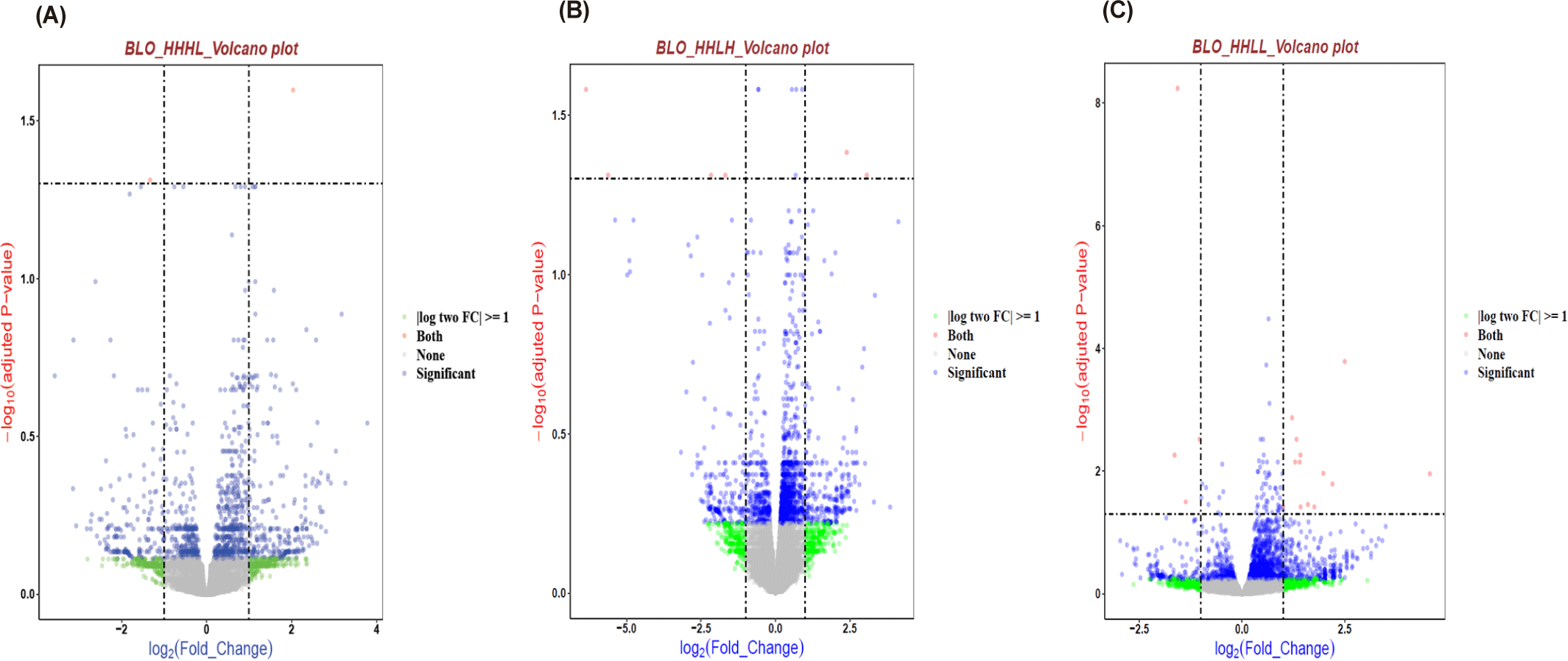
처리군2(LH) 영양수준에 따라 1,025개 차등 발현 유전자를 확인하였다(p-value<0.05). 조단백질만이 감소했을 때 790개 유전자의 발현이 증가했고, 235개 유전자의 발현이 감소했다. 이 중 RGN, IMPG1 유전자 발현이 증가했고 CEP76 유전자 발현이 감소했다(Fig. 4B). RGN은 세포 내 칼슘 항상성 및 산화 스트레스 방어에 관여하는 것으로 알려져 있으며[19] 조단백질 감소 조건에서 발현이 증가한 것은 저단백질 환경에서 산화 스트레스 조절이 강화될 가능성을 시사한다. IMPG1 유전자는 지방 생산량과 관련이 있는 것으로 보고되었으며[20] 혈액에서의 발현 증가 양상은 단백질 사료에서 에너지 공급원으로서 지질대사 의존도가 증가할 가능성과 연결될 수 있다. CEP76는 중심체 관련 단백질로, 세포 주기와 세포 분열 조절에 관여하는 것으로 알려져 있다[21]. 본 연구에서 CEP76 발현 감소는 저단백질 사료에 대한 세포 주기 및 증식 관련 적응 반응의 일부일 수 있으며 성장률, 조직 발달 등과의 연관성은 향후 조직 수준 분석을 통해 추가 검증이 필요하다. 반면, 처리군3(LL) 영양수준에서 1,084개 차등 발현 유전자를 확인했다(p-value<0.05). 인산분해효소와 조단백질 모두가 감소했을 때 850개 유전자의 발현이 증가했고, 233개 유전자 발현이 감소했다(Fig. 3C).
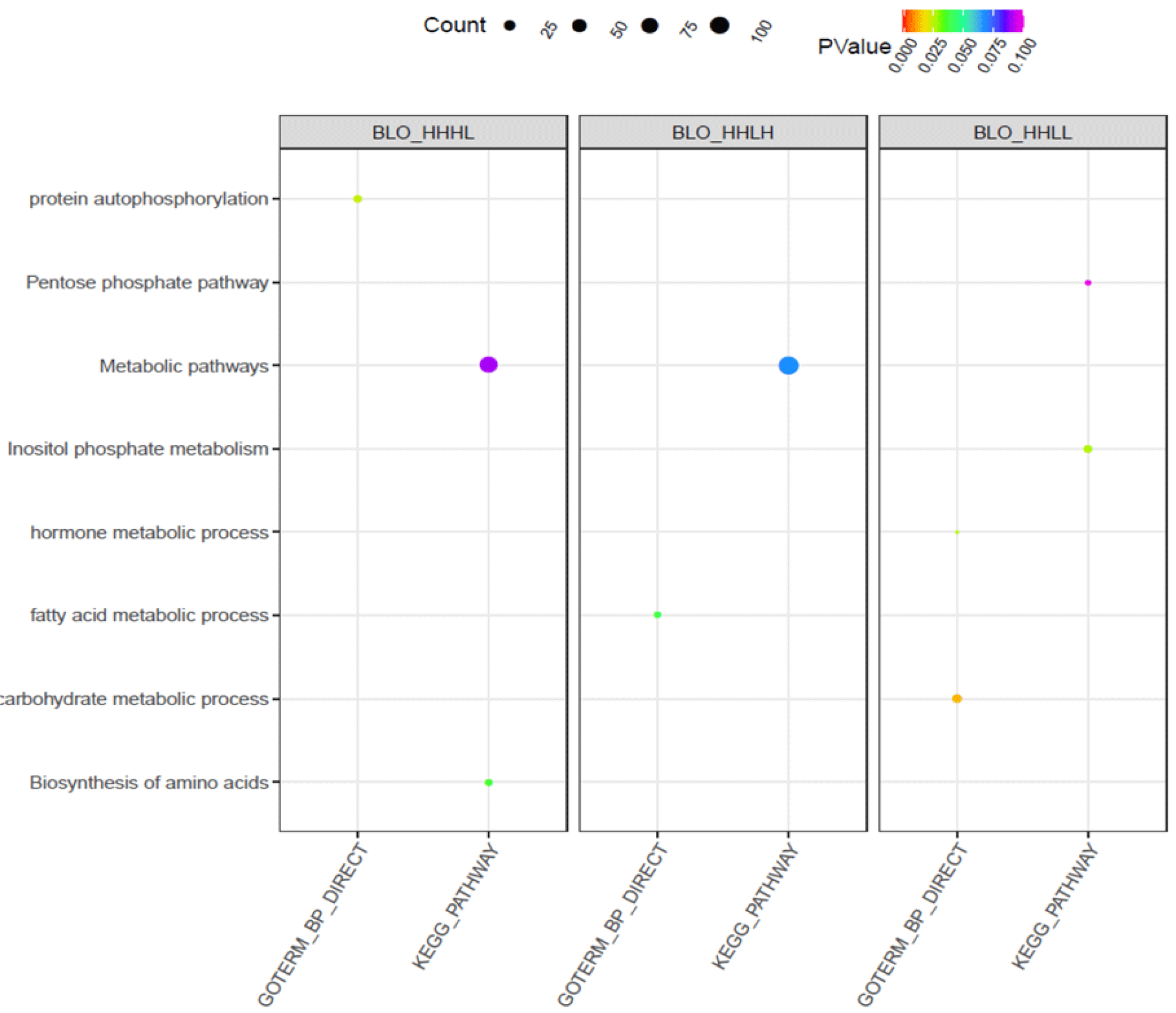
대조군(HH) 대비 각 처리군(HL, LH, LL)에서 발현 차이를 나타내는 유전자를 대상으로 Gene Ontology, DAVID 방법을 적용하여 기능분석을 추가하였다(Fig. 4). 육계 1주령 혈액에서 처리군1(HL)에 따른 501개 차등 발현 유전자의 반응경로를 분석한 결과(p-value<0.05, EASE < 0.1), 단백질 자가 인산화(protein autophosphorylation) 반응에 11개 유전자, 대사경로(metabolic pathways) 84개 유전자, 아미노산 생합성(biosynthesis of amino acid) 8개 유전자 등에 관여했다. 단백질 자가인산화 반응은 세포증식, 분화, 대사, 이동 및 생존 등 세포신호전달을 조절하기 위해 필수적이다[22].
육계 1주령 혈액에서 처리군2(LH)에 따른 1,025개 차등 발현 유전자의 반응경로를 분석한 결과(p-value<0.05, EASE < 0.1), 지방산 대사 과정(fatty acid metabolic process) 7개 유전자, 대사경로(metabolic pathways) 110개 유전자에 관여했다. 처리군3(LL)에 따른 총 1,084개 차등 발현 유전자의 반응경로를 분석한 결과 (p-value<0.05, EASE < 0.1), 인산이노시톨 대사(inositol phosphate metabolism) 11개 유전자, 스테로이드 생합성(pentose phosphate pathway) 5개 유전자, 호르몬 대사 과정(hormone metabolic process)에 4개 유전자, 탄수화물 대사 과정(carbohydrate metabolic process)에 15개 유전자 등에 관여했다. 총 40개 차등 발현 유전자의 반응경로를 분석 결과(p-value<0.05, EASE < 0.1), 사이토카인-사이토카인 수용체 상호작용(cytokine-cytokine receptor interaction) 반응 관련 유전자 TNFRSF21, IL10RB, IL6R가 확인됐다(Fig. 5). 영양상태에 따른 사이토카인-사이토카인 수용체 경로는 조류의 지질 대사, 세포 성장, 분화 및 면역/염증 조절에 관여한다[23].
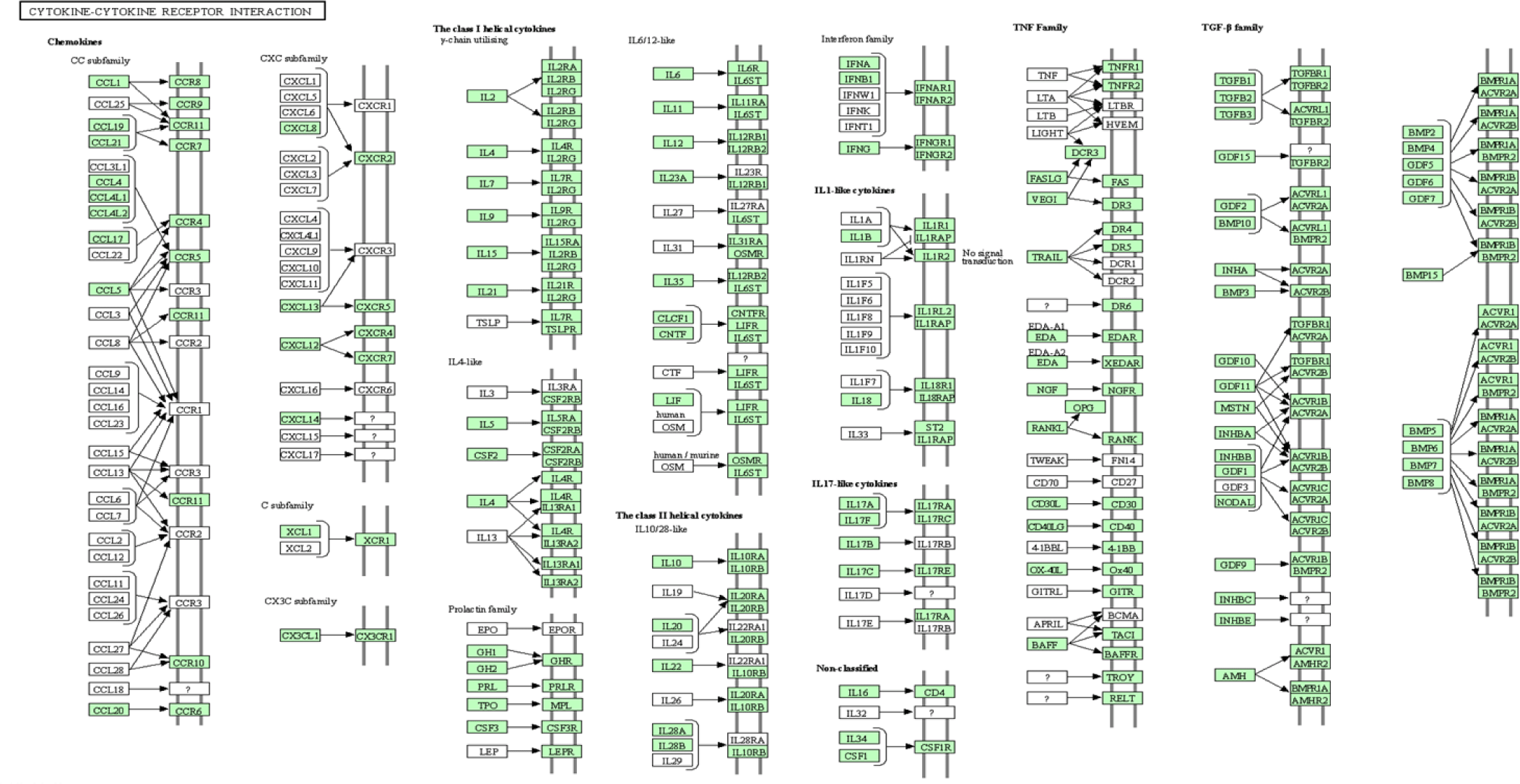
Table 3은 대조군(HH) 대비 각 처리군(HL, LH, LL)에서 발현 차이를 나타내는 유전자(p-value<0.05) 731개, 1,025개, 1,084개를 대상으로 Gene Ontology, DAVID 방법을 적용하여 공통된 생물학적 기능분석(EASE < 0.05)을 확인하였다. 그 결과, 면역 반응(immune response) 관련 20개 유전자, 세포 모양의 조절(regulation of cell shape) 관련 14개 유전자, 해당과정(glycolytic process) 6개 유전자, 글리세롤지질 대사 과정(glycerolipid metabolic process) 4개 유전자가 관여했다.
It is according to the difference about decreasing phytase (from 1,000 ppm to 500 ppm) content of control group HH vs treatment HL, crude protein (from 22% to 20%) contents of control group HH vs treatment LH. Finally, it is according to the crude protein (from 22% to 20%) and phytase (from 1,000 ppm to 500 ppm) contents of control group HH vs treatment LL in blood.
DISCUSSION
이 연구에서 조단백질과 인산분해효소 수준을 조합한 4개 처리구의 혈액 전사체를 분석한 결과, 에너지·아미노산·지질 대사와 면역·염증 조절 관련 경로가 유의하게 변화하였다. 이러한 결과는 최근 발표된 조단백질·인산분해효소 관련 연구들과 비교했을 때 다음과 같은 의미를 갖는다.
Asiamah 등[24]은 broiler에서 reduced crude protein diet가 간 전사체에서 PPAR 신호전달과 지질 대사 관련 유전자(ACSL6, ME1, IGFBP2, HSD3B1 등)의 발현을 변하게 하며 단백질 이용 효율 증가를 동반한 대사 적응을 유도한다고 보고하였다. 본 연구에서도 혈액에서 지방산 대사와 대사경로 관련 DEGs가 유의하게 풍부해져, 조단백질 사료가 간뿐만 아니라 혈액 수준에서도 에너지·지질 대사 조절을 유도한다는 점을 뒷받침한다. Son 등[25]은 welfare-friendly 환경에서 조단백질을 단계적으로 저감할 경우 생산성에는 큰 영향을 주지 않으면서 질소 이용률과 복지 지표가 개선된다고 보고하였다. 본 연구에서 확인한 immune response 및 hormone metabolic process 관련 유전자의 변화는 이러한 생리·복지 개선 효과의 분자생물학적 기반을 제공할 수 있다. Nuamah 등[26]의 메타분석에 따르면 P·Ca 결핍 사료에 인산분해효소를 첨가하면 성장률, 사료요구율, 골 무기질화가 개선되고 특히 starter 단계에서 효과가 크다. HL 처리에서 단백질 자가 인산화(protein autophosphorylation) 관련 유전자들이 풍부하게 나타난 것은 인산분해효소 감소에 대한 초기 반응으로 세포 내 신호전달 네트워크가 재조정되고 있음을 시사한다. 단백질 인산화는 세포 증식, 분화, 대사, 이동 및 생존 등 다양한 세포 기능 조절에 필수적인 기전으로 알려져 있으며[22] phytase 수준 변화에 따른 인·이노시톨 대사 변화가 세포 내 신호전달에 연쇄적인 영향을 줄 수 있다. HL와 LH, LL 처리에서 공통적으로 대사 경로(metabolic pathways)와 아미노산 생합성(biosynthesis of amino acids), 해당과정(glycolytic process) 관련 유전자들의 발현이 변화하였다. 이는 조단백질 및 인산분해효소 수준 변화가 단순히 인 이용성이나 단백질 소화율에만 영향을 주는 것이 아니라, 탄수화물·지질·아미노산을 아우르는 에너지 대사 전반의 재프로그래밍을 유도하고 있음을 보여준다. Asiamah 등[24]이 reduced crude protein diet에서 간 전사체 수준에서 PPAR 신호전달 및 지질 대사가 재조정된다고 보고한 결과와 본 연구의 혈액 전사체 결과를 종합하면, 저단백질 사료는 간·혈액 등 여러 조직에서 에너지·질소 대사를 통합적으로 재조정하는 것으로 해석할 수 있다. LL 처리에서 인산이노시톨 대사(inositol phosphate metabolism) 및 스테로이드 생합성(steroid biosynthesis), 호르몬 대사 과정(hormone metabolic process)이 유의하게 풍부하게 나타난 것은, 조단백질과 인산분해효소를 동시에 감소시켰을 때 피테이트·이노시톨 대사 축과 내분비·스테로이드 대사가 함께 조절되고 있음을 시사한다. Gonzalez-Uarquin 등[27]은 phytase 및 myo-inositol 보충이 혈장 대사체에서 acyl-carnitine, phosphatidylcholine, amino acids 등 다양한 대사물질을 변화시킨다고 보고하였는데, 본 연구의 혈액 전사체 결과는 이러한 대사체 변화가 유전자 발현 수준에서도 반영되고 있음을 보여주는 근거가 될 수 있다.
Hong 등[28]은 Bacillus amyloliquefaciens TL 처리가 육계 ileum에서 면역 관련 유전자 발현을 감소시켜 성장 성적을 개선한다고 보고하였고, Park 등[29]은 Ca 수준이 다른 사료를 급여한 육계 신장 조직에서 RNA-seq을 통해 무기질 대사·수송체 관련 유전자의 차등발현을 규명하였다. 본 연구는 장이나 신장이 아닌 혈액 전사체를 대상으로 조단백질과 인산분해효소 수준 변화에 따른 DEGs와 면역·대사 경로를 규명했다는 점에서 기존 연구를 확장하는 의미를 갖는다.
본 연구에서 혈액 수준에서 관찰된 DEG 및 경로(지방산 대사, 해당과정, 인산이노시톨 대사, cytokine–cytokine receptor interaction 등)는 이러한 조직 수준 변화와 전신적으로 연계될 가능성이 크다. 예를 들어, 지방산 대사 및 글리세롤지질 대사 관련 DEGs는 간 조직에서 보고된 지질 대사 경로 변화[24]와 방향성이 일치하며 cytokine–cytokine receptor interaction 경로에 관여하는 TNFRSF21, IL10RB, IL6R 등은 간·장 조직에서 보고된 면역·염증 및 에너지 대사 관련 조절 기전[23, 28]과도 연결된다. 다만, 본 연구는 혈액 전사체만을 분석하였기 때문에, 실제 간·장·근육 등의 조직 수준에서 나타나는 생리적 변화(예: 성장률, 사료효율, 장 구조 및 장내 미생물 환경, 분변 N·NH₃ 배출량 등)를 직접적으로 측정하지 못한 한계가 있다. 향후 본 연구에서 도출된 혈액 DEGs 및 경로를 기반으로, 간·장·신장·근육 등 다양한 조직의 전사체 및 대사체, 성장 성적·환경 지표와 통합 분석하여 보다 직접적인 생리학적 의미를 규명할 필요가 있다.
최근 연구에 따르면 조단백질 수준을 적정 수준까지 저감하고, 아미노산 및 효소제를 적절히 보완할 경우 질소 배출과 암모니아 발생을 줄이면서 생산성과 복지를 유지할 수 있다[18, 25, 26]. 본 연구에서 확인한 immune response, glycolytic process, glycerolipid metabolic process, cytokine–cytokine receptor interaction 등은 이러한 환경·복지 개선 전략이 초기 생육 단계 육계의 전신 대사 및 면역 조절을 통해 실현될 수 있음을 시사한다. 특히, 혈액 전사체는 채혈만으로도 반복 측정이 가능하다는 점에서 조단백질·인산분해효소 급여 전략의 분자적 효과를 조기에 모니터링할 수 있는 유용한 바이오마커 자원이 될 수 있다. 향후에는 혈액 DEGs와 생산성 지표, 분변 N·NH₃ 배출량, 장 미생물 구성 등을 통합 분석하여 실질적인 사료 설계 및 환경부하 저감 전략에 활용할 수 있는 정밀영양 모델을 개발할 필요가 있다.
결론
본 연구에서는 육계 1주령 48수에 대해 사료 내 주성분의 영양수준(조단백질과 인산분해효소)에 따라 혈액에서 차등 발현 유전자와 대사 경로를 확인하였다. 그 결과, 731개, 1,025개, 1,084개 차등 발현 유전자(p-value<0.05 기준)를 탐색하였다. 탐색된 차등 발현 유전자군의 기능을 분석한 결과, 대조군(조단백질 22%, 인산분해효소 1,000 ppm) 대비 인산분해효소 첨가량의 감소(1,000 ppm에서 500 ppm, 총 500 ppm 감소)에 따라 단백질 자가 인산화, 대사경로, 아미노산 생합성 관련 유전자들의 발현 차이가 났다. 또한 조단백질 첨가량의 감소(22%에서 20%, 총 2% 감소)에 따라 지방산 대사 과정, 대사경로 관련 유전자들의 발현 차이가 났다. 조단백질과 인산분해효소 첨가량의 감소(1,000 ppm에서 500 ppm과 22%에서 20%, 총 500 ppm과 2% 감소)에 따라 인산이노시톨 대사, 스테로이드 생합성, 호르몬 대사 과정, 탄수화물 대사 과정 관련 유전자들의 발현 차이가 났다. 특히, 조단백질과 인산분해효소 첨가제가 감소된 혈액 내 영양 상태에서 조류의 지질 대사, 세포 성장, 분화 및 면역/염증 조절하는 사이토카인-사이토카인 수용체 경로에서 유전자 발현의 차이(p-value<0.05)가 관여되고 있었다.
사료 주성분(조단백질과 인산분해효소 등) 급여량을 적절히 이용하여 가축의 영양 및 사료 효율 문제를 개선할 뿐만 아니라, 질소 및 암모니아 배출 감소 등 지속적인 육계 생산에 관한 연구가 진행될 필요성이 있다.







