INTRODUCTION
면역이란 면역세포가 자기(self)와 비자기(nonself)를 식별하여 비자기로부터 자기를 지킴으로써 생체의 항상성을 유지하는 방어기전으로 크게 선천 면역(innate immunity)과 적응 면역(adaptive immunity)으로 구분된다[1–3]. 선천 면역은 침입한 병원체가 TLR(toll-like receptor) 등을 갖는 숙주 세포에 의해 인지되어 수 시간 내에 염증반응을 유발함으로써 병원체를 직접 제거하는 특이적인 면역반응을 의미한다. 이와 달리, 적응 면역은 선천 면역반응에 의한 일차적인 방어 이후 병원체의 특정 항원에 대한 기억 반응을 통해 나타나는 후천적인 반응으로 동일한 병원체의 재 침투 시 B 세포 중심의 체액성 면역반응과 T 세포 중심의 세포성 면역반응을 통해 강력하고 지속적으로 병원체를 제거하게 된다[2, 4, 5].
한편, 염증(inflammation)이란 외부에서 유입된 세균, 바이러스, 화학물질 등 유해물질의 침입으로부터 우리 몸을 보호하는 대표적인 선천 면역반응으로, 대식세포(macrophage)가 염증을 일으키는 주요 세포로 알려져 있다[6]. 대식세포는 자체적인 식세포 작용, 세포 독성, 세포살해능력을 활용하여 선천 면역을 활성화시킬 뿐만 아니라, 항원 제시를 통해 적응 면역을 촉진한다[7, 8].
LPS(lipopolysaccharide)는 그람 음성 세균 외막의 주성분으로 대식세포 등의 표면에 존재하는 pattern recognition receptor인 TLR4와 반응하는데, 비록 감염 초기에는 이러한 반응이 숙주 방어에 중추적인 역할을 하나, 과도한 LPS 자극에 의해 활성화된 대식세포는 TNF-α(tumor necrosis factor-α), IL-1β(interleukin-1β) 및 IL-6와 같은 전염증성 사이토카인(proinflammatory cytokine)과 NO(nitric oxide), PGE2(prostaglandin E2) 등의 염증 매개 인자(inflammatory mediator)를 다량 분비하여 염증반응을 일으키게 된다[9–12].
이러한 전염증성 사이토카인과 NO 및 PGE2 생산을 담당하는 iNOS(inducible nitric oxide synthase), COX-2(cyclooxygensase-2) 등의 유전자 발현은 주로 MAPKs(mitogen-activated protein kinases)와 NF-κB(nuclear factor kappa B)에 의해 조절되는데, 특히 LPS가 대식세포의 TLR4와 반응하면, MyD88(myeloid differentiation primary response gene 88)을 통해 NF-κB가 활성화되면서 NF-κB와 결합해 있던 IκBα(nuclear factor of kappa light polypeptide gene enhancer in B cells inhibitor, alpha)가 분해되어 NF-κB가 세포질에서 핵으로 들어가게 되며, 이후 TNF-α, IL-1β와 같은 사이토카인의 전사인자로 작용하여 이들의 발현을 촉진하게 된다[13, 14]. 이는 MAPKs 또는 NF-κB 신호전달경로를 조절할 경우, 대식세포의 사이토카인 및 염증 매개 인자의 생산을 조절함은 물론, 이들에 의한 면역반응까지도 상향 또는 하향 조절할 수 있음을 시사한다.
개다래나무(Actinidia polygama)는 다래나무과(Actinidiaceae)의 다년생 식물로 한국, 중국, 러시아, 일본 등에 분포하며, 복통, 중풍, 류마티스 관절염 등을 치료하는 데 사용되어 왔다[15, 16]. 현재까지 진행된 다양한 연구에 따르면, 개다래 추출물은 ovalbumin으로 유도한 천식 마우스에서 호산구혈증과 기관지의 과민반응을 억제하고, 고지방식이 유도 비만 마우스에서 항비만 효과를 보였으며, 항염증 활성과 함께 암세포의 증식 억제 작용을 가진 것으로 확인되었다[17–20]. 뿐만 아니라, ultraviolet B를 조사한 무모 마우스와 인간 각질세포를 이용한 선행 연구에서 개다래 추출물이 collagen과 matrix metalloproteinases 조절을 통해 피부 주름을 개선시키고, 피부 수분과 피부 장벽 기능을 유지함으로써 광노화를 억제할 수 있음이 입증되었다[21, 22]. 그러나, 개다래 추출물이 대식세포에서의 염증반응 조절 또는 면역 증진에 구체적으로 어떠한 효과를 나타내는지 체계적으로 연구된 적은 거의 없다.
이에 본 연구에서는 마우스 대식세포주인 RAW264.7 세포를 이용하여 LPS로 유도된 염증반응에 미치는 개다래 추출물의 효과와 함께 개다래 추출물이 대식세포를 직접 활성화시킬 수 있는지 여부를 관찰하고 그 기전을 확인하고자 하였다.
MATERIALS AND METHODS
개다래 추출물(PB203)을 제조하기 위해 국내산 개다래나무의 열매 건조물을 구입한 다음, 이를 칭량 및 세척하고 원재료의 약 14배에 해당하는 정수를 투입한 후, 85 ± 5℃의 조건에서 4–8시간 동안 환류 추출하였다. 추출물은 여과를 거친 다음, 60℃ 이하에서 감압 농축하였으며, 이후 농축액을 덱스트린과 함께 고형분 중량 기준 7:3으로 혼합하고 살균 및 건조과정을 거쳐 분말 형태의 시험물질인 PB203을 제조하였다. 본 연구에 사용된 PB203의 농도는 모두 추출물 고형분 기준으로 설정하였다.
Mouse macrophage cell line인 RAW264.7은 ATCC(American Type Culture Collection, Manassas, VA, USA)에서 분양 받아 사용하였으며, 세포 배양을 위해 10% heat-inactivated FBS(fetal bovine serum, Sigma-Aldrich, St. Louis, MO, USA), 1% HEPES(Sigma-Aldrich), 1% L-Glutamine(Sigma-Aldrich), 1% Penicillin-Streptomycin(Sigma-Aldrich)이 함유된 RPMI-1640 medium(Sigma-Aldrich)을 이용하여 37℃, 5% CO2 조건에서 배양하였다.
RAW264.7 세포에서 LPS 처리 유무에 따른 PB203의 세포 독성을 평가하기 위한 세포 생존율 실험은 WST-1(water soluble tetrazolium salt-1) assay 방법을 이용하였다. 먼저 RAW264.7 세포를 24 well plate에 4 × 104 cells/well로 0.5 mL씩 분주하여 24시간 동안 배양 후 기존 배지를 제거한 뒤 PB203을 농도별(0, 125, 250, 500 μg/mL)로 처리함과 동시에 LPS 500 ng/mL를 가하여 18시간 반응하였다. PB203 단독 처리시에는 농도별(0, 125, 250, 500 μg/mL)로 처리하여 24시간 동안 배양하였다. 배양 후 상등액에 WST-1 solution(EZ-cytox, Dogenbio, Seoul, Korea)를 10 μL 첨가하여 세포배양기(37℃, 5% CO2)에서 3시간 반응하였다. 반응 후 500 μL의 배양액을 microtube에 옮긴 뒤 1,200 × g에서 3분 동안 원심분리하고, 상등액 100 μL를 96 well plate에 옮겨 450 nm에서 흡광도를 측정하고 세포 생존율(cell viability, %)을 계산하였다.
PB203의 항염증 효과 측정을 위한 대식세포 시험은 Yang 등의 방법을 응용하여 실시하였다[23]. 먼저, RAW264.7 세포를 24 well plate에 4 × 104 cells/well로 분주하여 24 시간 동안 배양한 다음, 기존 배지를 제거하고 나서 PB203을 농도별(0, 250, 500 μg/mL)로 처리함과 동시에 500 ng/mL의 LPS로 자극을 가하여 18시간 동안 배양하였다. 배양이 끝난 후 세포 배양액을 수집하고, 세포에서 RNA를 추출하여 사이토카인 등의 분석에 사용하였다.
PB203의 면역증강 효과 측정을 위한 대식세포 시험은 Yang 등의 방법을 변형하여 수행하였다[24]. 구체적으로, RAW264.7 세포를 24 well plate에 4 × 104 cells/well로 분주하여 24시간 동안 배양한 다음, 기존 배지를 제거하고 나서 PB203을 농도별(0, 250, 500 μg/mL)로 처리한 후 24시간 동안 배양하였다. 또한, PB203의 면역 증강 효과가 NF-κB 신호전달경로를 통한 것인지 확인하기 위해 PB203 처리 30분 전에 NF-κB 억제제인 BAY 11-7082(Sigma-Aldrich) 10 μM을 전처리한 다음, PB203을 농도별(0, 250, 500 μg/mL)로 처리하고 나서 24시간 동안 배양하였다. 배양이 끝난 후 세포 배양액을 수집하고, 세포로부터 RNA를 추출하여 사이토카인 등의 분석에 사용하였다.
RAW264.7 세포로부터 TRIzol reagent(Cosmogenetech, Seoul, Korea)을 사용하여 RNA를 추출하였다. 추출된 RNA를 주형으로 cDNA synthesis kit(Cosmo Genetech)를 이용하여 cDNA를 합성하였다. 이후 합성된 cDNA에 primer와 함께 TOPrealTM SYBR Green qPCR PreMIX(Enzynomics, Seoul, Korea)를 가한 다음, StepOnePlusTM Real-Time PCR System(Applied Biosystems, Waltham, MA, USA)을 사용하여 qRT-PCR을 실시하였다. 각 유전자의 발현량은 ΔCt(cycle threshold) 값을 이용하여 계산하였고, internal control은 glyceraldehyde-3-phosphate dehydrogenase를 사용하였으며, 모든 시험군의 유전자 발현량은 정상군(normal)의 값이 1일 때의 상대적인 배수(fold)로 표시하였다. 각 유전자별로 사용된 primer의 서열은 Table 1과 같다.
PCR, polymerase chain reaction; HO-1, heme oxygenase-1; Nrf2, nuclear factor erythroid 2–related factor 2; iNOS, inducible nitric oxide synthase; COX-2, cyclooxygensase-2; TNF-α, tumor necrosis factor-α; IL, interleukin; TLR4, toll-like receptor 4; NF-κB, nuclear factor kappa B; G-CSF, granulocyte colony-stimulating factor; GM-CSF, granulocyte-macrophage colony-stimulating factor; TGF-β, transforming growth factor-β; IFN-γ, interferon-γ; MCP-1, monocyte chemoattractant protein-1; GAPDH, glyceraldehyde-3-phosphate dehydrogenase.
NO 농도를 측정하기 위해 배양액 상등액 50 μL와 Griess reagent 50 μL를 96 well plate에 분주하여 15 분간 상온에서 반응시킨 후, microplate reader(SpectraMax ABS Plus; Molecular Devices, Sunnyvale, CA, USA)를 이용하여 540 nm에서 흡광도를 측정한 다음, nitrite/nitrate standard의 농도별 표준곡선을 이용하여 배양액 중의 NO 농도를 결정하였다. 또, 배양액 내 PGE2, TNF-α, IL-1β의 농도는 R&D systems(Minneapolis, MN, USA)의 ELISA 키트를, IL-6는 Koma Biotech(Seoul, Korea)의 ELISA 키트를 이용하여 측정하였다.
RESULTS
LPS로 활성화시킨 RAW264.7 대식세포는 항염증 활성을 갖는 소재를 탐색하는 방법으로 널리 사용되고 있다. LPS 자극을 가한 RAW264.7 세포에서 PB203의 항염증 활성을 평가하기에 앞서 먼저 PB203의 세포 독성 유무를 확인하기 위해 WST-1 assay 방법을 이용하여 세포 생존율을 분석하였다. 그 결과, LPS와 PB203을 모두 처리하지 않은 정상군(normal)에 비해 LPS만 처리한 유발대조군(LPS+media)의 경우 세포 생존율이 약 5% 정도 증가되는 모습을 보였으나 통계적으로 유의하지는 않았으며, LPS와 PB203을 함께 처리한 경우에도 정상군이나 유발대조군 대비 PB203 처리군의 통계적 유의성은 모두 관찰되지 않아 PB203의 처리가 LPS를 처리한 RAW264.7 세포에 독성을 나타내지는 않는 것으로 확인되었다(Fig. 1A).
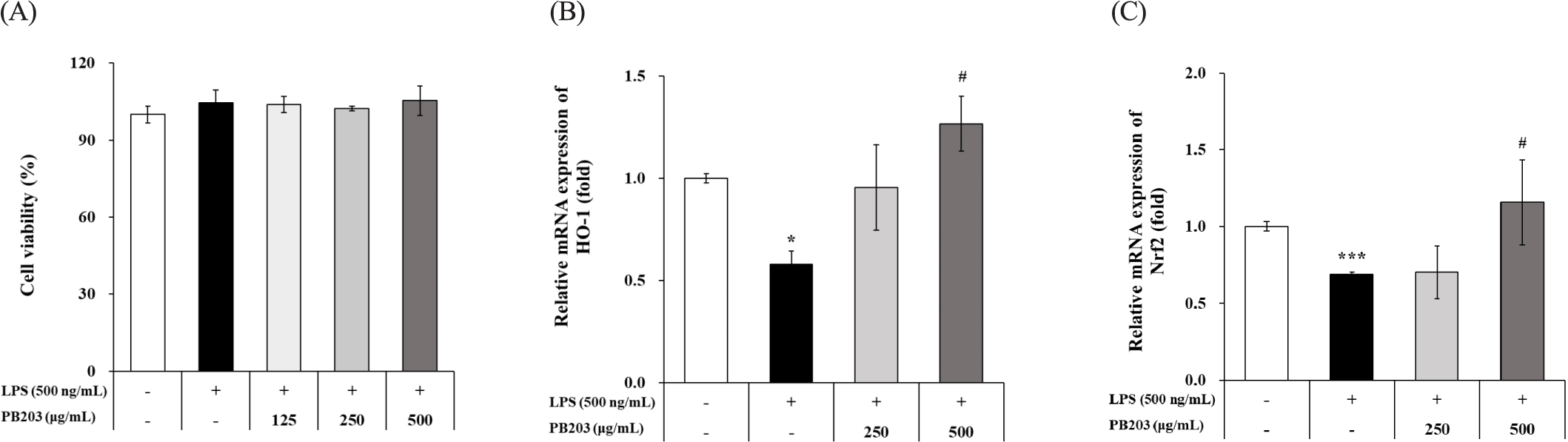
또, LPS 자극에 따른 산화적 스트레스 발생에 대한 PB203의 영향을 확인하기 위해 세포 내 항산화 효소인 HO-1(heme oxygenase-1)의 mRNA 수준을 qRT-PCR로 분석하였다. HO-1은 heme의 분해 과정에 관여하는 속도 조절효소로 산화적 스트레스로부터 세포와 조직을 보호하고 염증반응을 완화하는 데 중요한 역할을 하는 것으로 인식되고 있다[25, 26]. HO-1의 발현은 산화적 스트레스에 대응하는 일차적인 전사인자인 Nrf2(nuclear factor erythroid 2–related factor 2)에 의존적으로 조절되는데[27, 28], Tsoyi 등은 RAW264. 7 세포에서 HO-1의 과발현을 유도했을 때, LPS에 의한 NF-κB 및 STAT1(signal transducer and activator of transcription 1) 활성이 부분적으로 억제되어 NO와 iNOS 생성이 저해되었다는 보고를 한 바 있으며[29], Han 등의 연구에서는 procyanidin A1이 Nrf2의 발현 및 핵 내 이동을 촉진시키고 HO-1의 발현을 증가시킴으로써 LPS에 의한 RAW264.7 세포의 염증반응을 완화시킨 것으로 나타났다[30]. 본 연구에서 RAW264. 7 세포의 HO-1 발현을 분석한 결과, LPS로 자극한 유발대조군의 mRNA 수준은 정상군보다 약 42% 감소된 데 반해, 250 및 500 μg/mL의 PB203을 처리한 세포에서는 HO-1이 농도의존적으로 증가하였으며, 특히 500 μg/mL 처리군에서 유발대조군 대비 약 2.2배의 유의적인 증가를 보였다(Fig. 1B). 또, HO-1의 발현을 촉진하는 전사인자인 Nrf2의 유전자 발현을 확인했을 때에도 LPS에 의해 유의하게 감소된 Nrf2의 발현이 PB203 500 μg/mL 처리군에서 유의하게 상승하는 결과를 보였다(Fig. 1C). 이는 PB203이 Nrf2를 통해 HO-1의 발현을 유도함으로써 LPS 처리로 인한 산화적 스트레스 및 그로 인한 염증반응으로부터 세포를 보호할 수 있음을 시사한다.
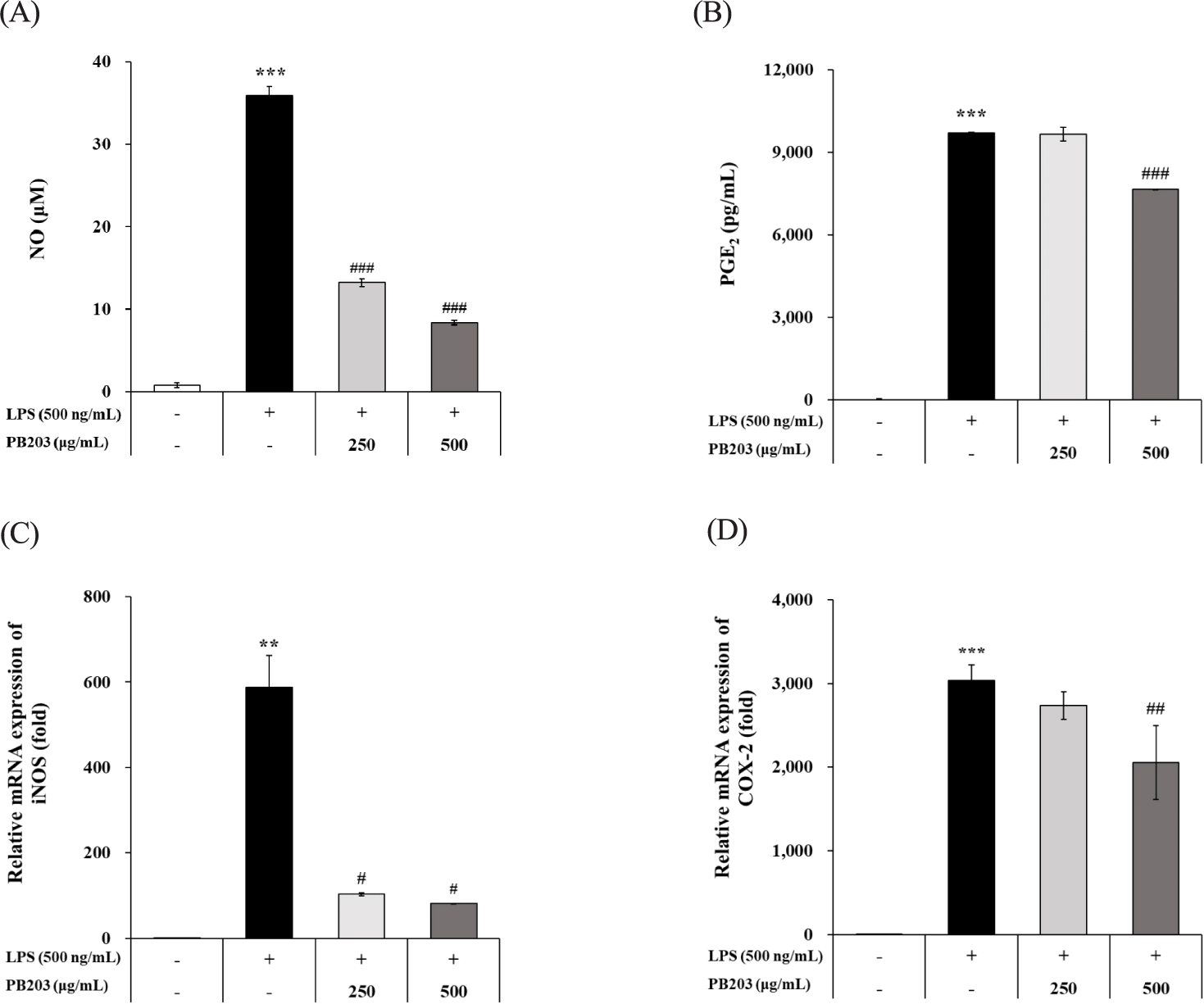
LPS 자극에 의해 활성화된 대식세포는 NO, PGE2 등 초기 염증반응을 주도하는 염증 매개 인자를 다량 분비하게 된다[31]. NO는 활성화된 대식세포에서 증가된 iNOS에 의해 합성되는데, iNOS에 의한 NO의 과도한 생성은 염증을 유발하여 혈관 확장, 세포독성, 조직 손상 등 유해 작용을 일으키며[32, 33], 아라키돈산으로부터 만들어지는 PGs(prostaglandins)의 일종인 PGE2는 염증반응 발생 시 주로 COX-2에 의해 생성되어 통증과 부종을 유발하는 강력한 전염증성 물질로 작용한다[34]. LPS로 자극한 RAW264.7 세포에 PB203을 두 가지 농도로 처리하여 배양한 다음 배양액으로부터 NO와 PGE2 농도를 측정한 결과, LPS를 처리한 유발대조군에서는 NO와 PGE2가 각각 36 μM과 9,688 pg/mL까지 통계적으로 유의하게 상승하였다. 반면, PB203을 처리한 군에서 NO는 농도의존적으로 최대 77%까지 의미 있게 감소되었으나, PGE2는 500 μg/mL 농도에서만 유의적인 감소효과를 나타냈다(Fig. 2A and B). 또, NO 및 PGE2를 생성하는 효소인 iNOS와 COX-2의 발현을 분석한 결과, 두 가지 효소 모두 LPS에 의해 mRNA 수준이 수백~수천 배 높아졌으나, PB203을 처리한 경우 iNOS는 두 가지 농도 모두에서, COX-2는 500 μg/mL 농도에서 유의하게 감소된 모습을 보여주었다(Fig. 2C and D). 이는 PB203이 LPS에 의해 활성화된 대식세포에서 iNOS와 COX-2의 발현을 억제함으로써 NO와 PGE2를 감소시켜 초기 염증반응을 조절하는 데 기여할 수 있음을 의미한다.
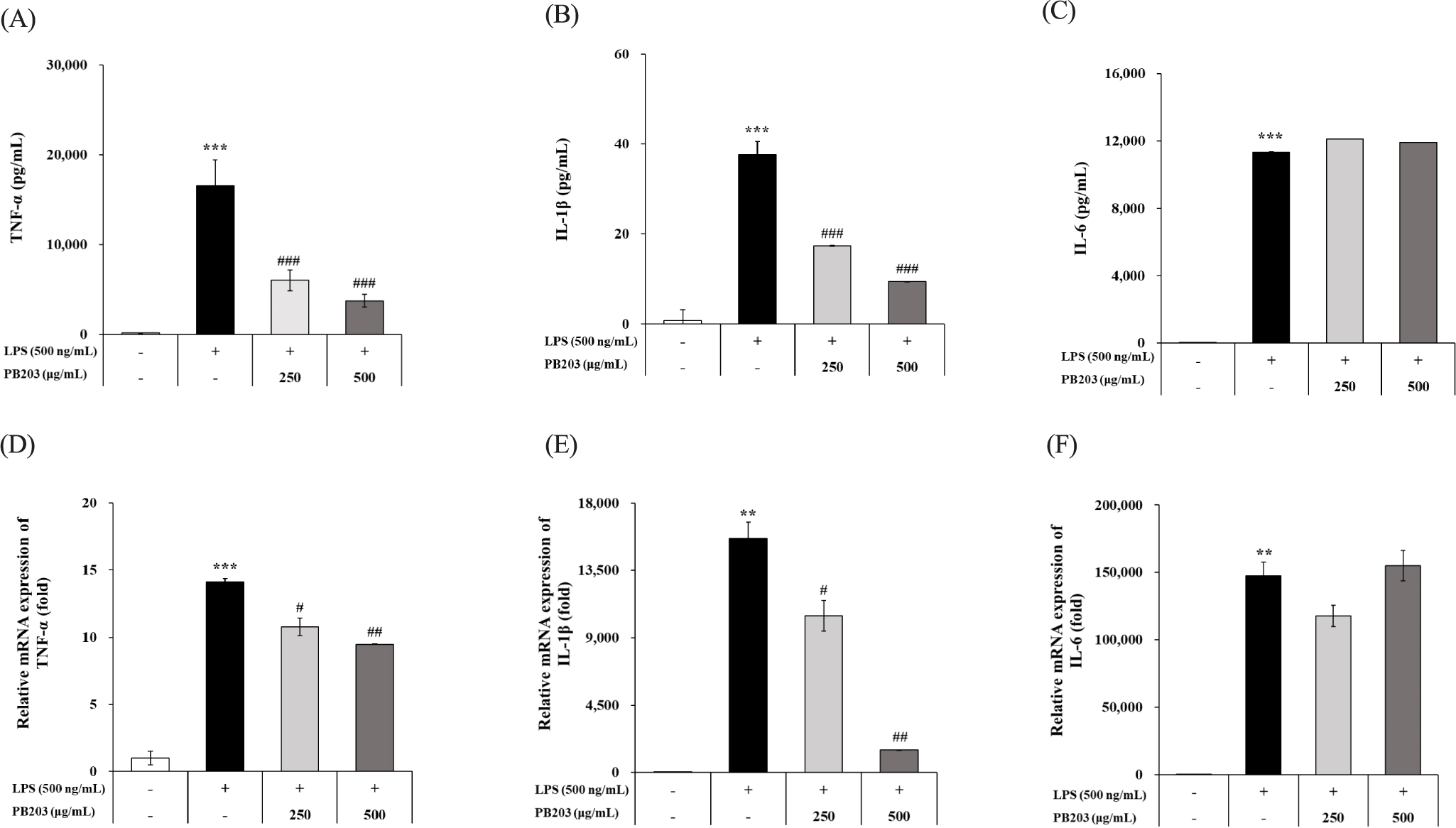
LPS에 의해 대식세포가 활성화되는 과정에서 TNF-α, IL-1β 및 IL-6와 같은 전염증성 사이토카인의 생성은 NO 및 PGE2 등과 함께 염증반응을 나타내는 중요한 지표이다[35]. PB203이 LPS를 처리한 RAW264.7 세포에서 이러한 전염증성 사이토카인의 생성에 어떠한 변화를 주는지 확인하기 위해 TNF-α, IL-1β 및 IL-6의 단백질 농도와 mRNA 발현을 ELISA와 qRT-PCR로 각각 평가하였다. 먼저, 세포 배양액에서 각 사이토카인의 단백질 농도를 분석한 결과, PB203은 LPS에 의해 증가된 TNF-α와 IL-1β를 최대 78%와 75%까지 농도의존적으로 유의하게 억제하였다. 그러나, 이와 달리 IL-6 농도는 PB203 처리에도 불구하고 변화를 보이지 않았다(Fig. 3A, B, and C). 이들 사이토카인의 단백질 생산에 대한 PB203의 효과가 유전자 발현 조절로 인한 것인지 확인하기 위해 mRNA 발현을 정량적으로 측정한 결과, TNF-α와 IL-1β 모두 PB203에 의해 농도의존적으로 유의한 감소효과를 보였으나, IL-6의 경우 두 가지 농도 모두에서 의미 있는 차이를 보이지 않아 단백질 분석 결과와 유사한 경향을 보여주었다(Fig. 3D, E, and F). 이를 통해 PB203은 염증을 유발하는 전염증성 사이토카인 중 TNF-α와 IL-1β의 유전자 발현 및 단백질 생산을 억제함으로써 항염증 효과를 나타낼 수 있음을 확인하였다.
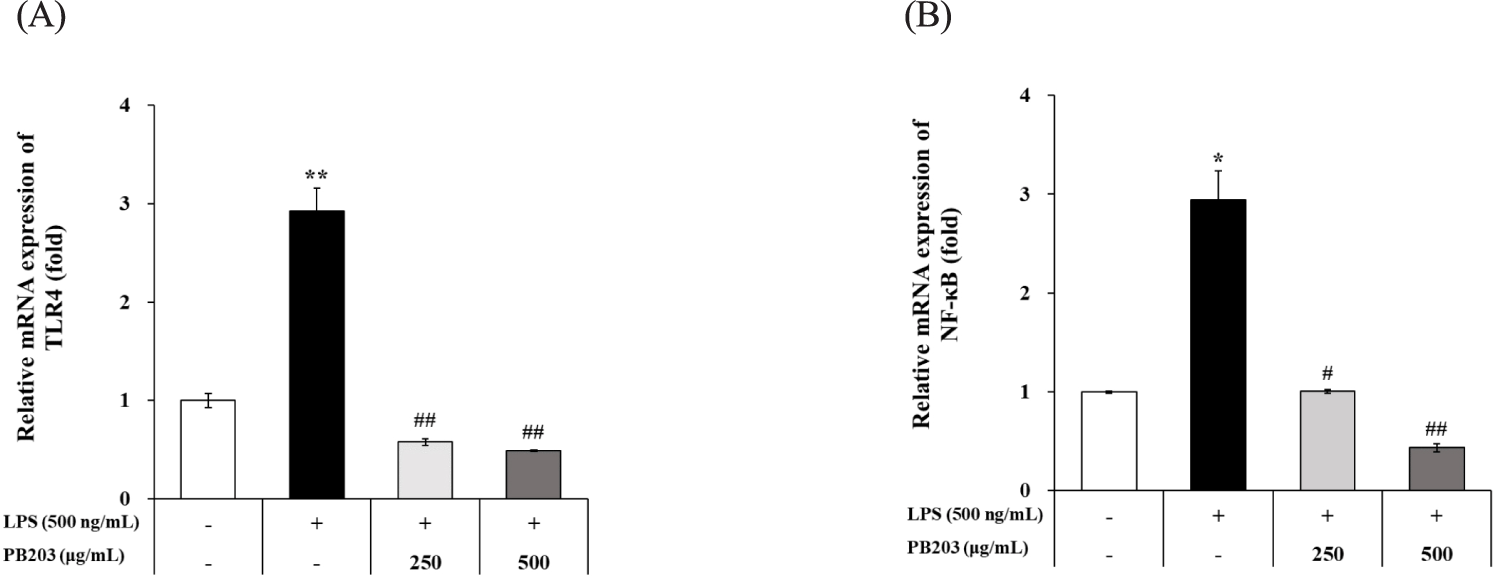
TLR4는 NF-κB 의존적인 전염증성 사이토카인 및 염증 매개 인자 관련 단백질 등의 전사를 유도함으로써 LPS 자극에 대한 염증반응의 신호전달경로에 중요한 역할을 담당한다[36]. PB203에 의한 TNF-α, IL-1β 및 iNOS와 COX-2의 감소가 TLR4/NF-κB 신호전달경로 조절에 따른 것인지 확인하기 위해 TLR4와 NF-κB의 유전자 발현을 정량 분석하였다. 그 결과, LPS에 의해 유의하게 증가된 TLR4와 NF-κB의 mRNA 생산이 PB203 처리에 의해 정상 수준까지 농도의존적으로 유의하게 억제되는 것이 관찰되었다(Fig. 4A and B). 이러한 결과는 PB203이 TLR4/NF-κB 신호전달경로를 하향조절 함으로써 TNF-α, IL-1β 및 iNOS, COX-2의 전사를 억제하여 염증반응을 감소시킬 수 있음을 의미한다.
외부물질 침입을 가장 먼저 인지함으로써 생체 방어의 최전선을 담당하는 대식세포는 선천 면역을 이끄는 가장 중요한 세포로 알려진 데다 적응 면역의 유발에도 관여하기 때문에 대식세포의 활성화 유무는 생체 방어에 매우 중요한 의미를 갖는다. PB203이 LPS를 처리하지 않은 정상 대식세포를 활성화시켜 면역 증진에 기여하는지 확인하기 위해 RAW264.7 세포에 PB203을 농도별로 처리하여 배양한 후 먼저 세포 생존율을 측정하였다. 그 결과, 정상군(normal)과 PB203 처리군의 세포 생존율 간에 통계적인 유의성이 관찰되지 않아 PB203이 RAW264.7 세포에 독성을 나타내지 않은 것으로 확인되었다(Fig. 5A).
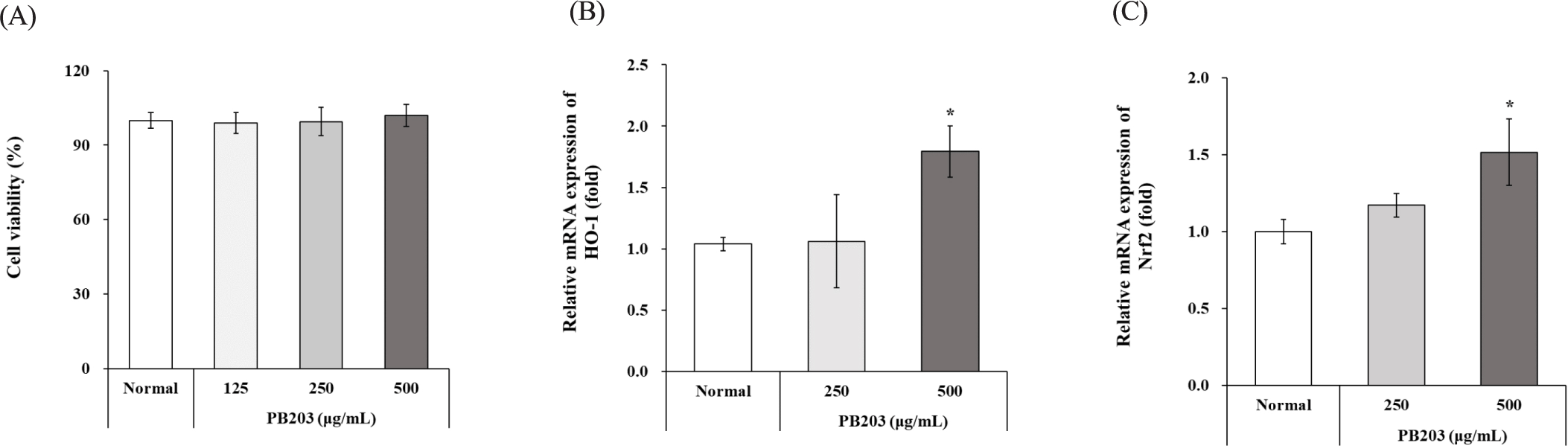
한편, LPS를 처리하지 않은 정상 대식세포에 PB203만 처리했을 때에도 Fig. 1B와 1C처럼 HO-1 및 Nrf2의 발현에 영향을 주는지 확인하기 위해 이들의 mRNA 수준을 qRT-PCR로 분석한 결과, PB203 250 μg/mL를 처리한 세포에서는 정상군 대비 통계적으로 유의한 차이를 보이지 않았으나, 500 μg/mL 처리군에서만 HO-1과 Nrf2 모두 정상군보다 각각 약 79%와 52% 유의하게 증가된 유전자 발현을 보였다(Fig. 5B and C). 이러한 결과는 PB203이 LPS를 처리한 대식세포뿐만 아니라, 정상 대식세포에서도 Nrf2를 통한 HO-1 발현을 유도함으로써 세포 활성화 및 산화적 스트레스에 대한 저항성 증가에 기여할 수 있음을 시사한다.
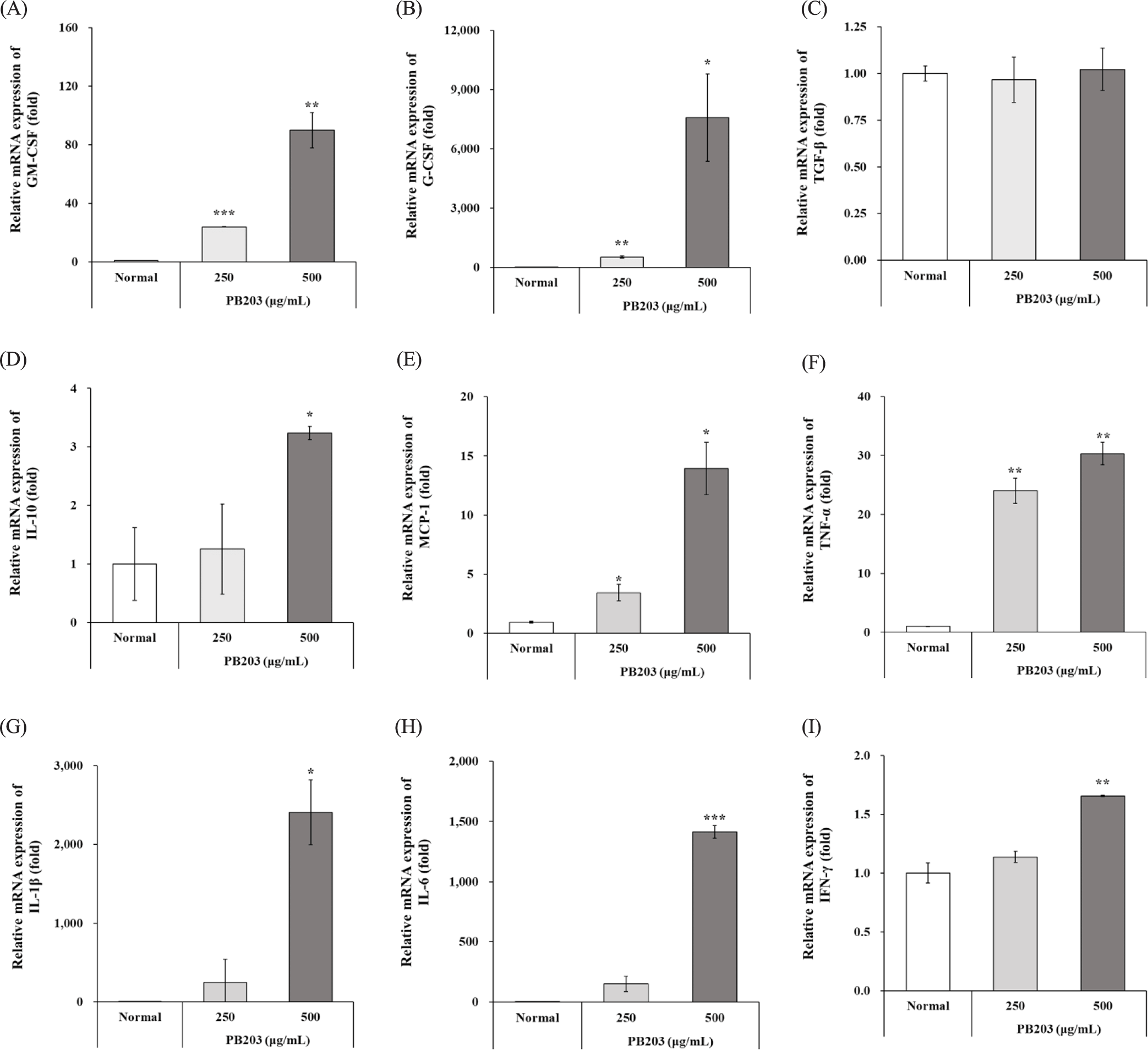
대식세포가 활성화되는 과정에서 세포는 GM-CSF(granulocyte-macrophage colony-stimulating factor), G-CSF(granulocyte colony-stimulating factor), TGF-β(transforming growth factor-β), IL-10, MCP-1(monocyte chemoattractant protein-1), TNF-α, IL-1β, IL-6, IFN-γ(interferon-γ)와 같은 다양한 사이토카인을 생성하는데, 이들은 조혈세포의 증식, 분화와 함께 과립구의 활성화에 기여하며, 사이토카인의 균형을 조절하여 면역의 항상성을 유지하거나, 염증반응을 활성화하는 등 선천 면역을 조절하는 면역조절자(immunomodulators)로 작용한다[37–44]. PB203이 정상 대식세포를 활성화시켜 선천 면역반응에 기여하는 이들 사이토카인의 생성을 촉진하는지 확인하기 위해 RAW264.7 세포에 PB203을 두 가지 농도로 처리하여 배양한 후, 각 사이토카인 유전자의 발현을 정량 분석하였다. 그 결과, GM-CSF, G-CSF, MCP-1의 mRNA 수준은 정상군 대비 PB203 처리군에서 농도의존적으로 유의하게 증가하였으며, 특히 PB203 500 μg/mL를 처리했을 때, 각각 90배, 7,578배 및 14배에 달하는 두드러진 증가를 보였다(Fig. 6A, B, and E). 이와 달리, TGF-β는 정상군과 PB203 처리군 사이에 의미 있는 차이를 보이지 않았으며, 또 다른 조절 사이토카인의 하나인 IL-10의 발현은 PB203에 의해 농도의존적으로 증가하긴 하였으나, 정상군 대비 통계적인 유의성은 PB203 500 μg/mL 처리군에서만 확인되었다(Fig. 6C and D). 한편, 병원체를 제거하기 위한 선천 면역의 핵심인 염증반응을 유도하는 전염증성 사이토카인 중 TNF-α의 mRNA 발현은 PB203에 의해 농도의존적으로 유의하게 20배 이상 증가되는 모습을 보인 반면, IL-1β, IL-6의 발현은 PB203에 의해 농도의존적으로 상승하는 경향을 나타냈으나, 정상군 대비 통계적인 유의성은 PB203 500 μg/mL 처리군에서만 관찰되었다(Fig. 6F, G, and H). 또, 선천 면역은 물론 적응 면역 활성화에 중요한 IFN-γ의 mRNA 수준 역시 500 μg/mL 처리군에서만 1.6배 이상 유의한 증가를 보였다(Fig. 6I). 이상의 결과는 앞서 PB203이 LPS에 의해 유도된 과도한 염증반응에 대하여 전염증성 사이토카인 등의 과다 생성을 억제함으로써 항염증 활성을 보인 것과 비교되는 결과로서, PB203이 유해물질의 자극이 없는 상황에서도 정상 대식세포에 영향을 주어 다양한 사이토카인 및 케모카인의 생산을 유도함으로써 선천 면역의 활성화에 기여할 수 있음을 보여준다.
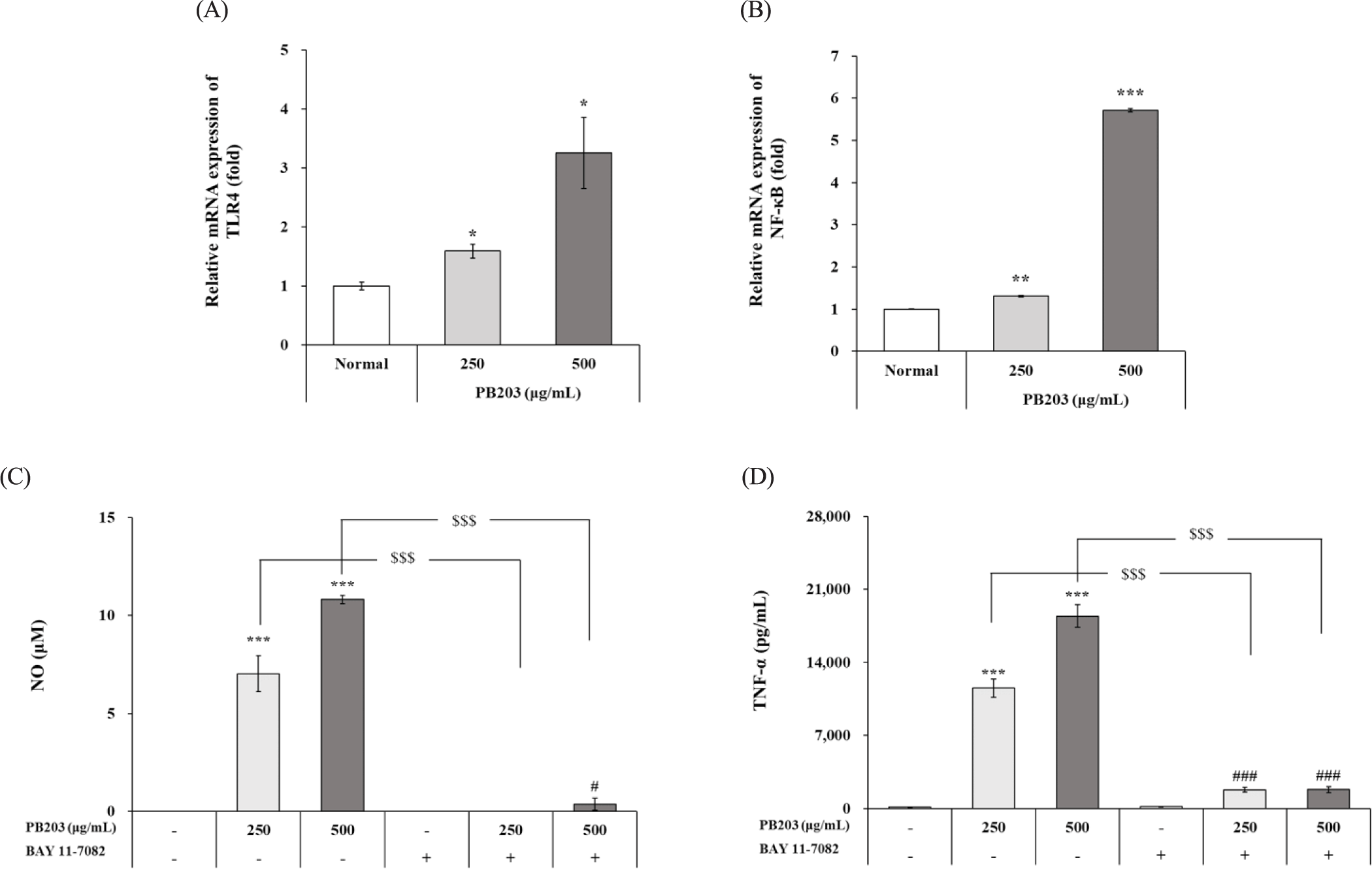
정상 대식세포에서 확인된 PB203의 사이토카인 증가 효과가 TLR4/NF-κB 신호전달경로 조절에 의한 것인지 확인하기 위해 TLR4, NF-κB의 유전자 발현을 정량 분석하는 한편, NF-κB 억제제인 BAY 11-7082를 PB203과 함께 처리하여 배양한 후, NO와 TNF-α의 농도를 분석하였다. 먼저 TLR4와 NF-κB의 유전자 발현을 평가한 결과, 정상군에 비해 PB203 처리군 모두에서 농도의존적으로 유의한 발현 증가가 확인되었으며, 특히 500 μg/mL 처리군에서 정상군 대비 TLR4와 NF-κB mRNA 발현이 각각 3.3배와 5.7배 증가된 것으로 나타났다(Fig. 7A and B). 또한, BAY 11-7082와 PB203의 처리 유무에 따른 NO 및 TNF-α의 농도를 비교한 결과, PB203에 의해 농도의존적으로 유의하게 증가된 NO와 TNF-α생산이 NF-κB 억제제에 의해 통계학적으로 의미 있게 감소된 것을 확인할 수 있었다(Fig. 7C and D). 이는 PB203에 의한 NO, TNF-α의 증가 및 이로 인한 대식세포 활성화가 TLR4/NF-κB 신호전달경로를 경유하여 나타나는 것이며, 결과적으로 PB203이 TLR4/NF-κB의 활성화를 통해 선천 면역 증진에 기여할 수 있음을 시사한다.
DISCUSSION
면역이란 인체에 세균, 바이러스 등의 병원체 또는 내독소 물질이 침투하였을 때 이를 신속히 인지하고 제거하는 방어 체계로서, 크게 선천 면역과 적응 면역으로 나뉘는데, 선천 면역은 병원체의 표면 분자를 인식할 수 있는 TLR 등을 지닌 탐식세포가 병원체를 인지하여 수 시간 내에 급성 염증반응을 유발하는 등 특이적인 반응을 나타낸다[4, 5, 9].
이때 선천 면역반응의 일환으로 발생하는 염증은 병원체나 손상 혹은 괴사된 조직을 제거하고 생체 기능을 회복하려는 보호반응으로, 정상적인 염증반응이 없으면 미생물에 의한 감염이 지속되어 상처가 회복되지 않을뿐더러, 이로 인해 부적절하거나 조절되지 않는 과도한 염증을 유발하게 된다. 다만, 정상적인 염증반응은 시간이 지남에 따라 체내에서 스스로 염증반응이 소멸되는 조절과정을 거치지만, 조절되지 않은 과도한 염증반응은 만성 염증성 질환, 조직 손상 및 종양 등의 원인이 되기도 한다[6, 45, 46].
염증반응에서 가장 핵심적인 역할을 하는 대식세포는 탐식세포의 일종으로 외부의 병원체로부터 인체를 방어하는 역할을 담당하는데, LPS와 같은 자극물질에 대한 대식세포의 초기 염증반응은 일반적으로 iNOS, COX-2와 이들 단백질에 의해 생산된 염증 매개 인자인 NO, PGE2에 의해 유도된다. NO는 NOS에 의해 L-arginine으로부터 생성되는데, NOS는 혈관긴장도, 신경전달, 항상성 메커니즘 등을 조절하는 중요한 역할을 수행한다. iNOS는 스트레스나 IL-1β, IL-6, TNF-α 같은 전염증성 사이토카인에 의해 발현되며, 이들 사이토카인은 대식세포를 활성화시키고, 탐식작용을 증가시키며, 급성 및 만성 염증반응을 일으키는 매개체로 작용한다[32, 33, 47, 48]. 한편, COX에는 두 가지 isoform인 COX-1과 COX-2가 있는데, COX-1은 대부분의 조직에서 일정한 수준으로 발현되며, COX-1에 의해 생성된 PGs는 조직 손상으로부터 위장과 신장을 보호하는 역할을 하는 것으로 알려져 있다. 반면, COX-2는 염증과 같은 병적인 환경에서 활성화된 대식세포, 단핵구, 혈관내피세포, 연골세포 등에서 분비되는데, COX-2에 의해 생산된 PGs, 특히 PGE2는 NO와 함께 초기 염증반응을 주도할 뿐 아니라, 통증과 부종을 유발하는 강력한 염증성 물질로 작용한다[34, 49, 50]. 또한, LPS에 의해 활성화된 대식세포는 NO, PGE2 외에 TNF-α, IL-1β 및 IL-6와 같은 전염증성 사이토카인을 다량 분비하여 염증반응을 촉진하게 된다[7–9, 50]. 따라서, 대식세포에서 LPS와 같은 병원체 성분에 의해 증가된 전염증성 사이토카인과 염증 매개 인자를 억제하는 것은 다양한 염증 관련 질환의 치료제 개발에 필수적인 요소이자 항염증 소재 발굴을 위한 중요한 타겟이 될 수 있다.
본 연구에서 개다래 추출물(PB203)은 LPS에 의해 증강된 NO와 PGE2와 함께 이들을 생성하는 효소인 iNOS와 COX-2의 mRNA 발현을 유의하게 억제하였으며, PB203의 이러한 효과는 PGE2와 COX-2보다는 NO와 iNOS에서 더 두드러진 것으로 확인되었다(Fig. 2). 뿐만 아니라, PB203은 TNF-α, IL-1β의 단백질과 mRNA 모두를 농도의존적으로 유의한 수준으로 감소시켰는데(Fig. 3A, B, D, and E), 이러한 결과는 PB203이 염증을 유발하는 NO 등의 염증 매개 인자와 함께 TNF-α, IL-1β 같은 전염증성 사이토카인을 억제함으로써 강력한 항염증 효과를 나타낼 수 있음을 보여준다.
LPS가 대식세포의 TLR4와 반응했을 때, 가장 대표적으로 활성화되는 신호전달경로는 NF-κB로, MyD88을 통해 TGF-β-activated kinase 1이 활성화되면서 NF-κB와 결합해 있던 IκBα가 인산화 및 분해되어 NF-κB가 세포질에서 핵으로 들어가게 되면, TNF-α, IL-1β, iNOS, COX-2와 같은 유전자의 프로모터 부위에 결합함으로써 이들의 전사를 촉진하게 된다[13, 14]. 동시에 TLR4를 통한 LPS 자극은 JNK(c-Jun N-terminal Kinase), p38 MAPK 등의 인산화를 유도하는데, 인산화 된 JNK, p38은 전사 인자인 Activator protein 1과 STAT1을 활성화하여 iNOS, COX-2, TNF-α, IL-1β, IL-6 등의 생성을 증강시키게 된다. 실제로 이번 연구에서 PB203은 LPS로 자극한 RAW264.7 세포에서 TLR4와 NF-κB의 발현을 감소시켰을 뿐만 아니라, NF-κB에 의해 조절되는 iNOS, COX-2, TNF-α, IL-1β의 발현을 모두 저해하는 것으로 나타나 PB203에 의한 항염증 활성이 TLR4/NF-κB 신호전달경로의 차단으로 인한 것임을 입증하였다(Figs. 2, 3A, B, D, E, and 4). 다만, PB203에 의한 TLR4 및 NF-κB의 발현 감소와 이로 인한 iNOS, COX-2, TNF-α, IL-1β 억제에도 불구하고, LPS에 의해 증가되는 전염증성 사이토카인의 하나인 IL-6의 발현에는 아무런 영향을 주지 않는 것으로 나타났는데(Fig. 3C and F), 그 원인을 규명하기 위해서는 IL-6의 생산을 유도하는 MAPKs, STAT1 등의 다른 신호전달경로에 미치는 PB203의 작용에 대한 추가 연구가 필요한 상황이다.
한편, 선천 면역계에서 생체 방어 기구의 최전선을 담당하는 대식세포는 숙주의 방어기구의 외부물질 침입을 가장 먼저 인지하여 체액성 면역과 세포성 면역에 관여하는데, 대식세포가 활성화되면 세포 증식과 확산 능력의 향상 등과 같은 세포의 형태적 변화만이 아니라 탐식능력의 증강, 염증 매개 인자 및 사이토카인의 증가를 수반함으로써 궁극적으로 암세포와 각종 유해균의 성장을 억제할 수 있는 것으로 여겨진다[51]. 최근에는 대식세포의 활성화를 통해 면역력을 증가시킬 수 있는 소재에 대한 연구가 활발히 진행되고 있는데, 특히 식물추출물과 같은 천연물질로부터 유래된 면역 증강제의 경우, 다양한 성분들의 상호작용을 통해 면역반응을 강화하거나 저하된 면역력을 회복시킬 수 있는 데다, 화학적 혹은 생물학적 소재에 비해 상대적으로 안전성이 높다는 장점이 있어 기대를 모으고 있다[52]. 이와 관련하여 Yang 등은 RAW264.7 세포에서 유자 에탄올 추출물의 면역력 증진 효과를 보고하였으며[53], Chen 등은 Russula griseocarnosa에서 추출된 polysaccharide PRG1-1이 RAW264.7 세포에서 MAPK와 NF-κB 신호전달경로를 통해 면역 증진 효과를 나타낸다는 결과를 발표하였고[8], Hong 등은 Cervus nippon mantchuricus extract를, Li 등은 Astragalus complanatus에서 얻은 플라보노이드를 이용하여 대식세포의 면역조절 활성 연구를 수행하였다[54, 55].
선천 면역에 기여하는 대식세포의 중요성을 고려할 때, PB203이 정상 대식세포를 자극하여 면역 증진 효과를 나타내는지 확인하기 위해 RAW264.7 세포에 PB203을 농도별로 처리하여 배양한 후 대식세포 및 선천 면역 활성화에 중요한 사이토카인 및 케모카인의 발현을 확인한 결과, PB203은 GM-CSF, G-CSF, MCP-1, TNF-α의 유전자 발현을 농도의존적으로 유의하게 상향 조절하였으며, 500 μg/mL 처리군에서는 IL-10, IL-1β, IL-6, IFN-γ의 발현까지도 유의하게 상승시키는 것으로 관찰되었다(Fig. 6). 이들 사이토카인과 케모카인은 모두 대식세포의 활성화 및 이를 통한 선천 면역의 기능 유지에 핵심적인 면역조절자로, 이들의 발현이 PB203에 의해 증가되었다는 것은 PB203이 대식세포를 통한 면역 증진, 더 나아가 선천 면역의 항상성 유지에 기여할 수 있음을 뒷받침하는 결과라 할 수 있다.
특히 LPS로 자극한 RAW264.7 세포에서 관찰된 PB203의 항염증 활성뿐 아니라, 정상 세포에서 나타난 사이토카인 증가 및 이로 인한 세포 활성화 역시 TLR4/NF-κB 신호전달경로를 경유하는 것으로 입증됨에 따라(Figs. 4 and 7), 대식세포에 대한 PB203의 항염증 효과 및 면역 증진 효과 모두에 있어 TLR4/NF-κB의 조절이 가장 핵심적인 기전임을 확인할 수 있었다. 실제로 Eo 등은 A. polygama의 열매를 물로 저온(4℃) 추출하여 다당류의 수득율을 높인 APE(A. polygama extract)를 제조한 다음 RAW264.7 세포에서 APE를 처리했을 때, APE가 iNOS, COX-2, TNF-α, IL-6, IL-1β의 mRNA 발현을 증가시켰을 뿐만 아니라, NF-κB 억제제 등을 이용한 실험을 통해 APE의 면역 증진 효과가 다당류에 의한 것이며, TLR4/NF-κB 신호전달경로를 경유하여 발현되는 것임을 보고하였다[56]. 본 연구에서도 이와 유사하게 PB203이 TLR4의 발현을 증가시키고 NF-κB를 경유하여 NO와 TNF-α의 생산을 유도한다는 사실이 확인되었으나(Fig. 7), APE와 추출방법이 다른 PB203의 면역 증진 효과가 APE처럼 전적으로 다당류에 기인한 것인지, 혹은 Ho 등이 보고한 플라보노이드와 폴리페놀에 의한 것인지[22], 아니면 다른 유효성분이 있는지에 대해서는 관련 연구가 더 진행되어야 할 것으로 판단된다. 또, NF-κB 억제제인 BAY 11-7082 처리에도 불구하고 NO 및 TNF-α가 PB203에 의해 BAY 11-7082 단독처리군(BAY 11-7082+media) 대비 여전히 유의한 수준으로 생산되었음을 고려할 때, 이들 인자들의 생산에 영향을 주는 MAPKs 등에 대한 PB203의 영향에 대해서도 추가 연구가 있어야 할 것으로 보인다.
추가적으로, PB203은 LPS를 처리한 대식세포뿐만 아니라, 정상 대식세포에서도 Nrf2를 통해 HO-1의 발현을 유도하는 항산화 작용을 나타냈으며(Figs. 1B, C, 5B, and C), 이러한 작용을 통해 PB203이 염증반응 유발 시의 산화적 스트레스 감소는 물론, 세포 활성화를 통한 면역 증진 상황에서의 항상성 유지에도 도움이 될 것으로 생각된다.
이상의 결과를 종합할 때, PB203은 LPS로 자극한 대식세포에서 염증 매개 인자와 전염증성 사이토카인을 억제함으로써 강력한 항염증 활성을 나타낼 뿐 아니라, 정상 대식세포에서 면역력 증진에 기여하는 다양한 사이토카인의 발현을 유도함으로써 염증성 질환의 완화 또는 선천 면역 강화를 위한 의약품 및 건강기능식품 소재로 활용 가능성이 높을 것으로 기대된다.







