Original Article
Anti-inflammatory effects of Rhizopus spp. fermentation products on ovalbumin-induced asthma in mice
Sanghun Kim1
,
Bohye Kim1
,
Sohi Kang1
,
Jeongmin Lee1
,
Jeongju Oh1
,
In-Sik Shin1
,
Changjong Moon1
,
Sung-Ho Kim1
,
Yun-Soo Seo2,*
,
Joong-Sun Kim1,*
Author Information & Copyright ▼
1College of Veterinary Medicine and BK21 Plus Project Team, Chonnam National University, Gwangju 61186, Korea
2Herbal Medicine Resources Research Center, Korea Institute of Oriental Medicine, Naju 58245, Korea
*Corresponding author: Yun-Soo Seo, Herbal Medicine Resources Research Center, Korea Institute of Oriental Medicine, Naju 58245, Korea, Tel: +82-61-338-7146, E-mail:
sys0109@kiom.re.kr
*Corresponding author: Joong-Sun Kim, College of Veterinary Medicine and BK21 Plus Project Team, Chonnam National University, Gwangju 61186, Korea, Tel: +82-62-530-2815, E-mail:
centraline@jnu.ac.kr
© Research Institute of Veterinary Medicine, Chungbuk National University.
Received: Dec 25, 2022; Revised: Jan 11, 2023; Accepted: Jan 11, 2023
Abstract
Fermentation by Rhizopus spp. has been used as a traditional medicine for treating various inflammatory diseases. Allergic asthma is a chronic respiratory disease that is caused by an exaggerated immune response. This study was conducted to ascertain the anti-inflammatory effects of Rhizopus spp. fermentation extract (RU) on a mouse model of ovalbumin (OVA)-induced asthma. The animals were intraperitoneally injected OVA on day 1 and 7, followed by OVA intranasal inhalation on days 14 to 18. The animals were treated daily with RU (100 and 200 mg/kg) by oral gavage from day 18 to day 23. RU significantly decreased eosinophilia and the production of inflammatory cytokines and OVA specific immunoglobulin E in animals with asthma, along with reducing airway inflammation and mucus secretion in lung tissue. Histological changes in the lungs and levels of inflammatory mediators of allergic airway inflammation were evaluated. The regulatory effects of RU on type 2 helper T (Th2) cell activation were investigated. RU administration attenuated asthmatic changes such as inflammatory cell infiltration and mucus production, decreased the levels of Th2-related cytokines, and reduced Th2 cell activation. Administration of RU effectively reduced allergic responses in asthmatic mice, which is associated with regulating Th2 cell activation and differentiation. These results indicate that RU can attenuate the respiratory symptoms of asthma.
Keywords: Rhizopus sp.; asthma; ovalbumin; cytokines; mice
INTRODUCTION
미세먼지와 대기 오염의 가속화, 흡연 인구의 증가 등의 이유로 발병하는 대표적인 환경성 질환으로 알려진 천식은 해마다 유병률이 증가되는 양상을 띠고 있으며, 천식으로 인한 사망률 또한 증가하고 있다[1]. 천식은 모든 연령대에 영향을 미치는 기도의 만성 염증성 질환이며, 천식 환자는 가역적 기관지 수축, 기도 염증, 점액 과분비, 기도 과민성 등 다양한 증상을 보인다[2, 3]. 연구의 주요 발전에도 불구하고 천식의 유병률은 최근 수십 년 동안 지속적으로 증가하였으며[4], 세계보건기구(WHO)의 보고서에 따르면 천식은 전 세계적으로 약 3억 3,900만 명에게 영향을 미치고, 상당한 건강 및 경제적 부담으로 작용하고 있는 실정이다[5, 6].
천식은 만성적인 기도의 염증성 병변으로, 기도에서는 Th2(T helper type 2) 면역 반응에 의해 조직병리학적으로 호산구, 비만세포, 림프구의 침윤이 관찰되며, 기도 재형성 즉 상피세포의 탈락, 술잔세포 증가, 기저막하부의 섬유화, 혈관 신생, 평활근의 비후 등의 소견을 관찰할 수 있다[7]. 천식의 발달에 중요한 원인으로 제기되는 Th2 타입의 면역반응은 다양한 자극 물질에 노출되면, IL-4, 5, 13 등의 사이토카인이 증가하게 된다[8]. IL-13은 비만 세포 활성화를 유발하는 면역글로불린 E(IgE)를 유도하여 다양한 전염증성 사이토카인 및 매개체를 방출한다[9]. IL-5는 호산구 축적을 일으키며[10], 축적된 호산구는 주요 염기성 단백질, 호산구성 양이온성 단백질, 호산구성 과산화효소와 같은 양이온성 단백질을 함유 및 배출하고, 이는 폐포 및 폐상피세포에 유독하다[11]. 이로 인하여 폐 및 비강 조직 내 염증반응을 유발하게 되며, 면역반응으로 인해 이주한 염증세포들은 전염증인자, 화학주성인자, 성장인자 등과 같은 매개인자들의 생성 및 방출을 증가시켜, 조직 내 염증반응을 더욱 악화시키게 된다. 이러한 일련의 반응으로 인하여 점액분비세포의 과형성 및 점액 분비가 증가되고, 호흡기계와 관련된 다양한 임상증상이 나타나게 된다. 따라서 Th2 반응을 억제하는 것이 천식 관리에 효과적인 접근법이 될 수 있다[12].
최근 들어 천식 마우스 모델에서 천식면역억제에 대한 천연물(강활, 백삼 등) 효능 연구가 활발하게 연구되고 있다[2, 13]. 우리나라는 전통적으로 곰팡이를 양조미생물로서 활용하여 누룩, 메주 등(조효소제)을 곡류에 발효시켜 제조 섭취함으로 대체 면역 강화 효과를 얻었다. 누룩 미생물 가운데 거미줄 곰팡이 발효추출물(Rhizopus spp., RU)은 발효 생산물에 다양한 생리활성 성분을 함유하고 있음이 보고되었으며, 기존 보고에 따르면 다양한 항산화 지표를 통해 항산화 효능이 확인되었다[14]. 거미줄 곰팡이 발효추출물은 갱년기 장애 예방 및 치료 경감을 위한 조성물로 프로스타글란딘을 활성화하고, 우울증 및 두통 예방 등 다양한 효능이 보고되었다[15, 16].
따라서, 본 연구에서는 난백알부민(ovalbumin, OVA; chicken egg albumin)으로 유도한 천식 마우스모델에서 거미줄 곰팡이 발효추출물을 경구 투여한 후 폐조직, 호산구 변화, 세포활성물질, T 세포의 분포와 활성 등의 분석을 통해 거미줄 곰팡이 발효추출물의 기관지 염증 억제 효능을 평가하고자 하였다.
MATERIALS AND METHODS
시험물질
본 실험에서 사용된 거미줄 곰팡이 발효추출물(RU)은 일본 우시고시 생리학 연구소(Sakura, Chiba, Ushikoshi, Tokyo, Japan)에서 구매하여 사용하였으며, 기존 논문에 보고된 내용을 참고로 사용하였다[17].
실험동물
6주령된 암컷 BALB/c 마우스를 ㈜두열바이오텍(Seoul, Korea)으로부터 공급받았으며, 적정량의 사료와 물을 공급하고, 온도 22 ± 2℃, 습도 55 ± 15%, 12시간–12시간(light-dark cycle)의 환경에서 1주간 적응시킨 뒤 실험에 사용하였다. 실험군은 PBS처리군(normal control, NC), 천식유도군(OVA), 천식유도 + 덱사메타손(5 mg/kg BW) 처리군(dexamethasone, DEX), 천식유도 + 저농도 RU(100 mg/kg BW) 처리군(RU100), 그리고 천식유도 + 고농도 RU(200 mg/kg BW) 처리군(RU200)으로 5군으로 군당 5마리씩 무작위로 나누어 시험하였다. 본 실험은 전남대학교 동물실험윤리위원회로부터 승인(동물사용윤리위원회 승인번호 CNU IACUC-YB-2022-69)을 받아 동물윤리준칙에 의거하여 실험하였다.
천식 유발 및 시험 물질 투여
천식동물모델은 기존 보고된 연구결과를 근거로 모델을 정립하였다[18]. 항원 감작을 위해 OVA 50 μg과 수산화알루미늄 2 mg을 현탁한 용액을 200 μL씩 실험 시작일로부터 1주 간격으로 2회 복강 투여하였다. 그리고 첫 번째 복강 투여 후 14일부터 18일까지 OVA 용액(0.5 mg/mL in PBS, 50 μL)을 비강 투여함으로써 폐기도 내 알러지성 염증반응을 유도하였다. RU는 각 100 mg/kg 및 200 mg/kg의 농도로 설정하여 첫 번째 OVA를 복강 투여 후 12일부터 18일까지 경구 투여하였다. 대조 약물군으로는 덱사메타손(DEX)을 5 mg/kg의 농도로 동일기간동안 경구 투여하였고, 그 외의 실험군은 동량의 PBS를 경구 투여하였다. 마지막 시험 물질 투여 다음날 마취 후 조직을 수집하였다.
병리조직학적 검사
기관지폐포세척을 시행하지 않은 좌측 폐를 떼어내어 4% paraformaldehyde에 고정시킨 후 조직절편을 만들었다. H&E(hematoxylin & eosin) 염색과 PAS(periodic acid-schiff) 염색을 실시하였으며, 광학현미경(Olympus BX53, Olympus, Tokyo, Japan)을 이용하여 병리조직학적 검사를 수행하였다[19].
기관지폐포세척액 중 염증세포 측정
기관지 폐포세척액(bronchoalveolar lavage fluid, BALF)은 마취 후 기관지에 PBS 0.7 mL 를 주입한 후 회수하는 방법으로 2회 반복하여 얻었다. 1회에 0.7 mL의 PBS를 2회 주입하여 수거하였으며, 수거율은 90% 이상이었다. BALF는 원심분리하여 상층액은 사이토카인 측정에 사용하였으며, 세포는 PBS 1 mL에 다시 혼합하여 BALF 중 총 세포 수를 측정하였다. 남은 검체는 Cytospin에 넣고 슬라이드 도말하여 Diff-Quick 염색한 후 백혈구 감별을 실시하였다.
기관지폐포세척액 중 사이토카인 측정
기관지폐포세척액의 사이토카인 IL-4 측정은 Mouse interleukin 4 Immunoassay kit(R&D System, Minneapolis, MN, USA)를 사용하였다. 실험은 2회 반복으로 하였다.
혈청 내 난백 알부민-특이 IgE 생성량 측정
실험 종료 후 각 군에서 채취한 혈청으로 혈청 내 IgE 및 OVA-특이 IgE(BD Biosciences, San Diego, CA, USA) 항체반응정도를 ELISA방법을 이용하여 측정하였다. 먼저 OVA의 농도를 100 μg/mL로 희석하여 96-well plate에 각 well 당 100 μL씩 분주하였으며, 이에 결합하는 각각의 특이 항체를 측정하고, 이때 표준 시료의 농도를 100 A.U.(arbitrary unit)로 가정하고 단계별로 희석하여 표준농도곡선을 얻은 다음 상대적인 단위 (A.U.)를 구하였다.
FACS(fluorescence-activated cell sorting) 분석을 통한 분화능 시험
실험 종료 후 적출한 폐 조직을 잘게 썰어 collagenase를 가하여 배양을 한 후 cell strainer(40 μm)를 이용하여 세포를 획득하였다. 획득한 현탁액은 ACK Lysing Buffer(Thermo Fisher Scientific, Waltham, MA, USA)를 이용하여 적혈구를 제거한 후 Flow Cytometry Staining Buffer(Thermo Fisher Scientific)로 완충액을 교체해 주었다. 획득한 세포는 최종적으로 cell strainer(40 μm)에 통과시켜 세포 이외의 분해되지 않은 조직이나 불순물을 제거한 후 4℃에서 형광표지 항체를 활용하여 세포 염색을 실시하였다. 획득한 세포 각각에 Anti-CD3-PerCP, Anti-CD4-FITC, Anti-CD25-APC-cy7, Anti-GATA3-PE 항체를 넣고 30분간 4℃에서 반응시켰다. 반응 후 Flow Cytometry Staining Buffer로 세척한 후 1% paraformaldehyde를 이용하여 고정한 후 분석을 진행하였다. 유세포분석은 CytoFLEX S(Beckman Coulter, Brea, CA, USA) 장비를 사용하여 진행하였으며, FlowJo 프로그램을 사용하여 CD3+ 세포 중 포함된 CD4+CD25+ 세포와 CD4+GATA3+ 세포의 비율은 분석하여 폐 조직내 면역세포의 분포 및 활성의 변화를 측정하였다.
통계처리
실험결과는 Prism 9을 이용하여 분석하였으며, 대조군과 약물 처치군 사이의 차이를 평가하기 위하여 One-way ANOVA로 통계 처리하였다. p값이 0.05 이하인 경우를 통계적 유의성이 있는 것으로 판단하였다.
RESULTS
RU(Rhizopus spp.)가 천식 마우스 모델에서 폐 조직병리학적 소견에 미치는 영향
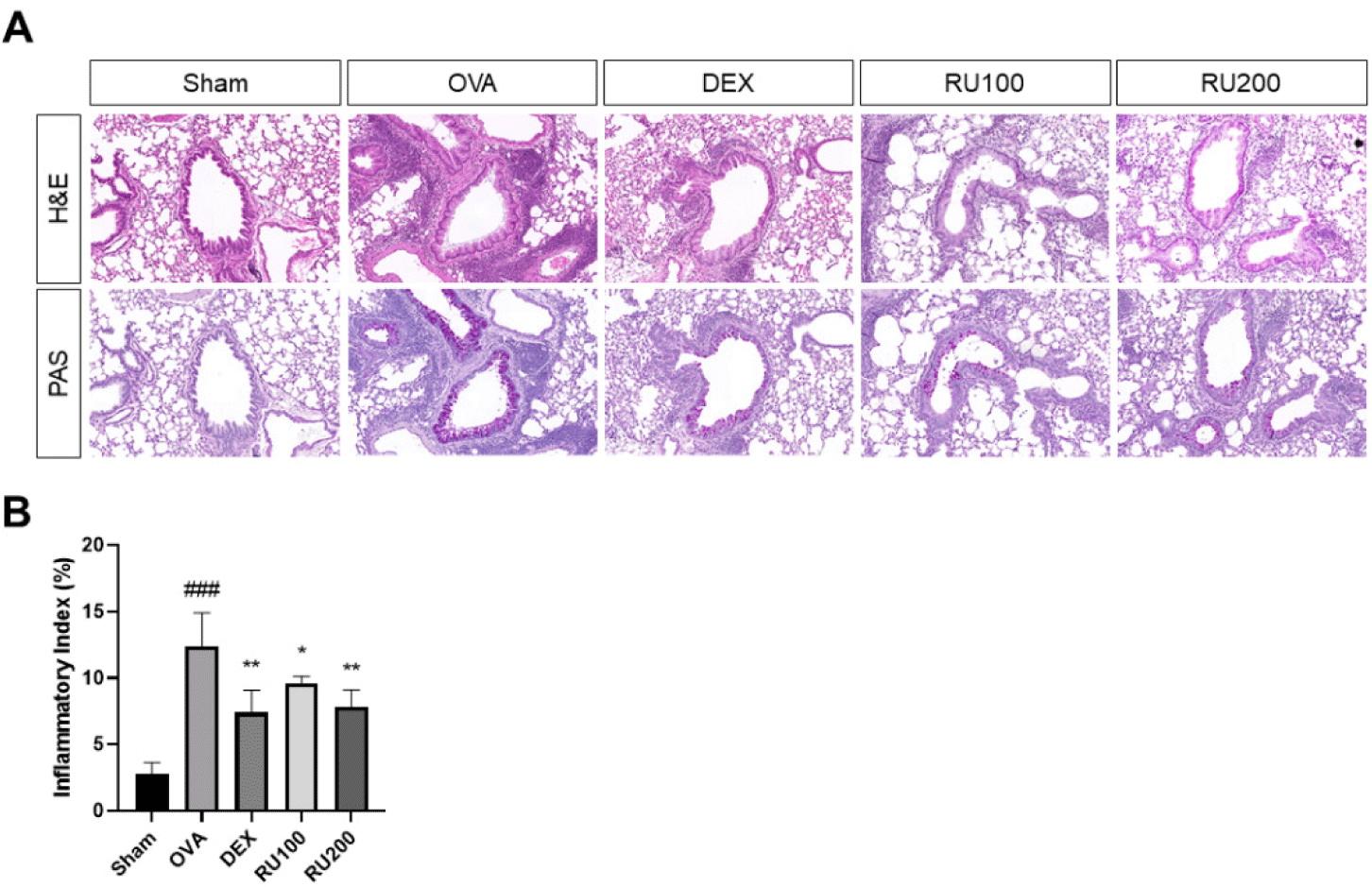
폐 조직 내의 염증세포 침윤 및 점액질 분비를 확인하기 위해 H&E 염색과 PAS 염색을 진행한 결과를 Fig. 1에 제시하였다. NC 군에서는 이상 소견이 관찰되지 않은 반면, OVA 군에서는 천식 유도에 따라 다량의 염증세포가 침윤되었고, PAS 양성세포가 증가하였다. 반면, DEX 군과 RU100 군 및 RU200 군의 폐 조직 염색 결과, OVA 군에 비해 염증세포 침윤 정도와 PAS 양성 세포가 감소하는 것으로 관찰되었다.
Fig. 1.
Effect of RU on histology of lung tissue in OVA-induced mice model of asthma.
(A) The lungs were stained by H&E (× 100), PAS (× 100). The percentages of (B) inflammation index. The data was expressed as means ± S.D. (n = 5). NC: PBS treatment and PBS challenge; OVA: PBS treatment and OVA challenge; DEX: dexamethasone (5 mg/kg) treatment and OVA challenge; RU100 and 200: RU (100 mg/kg and 200 mg/kg, respectively) and OVA challenge. ###p<0.001 versus NC, *, **p<0.05 and p<0.005 versus OVA. OVA, ovalbumin; DEX, dexamethasone; RU, Rhizopus spp.; H&E, hematoxylin & eosin; PAS, periodic acid-schiff; NC, normal control; PBS, phosphate buffered saline.
Download Original Figure
RU(Rhizopus spp.)가 천식 마우스 모델의 BALF(bronchoalveolar lavage fluid) 내 포함된 염증 세포 수에 미치는 영향
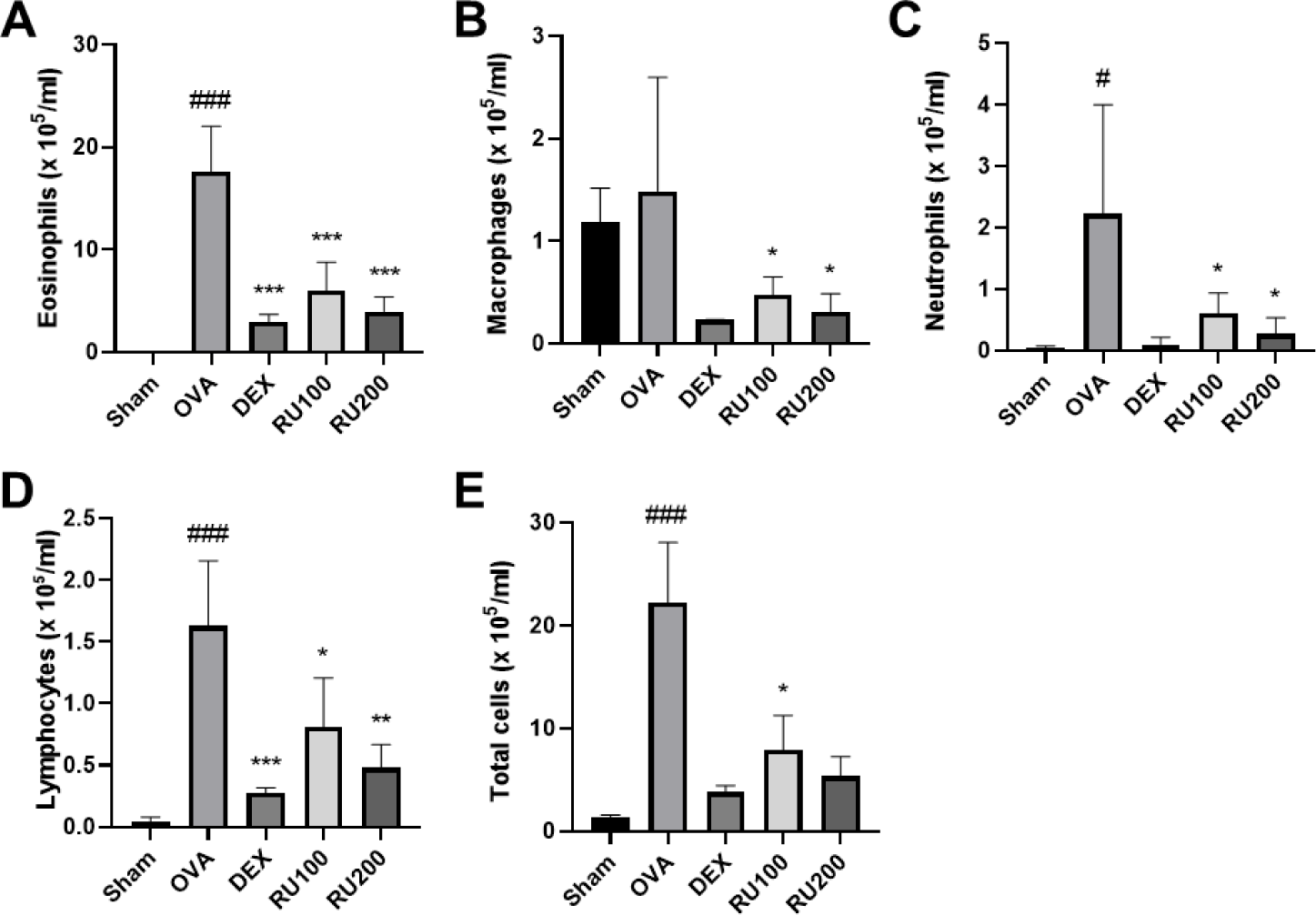
RU가 OVA로 유도된 천식 마우스에서 과민면역반응의 유도에 따른 폐조직내로의 염증세포 침윤에 미치는 영향을 확인하기 위해 백혈구 감별 계산을 통해 BALF 중 염증세포의 비율과 수를 확인하였으며, 해당 결과를 Fig. 2에 나타내었다. OVA 군의 경우, 총 세포 수를 비롯하여 대식세포, 호중구, 호산구 및 림프구의 수가 모두 NC군에 비해 증가한 것을 확인하였으며, 특히 천식에서 중요한 인자로 알려진 호산구의 수가 현저히 높아진 것을 확인하였다. DEX 군과 RU100 군 및 RU200 군의 경우, 과민성 면역반응 유도로 인해 증가된 염증세포의 수가 약물 처리에 의해 OVA군 대비 유의적으로 감소되는 것을 확인하였다.
Fig. 2.
Effects of RU on infiltration of inflammatory cells in BALF from OVA-challenged animals.
NC: PBS treatment and PBS challenge; OVA: PBS treatment and OVA challenge; DEX: dexamethasone (5 mg/kg) treatment and OVA challenge; RU100 and 200: RU (100 mg/kg and 200 mg/kg, respectively) and OVA challenge. The values are shown as the mean ± S.D. (n = 5). #p<0.01 and ###p<0.001 versus NC, *, **, ***p<0.05, 0.01, and 0.001 versus OVA. OVA, ovalbumin; DEX, dexamethasone; RU, Rhizopus spp.; BALF, bronchoalveolar lavage fluid; NC, normal control; PBS, phosphate buffered saline.
Download Original Figure
RU(Rhizopus spp.)가 천식 마우스 모델에서 Th2(T helper type 2) 사이토카인 및 IgE 수준에 미치는 효과
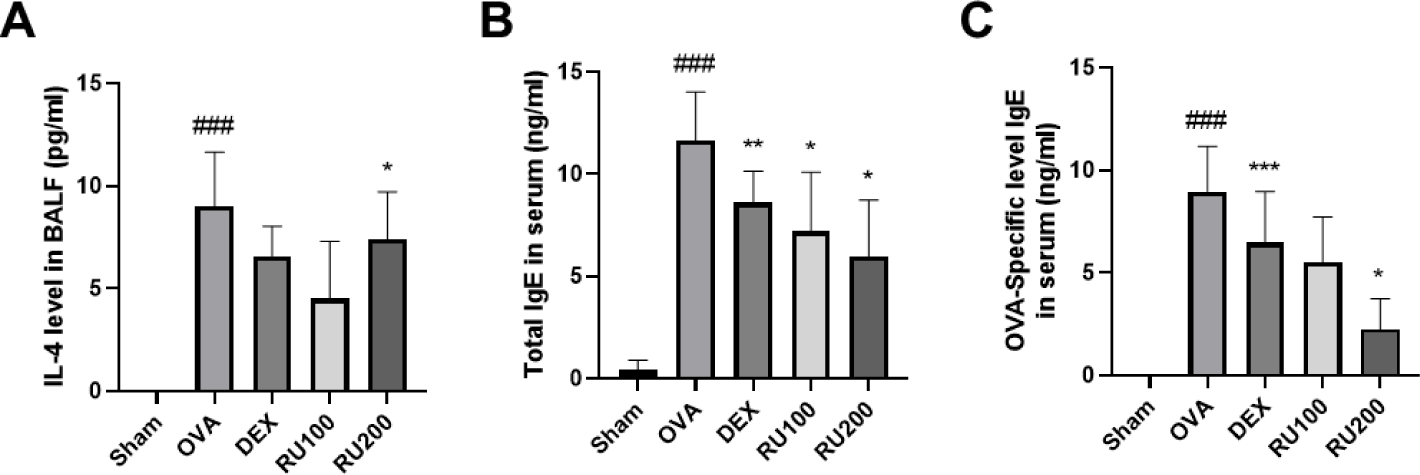
RU가 OVA로 유도된 천식 마우스의 BALF 중 IL-4의 농도와 혈청 내 IgE 농도에 미치는 영향을 Fig. 3에 나타내었다. OVA 군의 경우, 천식 반응이 유도됨에 따라 BALF 내 IL-4 및 혈청 내 IgE의 농도가 NC군에 비해 유의적으로 증가한 것을 확인하였다. 이러한 염증 매개 인자의 증가는 약물 처리에 따라 DEX 군과 RU100 군, RU200 군 모두에서 감소된 것을 확인하였다. 특히 알러지성 염증반응을 확인하는 주요 인자로 알려진 IgE의 경우, RU처리에 따라 농도의존적으로 감소하는 것을 확인할 수 있었다.
Fig. 3.
Effects of RU on IL-4 levels in BALF and total IgE and OVA-specific IgE levels in serum from OVA-challenged animals.
(A) IL-4, (B) total IgE, (C) OVA-specific IgE. NC: PBS treatment and PBS challenge; OVA: PBS treatment and OVA challenge; DEX: dexamethasone (5 mg/kg) treatment and OVA challenge; RU100 and 200: RU (100 mg/kg and 200 mg/kg, respectively) and OVA challenge. The values are shown as the mean ± S.D. (n = 5). ###p<0.001 versus NC; *, **, ***p<0.05, 0.01, and 0.001 versus OVA. BALF, bronchoalveolar lavage fluid; OVA, ovalbumin; DEX, dexamethasone; RU, Rhizopus spp.; NC, normal control; PBS, phosphate buffered saline.
Download Original Figure
난백알부민으로 유도한 천식 마우스 모델의 폐 조직에서 CD4+ T 세포 활성화에 미치는 영향
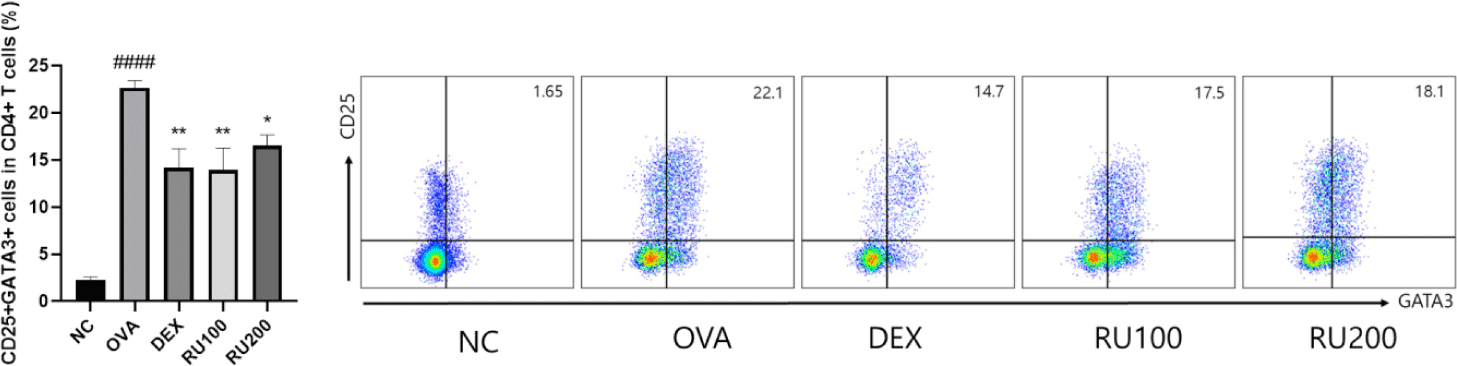
RU가 OVA로 유도된 천식 마우스의 폐 조직에서 T세포의 분화와 활성에 미치는 영향을 확인하기 위해 유세포 분석법을 이용하여 폐조직 내 면역세포의 비율을 확인하였으며, 해당 결과를 Fig. 4에 나타내었다. Th2 세포의 subtype marker(GATA3)와 T 세포의 활성도 마커(IL2 수용체, CD25)를 통해 활성화 되어 있는 Th2 세포의 비율을 확인한 결과, OVA 군의 경우, 천식이 유도됨에 따라 CD25+GATA3+세포의 비율이 NC군에 비해 유의적으로 상승한 것을 확인할 수 있었다. DEX 군과 RU100 군, RU200 군의 CD25+GATA3+ 세포 비율은 약물 처리에 따라 OVA 군에 비해 유의적으로 감소하는 것을 확인하였다.
Fig. 4.
Effects of RU on activation of Th2 cells in lung from OVA-challenged animals.
NC: PBS treatment and PBS challenge; OVA: PBS treatment and OVA challenge; DEX: dexamethasone (5 mg/kg) treatment and OVA challenge; RU100 and 200: RU (100 mg/kg and 200 mg/kg, respectively) and OVA challenge. The values are shown as the mean ± S.D. (n = 5). ####p<0.001 versus NC; *, **p<0.05 and 0.01 versus OVA. NC, normal control; OVA, ovalbumin; DEX, dexamethasone; RU, Rhizopus spp.; Th2, T helper type 2; PBS, phosphate buffered saline.
Download Original Figure
DISCUSSION
본 연구에서는 기침, 가래 등의 폐질환과 결핵, 당뇨병, 발기부전 등의 치료에 동북아시아 국가들의 전통 약재로 사용되어 온 거미줄 곰팡이 추출물이 염증과 천식에 어떠한 효과를 갖는지 알아보기 위해 OVA로 유도된 천식 동물모델에서 염증 반응에 미치는 영향을 평가하였다. 기존 연구를 통하여 OVA 유도 천식 마우스 모델은 호산구 모집, IgE 생산 및 잔 세포 증식을 유발하는 알레르겐 유도 Th2 세포 사이토카인 분비 연구에 대해 잘 확립되어 있다[20]. 본 연구에서도 OVA로 천식을 유도한 후 BALF와 혈액, 그리고 폐 조직에 대해 분석한 결과, BALF 중 사이토카인(IL-4)이 증가하였고, 중성구, 호산구, 림프구, 대식세포 및 총 세포수가 증가하였으며, 혈청 내 IgE 농도 또한 NC 군에 비해 유의하게 증가하였다. 천식이 유도된 동물모델에 대해 양성대조물질인 DEX와 저농도 RU(RU100) 및 고농도 RU(RU200)를 처치한 후에는 총 세포수가 현저히 감소하였으며, 세부적인 세포의 종류로는 대식세포, 호중구, 호산구, 림프구의 수가 OVA 군에 비하여 통계적으로 유의한 수준으로 감소하였다. 각 세포의 수는 RU100군보다 RU200 군에서 더욱 감소하였지만 DEX보다는 높은 수준으로 나타났다. 조직병리학적으로도 이와 비슷한 결과가 나타났는데, 각 군에 대해 폐의 염증 세포 침윤 정도를 비교한 결과, OVA 군에서 폐의 염증 세포 침윤 정도가 가장 컸으며, 다음 순차적으로 LRU, HRU, DEX 순으로 나타났고, NC 군에서는 염증이 거의 관찰되지 않았다. Th2 사이토카인은 천식 발병에 매우 중요한 인자로 여겨지고 있으며, 특히, IL-4는 B세포의 형질세포로의 분화를 촉진하고, IgE 생산에 중요한 역할을 하며, 천식과 같은 제1형과민반응에서 비만 세포의 탈과립(degranulation)이나 감작 반응에 중요한 역할을 하는 인자로 알려져 있다[21]. 본 연구에서는 약물 처리에 따른 BALF와 혈청 내 염증성 인자의 수치를 측정해본 결과, 정도의 차이는 있지만 양성대조약물인 DEX와 마찬가지로 RU의 투여가 BALF 중 호산구의 수와 IL-4 분비를 감소시키고, 혈청내 총 IgE와 OVA 특이적 IgE의 수치를 낮추는 것을 확인하였다. 이를 통해 RU의 투여가 천식의 주요 지표인 폐기도 내 염증세포의 침윤과 관련 염증매개인자의 발현을 억제함으로써 천식에 대한 유효한 치료효과를 나타내는 것으로 판단된다.
Th2 세포는 천식의 발병 및 진행과정에서 중요한 역할을 하는 것으로 알려져 있다. 공기중 오염원이나 집먼지진드기와 같이 기도로 유입된 항원은 항원제기세포에 의해 Th2 세포의 활성과 Th2 사이토카인의 분비를 유발한다. 이렇게 분비된 사이토카인은 객담의 분비, 호산구 등 염증세포의 모집 및 활성화, 기관지 수축 등을 유발하며, 천식의 증상 발현에 직접적으로 영향을 미친다[22]. RU 투여에 의한 염증세포의 침윤 및 염증매개인자의 발현 억제효과가 T 세포와 직접적인 연관성이 있는지 확인하기 위해 폐조직 내 T 세포에서 CD25와 GATA3의 발현을 유세포 분석법을 통해 분석하였다. T세포의 증식과 활성화에 관여하는 것으로 잘 알려진 IL2의 수용체인 CD25와 helper T 세포 중 Th2 세포의 subtype marker인 GATA3 양성 세포의 비율이 RU의 투여에 따라 감소되는 것을 확인하였으며, 이를 통해 RU의 천식 조절 작용이 T 세포의 분화 및 활성 억제를 통한 작용일 것으로 판단된다.
최근 들어, 천식 동물모델에서 Renifolin F의 치료 효과[23], Pistacia weinmannifolia 뿌리 추출물의 보호 효과[24], Phlomis umbrosa Turczaninow의 항-천식 효과[25] 등, 여러 천연물에 대한 효능이 보고되어 왔지만 거미줄 곰팡이 발효추출물(Rhizopus sp.)의 천식 개선 효과를 구명한 것은 본 연구가 처음이다. 본 연구 결과를 토대로, 거미줄 곰팡이 발효추출물이 기관지 내 천식과 관련된 인자들의 발현 수준을 감소시키는 것으로 판단되지만, IL-5, TNF-a, platelet aggregating factor, eosinophil chemotactic factor 등과 같은 천식과 관련된 인자들에 대해서도 유효성이 있는지는 추가적 연구가 필요하다.
본 연구에서는 천식을 유도한 마우스에서 거미줄 곰팡이 발효추출물의 알레르기성 염증 반응의 개선 효과를 규명하였다. 그 결과, 거미줄 곰팡이 발효추출물은 BALF에서 염증성 사이토카인 중 IL-4 분비량과 T세포 중 Th2 세포의 비율을 유의하게 억제시켰고, 혈청 내 IgE 농도를 감소시켰으며, 결과적으로 호산구를 비롯한 염증세포의 수의 감소 및 폐 조직 내 염증세포 침윤 정도를 유의하게 억제시켰다. 따라서 거미줄 곰팡이 발효추출물은 기관지 염증으로 유도되는 천식을 개선하는 데 효과가 있을 것으로 사료된다. 다만, 천식의 진단 지표로 활용되는 기도과민성에 미치는 영향이나 분자생물학적 기전 및 유효성분 구명을 위한 추가적인 연구가 필요하다.
Acknowledgements
This work was supported by the research grant of the Chonnam National University (No. 2022-2603).
References
Park JK, Choi YJ, Jung WS. An analysis on the distribution characteristics of PM10 concentration and its relation to the death from Asthma in Seoul, Korea. J Environ Sci Int 2015;24:961-968.

Ji JG. The convergence study on the effects of white ginseng complex extracts on OVA-induced allergic asthma in mice. J Digit Converg 2016;14:317-323.

Chung MH, Park H. Symptom experiences, sleep quality and quality of life for patients with asthma. J Korea Acad Ind Coop Soc 2016;17:616-628.

Boulet LP, FitzGerald JM, Reddel HK. The revised 2014 GINA strategy report: opportunities for change. Curr Opin Pulm Med 2015;21:1-7.


Blanc PD, Annesi-Maesano I, Balmes JR, Cummings KJ, Fishwick D, Miedinger D, Murgia N, Naidoo RN, Reynolds CJ, Sigsgaard T, Torén K, Vinnikov D, Redlich CA. 2019. The occupational burden of nonmalignant respiratory diseases. An official American Thoracic Society and European Respiratory Society statement. Am J Respir Crit Care Med 2019;199:1312-1334.



Dhong HJ, Ha BS, Rho HI, Bang EG, Lee CK. Histopathologic characteristics of chronic sinusitis with asthma. Korean J Otorhinolaryngol Head Neck Surg 2002;45:878-883.
Mitchell J, Dimov V, Townley RG. IL-13 and the IL-13 receptor as therapeutic targets for asthma and allergic disease. Curr Opin Investig Drugs 2010;11:527-534.
O’Byrne PM, Inman MD, Parameswaran K. The trials and tribulations of IL-5, eosinophils, and allergic asthma. J Allergy Clin Immunol 2001;108:503-508.


Pham TH, Damera G, Newbold P, Ranade K. Reductions in eosinophil biomarkers by benralizumab in patients with asthma. Respir Med 2016;111:21-29.


Lim HJ, Kim JG, Shim EK, Hong CH, Hwang CY. The inhibitory effects of cortex mori water extract in a mouse model of allergic asthma. J Tradit Korean Med 2004;14:82-102.
Bae JH, Yoo JH, Kil GJ. Effects of NR on production levels of cytokines and distribution of BAL cells in allergic asthma. Korea J Herbology 2010;25:33-38.
Song G, Lu Y, Yu Z, Xu L, Liu J, Chen K, Zhang P. The inhibitory effect of polysaccharide from Rhizopus nigricans on colitis-associated colorectal cancer. Biomed Pharmacother 2019;112:108593.


Kim EJ, Song BN, Jeong DS, Kim SY, Cho YS, Park SY. Anti-oxidative and anti-inflammatory activities of fermented turmeric (Curcuma longa L.) by Rhizopus oryzae. J Life Sci 2017;27:1315-1323.
Mingist M, Ushikoshi S, Ueda H. In vivo and in vitro effects of Rhizopus extract on body growth and steroid production in masu salmon, Oncorhynchus masou Brevoort. Aquac Res 2007;38:708-717.

Nam HH, Lee JH, Ryu SM, Lee S, Yang S, Noh P, Moon BC, Kim JS, Seo YS. Gekko gecko extract attenuates airway inflammation and mucus hypersecretion in a murine model of ovalbumin-induced asthma. J Ethnopharmacol 2022;282:114574.


Lee S, Chun JM, Lee JH, Seo YS, Park JH, Lee HJ, Moon BC, Kim SH, Kim JS. Celecoxib, a selective cyclooxygenase-2 inhibitor, aggravates radiation-induced intestinal damage in mice. J Biomed Transl Res 2021;22:12-18.

Fish SC, Donaldson DD, Goldman SJ, Williams CMM, Kasaian MT. IgE generation and mast cell effector function in mice deficient in IL-4 and IL-13. J Immunol 2005;174:7716-7724.


Hansbro PM, Scott GV, Essilfie AT, Kim RY, Starkey MR, Nguyen DH, Allen PD, Kaiko GE, Yang M, Horvat JC, Foster PS. Th2 cytokine antagonists: potential treatments for severe asthma. Expert Opin Investig Drugs 2013;22:49-69.


Lee JW, Min JH, Kim MG, Kim SM, Kwon OK, Oh TK, Lee JK, Kim TY, Lee SW, Choi S, Li WY, Ryu HW, Ahn KS, Oh SR. Pistacia weinmannifolia root exerts a protective role in ovalbumin-induced lung inflammation in a mouse allergic asthma model. Int J Mol Med 2019;44:2171-2180.



Pak SW, Lee AY, Seo YS, Lee SJ, Kim WI, Shin DH, Kim JC, Kim JS, Lim JO, Shin IS. Anti-asthmatic effects of Phlomis umbrosa Turczaninow using ovalbumin induced asthma murine model and network pharmacology analysis. Biomed Pharmacother 2022;145:112410.