INTRODUCTION
피부 노화는 원인에 따라 내인성 노화와 외인성 노화로 나뉘는데, 내인성 노화는 호르몬이나 세포 노화에 의해 유발되며, 외인성 노화는 자외선(ultraviolet, UV), 대기 오염 물질, 흡연 및 감염과 같은 다양한 요인에 의해 발생한다[1–3]. 이 중에서 자외선에 의한 노화 현상을 광노화(photoaging)라고 하는데, UV에 과도하거나 지속적으로 노출되면 피부에서 활성산소종(reactive oxygen species, ROS)의 생성을 촉진해 DNA를 손상시키고 단백질의 구조를 변화시키며, SOD(superoxide dismutase)와 같은 항산화 효소의 발현을 감소시키고 염증반응을 유발하여 피부 광노화뿐 아니라 피부암까지도 유발할 수 있는 것으로 알려져 있다[3–8].
UV 노출에 의한 ROS 증가는 MAPK(mitogen-activated protein kinase) 신호 전달 경로를 활성화하여AP-1(activated protein-1) 복합체를 형성하는 c-Jun 및 c-Fos의 발현을 증가시킨다[9–11]. AP-1은 c-Jun과 c-Fos의 heterodimer로 존재할 때 가장 높은 전사활성을 나타내는 전사인자로 UV에 의해 인산화 된 ERK(extracellular signal-regulated kinase), JNK(c-Jun N-terminal kinase) 및 p38 MAPK가 증가되면, c-Jun 및 c-Fos 단백질의 발현 및 활성화가 순차적으로 유도된다. AP-1이 활성화되면, 피부 탄력과 수화 능력을 유지시키는 collagen, elastin과 같은 세포외기질(extracellular matrix, ECM) 단백질을 분해하는 MMPs(matrix metalloproteinases)의 발현이 강력하게 유도되는데, 이는 결국 피부 주름 형성을 촉진하여 광노화를 일으키게 된다[9, 12–16].
한편, filaggrin은 각질세포의 말단 분화와 피부 장벽(skin barrier) 기능 및 피부 보습에 중요한 단백질로 involucrin, loricrin과 함께 UV 노출에 대한 첫 번째 방어선인 각질층 형성에 관여하는데, UV는 이러한 filaggrin 등의 발현을 감소시킴으로써 표피의 수분 손실을 증가시킨다[17–20]. 결국 UV 노출은 MMPs에 의한 collagen 분해를 촉진하여 피부 주름 형성을 가속화할 뿐 아니라, filaggrin 등의 각질층 단백질 감소로 인한 피부 수분 손실 및 장벽 기능의 저하를 초래하므로, 이러한 광노화로부터 피부를 보호하기 위해서는 UV에 의한 산화적 스트레스를 감소시키고 피부의 분자생물학적 변화를 개선할 필요가 있다.
개다래나무(Actinidia polygama)는 다래나무과(Actinidiaceae)의 다년생 식물로 한국, 중국, 러시아, 일본 등에 분포하며, 복통, 중풍, 류마티스 관절염 등을 치료하는 데 사용되어져 왔다[21, 22]. 또, 다양한 논문에 따르면, 개다래 추출물은 ovalbumin으로 유도한 천식 마우스에서 호산구혈증과 기관지의 과민반응을 억제하였으며, 고지방식이 유도 비만 마우스에서 항비만 효과를 보였을 뿐 아니라, 항염증 활성과 함께 암세포의 증식 억제 작용을 가진 것으로 확인되었다[23–26]. 이 밖에도 선행 연구를 통해 개다래 추출물이 UVB(ultraviolet B)를 조사한 무모 마우스에서 collagen과 MMPs의 발현을 조절하여 피부 주름 형성과 수분 손실을 억제함으로써 자외선에 의한 피부 손상을 개선한다는 사실이 확인되었으나[27], 개다래 추출물의 피부 광노화 억제 기전에 대해서는 아직 정확히 규명되지 않은 상태이다.
이에 본 연구에서는 UVB를 조사한 무모 마우스와 인간 각질세포에서 개다래 추출물(PB203)의 광노화 억제 효과를 검증하고 분자생물학적 작용 기전을 확인함으로써 자외선에 의한 피부 손상 및 피부 보습을 개선하는 신규 건강기능식품 소재로서 PB203의 활용 가능성을 평가하고자 하였다.
MATERIALS AND METHODS
개다래 추출물(PB203)을 제조하기 위해 국내산 개다래나무의 열매 건조물을 구입한 다음, 이를 칭량 및 세척하고 원재료의 약 14배에 해당하는 정수를 투입한 후 85 ± 5℃의 조건에서 4–8시간 동안 환류 추출하였다. 추출물은 여과를 거친 다음, 60℃ 이하에서 감압 농축하였으며, 이후 농축액을 덱스트린과 고형분 기준 7:3으로 혼합하고 살균 및 건조과정을 거쳐 분말 형태의 시험물질인 PB203을 제조하였다. 한편, 동물실험에 사용할 양성대조물질은 ㈜휴온스내츄럴(Jincheon, Korea)의 허니부쉬발효추출분말(HU-018)을 사용하였으며, 시험물질과 양성대조물질은 모두 추출물 고형분 기준으로 투여량을 설정하였다.
식물의 대표적인 항산화 성분인 플라보노이드와 폴리페놀이 PB203에 얼마나 함유되어 있는지 확인하기 위하여 다음과 같이 총 플라보노이드와 총 폴리페놀의 함량을 측정하였다. 먼저 총 플라보노이드 함량은 Byun 등의 방법을 응용하여 분석하였다[28]. 0.1 mL의 PB203과 1 mL의 diethylene glycol을 혼합한 다음 0.1 mL 1 N NaOH를 추가하여 1시간 동안 37℃에서 반응시킨 후, microplate reader(SpectraMax ABS Plus, Molecular Devices, San Jose, CA, USA)를 이용하여 420 nm에서 흡광도를 측정하였다. 표준물질로는 naringin(purity ≥ 95%; Sigma-Aldrich, St. Louis, MO, USA)을 사용하였으며, naringin의 검량선을 이용하여 총 플라보노이드 함량을 산출한 후, mg NE(naringin equivalent)/g of extract로 표현하였다.
총 폴리페놀 함량은 Folin과 Denis 방법에 따라 Folin-Ciocalteu 시약(Sigma-Aldrich)이 추출물의 폴리페놀성 화합물에 의해 환원되어 몰리브덴 청색으로 발색되는 원리를 이용하여 분석하였다[29]. 우선 PB203을 물에 녹여 1 mg/mL 농도로 만들어 100 μL를 취한 다음, 여기에 Folin-Ciocalteu 시약 40 μL와 증류수 400 μL를 가하였다. 이를 상온에 5분간 방치한 후, 20% Na2CO3 400 μL를 가하고 다시 상온에서 1시간 반응시킨 다음, microplate reader(Molecular Devices)를 이용하여 765 nm에서 반응액의 흡광도를 측정하였다. 표준물질로는 gallic acid(purity ≥ 98.5%; Sigma-Aldrich)를 사용하였으며, gallic acid의 검량선을 이용하여 총 폴리페놀 함량을 산출한 후, mg GAE(gallic acid equivalent)/g of extract로 기재하였다.
PB203의 항산화 활성을 평가하기 위해 Re 등의 방법에 따라 ABTS 라디칼 소거능 시험을 실시하였다[30]. 구체적으로, 7.4 mM ABTS(Sigma-Aldrich)와 2.6 mM potassium persulphate(Sigma-Aldrich)를 1:1로 혼합한 후, 실온 조건의 암소에서 24시간 반응시킨 다음, 반응액을 증류수로 희석하여 734 nm에서 흡광도 값이 0.7 ± 0.1이 되게 맞춘 ABTS solution을 제조하였다. 이후 96-well plate에 농도별로 제조된 PB203 50 μL와 ABTS solution 150 μL를 처리하여 암소에서 10분 동안 반응시킨 뒤, microplate reader(Molecular Devices)를 이용하여 734 nm에서 흡광도를 측정하였다.
한편, DPPH 라디칼 소거능은 Brand-Williams 등의 방법을 변형하여 농도별로 제조된 PB203 100 μL에 0.36 mM DPPH(Sigma-Aldrich) 에탄올 용액 100 μL을 96-well plate에서 30분 동안 반응시킨 다음, microplate reader(Molecular Devices)를 이용하여 515 nm에서 흡광도를 측정하였다[31].
ABTS 및 DPPH 라디칼 소거능 (%)은 측정된 흡광도 값을 이용하여 아래 식에 따라 계산하였다.
실험동물은 ㈜오리엔트바이오(Seongnam, Korea)에서 6주령의 암컷 SKH-1 무모 마우스를 공급받아 사용하였다. 실험 당일까지 고형사료(항생제 무첨가)와 물을 충분히 공급하고 온도 23 ± 2℃, 습도 55 ± 10%, 12시간-12시간(light-dark cycle)의 환경에서 1주간 순화한 후 실험에 사용하였다. 모든 동물실험 과정은 NIH(National Institutes of Health)의 실험동물관리 규정(Principle of Laboratory Animal Care)을 준수하면서 중앙대학교 동물실험윤리위원회(Institutional Animal Care and Use Committee, IACUC)의 승인을 받아 수행하였다(No. 201800110).
UVB 조사를 통한 피부 손상 유발은 Im 등의 연구에서 사용된 방법을 응용하였다[19]. 총 48마리의 마우스를 12마리씩 4군으로 나눈 다음, BIO-LINK(Vilber, Collégien, France)를 사용하여 주 3회씩 총 12주 동안 UVB를 50 mJ/cm2(1 MED, minimal erythemal dose)부터 80 mJ/cm2까지 매 2주마다 10 mJ/cm2씩 강도를 증가시킨 후, 12주까지 80 mJ/cm2을 유지하면서 피부에 조사하였다. 동시에 UVB를 조사한 동물을 대상으로 시험물질인 PB203과 양성대조물질인 HU-018을 각각 추출물 고형분 기준 100 mg/kg/day로 12주간 경구투여 하였으며, UVB를 조사하지 않은 정상군과 UVB를 조사한 유발대조군은 부형제인 saline을 12주간 경구투여 하였다. 또, 시험기간 동안 동물의 건강 상태를 확인하기 위하여 주 1회씩 체중을 측정하였다.
광노화에 따른 피부 상태 변화를 평가하기 위해 UVB 조사 12주 후에 Zoletil(Virbac, Carros, France) 40 mg/kg와 Rompun(Bayer Korea, Seoul, Korea) 5 mg/kg을 이용하여 마우스를 마취시키고, DermascopeⓇ(Dino-Lite, NN Almere, Netherlands)을 이용하여 피부의 상태를 근접 촬영하였다. 또, 피부 거칠기 변화는 피부 주름의 3차원 측정장비인 PRIMOSLite(GFMesstechnik GmbH, Berlin, Germany)를 이용하여 촬영하였다. 이때, 촬영된 이미지는 PRIMOS 전용 소프트웨어인 PRIMOSLite version 5.8E program을 이용하여 Ra(average roughness), Rmax(maximum roughness)와 같은 피부 거칠기 분석에 사용하였다.
UVB 조사 12주 후, 무모 마우스 등 피부의 경피수분손실량(transepidermal water loss, TEWL)을 TewameterⓇ(Courage+Khazaka Electronic GmbH, Cologne, Germany)로 측정하였다. 또, CorneometerⓇ(Courage+Khazaka Electronic GmbH)를 이용하여 피부 수분량을 측정하였다. 경피수분손실량과 피부 수분량의 측정 장소는 실내 온도 22℃–24℃, 습도 50%–60%로 유지하였으며, 경피수분손실량은 초기값을 제외한 평균값 중 편차가 가장 작은 값을 사용하였고, 피부 수분량은 동일 부위에서 수분량을 3회 측정한 후 평균값을 이용하였다.
피부 탄력은 UVB 조사 12주 후에 탄력측정기인 CutometerⓇ(Courage+Khazaka Electronic GmbH)와 Ballistometer(BLS780, Dia-Stron, Andover, UK)를 이용하여 측정하였다. Cutometer는 지속적인 음압으로 측정시간 동안 probe 속으로 피부가 함몰된 뒤 음압이 제거되면 피부가 원래 상태로 돌아가는 원리를 이용하여 진피층의 탄력도를 측정하는 장비로서 다양한 파라미터 중에서 대표적으로 R2(gross elasticity)와 R7(biological elasticity) 값을 측정하였다. 그리고, Ballistometer는 진동에너지를 가했을 때 파형이 유지되는 모양을 분석하여 피부의 탄력, 회복력, firmness, softness, 부종 등을 측정할 수 있는 장비로서 본 시험에서는 Indent(indentation depth)와 Alpha(rate of exponential decay) 값을 측정하였다.
피부 손상에 따른 피부 조직 구조의 변화를 관찰하기 위해 UVB 노출 12주 후에 마우스로부터 피부조직을 분리한 후 10% neutral buffered formalin에 고정하고, 저농도부터 고농도 에탄올 용액으로 단계적인 탈수과정을 거쳐 파라핀 블록을 제작하였다. 각 조직 블록을 5 μm의 두께로 절단하여 슬라이드에 조직 절편을 붙인 후, 각 조직 슬라이드를 xylene으로 탈파라핀화한 뒤, 알코올에 함수시켰다. 준비된 조직 슬라이드는 H&E(hematoxylin & eosin), MT(Masson’s trichrome) 및 VB(Victoria blue)로 염색한 다음, 광학현미경(Leica, Wetzlar, Germany)을 이용하여 조직의 상태를 관찰하고 Image J program을 이용하여 표피 두께를 측정하였다.
상기 동물 실험에서 획득한 무모 마우스의 피부 조직과 UVB를 조사한 HaCaT 세포로부터 TRIzol(Invitrogen, Waltham, MA, USA)을 사용하여 총 RNA를 추출하였다. HaCaT 세포 시험은 아래 세포 독성 시험과 동일한 방법을 사용하였다. 추출된 RNA를 주형으로 PrimeScriptTM RT master mix(Takara, Tokyo, Japan)를 이용하여 cDNA를 합성하였다. 이후 합성된 cDNA에 TOPrealTM SYBR Green qPCR PreMIX(Enzynomics, Seoul, Korea)를 가한 다음, StepOnePlusTM Real-Time PCR System(Applied Biosystems, Waltham, MA, USA)을 사용하여 qRT-PCR을 실시하였다. 각 유전자의 발현량은 ΔCt(cycle threshold) 값을 이용하여 계산하였고, internal control은 GAPDH(glyceraldehyde 3-phosphate dehydrogenase)를 사용하였다. 각 유전자별로 사용된 primer의 서열은 Table 1과 같다.
UVB 조사에 따른 피부 조직 단백질의 변화와 이에 대한 PB203의 효과를 평가하기 위해 무모 마우스의 피부 조직에 protease inhibitor와 phosphatase inhibitor를 포함하는 RIPA lysis buffer(Sigma-Aldrich)를 넣어 균질화 한 다음, 이를 원심분리(12,000 × g, 10 min, 4℃)하여 상층액을 취하고 bicinchoninic acid법으로 cell lysate의 총 단백질량을 측정하였다. 단백질 농도를 동일하게 맞춘 cell lysate에 sample buffer를 혼합하여 100℃에서 7분간 가열하고, 이렇게 준비된 단백질 시료를 SDS-PAGE로 전기영동 한 후, polyvinylidene difluoride membrane에 옮기고 5% BSA(bovine serum albumin)를 함유한 TBS(tris-buffered saline)를 사용하여 1시간 동안 blocking 하였다. 이후 1차 항체로서 anti-filaggrin, anti-involucrin, anti-loricrin(Invitrogen)과 anti-phospho-p38, anti-p38, anti-phospho-c-Jun, anti-c-Jun, anti-phospho-c-Fos 및 anti-c-Fos antibodies(Cell Signaling Technology, Danvers, MA, USA)를 0.2% BSA(in TBS)에 희석하여 1시간 동안 반응시킨 뒤, membrane을 세척하고, 2차 항체인 anti-mouse 또는 anti-rabbit antibodies(Amersham, Arlington Heights, IL, USA)를 반응시켰다. 반응이 끝난 후, ECL 용액으로 X-ray 필름에 감광을 시킨 다음, 발색된 밴드의 강도를 Image J program으로 분석하였다. Internal control은 β-actin을 사용하였다.
상기와 동일한 방법으로 획득한 무모 마우스 피부 조직의 cell lysate를 대상으로 Superoxide Dismutase Assay Kit(Cayman Chemical, Ann Arbor, MI, USA)를 사용하여 제조사의 매뉴얼에 따라 SOD 활성을 분석하였다. 또, 아래 세포 독성 시험과 동일한 방법으로 처리한 HaCaT 세포의 cell lysate에 대해서도 SOD 활성을 분석하였다.
인간 각질세포주(human keratinocyte cell line)인 HaCaT 세포(ATCC, Manassas, VA, USA)는 10% heat-inactivated fetal bovine serum(Sigma-Aldrich), 100 U/mL penicillin/streptomycin이 포함된 Dulbecco's modified Eagle's medium(Sigma-Aldrich)을 이용하여 37℃, 5% CO2 조건의 배양기에서 배양하였다.
HaCaT 세포에 대한 UVB 및 PB203의 세포 독성을 평가하기 위한 세포 생존율 실험은 WST-1(water soluble tetrazolium salt-1) assay 방법을 이용하였다. 먼저 세포를 12-well plate에 1 × 105 cells/well 농도로 분주하여 24시간 동안 안정화한 후, PB203을 각각 0, 10, 20 μg/mL의 농도로 처리하여 24시간 동안 배양하고 나서 세포를 PBS로 세척한 다음, UVB를 30 mJ/cm2로 조사한 후 다시 24시간 동안 배양하였다. 세포 배양 후 각 배양액을 96-well plate로 옮긴 다음, WST-1 solution(EZ-Cytox Plus, DoGenBio, Seoul, Korea)을 well당 10 μL씩 첨가하여 37℃에서 1시간 동안 반응시킨 다음, microplate reader(Molecular Devices)를 이용하여 450 nm에서 흡광도를 측정하고 세포 생존율(cell viability, %)을 계산하였다.
세포에 손상을 가한 후 세포 증식 및 이동에 의한 상처 회복율을 확인하기 위해 Muniandy 등의 방법을 변형하여 in vitro wound scratch and recovery assay를 실시하였다[32]. 구체적으로, 10 cm2 cell culture dish에 HaCaT 세포를 100% confluency 상태로 배양한 다음, UVB를 30 mJ/cm2로 조사하고 나서 1 mL 파이펫 팁으로 dish의 바닥을 긁어 상처를 발생시켰다. 그러고 나서 PBS로 dish를 2회 세척한 다음, PB203을 0, 10, 20 μg/mL로 처리하여 48시간 동안 배양하였다. 이 때, PB203 처리 전 및 48시간 후에 광학현미경(IX53, Olympus, Tokyo, Japan) 및 카메라로 동일 위치를 40배율로 촬영한 다음, ImageView version 3.7 program으로 상처의 간격 정도를 측정하여 상처 회복률(wound recovery rate, %)을 산출하였다.
RESULTS
플라보노이드와 폴리페놀은 여러 식물에 존재하는 대표적인 항산화성 물질로 ROS 생성을 억제하는 강력한 항산화 작용과 함께 항염증 작용 등 다양한 생리활성을 나타내는 것으로 알려져 있다[33, 34]. 이러한 플라보노이드와 폴리페놀이 PB203에 얼마나 함유되어 있는지 확인하기 위하여 총 플라보노이드 및 총 폴리페놀 양을 분석한 결과, 총 플라보노이드는 28.39 ± 0.58 mg NE/g of extract로 나타났으며, 총 폴리페놀은 61.67 ± 0.16 mg GAE/g of extract로 나타나 플라보노이드보다 폴리페놀의 함량이 더 높은 것으로 확인되었다. 또, PB203의 항산화 활성을 확인하기 위해 실시한 ABTS 및 DPPH 라디칼 소거능 시험에서 PB203은 라디칼을 50% 소거하는 농도인 IC50 기준으로 각각 259.83 ± 7.12 μg/mL과 269.74 ± 4.97 μg/mL의 값을 기록하였다. 이를 Lee와 Lee가 보고한 개다래 열매의 에탄올 및 증류수 추출물의 결과와 비교했을 때, 총 플라보노이드 함량 및 DPPH 라디칼 소거 활성은 더 높게 나타난 반면, 총 폴리페놀 함량 및 ABTS 라디칼 소거 활성은 더 낮거나 비슷한 수준으로 관찰되었는데[35], 이는 원재료의 산지, 채집시기나 추출방법 등의 차이에 기인한 것으로 생각된다.
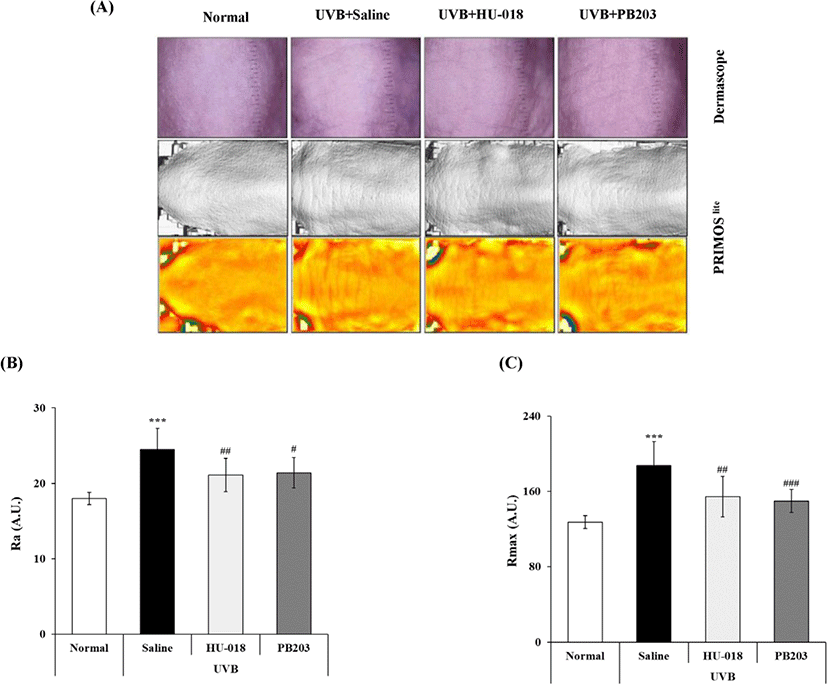
피부 주름 형성으로 인한 피부 거칠기의 증가는 자외선으로 인한 피부 손상, 즉 광노화의 가장 대표적인 변화이다[5, 7, 8]. PB203이 자외선 조사에 의한 피부 거칠기 변화에 미치는 효과를 확인하기 위하여 무모 마우스에 12주간 UVB를 조사하면서 동시에 PB203을 경구 투여하였다. 시험기간 동안 시험군 간에 UVB 조사 또는 시험물질 투여로 인한 의미 있는 체중 변화는 관찰되지 않았다(data not shown). 12주 후, DermascopeⓇ와 PRIMOSlite로 마우스의 피부 표면을 촬영하여 피부 거칠기를 측정한 결과, 유발대조군(UVB + saline group)의 경우 정상군(normal group)에 비해 깊고 굵은 주름의 형성이 뚜렷하게 관찰되었으나, PB203 섭취군(UVB + PB203 group)에서는 이러한 주름이 크게 감소한 것으로 나타났다(Fig. 1A). 또, PRIMOSlite를 통해 촬영된 3D 이미지를 이용하여 피부 거칠기 정도를 평균 거칠기인 Ra와 최대 거칠기인 Rmax 값으로 정량 평가했을 때, 유발대조군에서 정상군 대비 Ra와 Rmax 값이 각각 36.1%와 47.4% 유의하게 증가한 반면, PB203 섭취군에서는 두 값이 각각 12.7%와 20.1% 유의하게 감소한 것으로 확인되었다(Fig. 1B and C). 한편, 양성대조물질로 사용한 HU-018 역시 PB203과 유사한 효과를 가진 것으로 나타났다. 이러한 결과는 UVB 조사에 의한 피부 주름 형성 및 피부 거칠기의 증가와 같은 광노화 증상이 PB203 섭취에 의해 효과적으로 억제될 수 있음을 보여준다.
12주간의 UVB 조사 및 시험물질 경구투여가 끝난 후 TewameterⓇ를 이용하여 경피수분손실량(TEWL)을 측정한 결과, 유발대조군은 정상군에 비해 TEWL이 약 53.5% 유의하게 증가한 반면, PB203 섭취군은 이를 19.7%, HU-018 섭취군(UVB + HU-018 group)은 17.8% 유의하게 감소시켜 두 가지 물질 모두 UVB로 인한 표피의 수분 손실을 뚜렷하게 억제하는 것으로 확인되었다(Fig. 2A). 또, CorneometerⓇ를 이용하여 피부 수분량을 측정한 결과, Fig. 2B와 같이 유발대조군의 피부 수분량은 정상군의 83.0% 수준으로 낮아진 데 반해, PB203 섭취군과 HU-018 섭취군은 유발대조군보다 약 30% 더 수분량이 증가하여 통계적으로 유의한 차이를 보여주었다.
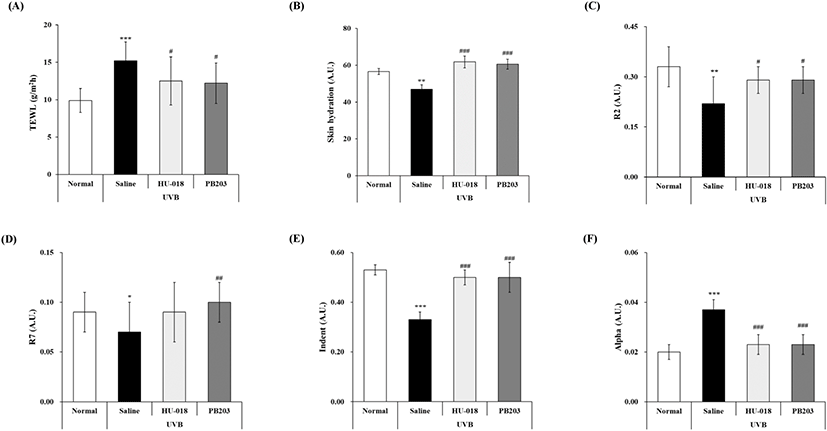
피부 수분의 증가는 피부 탄력의 증가에 기여하는 것으로 알려져 있다. 앞서 확인된 피부 보습 효과에 더하여 PB203이 피부 탄력에 미치는 영향을 분석하기 위해 UVB가 조사된 무모 마우스의 피부 탄력을 CutometerⓇ와 Ballistometer로 측정하였다. 그 결과, gross elasticity를 나타내는 R2는 정상군에 비해 유발대조군에서 33.3% 유의하게 감소된 반면, PB203 섭취군에서는 유발대조군 대비 31.8% 증가함으로써 유의적인 개선 효과를 보였다(Fig. 2C). Biological elasticity를 의미하는 R7의 경우, 유발대조군에 비해 PB203 섭취군에서 42.9% 유의하게 증가하여 실질적인 피부 탄력이 향상된 모습을 보여주었다(Fig. 2D). HU-018의 섭취는 R2를 31.8%, R7을 28.6% 증가시켜 PB203과 비슷한 탄력 개선 효과가 관찰되었으나, R7의 경우 통계학적인 유의성은 나타나지 않았다. 또 다른 피부 탄력 파라미터인 Indent와 Alpha 값의 경우, UVB 조사에 의해 유의하게 감소된 Indent 값은 PB203 섭취군에 의해 51.5% 유의적인 증가를 보였으며, UVB에 의해 유의하게 증가된 Alpha 값은 PB203에 의해 의미 있는 수준으로 37.8% 감소한 것으로 확인되었다(Fig. 2E and F). 이는 PB203이 자외선에 의한 피부 주름 형성뿐만 아니라, 피부의 수분과 탄력의 감소까지 개선함으로써 피부 광노화 억제에 기여할 수 있음을 보여준다.
PB203이 피부 광노화에 따른 피부 조직 구조 및 피부 장벽 기능에 미치는 영향을 평가하기 위하여 조직학적인 분석을 실시하였다. 먼저, 광노화 피부의 지표로서 무모 마우스의 피부조직을 H&E로 염색하여 전반적인 피부 상태와 함께 표피의 두께를 측정한 결과, UVB를 조사한 유발대조군의 경우 정상군에 비해 피부 각질의 증가, 염증세포의 침윤이 관찰되었으며, 특히 표피의 두께가 3배 가까이 유의하게 증가된 것을 확인할 수 있었다. 반면, PB203을 섭취한 군에서는 정상에 가까운 피부 조직 상태를 나타냈으며, 표피의 두께 역시 40% 이상 감소하여 통계적으로 유의한 차이를 보였고, 이러한 효과는 양성대조물질로 사용한 HU-018보다 조금 더 우수한 것으로 확인되었다(Fig. 3A and B). 또, 진피층에 함유된 대표적인 교원섬유 단백질인 collagen 밀도를 확인하기 위해 MT 염색을 실시한 결과, UVB를 조사하지 않은 정상군의 진피층에서는 aniline blue에 의해 진하게 염색된 collagen이 관찰되었으나, UVB를 조사한 유발대조군의 경우 collagen 밀도가 뚜렷하게 약화된 것으로 나타났다. 이에 반해, PB203을 섭취한 마우스의 경우 유발대조군 대비 진피층의 collagen 밀도가 현저하게 증가된 모습이 관찰되었다(Fig. 3A). 피부 조직에서 관찰된 collagen의 이러한 변화는 진피층의 교원섬유 단백질의 대부분을 차지하는 collagen I(type I collagen)의 유전자인 COL1A1의 mRNA 정량 분석 결과에서도 동일한 양상으로 나타났다(Fig. 3C). 추가적으로, VB 염색을 통해 진피층을 구성하는 탄력섬유 단백질인 elastin을 분석한 결과에서도 유발대조군 대비 PB203은 파랗게 염색된 진피층의 elastin을 정상에 가깝게 크게 증가시킨 것으로 확인되었다(Fig. 3A). 이러한 결과는 앞서 Fig. 1과 Fig. 2에서 나타난 피부 주름 및 피부 탄력에 대한 PB203의 개선 효과를 분자적인 수준에서 뒷받침하는 것이라 할 수 있다.
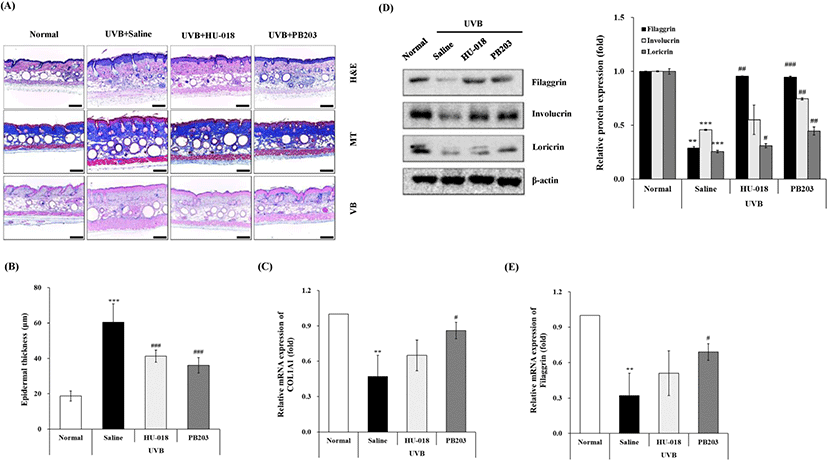
한편, PB203이 자외선으로 인해 손상된 피부 장벽 기능에 미치는 영향을 조사하기 위해 피부 장벽 기능을 담당하는 표피의 주요 단백질인 filaggrin, involucrin 및 loricrin의 단백질 발현을 western blot으로 분석하고, 이 중에서 장벽 기능에 가장 핵심적인 filaggrin의 유전자 발현 변화를 qRT-PCR로 분석하였다. UVB에 의해 피부가 손상되면, 피부 장벽을 구성하는 filaggrin, involucrin 및 loricrin의 발현이 감소하게 되고, 이는 곧 피부 장벽 기능의 저하로 이어지면서 수분 손실이 증가하게 된다[17–20]. 먼저 단백질 발현을 분석한 결과, filaggrin, involucrin 및 loricrin의 발현은 UVB에 의해 모두 유의하게 감소된 것으로 나타났다. 그러나, PB203을 섭취한 마우스에서는 유발대조군보다 filaggrin은 약 3.3배, involucrin과 loricrin은 각각 60%와 70% 이상 유의하게 증가된 모습이 관찰되었다(Fig. 3D). 또, 피부 조직 내 filaggrin의 mRNA 발현량을 측정한 결과, UVB 조사에 의해 정상군 대비 약 1/3 수준으로 유의하게 감소된 filaggrin의 발현이 PB203 섭취군에서는 2배 이상 의미 있게 증가되는 것을 확인할 수 있었다(Fig. 3E). HU-018의 경우, 비록 involucrin 단백질 및 filaggrin mRNA 발현에서는 유발대조군 대비 유의미한 차이를 보이지 않았으나, filaggrin과 loricrin 단백질 발현에 있어서는 PB203과 유사한 경향을 보여주었다. 이상의 결과는 PB203이 정상적인 피부 조직 및 장벽 기능 유지에 필수적인 collagen, elastin, filaggrin 등과 같은 단백질의 발현을 증가시킴으로써 자외선에 의한 피부 손상으로부터 피부를 보호하는 데 기여할 수 있음을 시사한다.
UVB 조사에 의한 ROS의 증가는 MAPK 신호 전달 경로를 활성화하여 AP-1의 인산화를 증가시키며, 이를 통해 collagen과 같은 ECM 단백질을 분해하는 MMPs의 발현을 강력하게 유도하여 피부 주름 생성을 촉진한다[10–13, 15, 16]. 특히, Bachelor 등은 UVB를 조사한 각질세포와 무모 마우스의 피부에서 p38 MAPK의 신호 전달을 차단했을 때, c-Fos의 발현 감소를 통해 UVB에 의해 유도된 AP-1 활성화가 억제됨을 보여줌으로써 p38이 AP-1의 활성화에 중요한 역할을 담당함을 입증하였다[36]. 이에 본 연구에서는 PB203이 UVB 조사에 의해 증가된 MMPs 발현 및 p38과 AP-1의 활성화에 미치는 효과를 평가하였다. 먼저, Fig. 3A 및 3C에서 확인한 collagen의 변화가 MMPs 발현 변화에 의한 것인지 확인하기 위해 UVB를 조사한 무모 마우스의 피부조직으로부터 mRNA를 추출한 뒤, MMP-1, 3, 9의 유전자 발현 변화를 정량 분석한 결과, 정상군에 비해 유발대조군의 MMP-1 발현은 약 15배, MMP-3는 약 12배, MMP-9은 약 3배 이상 유의하게 증가된 반면, PB203을 섭취한 군에서는 최소 49.1%에서 최대 77.5%까지 모두 의미 있는 수준으로 MMP-1, 3, 9를 감소시켰다. 이와 달리 HU-018은 UVB 조사에 따른 MMP-1의 발현 증가는 유의하게 감소시켰으나, MMP-3와 MMP-9은 감소되는 경향만 나타냈을 뿐, 통계학적으로 유의한 차이를 보이지는 않았다(Fig. 4A, B, and C).
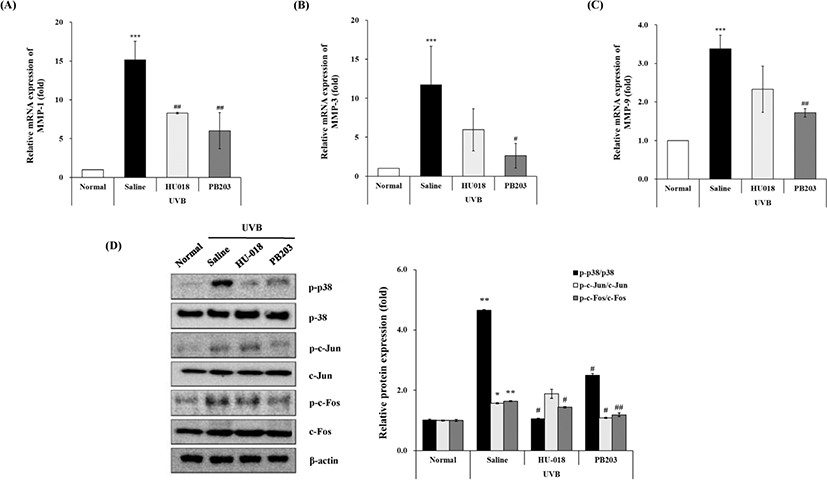
이어서 PB203에 의한 MMPs 발현 억제 기전을 확인하기 위해 MMPs의 가장 중요한 전사인자인 AP-1과 AP-1의 상위 신호 조절자 중 하나인 p38 MAPK에 대한 western blot analysis를 실시한 결과, Fig. 4D와 같이 PB203 섭취는 UVB 조사에 의해 활성화된 p-p38과 p-c-Jun, p-c-Fos 발현을 모두 저해하여 p-p38/p38, p-c-Jun/c-Jun 및 p-c-Fos/c-Fos 발현비율을 각각 46.5%, 30.6%, 27.4% 통계적으로 유의하게 저해하는 것으로 확인되었다. HU-018의 경우에도 p-c-Jun/c-Jun을 제외한 나머지 인자의 발현비율에서는 유의한 감소효과를 나타냈다. 이러한 결과는 PB203이 p38 MAPK 및 AP-1의 활성화를 억제하여 MMPs의 발현을 감소시킴으로써 피부 조직의 collagen 분해를 막아 피부 주름 감소에 기여할 수 있음을 보여준다.
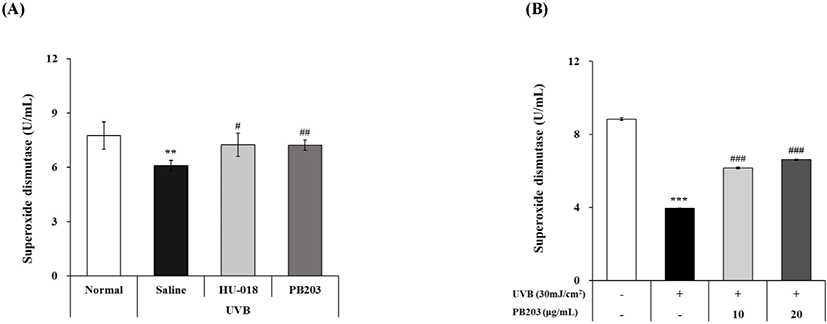
UVB 노출에 따른 ROS 증가가 생체 내 항산화 효소에 미치는 영향을 확인하기 위해 무모 마우스의 피부 조직으로부터 획득한 cell lysate를 이용하여 SOD 활성을 분석한 결과, PB203은 UVB 조사에 의해 유발대조군에서 통계학적으로 유의하게 감소된 SOD 활성을 정상에 가깝게 의미 있는 수준으로 증가시켰다(Fig. 5A). 또, 이러한 효과가 세포 수준에서도 재현되는지 확인하기 위해 HaCaT 세포에 얻은 cell lysate로부터 SOD 활성을 측정했을 때에도 UVB에 의해 정상세포 대비 40% 수준까지 낮아진 SOD 활성이 PB203 처리군에서는 농도의존적으로 최대 67.8%까지 유의하게 증가되는 것으로 나타났다(Fig. 5B). 이를 통해 PB203이 in vivo 및 in vitro 모두에서 항산화 효소인 SOD의 활성을 상향조절 함으로써 UVB로 인해 생성된 ROS를 제거하여 산화적 스트레스에 의한 피부 손상을 개선할 수 있음을 입증하였다.
UVB를 조사한 무모 마우스 실험을 통해 확인된 PB203의 광노화 억제 효과를 세포 수준에서 다시 확인하기 위해 인간 피부 각질세포인 HaCaT 세포를 이용하여 in vitro 시험을 진행하였다. 우선 PB203을 HaCaT 세포에 처리했을 때, UVB로부터 세포를 보호할 수 있는지, 또 세포 독성이 있는지 확인하기 위해 세포 생존율 실험을 실시한 결과, Fig. 6A에 보이는 바와 같이 UVB를 조사한 유발대조군(UVB + media group)에서 유의한 수준으로 20% 이상 감소된 세포 생존율이 PB203 처리군(UVB + PB203 group)에서는 농도의존적으로 증가되는 것을 확인할 수 있었으며, 특히 PB203 20 μg/mL 처리군에서는 통계적으로 유의한 수준의 증가가 관찰되었다.
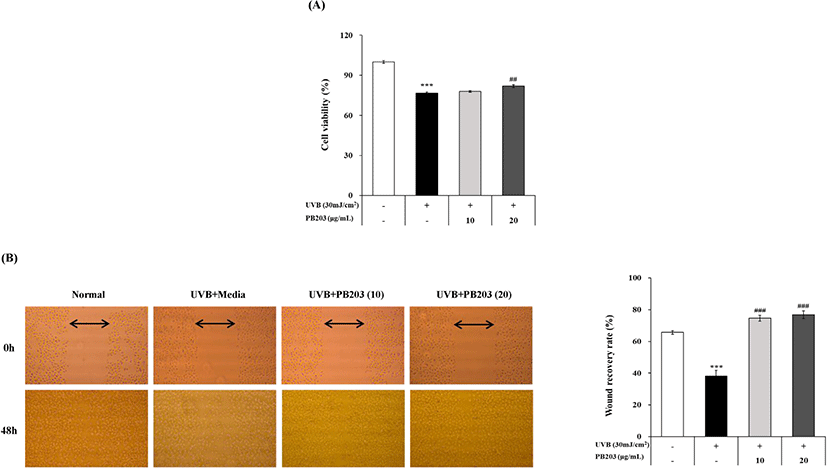
PB203의 이러한 세포 보호 효과에 더하여 PB203이 물리적인 손상이 가해진 세포를 UVB 조사 환경에서 얼마나 회복시키는지 평가하기 위해 in vitro wound scratch and recovery assay를 실시하였다. 각 시험군에 1 mL 파이펫 팁으로 일정하게 scratch를 가한 상태에서 48시간이 경과한 후 세포 상태를 현미경으로 관찰한 결과, 유발대조군에서는 UVB 조사로 인해 세포의 증식 및 이동이 억제되어 상처 회복이 더딘 반면, PB203 10 및 20 μg/mL 처리군에서는 유발대조군은 물론, 무처리군(non-treatment group)에 비해서도 더 원활한 상처 회복을 보였다. 또, 이를 정량 평가한 결과에서도 유발대조군에서는 무처리군 대비 40% 가까이 상처 회복율이 낮은 반면, PB203 처리군의 경우 두 농도 모두에서 유발대조군보다 약 2배 정도 높은 상처 회복율이 관찰되었다(Fig. 6B). 이는 PB203이 세포 독성 없이 자외선으로부터 각질세포를 보호하고 세포의 증식 및 이동을 촉진하여 손상된 각질세포, 즉 피부 상처의 회복을 도울 수 있음을 보여준다.
앞서 UVB를 조사한 무모 마우스에서 확인된 PB203의 피부 관련 유전자 조절 효과가 세포 수준에서도 재현되는지 확인하기 위해 HaCaT 세포에 PB203을 처리하고 나서 UVB를 조사하고 세포를 배양한 후, 피부 주름 및 피부 장벽 기능에 관련된 주요 유전자들의 발현을 qRT-PCR로 분석하였다. 그 결과, UVB를 조사한 세포에서 유의하게 감소된 collagen I의 유전자 발현이 PB203 10 및 20 μg/mL 처리에 의해 농도의존적으로 각각 39.7%와 52.7%로 의미 있게 증가된 것을 확인하였다(Fig. 7A). 이와 함께 collagen 등 ECM 단백질을 분해하는 MMP-1, 3, 9의 발현을 측정한 결과, UVB 노출에 의해 유의한 수준으로 증가된 MMPs 발현이 PB203에 의해 모두 농도의존적으로 유의하게 최대 93.2%까지 감소된 것으로 관찰되었다(Fig. 7B, C, and D).
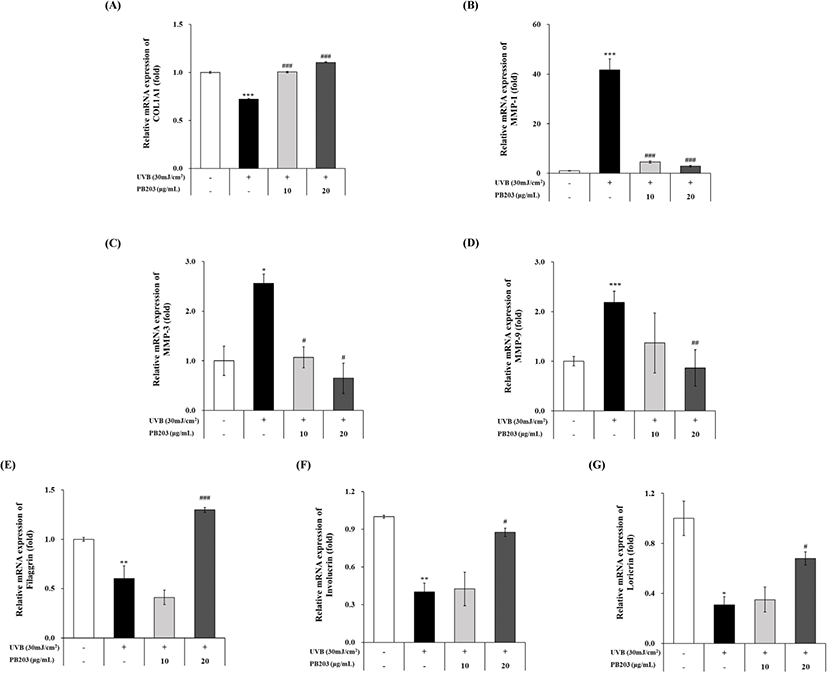
또한, 피부 장벽 기능을 조절하는 각질세포의 주요 단백질인 filaggrin, involucirn, loricrin의 mRNA 발현 역시 유발대조군 대비 PB203 20 μg/mL 처리군에서 모두 2배 이상 통계학적으로 유의한 증가를 보였다(Fig. 7E, F, and G). 이러한 결과는 UVB를 조사한 무모 마우스 실험을 통해 확인된 PB203의 피부 주름 감소 및 장벽 기능 개선 효과가 피부 각질세포에서도 일관성 있게 입증된 것으로, PB203이 자외선에 의한 피부 손상을 관련 유전자 수준에서 조절하고 있음을 시사한다.
DISCUSSION
UV에 지속적으로 노출되면 피부 광노화를 유발하는 주름 형성 및 피부 수분 손실과 같은 피부 손상이 크게 증가하게 된다. 본 연구에서 무모 마우스에 12주간 UVB를 반복적으로 조사했을 때, 피부의 굵은 주름 형성과 함께 TEWL이 증가하였으며, 피부 수분량과 피부 탄력이 감소되는 등 광노화에 따른 피부 손상이 관찰되었다. 그러나, 같은 기간 PB203을 섭취한 군에서는 이러한 피부 손상이 모두 효과적으로 개선되는 것을 확인할 수 있었다.
UV 조사에 의해 유발된 산화적 스트레스는 피부 광노화의 가장 중요한 원인이다. UV 조사는 피부에서 과산화수소와 같은 ROS 생산을 증가시키는데, 이렇게 증가된 ROS는 다양한 유전자와 단백질의 구조 및 기능을 변형시켜 피부 손상을 유발한다[4, 5, 8, 37]. 정상적인 상황에서 ROS는 세포에 존재하는 다양한 항산화제에 의해 엄격하게 제어되지만, UV 조사와 같이 산화적 스트레스가 가해진 상황에서는 ROS의 축적이 세포의 산화-환원 항상성의 손실을 가져와 DNA 및 피부 세포의 손상을 유발함으로써 피부 광노화 및 발암을 촉진하게 된다[38, 39]. 따라서 강력한 항산화 작용으로 ROS 생성에 따른 산화적 스트레스를 감소시키는 것이 광노화를 예방하는 중요한 표적이 될 수 있으며, 이러한 관점에서 식물의 대표적인 항산화 성분인 플라보노이드, 폴리페놀 또는 이들을 함유하는 식물추출물이 광노화 억제제의 좋은 후보가 될 수 있다.
플라보노이드는 여러 식물에 존재하는 대표적인 항산화성 물질이며, 지질 과산화물과 ROS의 생성을 억제하고 다양한 생리활성을 나타내는 것으로 알려져 있다[33]. 또, 폴리페놀은 하나 이상의 벤젠 고리와 하나 이상의 수산기를 가지고 있는 물질로 강력한 항산화 작용과 항염증 작용 등을 하는 것으로 보고되고 있다[34]. Lee와 Lee의 연구에서 개다래 열매의 추출물은 다량의 플라보노이드와 폴리페놀 성분을 함유하고 DPPH와 ABTS 라디칼 소거능 시험 등에서 우수한 항산화 활성을 나타냄으로써 개다래 열매 추출물이 천연 항산화제로서 충분한 개발 가치가 있음을 보여주었다[35]. 또, 본 연구에서 PB203은 Garcia-Herrera 등과 Zuo 등이 보고한 A. deliciosa, A. chinensis, A. arguta 등 다른 다래나무과 열매의 추출물보다 수 배에서 수십 배 이상 더 많은 플라보노이드와 폴리페놀을 함유하고 있었으며, 그 결과 이들보다 더 높은 수준의 ABTS와 DPPH 라디칼 소거 활성을 보여주었다[40–42]. 뿐만 아니라, UVB를 처리한 무모 마우스와 HaCaT 세포 모두에서 ROS를 제거하는 항산화 효소인 SOD의 활성을 유지시켜 UVB로 인한 산화적 스트레스를 억제함으로써 피부 광노화를 개선하는 것으로 나타났다(Fig. 5).
광노화 동안 일어나는 ROS 생성 및 이로 인한 MMPs 발현 증가와 collagen의 분해는 정상적인 ECM의 구조를 파괴하고 피부 주름 형성을 비롯한 다양한 문제를 유발하게 된다[7, 8, 10–12, 37, 38]. 사람 피부에는 19종의 MMP가 존재하는데 그 중 MMP-1, 3, 9만 UV에 의하여 증가한다. MMP-1은 ECM에서 가장 풍부한 collagen I 및 collagen III를 분해할 수 있으며, MMP-3는 MMP-1의 활성화를 촉진하고 기저막의 collagen VI를 분해할 뿐만 아니라, MMP-9와 협력하여 collagen 단편을 추가적으로 분해하는 역할을 한다[15, 43]. 이전 연구에서 PB203은 UVB에 노출된 무모 마우스에서 유도된 MMP-1, 3, 9의 생성을 억제하고 collagen I의 발현을 개선하였을 뿐만 아니라, 진피층의 collagen 밀도를 정상에 가깝게 회복시켰다[27]. 또, 본 연구에서 PB203은 UVB를 조사한 무모 마우스는 물론, 인간 피부 각질세포인 HaCaT 세포에서도 UVB에 의해 증가된 MMP-1, 3, 9를 감소시킴과 동시에 UVB에 의해 감소된 collagen I을 증가시키는 효과를 나타냈는데(Fig. 3C; Fig. 4A, B, and C; Fig. 7A, B, C, and D), 앞서 기술한 PB203의 항산화 활성을 고려할 때, 이는 PB203이 ROS 생성을 억제하는 항산화 활성을 토대로 MMPs에 의한 collagen 분해를 차단함으로써 ECM의 구조 변화 및 이로 인한 주름 형성을 억제하는 것임을 시사한다.
UVB에 의해 유도된 MMPs의 발현은 MAPK, AP-1, NF-κB(nuclear factor-κB) 및 TGF-β(transforming growth factor-β)/Smad(suppressor of mothers against decapentaplegic)를 포함한 많은 신호 전달 경로를 포함하는데, 이 중에서 ERK, JNK, p38를 포함하는 MAPK는 고도로 보존된 serine/threonine protein kinase 계열에 속하는 효소로 세포 인산화 유형 및 자극에 따라 성장 및 생존, 분화, 발달, 세포 주기 조절 및 세포 사멸 등에 관여한다[44, 45]. UVB에 의해 생성된 ROS 축적은 MAPK의 인산화를 촉진하는데, 인산화 된 p38, JNK 등은 c-Fos와 c-Jun을 활성화시키고, 이들이 AP-1 복합체를 형성하여 MMPs와 같은 유전자의 발현을 조절한다[10–13, 15, 16]. 본 연구에서 PB203은 UVB 조사 무모 마우스에서 p-c-Jun 및 p-c-Fos 뿐만 아니라, p-p38의 수준을 하향조절하여 MMP-1, 3, 9의 발현을 모두 감소시키는 것으로 확인되었다(Fig. 4). 이는 Bachelor 등의 연구에서 확인된 바와 같이 UVB를 조사한 각질세포와 무모 마우스의 피부에서 p38 MAPK의 활성화가 AP-1의 활성화에 중요한 역할을 담당하고 있음을 입증하는 것으로[36], PB203이 MAPK/AP-1 경로의 비활성화를 통해 MMPs의 발현을 감소시킴으로써 collagen의 분해를 억제하고, 나아가 피부 주름의 형성을 차단할 수 있음을 보여주는 결과라 할 수 있다. 다만, PB203이 광노화를 억제함에 있어 NF-κB 등 다른 신호 전달 경로에 어떠한 영향을 미치는지는 추가적인 연구가 필요하다.
피부 조직의 구조와 기능을 정상적으로 유지함에 있어 진피층에 분포하는 collagen 만큼 중요한 피부 단백질이 표피의 각질세포막을 구성하는 filaggrin, involucrin, loricrin이다. 물에 녹지 않는 구조물로서 수분을 유지하고 외부로부터의 침입을 보호하는 피부 장벽 기능을 제공하는 각질세포막은 각질세포의 분화 과정에서 생성된 filaggrin, loricrin, involucrin 등의 단백질이 transglutaminase에 의해 결합되면서 형성된다[46, 47]. 이들 중 keratin 다발의 응집을 통해 각질세포에 물리적 강도를 부여하는 filaggrin은 표피의 수화 및 장벽 기능을 유지하는 데 특히 중요한 역할을 담당하는데, UVB 노출에 따른 filaggrin 등의 감소는 피부 장벽 기능의 저하로 이어지며, 이는 곧 표피를 통한 수분 손실을 초래하여 피부의 탄력을 감소시킨다[18–20, 48]. PB203은 UVB를 조사한 무모 마우스의 피부 조직과 HaCaT 세포 모두에서 filaggrin, involucrin, loricrin의 발현을 상향 조절함으로써 filaggrin 등의 감소로 인한 피부 수분의 손실 및 장벽 기능의 저하를 효과적으로 방지하는 것으로 확인되었다(Fig. 3D and E; Fig. 7E, F, and G).
UVB를 조사한 무모 마우스와 HaCaT 세포에서 확인된 이상의 결과를 종합할 때, PB203은 플라보노이드, 폴리페놀 등의 성분에 의해 세포 및 생체 수준에서 항산화 활성을 나타냄으로써 UVB 조사로 인한 산화적 스트레스를 억제하였으며, 이를 통해 MAPK/AP-1 신호 전달 경로의 활성화를 감소시킴으로써 MMPs에 의한 collagen 분해를 차단하는 한편, filaggrin 등의 발현을 증가시켜 궁극적으로 피부 주름의 형성, 수분 손실 및 피부 탄력 저하 등과 같은 광노화의 증상을 모두 개선할 수 있는 것으로 확인되었다. 이를 토대로 PB203은 자외선에 의한 피부 손상 개선 및 피부 보습을 위한 신규 건강기능식품으로서 충분한 개발 가치를 지닌 것으로 판단된다.







