INTRODUCTION
고양이 갑상선기능항진증은 노년기의 고양이에서 가장 흔하게 발생하는 내분비장애로써 10% 정도의 발생율을 보인다. 고양이 갑상선기능항진증은 치료하지 않으면 생명을 위협할 수 있는 만성 진행성 질병이기 때문에, 효과적인 치료 방법의 선택이 필요하다. 현재까지 고양이 갑상선 기능 항진증의 병인은 알려져 있지 않으며, 갑상선에서 갑상선 호르몬의 과도한 분비를 조절하는 것이 주된 치료 방법으로 사용된다[1].
고양이 갑상선기능항진증의 치료법으로는 항갑상선제 투여, 수술적 제거, 방사성요오드(131I) 투여 등이 고려된다. 각각의 치료방법은 장단점이 있지만, 고양이 갑상선기능항진증에 이환된 대부분의 고양이에서 방사성 요오드는 가장 효율적인 치료법으로 권장되어 선택되며, 그 이유는 다음과 같다[2, 3].
먼저, 메티마졸(methimazole) 등 항갑상선제 투여는 대부분의 고양이에서 갑상선기능항진증을 조절하는 데 효과적이지만, 몇 가지 단점이 있다. 일반적으로 항갑상선제는 하루에 1–3회 경구로 투여해야 하지만, 일부 고양이에서는 경구로 약물을 투여하기가 매우 어렵다. 또한, 항갑상선제는 드물지만 심각한 이상 반응(예: 혈소판 감소증, 백혈구 감소증, 간병증)을 나타낸다. 그리고 남은 생애 동안 매일 경구로 약물을 투여해야 하기 때문에 보호자가 이러한 치료법을 선택하기 어려울 수도 있다[2, 4].
수술적 제거 방법 또한 대부분의 고양이에서 효과적이지만, 몇 가지 단점이 있다. 갑상선기능항진증에 이환된 많은 고양이가 이차성 심근병증을 가지고 있기 때문에 수술 및 마취의 위험성이 높다[4]. 또한, 수술을 하는 도중에 인접한 부갑상선 또는 경부 조직이 손상될 수 있으며, 이로 인해 일시적이거나 영구적인 부갑상선기능저하증 또는 저칼슘혈증 등이 발생할 위험이 있다. 이러한 합병증으로 인하여 추가적인 입원과 비용이 필요할 수 있으며, 수술 받은 고양이의 생명을 위협할 수도 있다. 이 밖에도 수술 후 갑상선기능저하증이 종종 발생되어 갑상선호르몬 대체 치료가 필요할 수도 있으며, 수술이 성공적으로 끝났다고 할지라도 몇 개월에서 몇 년 후에 갑상선기능항진증이 재발할 가능성이 있다[2, 5].
이에 반해 방사성요오드(131I) 치료는 항갑상선제 투여 또는 외과적 치료에 비해 몇 가지 뚜렷한 장점이 있다. 항갑상선제 투여와 비교하였을 때, 방사성요오드(131I) 치료는 일반적으로 단회 투여에 의하여 치료가 끝나기 때문에, 매일 경구 투여해야 하는 불편함이 없다. 또한, 항갑상선제와 관련된 부작용의 위험성이 사라진다. 수술적 제거 방법과 비교하였을 때, 방사성요오드(131I) 치료는 마취가 필요하지 않으며, 수술로 인해 발생할 수 있는 부갑상선기능저하증 등 합병증의 위험이 사라진다. 투여된 방사성요오드(131I)는 정상적인 경부 조직과 부갑상선 등에 영향을 주지 않고, 기능이 항진된 갑상선 조직을 선택적으로 파괴하여 치료한다. 이러한 이유로 방사성요오드(131I)는 갑상선기능항진증에 이환된 고양이에게 가장 간단하고 효과적이며 안전한 치료법으로 추천된다[2, 6].
방사성요오드(131I) 치료의 단점으로는 방사성요오드(131I)를 투여한 후 체내 방사성 물질이 배출될 때까지 국가별 규제에 따라 1–2주간 격리가 필요하다는 점이다.
국외에서는 1990년대부터 방사성요오드(131I)를 이용한 고양이 갑상선기능항진증의 치료를 수행하고 있다. 그러나 이 치료법은 방사선 안전을 위한 규제가 까다롭게 적용되고 있어, 국가별 법령에 따라 허가 받은 시설과 취급자가 필수적이다. 2018년 한국에도 방사성의약품을 동물의 치료에 사용할 수 있는 시설이 구축되었다. 이에 따라 방사성요오드(131I) 등 효율적인 동물용 방사성의약품을 한국에 도입하기 위한 연구가 요구되고 있다[6].
다양한 종류의 방사성요오드가 의료적으로 사용되고 있으나, 갑상선 질환의 치료에는 요오드-131(131I)이 사용된다[2]. 일반적으로 방사성요오드(131I)는 원자로에서 텔루륨(tellurium)을 중성자 조사한 후에 요오드화나트륨(sodium iodide I-131, 131I) 용액 형태로 분리 정제된다[7]. 싸이로키티 주사액(I-131)은 이러한 방사성요오드(131I)를 단일 유효성분으로 한다. 인체용으로 상용화되어 있는 높은 방사능량의 방사성요오드(131I) 의약품에 비하여, 고양이에 대한 치료 용량에 따라 낮은 방사능량으로 제조되며 피하 주사로 투여할 수 있도록 개발 중인 의약품이다. 본 연구에서는 향후 한국에 동물용 방사성의약품을 도입하기 위하여, 싸이로키티 주사액(I-131)의 약리학적 특성을 확인하였다.
MATERIALS AND METHODS
시험물질인 싸이로키티 주사액(I-131)은 한국원자력연구원의 방사성의약품 제조시설에서 제조되었으며, 제조소의 시험 및 기준법에 따라 시험물질의 성상, 확인, pH, 방사화학적 순도, 엔도톡신, 불용성이물, 방사능량 등이 시험되었다.
FRTL-5 랫드 정상 갑상선 세포(rat thyroid follicular cell line)는 서울대학교병원 박영주 교수로부터 제공받아 시험에 사용하였다. 즉, F-12 nutrient mixture Ham Kaighn’s modification medium(LM 010-03, Welgene, Gyeongsan, Korea) 배지에 5% bovine calf serum(S003-01, Welgene), antibiotic-antimycotic solution(AA001, Solbio, Suwon, Korea), 1% 10 mM MEM-Non essential amino acid(LS005-01, Welgene)를 넣었으며, 추가적으로 6가지 호르몬(10 mU/mL bovine thyroid stimulating hormone(T1614, Scripps, Cincinnati, OH, USA), bovine insulin(I5500, Sigma-Aldrich, St. Louis, MO, USA) 10 ug/mL, human transferrin(T2252, Sigma-Aldrich) 5 ug/mL, hydrocortisone(3867, Calbiochem, San Diego, CA, USA) 0.36 ng/mL, somatostatin(S9129, Sigma-Aldrich) 10 ng/mL, Glycyl-L-histidyl-L-Lysine acetate(G1887, Sigma-Aldrich) 2 ng/mL를 넣어 만든 배양액으로 배양하였다. 또한, clone-9 세포(CRL-1439, ATCC, Manassas, VA, USA)는 ATCC로부터 구매하였으며, ATCC에서 제공된 방법대로 배양하였다. 즉, F-12 nutrient mixture Ham Kaighn’s modification medium(LM 010-03, Welgene) 배지에 5% fetal bovine serum(S001-01, Welgene)과 antibiotic-antimycotic solution(AA001, Solbio, Suwon, Korea)을 넣어 만든 배양액으로 배양하였다. 위 두가지 세포는 항온, 항습 배양기(37℃, 95% air, 5% CO2)에서 배양하였으며, 세포 confluence 80% 상태가 되면 계대배양하여 세포유지 및 실험 목적에 맞게 사용하였다.
Clone 9 세포와 FRTL-5 세포를 12 well plate에 well 당 5 × 105 수로 seeding하였다. 준비한 각 세포에 5 uCi의 싸이로키티 주사액(I-131)과 1 uM의 요오드(Sodium iodide, Sigma-Aldrich)를 동시에 처리하거나, 5 uCi의 싸이로키티 주사액(I-131)만을 처리하여 2시간 동안 37℃에서 배양하였다. 각 처리 방법에 따른 그룹별 표본수는 3개(n = 3)로 하였다. 배양이 종료된 후에 세포배양액을 회수하고, 차가운 phosphate-buffered saline로 세척하여 세척액을 회수하였다. 감마카운터(Wallac Wizard1470, Perkinelmer)를 이용하여 세포배양액과 세척액의 방사능량을 측정함으로써, 세포에 섭취되지 않은 싸이로키티 주사액(I-131)의 양을 확인하였다. 그리고 1N NaOH로 각 세포액을 회수하고, 감마카운터로 세포액의 방사능량을 측정하여 세포에 섭취된 싸이로키티 주사액(I-131)의 양을 확인하였다.
FRTL-5 세포를 96 well plate에 well 당 1 × 104수로 seeding하였다. 대조군에는 생리식염수를, 실험군에는 100 uCi의 싸이로키티 주사액(I-131)을 처리하여 37℃에서 48시간 동안 배양하였다(n = 3). 배양이 종료된 후에 각 well당 10 uL water soluble tetrazolium salt(WST) solution을 첨가하고 37℃에서 1시간 동안 반응시켰다. 그리고 흡광도 마이크로플레이트 리더기(Spectra Max ABS, Molecular devices)를 사용하여, 450 nm에서 각 well의 흡광도를 측정하였다.
특정 병원체 부재(specific pathogen free) 조건의 생후 6주령의 수컷 ICR 마우스(DBL, Eumseon, Korea)를 구매하여 일주일의 순화기간을 거친 후 실험을 수행하였다. 역상삼투압수와 방사선 멸균 사료를 공급하고, 사육 및 실험은 동물실험윤리위원회(#kirams2022-0117)와 국가RI신약센터 실험동물시설(제611호) 설치류 계류지의 표준작업지침서(IMG-SOP-ANI-001-008)에 따라 수행하였다.
필요에 따라 생리식염주사액을 이용하여 투여용량을 맞추었으며, 싸이로키티 주사액(I-131)은 마리당 2 mCi/kg 용량으로 0.1 mL를 투여하였다. 투여용량은 투여 당일 실험동물의 체중을 측정한 후, 반올림하여 10 uL 단위로 산출하였다. 투여 부위의 털을 제거하고, 2.0 × 2.5 cm의 크기로 투여부위를 표시한 후 목덜미 피하에 투여하였다. 투여 전 후 주사기의 방사능량을 측정하여 실제 투여된 방사능량을 계산하였다.
총 28마리의 마우스를 각 시간대 별로 4마리씩 7개군으로 분리하였다. 마리당 시험물질 2 mCi/kg/0.1 mL(± 20%)씩 목덜미 피하에 투여한 후, 5분(0.083시간), 1, 6, 24, 48, 72, 168시간 이후에 체중을 측정하고 혈액, 심장, 간, 폐, 비장, 신장, 위, 소장, 대장, 근육, 대퇴골, 뇌, 갑상선, 투여부위의 피부조직(skin), 생식기를 채취하였다. 투여 당일, 희생되는 실험동물 군은 희생 전 체중을 측정하지 않았다. 혈액은 각 개체의 심장 채혈을 통하여 채취한 후, 1.7 mL 마이크로튜브에 담아 무게를 측정하였으며, 빈 튜브의 무게를 제외하여 실제 혈액 무게를 계산하였다. 채취한 생체 조직의 무게를 측정한 뒤, 시험물질의 투여 방사능량의 1/5, 1/100 및 1/200로 희석해 준비한 표본물질(STD, standard)과 함께 감마카운터를 이용해 샘플당 1분씩 방사능량을 측정하였다. 결과값은 표준물질의 방사능량을 기준으로 주입된 양의 %ID(injected dose)으로 환산하였으며, 각 조직별 결과값을 이용하여 %ID/g 및 주요장기에서의 pharmacokinetic(PK) parameter(AUC, Area under the curve, Tmax, Cmax, CL 등)를 Phoenix WinNonlin 8.2를 이용하여 산출하였다.
총 4마리의 마우스에 마리당 2 mCi/kg/0.1 mL(± 20%)씩 목덜미 피하에 투여한 후, 마우스용 대사케이지로 이동하여 1 케이지당 1마리씩 수용하였다. 싸이로키티 주사액(I-131) 투여 후, 6, 24, 48, 72, 120, 168시간에 뇨 및 변을 수집하였으며, 케이지 내부 및 철망을 알코올 솜으로 닦아내어 별도 시료로 수집하였다. 각각의 시료는 처리한 시험물질 방사능량의 1/10, 1/100과 1/200을 표준물질(STD)로 준비하여 감마카운터기로 측정하였으며, 시료당 1분간 측정하였다. 표준물질을 기준으로 넣어준 방사능량을 계산하여 %ID로 계산하였으며, 시간에 따른 배설량을 누적하여 계산하였다. 알코올 솜으로 닦아낸 시료는 뇨 샘플에 더하여 최종 뇨 및 변으로의 배출량을 산출하였다.
이번 실험의 모든 결과는 Microsoft excel, GraphPad Prism(Prism 5 version 5.01, GraphPad Softward, San Diego, CA, USA) 및 Statistical Package for the Social Sciences(SPSS version 23.0, Chicago, IL, USA)를 이용하여 각 그룹 간 통계학적으로 유의미한 차이를 분석하였다. 일표본 Kolmogorov-Smirnov Z Test를 실시하여 정규성을 검정한 후, 정규성이 확인되면 일원배치분산분석(ANOVA)으로 검정하였다. 군간 차이는 Levene test로 등분산검정을 실시하여 등분산이 가정되면 Tukey 다중비교를 실시하였다. 정규성이 만족하지 않은 경우 Kruskal-Wallis T 검정을 실시하였다.
RESULTS
싸이로키티 주사액(I-131)은 방사성요오드(131I)가 단일 유효성분이기 때문에, 시험물질이 약리적 효과를 발휘하기 위해서는 방사성요오드(131I) 핵종에 대한 확인과 방사화학적 순도의 확인이 필수적이다. 품질 확인 결과, 두 시험물질 모두 방사성요오드(131I)의 주피크인 0.364 MeV가 확인되고 방사화학적 순도 또한 95% 이상으로써 일반적으로 방사성의약품에 요구되는 기준을 충족하였다. 세포 섭취율 시험 및 세포 사멸 효과 시험에 사용된 싸이로키티 주사액(I-131)의 품질(Supplementary Fig. S1)과 조직 분포 및 배설 시험에 사용된 싸이로키티 주사액(I-131)의 품질(Supplementary Fig. S2)은 별도로 첨부하였다.
갑상선 세포에서 싸이로키티 주사액(I-131)과 요오드(sodium iodide)의 경쟁반응에 따른 세포 내 섭취율을 비교 평가함으로써, 싸이로키티 주사액(I-131)이 갑상선 세포에 선택적으로 섭취되는 작용기전을 평가하였다.
Fig. 1과 같이 clone 9 세포에서 싸이로키티 주사액(I-131)의 세포 섭취율(%cell uptake)은 0.022 ± 0.005%이었고, 이에 반해 FRTL-5 세포에서 싸이로키티 주사액(I-131)의 세포 섭취율은 0.410 ± 0.016%로써 유의적으로 높은 수치를 보였다. 이를 통하여 싸이로키티 주사액(I-131)은 갑상선 세포에서 특이적으로 섭취됨을 확인하였다.
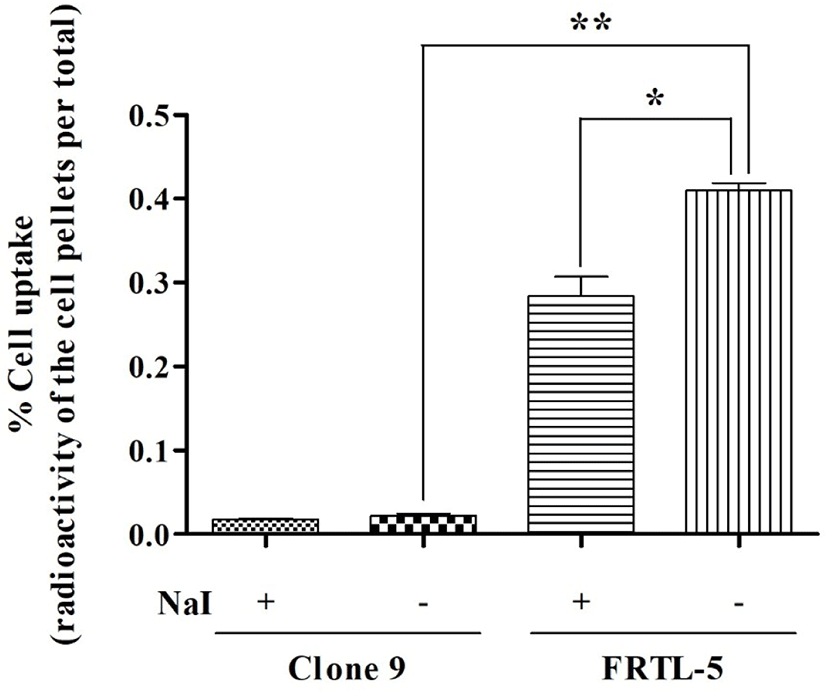
요오드와의 경쟁 반응 시, clone 9 세포에서 싸이로키티 주사액(I-131)의 세포 섭취율은 0.018 ± 0.001%이었으며, FRTL-5 세포에서 싸이로키티 주사액(I-131)의 세포 섭취율은 0.284 ± 0.033%이었다. 타 장기의 세포에서는 요오드와의 경쟁 반응이 싸이로키티 주사액(I-131)의 세포 섭취율에 큰 영향을 주지 않았으나, 갑상선 세포에서는 세포 섭취율을 유의적으로 감소시키는 결과가 확인되었다. 이를 통하여 싸이로키티 주사액(I-131)은 요오드(sodium iodide)와 동일한 기전으로 갑상선 세포에 섭취됨을 확인하였다.
갑상선 세포에서 싸이로키티 주사액(I-131)의 세포독성도를 평가함으로써 싸이로키티 주사액(I-131)의 갑상선 세포 사멸 효과를 평가하였다.
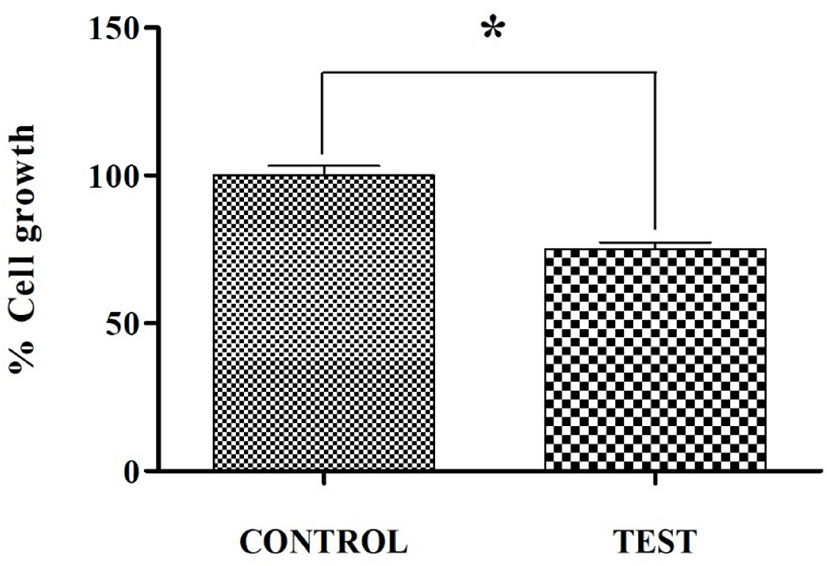
Fig. 2와 같이 FRTL-5 갑상선 세포에 100 uCi의 싸이로키티 주사액(I-131)을 처리하고 2일 동안 배양한 결과, 생리식염수를 처리한 대조군(100.00 ± 5.72%)에 비하여 싸이로키티 주사액(I-131)을 처리한 실험군의 세포 성장률은 75.00 ± 3.93%로 약 25%의 유의적인 감소를 보였다. 이를 통하여 싸이로키티 주사액(I-131)은 갑상선 세포에 대하여 세포 사멸 효과가 있음을 확인하였다.
먼저, 시험을 위한 그룹을 구분하고, 그룹별 실험동물의 몸무게를 측정하였다. 순화기간동안 일반증상 이상 및 사망개체는 발견되지 않았다. 시험당일 개체별 몸무게를 측정하였으며, 평균 33.38 ± 1.07 g이었다.
조직분포 실험용으로 오름차순으로 총 7개 그룹으로 그룹당 4마리 씩, 배설 실험용으로 4 마리를 나누고, 각 그룹별 몸무게를 측정하였다. 각 개체별 투여된 시험물질은 평균 73.09 ± 8.32 uCi(2.70 ± 0.31 MBq)/100 uL로 1마리를 제외한 나머지 개체에 투여 허용 범위 내로 주입되었으며, 투여 이후 실험기간 내 일반증상 이상 및 사망개체는 발견되지 않았다(Table 1, Supplementary Table S1).
Table 2와 같이 싸이로키티 주사액(I-131)을 투여한 후, 조직 적출 전 개체별 몸무게를 측정하여 그룹별로 투여 당일과 적출일에 몸무게를 비교하였다. 당일에 희생하는 그룹 및 배설의 실험동물 몸무게는 별도로 측정하지 않았다. 시험물질 투여 후 몸무게의 감소는 관찰되지 않았으며, 최대 7일 동안 몸무게의 변화는 10% 이내로 투여된 시험물질은 실험동물에게 주요한 영향을 미치지 않음을 확인하였다.
각 시간대별 싸이로키티 주사액(I-131)의 조직 내 분포 양상을 전체 조직 및 조직 무게(g)로 보정하여 분석하였다. 각 조직의 무게는 혈액, 근육 및 대퇴골을 제외하고는 전체 장기를 적출하여 무게를 측정하여 적용하였다. 혈액, 근육 및 대퇴골은 적출한 무게를 기준으로 전체 몸무게를 기준으로 유추하여 계산하였다. G4 그룹의 한 마리는 조직 적출 시, 신장이 1개로 유전적인 결함으로 사료되어 결과값에서 제외하였다.
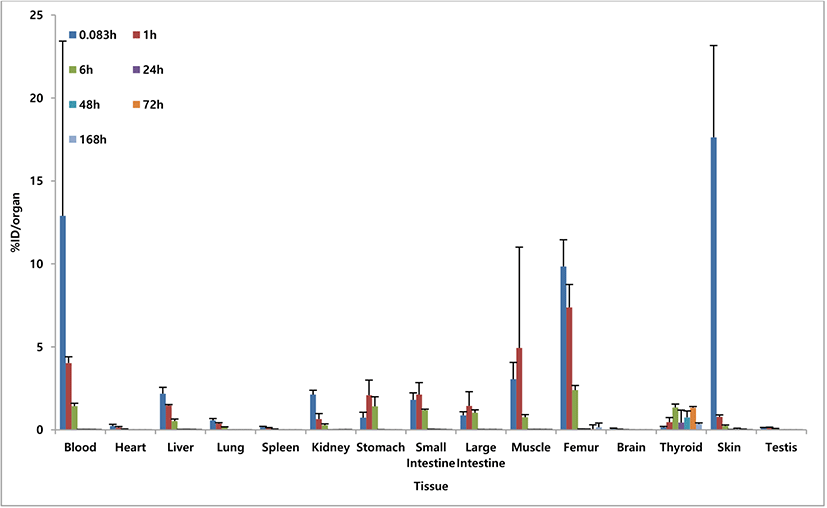
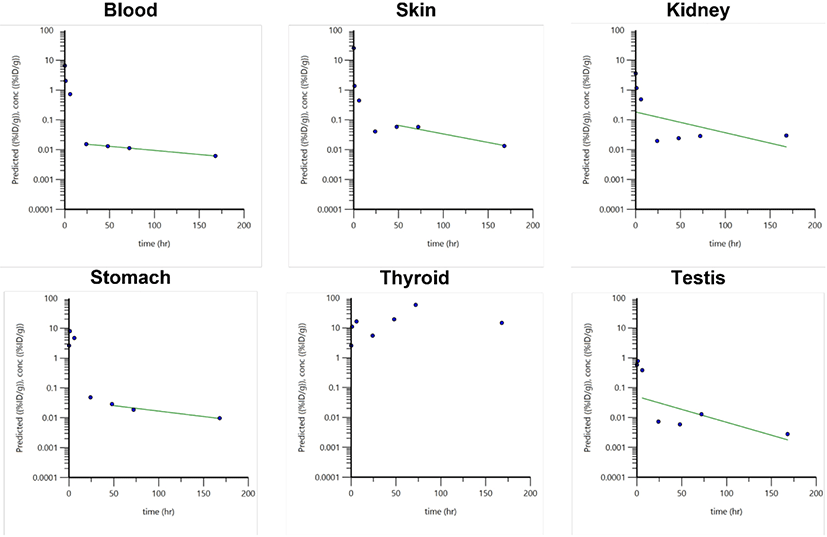
Table 3과 같이 싸이로키티 주사액(I-131)은 목덜미 피하에 주사된 후에 각 조직으로 흡수, 분포 되었다가 신장 및 소화기관(위, 소장, 대장)을 통하여 배설됨을 확인하였다. 마우스의 혈액, 대퇴골 및 근육은 몸무게를 기준으로 각각 58.5 mL/kg, 14% 및 22%를 총량으로 설정하여 적출한 무게의 값을 곱하여 산출하였다. 시험물질은 배설장기를 제외한 대부분의 조직에서 0.083시간에 최대 분포를 확인하였으며, 피하 투여 직후(5분 이내)에 빠르게 전신으로 퍼지는 것을 확인하였다. 시험물질은 시간이 지남에 따라 대부분 장기에서 분포량이 낮아지는 것을 확인하였으며, 배출장기인 신장을 포함하여 대부분의 조직에서 0.083시간에, 소화장기인 위, 소장, 대장 및 근육에서는 1시간에, 내분비기관인 갑상선에서는 6시간에 최고 분포를 보임을 확인하였다. 피하 투여의 특성상, 투여 부위에서의 정확한 분포를 확인하기 어려워, 투여부위를 표시하고, 표시한 부위의 피부 조직을 적출하여 방사능량을 평가하였다(Supplementary Table S2). Fig. 3과 같이 혈액, 심장, 간 및 투여부위 피부에서 시간이 지남에 따라 낮아지는 양상은 피하투여 약물의 전형적인 분포로 보이며, 위와 갑상선에 증가하였다가 점차 낮아지는 양상은 생체 내에서 방사성요오드(131I) 투여 후의 전형적인 분포 양상으로 보인다[8]. 시험물질의 대부분은 신장 및 소화기관(위, 소장, 대장)을 통하여 배출되는 것으로 확인하였으며, 주사 후 48시간에 갑상선을 제외한 장기에서 0.5 %ID 이하로 확인되어 거의 대부분이 배출된 것으로 확인되었다.
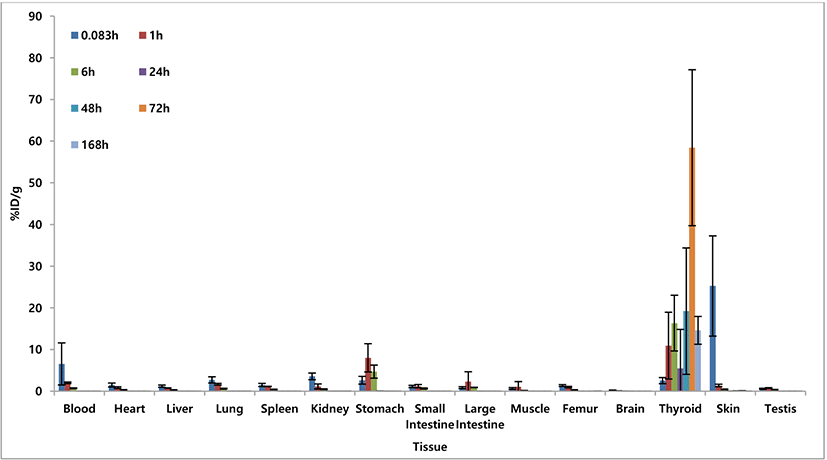
각 시간대별 싸이로키티 주사액(-131)의 조직 내 분포 양상을 각 조직 무게(g)로 보정하여 마우스당 주입된 양의 %ID/g으로 환산하였으며, 각 조직에서의 시간에 따른 분포 양상은 비슷하게 나타남을 확인하였다(Table 4, Supplementary Table S3). 배출 장기인 신장에서 0.083시간에, 소화장기인 위, 소장, 대장 및 근육, 생식기에서는 1시간에, 내분비기관인 갑상선에서는 72시간에 최고 분포를 보임을 확인하였다. Fig. 4와 같이 갑상선과 위, 소장, 대장, 근육, 생식기를 제외한 다른 장기에서 0.083시간 이후로 낮아지는 양상을 보였으며, 24시간 이후 갑상선을 제외한 모든 조직에서 0.05 %ID/g 이하로 확인되었다.
싸이로키티 주사액(I-131)을 피하 투여한 후, 각 시간에 따른 조직 내 분포의 약동학적 파라미터(PK parameter)를 산출하여 비교하였다. Table 5 및 Fig. 5와 같이 각 조직별로 AUC를 비교하였을 때, 대부분의 조직에 분포하였다가 배설되는 것을 확인하였으며, 뇌 및 근육에서는 거의 분포하지 않았으며, 그 외 주요 장기 및 배설장기들에 비슷하게 분포 및 지속된 것으로 확인되었다. 투여부위의 피부조직에 비하여 요오드가 흡수되는 조직인 위에서 약 2.70배, 갑상선에서 약 213.68배 더 높은 값을 나타냈으며, 이를 제외하고는 시험물질이 거의 영향을 미치지 않음을 확인하였다.
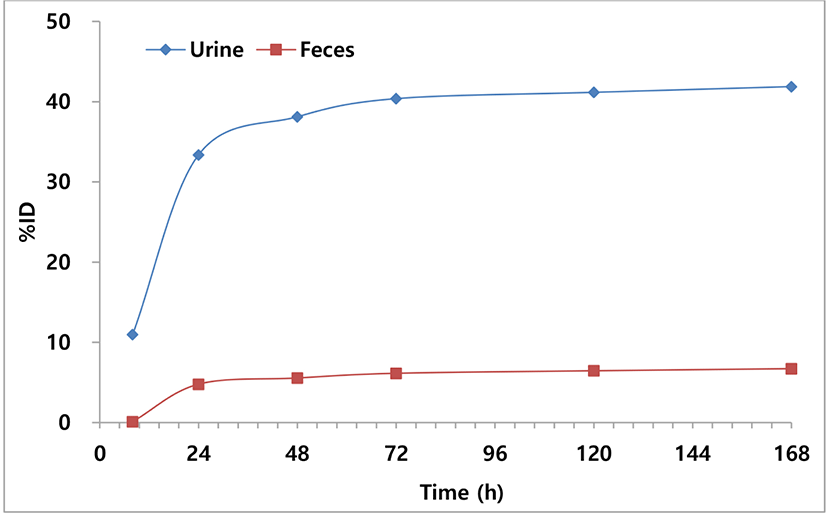
싸이로키티 주사액(I-131)을 피하 투여한 후, 시간에 따른 생체 내 배설 정도를 확인하기 위하여 정상 마우스 4마리에 목덜미 피하로 투여한 후, 대사케이지당 1마리씩 넣어 6, 24, 48, 72, 120 및 168시간까지 뇨와 변 시료를 회수하였다. 시료 회수시간에 시간 경과에 따른 뇨 시료의 정확한 회수를 위하여 대사케이지 내부를 알코올 솜으로 닦았으며, 뇨 시료와 합쳐서 계산하여 배설 정도를 평가하였다. 배설 시험 기간 동안 실험동물의 이상사태(탈출, 급이상황 등) 및 사망개체는 발견되지 않았다.
Table 6과 같이 싸이로키티 주사액(I-131)이 168시간(7일)까지 뇨와 변을 통하여 배설된 총량은 주입된 양의 48.59%이며, 뇨로 41.88%(총 배설량의 86.18%), 변으로 6.72%(총 배설량의 13.82%)가 배설되었음을 확인하였다(Supplementary Table S4). Fig. 6과 같이 총 배설량의 78.45%가 주사 후 48시간 이내(24시간 이내에 68.66% 배출)에 배설되었으며, 72시간(3일)까지 83.09%가 뇨와 변으로 배설되었음을 확인하였다. 뇨와 변으로 배설된 총량이 약 49%로 일반적인 방사성동위원소를 이용한 배설 평가(80%–85% 회수율)보다 낮은 회수율을 보이는 것은 방사성요오드(131I)가 방출하는 에너지의 특성에 따라 감마카운터의 측정 범위가 에너지 범위의 약 54%임을 감안하면, 실제 회수율은 약 90%로 판단된다.
DISCUSSION
미국, 유럽 등에서는 방사성요오드(131I)를 이용한 고양이 갑상선기능항진증 치료법을 1990년대부터 사용하고 있으며, 치료효과가 높고 부작용이 작으며 마취가 필요 없기 때문에 고양이 갑상선기능항진증의 치료에 가장 효과적인 치료법으로 권장된다[6, 9, 10]. 본 연구에서는 이러한 방사성요오드(131I)를 단일 유효성분으로 하여 고양이 갑상선기능항진증 치료제로 개발되고 있는 싸이로키티 주사액(I-131)의 약리학적 특성을 FRTL-5 갑상선 세포와 랫드를 이용하여 시험하였다.
체내에서 요오드(Iodide)는 갑상선 소포 세포의 Sodium-iodide symporter(NIS)에 의하여 선택적으로 섭취된다. NIS는 갑상선 소포 세포의 세포막에 발현되는 세포막단백질이다. 이 단백질은 ATP를 사용하여 2개의 나트륨 이온과 1개의 요오드 이온을 갑상선 소포 세포 안으로 능동 수송한다. 이러한 기전으로 갑상선 소포 세포에 선택적으로 섭취된 요오드는 갑상선 소포(follicular lumen) 내로 운반되어 저장되며, thyroid peroxidase(TPO)에 의해 산화되어 T3(triiodothyronine) 또는 T4(thyroxine) 등 갑상선호르몬(thyroid hormone)의 합성에 사용된다[11, 12].
갑상선 소포 세포는 안정한 요오드(127I)와 방사성요오드(131I)를 구분하지 않고 섭취한다. 따라서 갑상선기능항진증에 이환된 고양이에 투여된 방사성요오드(131I)는 과증식된(hyperplastic) 갑상선 조직에 집중적으로 섭취되며, 기능이 항진된 갑상선 세포와 조직은 방사성요오드(131I)가 방출하는 방사선에 의하여 파괴된다. 특히, 방사성요오드(131I)는 비교적 높은 에너지를 갖는 베타 입자 형태의 이온화 방사선(ionizing radiation)을 방출함으로써 수주 내지 수개월에 걸쳐 세포 사망을 유도하며 치료효과를 나타낸다[2, 9, 13–15].
싸이로키티 주사액(I-131)의 약리작용을 나타내는 활성성분은 방사성요오드(131I)이다. 이는 원자로에서 텔루륨(tellurium)을 중성자 조사한 후에 요오드화나트륨(sodium iodide, 131I) 용액 형태로 분리 정제되며, 미국, 유럽 등에서 고양이 갑상선기능항진증 치료에 사용되는 방사성요오드(131I)와 동일하다.
본 연구 결과와 같이 타 장기인 간세포에 비하여 갑상선 세포에서 싸이로키티 주사액(I-131)의 세포 섭취율은 18배 이상으로 유의적으로 높은 수치를 보였다. 또한, 요오드와 경쟁 반응하였을 때 갑상선 세포에서 싸이로키티 주사액(I-131)의 세포 섭취율은 69% 수준으로 유의적인 감소를 보였다. 이에 따라 싸이로키티 주사액(I-131)은 요오드와 동일하게 갑상선 세포의 NIS를 통하여 선택적으로 갑상선에 섭취되는 작용 기전을 가진다는 것이 확인되었다. 또한, 싸이로키티 주사액(I-131) 처리에 의하여 갑상선 세포의 세포 성장률은 유의적으로 감소하였다. 시험에 사용된 싸이로키티 주사액(I-131)은 주피크 0.364 MeV를 방출하는 방사성요오드(131I)를 주성분으로 하며, 방사화학적 순도 또한 95% 이상으로써 일반적으로 방사성의약품에 요구되는 품질 기준을 만족하는 것이 확인되었다. 이를 통하여 싸이로키티 주사액(I-131)이 방출하는 방사선에 의하여 갑상선 세포 사멸 효과가 유발된다는 것이 확인되었다.
이와 같이 싸이로키티 주사액(I-131)은 갑상선 소포 세포의 세포막에 발현되는 NIS 단백질에 의한 선택적인 능동수송을 통하여 갑상선에 섭취되고 저장된다. 그리고 베타 입자 형태의 이온화 방사선을 방출함으로써 갑상선 세포 사멸을 유발하며 과증식된 갑상선에 대하여 치료 효과를 나타낸다. 이는 방사성요오드(131I)를 이용한 고양이 갑상선기능항진증 치료와 관련된 문헌에서 보고된 바와 동일하다.
방사성요오드(131I)는 갑상선 질환에 대한 치료제로 수십 년 간 사용되고 있어, 기존의 많은 문헌 보고를 통하여 생체 내에서 방사성요오드(131I)의 흡수, 대사, 분포, 배설 특성을 확인할 수 있다.
경구, 정맥, 피하 등 투여 경로는 방사성요오드(131I)의 흡수와 치료 효과에 영향을 주지 않는다[16]. 투여된 방사성요오드(131I)는 주로 위에서 흡수되어 혈액을 통해 갑상선에 섭취된다. 흡수되는 양은 갑상선기능항진증 또는 갑상선종에서 상대적으로 증가하며, 갑상선기능저하증에서는 상대적으로 감소한다. 싸이로키티 주사액(I-131)의 피하 투여에 따른 조직분포 시험 결과도 기존 보고와 차이가 없었다. 피하 투여된 싸이로키티 주사액(I-131)은 피하 투여 직후(5분 이내) 빠르게 전신으로 퍼졌으며, 투여부위인 피부조직에 비하여 요오드가 흡수되는 조직인 위에서 약 2.70배, 갑상선에서 약 218.68배 더 높은 조직 내 분포(%ID/g)를 보여 방사성요오드(131I)의 전형적인 흡수 양상이 확인되었다.
요오드(iodide)는 체내 흡수된 후, 주로 세포외액(extra-cellular fluid)에 분포하며 갑상선에 섭취되어 농축된다. 갑상선은 안정한 요오드(127I)와 방사성요오드(131I)를 구분하지 않고 섭취하며, 이는 갑상선의 정상적인 생리적 기능이다[2]. 싸이로키티 주사액(I-131)의 피하 투여에 따른 조직분포 시험 결과도 기존 보고와 차이가 없었다. 싸이로키티 주사액(I-131)은 피하 투여된 후, 위, 소장, 대장, 근육 및 갑상선을 제외한 대부분의 장기에 0.083시간(5분)에 최고 농도로 분포되었으며, 주로 신장을 통하여 배설되는 양상으로 확인되었다. 위에서 기술한 바와 같이, 위와 갑상선의 경우 방사성요오드(131I) 투여 시 관찰되는 전형적인 분포 양상을 보였다.
일반적으로 요오드(iodide)의 대사 과정은 다음과 같이 3단계로 진행된다. 첫 번째 단계에서 혈액 중 요오드는 갑상선 소포 세포의 표면에 있는 NIS에 의하여 능동수송 방법으로 갑상선에 섭취된다. 두 번째 단계에서 갑상선에 섭취된 요오드는 갑상선 과산화효소(TPO)에 의해 산화되어 티로글로불린(thyroglobulin)과 결합하며, 모노요오드티로신(monoiodotyrosine) 또는 다이이오도티로신(diiodotyrosine, DIT)을 생성한다. 그리고 모노요오드티로신과 다이오오도티로신은 서로 결합하여 트리요오드타이로닌(triiodothyronine, T3) 또는 타이록신(thyroxine, T4) 등 갑상선호르몬이 되며, 갑상선 소포 내강에서 콜로이드 형태로 저장된다. 마지막 단계에서 갑상선호르몬은 시상하부의 갑상선자극호르몬 분비호르몬(thyroid releasing hormone) 및 뇌하수체 전엽의 갑상선자극호르몬(thyroid stimulating hormone, TSH)의 제어에 의하여 megalin receptor 등을 통해 혈관으로 분비된다. 혈관으로 분비된 갑상선호르몬의 99%는 타이록신 결합 글로불린(thyroxine binding globulin), 타이록신 결합 전알부민(thyroxine binding prealbumin), 타이록신 결합 알부민(thyroxine binding albumin) 등 혈장 갑상선 결합 단백질에 의해 특이적으로 결합된 형태로 이동한다[2, 11]. 갑상선은 안정한 요오드(127I)와 방사성요오드(131I)를 구분하지 않고 섭취하여 대사하므로[2], 싸이로키티 주사액(I-131)의 대사 과정도 이와 동일하다.
고양이에게 투여된 방사성요오드(131I)는 주로 신장을 통한 뇨로 배설되며, 일부는 변으로 배설된다[2]. 배설되는 양은 투여된 방사성요오드(131I)의 37%–75%에 해당되며, 환자의 갑상선 및 신장의 기능에 따라 차이가 있다[13]. 싸이로키티 주사액(I-131)의 피하 투여에 따른 조직분포 시험 결과도 기존 보고와 차이가 없었다. 싸이로키티 주사액(I-131)은 피하 투여된 후, 총 배설량의 약 78.45%가 48시간 이내 배설되었으며, 이 중 85% 이상 뇨로 배설되는 것이 확인되었다.
결론적으로 싸이로키티 주사액(I-131)은 고양이 갑상선기능항진증 치료와 관련하여 보고된 방사성요오드(131I)와 동일한 작용기전, 효력, 흡수, 분포, 대사 및 배설 특성을 가진다. 향후 본 연구 결과를 활용하여 싸이로키티 주사액(I-131)을 동물용 방사성의약품으로 허가 받아 한국에서 싸이로키티 주사액(I-131)이 임상 치료에 사용될 수 있기를 기대한다.