INTRODUCTION
프로바이오틱스(probiotics)는 적정량 섭취 시 숙주에게 도움을 주는 살아 있는 미생물로 정의된다. 프로바이오틱스 균주로 이용되는 주요 미생물로는 Lactobacillus, Bifidobacterium, Enterococcus와 같은 젖산(lactic acid)을 생산하는 유산균과 Leuconostoc, Pediococcus, Bacillus 그리고 효모 등 다양한 미생물들이 사용되고 있다[1]. 이러한 균주들은 장내 미생물 균형을 유지시킴으로서 장 건강에 도움을 주는 것으로 알려져 있다[1]. 최근 광범위하고 심도 있는 연구를 통해 프로바이오틱스는 장건강뿐만 아니라 다양한 메커니즘으로 전신에 영향을 끼치는 것으로 보고되고 있다[2]. 프로바이오틱스는 항체 반응 증강, 염증 완화, 식세포 작용(phagocytosis) 자극 등의 면역반응 조절, 항균 물질 생산, 젖산 및 아세트산 생산을 통한 결장 내 pH 감소, 유해균 장내 정착 저항성 증가, 융합막(tight junction) 단백질 발현 및 점액 분비 증가를 통한 장방어막 기능 향상, 트립토판(tryptophan), 히스타민(histamine), 신경화학물질, 포만 호르몬(satiety hormone) 등의 저분자 물질 생성, 효소 생성 등을 통해 장내 건강유지에 기여하고 있다[2, 3]. 이러한 프로바이오틱스 균주의 효과는 균종(species) 및 균주(strain)별로 다른 항균효과 및 다양한 효능을 나타내며 이러한 특성으로 신규 프로바이오틱스 균주의 분리 및 특성 분석 연구가 지속되고 있다[3, 4]. 프로바이오틱스 균주들은 장관 계열과 유사한 환경에서 높은 생존력을 보여야 효과적인 프로바이오틱스 효과를 볼 수 있으므로 낮은 pH, 위산액, 담즙액, 페놀, 리소자임뿐만 아니라 다양한 항생제에 대한 충분한 저항성을 갖추어야 한다[5].
영장류는 해부생리학적, 유전학적, 면역학적으로 사람과 가장 가까운 전임상 동물종으로써 현재 전 세계적으로 광범위하게 다양한 생명공학 연구 분야에 이용되고 있다. 영장류는 사육 형태에 따라 야생(wild), 반 실내 사육(semi-captive) 및 실내 사육(captive) 형태로 구별되어 사육되고 있다. 그 중 실험용으로 주로 사용되고 있는 실내 사육 영장류에서는 원인불명의 만성 설사증(idiopathic chronic diarrhea), 위 팽창증 및 파열증(gastric dilatation and rupture)이 주된 자연 폐사의 원인으로, 수의학적으로 많은 문제를 일으키고 있다[6–8]. 이러한 장질환은 항생제 사용, 스트레스, 클로스트리디움 퍼프린겐스(Clostridium perfringens) 감염증 등 다양한 원인이 추측되고 있으나 명확한 기전은 밝혀져 있지 않고 있다. 최근 사람 만성 설사증 환자에서 장내 마이크로바이옴 교란(dysbiosis)으로 인한 간질환[9], 뇌질환[10] 등 다양한 질병과의 연관성에 대한 연구 및 사례 보고가 이루어지고 있다. 따라서 뇌 질환 및 감염병 등 연구에 광범위하게 이용되고 있는 실험용 영장류의 장 건강 유지는 수의학적 측면뿐만 아니라 실험 재현성 측면에서 매우 중요하다. 그러나 현재까지 영장류 프로바이오틱스에 대한 연구 보고는 매우 제한적이다. 실제 임상에 적용 가능한 영장류 유래 프로바이오틱스 제품은 세계적으로 Lactobacillus reuteri, Saccharomyces boulardii를 포함하는 SD ProTM(Bio-Serv, Flemington, NJ, USA) 한 제품만 상업적으로 출시되어 있으나, 일부 영장류 센터에서는 관례적으로 사람 유산균 제품을 이용하여 실내 사육 실험용 영장류 개체들에게 적용 중인 것으로 알려져, 영장류 건강 유지 및 질병 치료를 위한 영장류 전용 프로바이오틱스 균주의 개발이 매우 중요하다.
이번 연구는 실내 사육 영장류의 주요 장질환 유발 병원성 장내세균에 대한 사람과 영장류 유래 프로바이오틱스 균주의 항균 효과를 비교 분석하고, 이를 통해 이종간 프로바이오틱스 효과 비교 및 분석을 실시하여 실내 사육 영장류의 건강 증진을 위한 영장류 유래의 프로바이오틱스 균주 개발을 위하여 연구를 수행하였다.
MATERIALS AND METHODS
이번 연구에 이용된 사람 유래 유산균은 충북대학교 수의과대학 세균학실험실에서 사람의 분변으로부터 분리한 유산균(Leuconostoc mesenteroides, Lactobacillus plantarum, Bifidobacterium longum, Bifidobacterium breve, Lactobacillus sakei) 총 5균주를 분양 받아 실험에 이용하였다. 영장류 유래 유산균은 한국생명공학연구원 국가영장류센터 내에 사육중인 필리핀 원숭이(Macaque fascicularis)의 정상 분변으로부터 분리한 유산균 총 15 균주(L. reuteri[3주], Lactobacillus salivarius[3주], Lactobacillus johnsonii[8주], Lactobacillus mucosae[1주])를 이용하였다. 연구에 사용된 영장류 유래 주요 병원성 장내 세균은 한국생명공학연구원 국가영장류센터에서 사육 중인 만성 설사증의 임상증상을 보이는 필리핀 원숭이 분변 및 자연 폐사한 개체에서 장관 계열의 병리학적 특성을 보이는 위장관 조직에서 분리하여 보관중인 병원성 장내세균 C. perfringens(4주), Escherichia coli(5주), Citrobacter freundii(1주), Salmonella Enteritidis(1주), Staphylococcus aureus(1주), Proteus mirabilis(1주) 총 6속의 13개 균주를 이용하였다.
유산균 배양을 위해 –80℃ 냉동 보관된 균주를 De Man, Rogosa and Sharpe(MRS; Oxoid, Basingstoke, UK) 액체 배지에 37℃, 24시간 혐기 배양하여 사용하였고, 사람 유래의 유산균 중 B. longum과 B. breve는 48시간 혐기 배양하여 사용하였다. 실험에 사용한 병원성 장내세균 중 C. perfringens는 Brain Heart Infusion(BHI; Oxoid)에 37℃ 48시간 동안 혐기 배양하였고, S. Enteritidis, S. aureus, P. mirabilis는 Tryptic Soy Broth(TSB; Becton, Dickinson and Company, Franklin Lakes, NJ, USA) 배지를 이용하여 37℃, 24시간 혐기 배양하여 실험에 사용하였다. E. coli는 TSB에 37℃, 24시간 호기 배양하여 실험에 사용하였다. 혐기성 균주들은 EZ container system(Becton, Dickinson and Company)에 Anaerobic GasPak(Becton, Dickinson and Company)을 이용하여 혐기 조건을 형성하여 배양하였다.
펩신 용액(Sigma-Aldrich, St. Louis, MO, USA)을 멸균 Dulbecco`s Phosphate-Buffered Saline 용액(PBS; Welgene, Gyeongsan, Korea)을 이용하여 용해한 후 염산 용액을 첨가하여 최종 0.3%(w/v), pH 2.0 펩신 용액을 제조한 후 0.22 µm 실린지 필터를 이용하여 용액을 멸균한 후 사용하였다. 사람 유래의 유산균 5균주와 영장류 유래의 유산균 15균주를 MRS 배지에서 24시간(Lactobacillus spp., Leuconostoc spp.) 및 48시간(Bifidobacterium spp.) 혐기 배양하고 제조된 인공 위액 9 mL당 유산균 배양액 1 mL(약 109 colony forming unit; CFU/mL)씩 접종하고, 대조군은 PBS 용액 9 mL에 유산균주 1 mL를 접종하여 37℃에서 3시간 동안 반응시켰다. 인공 위액에서 배양한 유산균을 10진 희석한 뒤 LBS(Lactobacillus Selection Agar) 배지(Becton, Dickinson and Company)에 100 µL 분주하고, spreader를 사용하여 도말한 후, 37℃에서 24시간(Lactobacillus spp., Leuconostoc spp.) 및 48시간(Bifidobacterium spp.) 혐기 배양 후 생균수를 측정하였다. 본 연구 방법은 기존에 보고된 방법을 일부 변형하여 수행하였다[5].
인공 담즙액 저항성 테스트는 기존 방법을 변형하여 수행하였다[5]. MRS 배양액에 Ox gall(Sigma-Aldrich)를 첨가하여 0.3%(w/v) 담즙액을 만들고, 900 µL 인공 담즙액에 사람 유래의 유산균 5균주와 영장류 유래의 유산균 15균주를 MRS 배지에서 24시간(Lactobacillus spp., Leuconostoc spp.) 및 48시간(Bifidobacterium spp.) 혐기 배양하고 각 100 µL 접종하여 37℃에서 8시간 동안 반응시켰으며, 대조군은 MRS 용액 900 µL에 유산균주를 각 100 µL 접종하여 37℃에서 8시간 동안 배양하였다. 인공 담즙액에서 배양한 유산균을 10진 희석하여 LBS 배지(Becton, Dickinson and Company)에 100 µL 분주하고, spreader를 사용하여 도말 후 37℃에서 24시간(Lactobacillus spp., Leuconostoc spp.), 48시간(Bifidobacterium spp.) 배양 후 생균수를 측정하였다.
Agar disc diffusion assay는 기존 논문에서 보고된 Agar well diffusion assay 방법을 변형하여 수행하였다[11]. 사람 유래의 유산균 5균주와 영장류 유래의 유산균 15균주를 600 nm에서 흡광도 0.220로 적정하고 9 mL MRS 용액에 1 mL씩 접종한 후 24시간(Lactobacilllus spp., Leuconostoc spp.) 및 48시간(Bifidobacterium spp.) 배양하였다. 배양액을 원심분리(4,000×g, 4℃, 10분) 하여 상층액을 채취한 후 0.22 µm 실린지 필터를 이용하여 멸균된 상층액을 확보하였다. Muller-Hinton(MH, Sigma-Aldrich) 배지에 TSB(E. coli, S. Enteritidis, S. aureus, P. mirabilis) 및 BHI(C. perfringens)에서 배양한 병원성 장내세균을 100 µL 분주 후 spreader를 사용하여 도말하고, 각각의 plate당 멸균된 0.65 mm 크기의 disc 8개를 간격에 맞게 배열하고 1개의 disc를 plate의 중앙에 놓고 대조군으로 활용하였다. 유산균 상층액을 균주당 2개의 disc에 각각 30 µL 분주하고, plate 중앙의 disc에는 MRS 배양액을 분주한 후, 37℃에서 48시간 배양하였다. 배양 후 disc 주변으로 투명하게 형성되는 억제환(inhibition zone)의 지름을 측정하였다.
병원성 장내세균에 대한 유산균주의 항균활성도의 정량적 측정을 위하여 기존 보고된 방법을 변형하여 수행하였다[11]. 유산균주를 600 nm에서 흡광도 0.220로 적정한 후 9 mL MRS 용액에 1 mL씩 접종한 후 37℃에서 24시간(Lactobacillus spp., Leuconostoc spp.) 및 48시간(Bifidobacterium spp.) 혐기 배양하였다. 배양액은 원심분리(4,000×g, 4℃, 10분)를 실시한 후 상층액을 채취하였고 0.22 µm 실린지 필터를 이용하여 멸균된 상층액을 확보하였다. 5 mL TSB, BHI 배양액에 각 병원성 장내세균을 200 µL씩 접종하고, 유산균 상층액을 1 mL 접종하여 24시간과 48시간 배양 후 각각 분광광도계(Epoch, BioTek, Winooski, VT, USA)를 사용하여 600 nm에서 흡광도를 측정하였다.
이번 실험의 모든 결과는 GraphPad Prism, version 8.4.3 소프트웨어(www.graphpad.com)를 이용하여 각 그룹 간 통계학적으로 유의미한 차이를 Mann-Whitney U test 방법을 통해 분석하였다.
RESULTS
사람 및 영장류 유래 유산균에 대해 인공 위액(pH = 2) 및 담즙액(0.3%)에 대한 저항성에 대해 조사하였다. 사람 유래 유산균 5균주와 영장류 유래 유산균 15균주는 인공 위액에 3시간 동안 처리한 결과, 모두 106 CFU/mL 이상의 세균 농도를 보였으며 담즙액에서 8시간 배양 후 사람 및 영장류 유래 모든 유산균주는 107 CFU/mL 이상의 세균 농도가 측정되었다. 유산균주에 대한 인공 위액 및 담즙액 처리에 의한 감소율은 다양하게 측정되었다(Table 1). 인공 위액 처리 시 영장류 유래 유산균주들은 모두 90% 이상의 세균이 생존하였으나 사람 유래 유산균주 중 L. plantarum은 77.5% 생존율을 보여 저항성이 약한 것으로 측정되었다. 반대로 인공 담즙액을 8시간 처리 시 사람 유래 유산균은 모두 80% 이상의 생존율을 나타냈으나 영장류 유래 유산균주 중 L. johnsonii(LF1)와 L. salivarius(1052S)는 각각 75.9%와 75.6%로 저항성이 약한 것으로 측정되었다(Table 1).
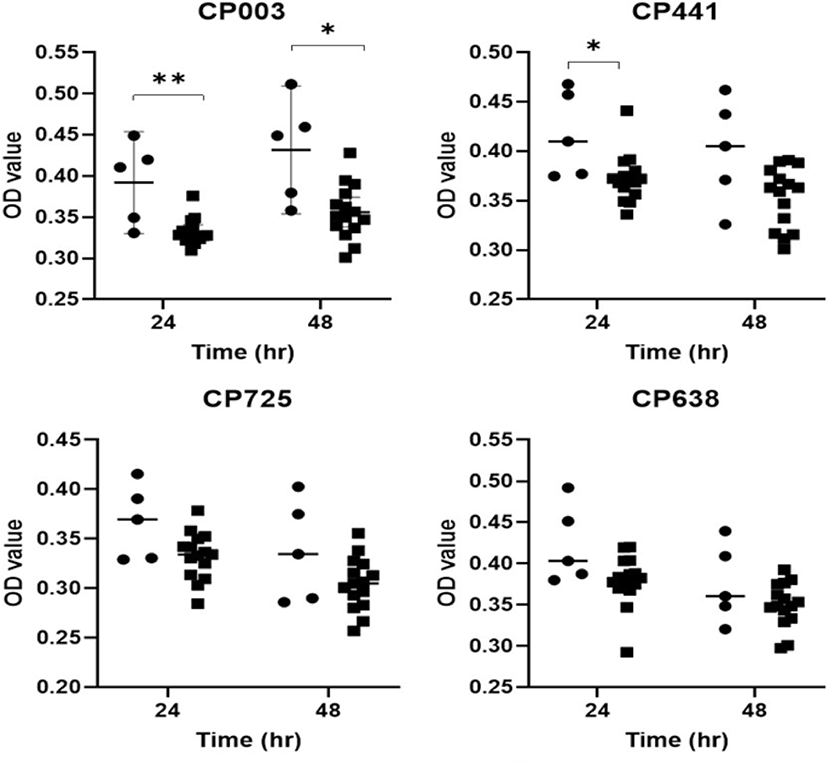
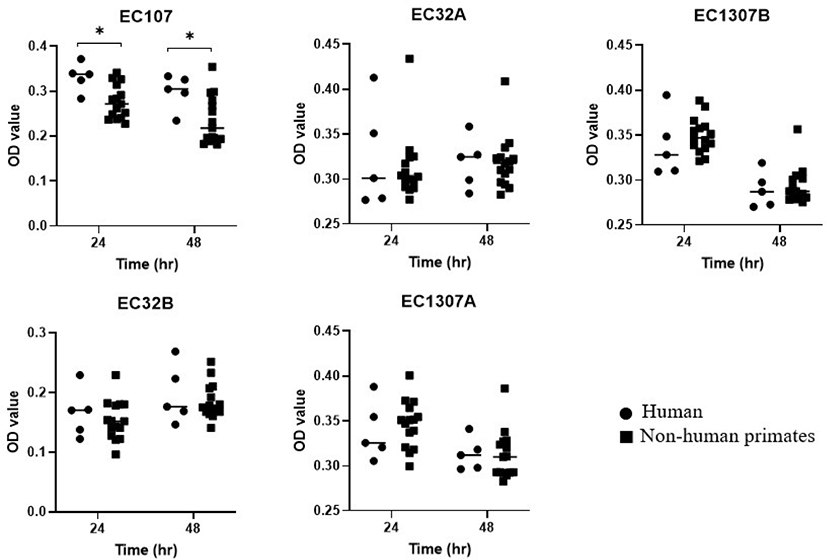
Agar disc diffusion assay를 이용하여 사람 유래 유산균(5균주) 및 영장류 유래 유산균(15균주)의 C. perfringens(4균주), E. coli(5균주), C. freundii(1균주), S. Enteritidis(1균주), S. aureus(1균주), P. mirabilis(1균주) 총 13균주 병원성 장내세균에 대한 항균 효과를 측정하였으며, 억제환(inhibition zone)을 나타낸 구역의 지름을 측정하여 항균력을 확인하였다(Table 2). 그 결과, 대부분의 유산균들이 C. perfringens 균주 중 CP441을 제외한 CP003, CP725, CP638 균주에 대해서 항균력을 나타내는 것으로 확인되었다. 사람 유래의 유산균 중 L. plantarum의 경우에는 C. perfringens를 제외한 9균주의 병원성 장내세균 중 32A, 1307A(E. coli) 균주를 제외한 7균주에 대해 항균력을 나타내 사람 유래의 유산균 중 항균력이 가장 뛰어난 것으로 나타났다. 그러나 사람 유래의 유산균 L. mesenteroides는 병원성 장내 세균 9균주 중 32A(E. coli), CF(C. freundii) 2균주에 대해서만 항균력을 나타냈고, B. longum, B. breve, L. sakei는 E. coli, C. freundii, S. Enteritidis, S. aureus, P. mirabilis에 대해 항균력을 보이지 못했다. 영장류 유래의 유산균은 E. coli를 비롯한 모든 병원성 장내세균에 대해 항균력을 보이는 것을 확인할 수 있었다.
사람 및 영장류 유래 유산균의 동물종 간의 항균효과를 비교 검증한 결과, 영장류 유래 유산균이 C. perfringens 2균주와 E. coli 1균주에 대해 통계학적으로 유의미하게 더 높은 항균 효과를 보이는 것을 확인하였다(Fig. 1 and 2). 그러나 C. freundii, S. Enteritidis, S. aureus, P. mirabilis 등의 병원성 장내세균에 대한 항균 효과의 차이는 관찰되지 않았다.
영장류 유래의 병원성 장내세균에 대한 유산균종(L. reuteri, L. johnsonii, L. salivarius) 간의 항균효과 및 동일종내의 균주 간 항균효과를 비교 분석한 결과, C. perfringens에 대해서는 유산균종 간의 유의성 있는 항균 효과 차이가 관찰되지 않았으나, 기타 다른 병원성 장내세균(E. coli, C. freundii, S. Enteritidis, S. aureus, P. mirabilis)에서 통계적으로 유의미하게 L. johnsonii가 높은 항균 효과를 보이는 것으로 확인되었다(Table 3 and 4). 이와 같은 항균효과 차이는 사람 유래의 유산균 종간의 비교에서도 확인할 수 있었다.
동일종 내에서 유산균주 간의 항균 효과 차이를 비교한 결과에서는 L. johnsonii에 속하는 균주 간의 C. perfringens에 대한 항균 효과 차이를 확인할 수 있었으며, L. reuteri에 속하는 균주 간의 C. perfringens에 대한 항균 효과 차이를 확인할 수 있었지만, 기타 다른 병원성 장내세균(E. coli, C. freundii, S. Enteritidis, S. aureus, P. mirabilis)에 대해서는 동일종 내의 균주 간의 항균 효과 차이는 관찰되지 않았다.
DISCUSSION
전 세계적으로 연구용 영장류는 감염병, 뇌질환, 대사질환 등 주요 질병에 대한 연구를 위한 전임상동물로 이용되어 왔다. 최근 COVID-19 등 감염병 연구의 주된 전임상 동물자원으로 영장류 연구가 급증하여 전 세계적으로 영장류 동물 자원의 부족 현상이 발생하였다. 이러한 연구용 영장류는 자연 상태의 영장류와는 달리 연구시설의 실내에서 사육되고 있으며 이러한 환경 변화는 영장류에 만성 설사증 및 위 팽창 등 장 질병을 유발시키고 이는 주된 영장류 폐사 원인으로 보고되고 있다[7, 12]. 따라서 실내 사육 연구용 영장류의 자원 확보 및 유지를 위해 영장류 장질환 예방은 수의학적으로 매우 중요하며 이를 위해 영장류 대상 유산균 요법이 필요하지만 영장류 대상 유산균 요법에 대한 연구 보고는 매우 제한적이다. 이번 연구에서는 세계 최초로 영장류 유래 병원성 장내세균에 대한 영장류 유래 유산균주들과 사람 유래의 유산균주들의 항균 효과를 비교 분석하였다.
신규 유산균주들은 실제 숙주 장관계열에서의 효과적인 작용을 위해 상부 장관계열에서의 위산 및 담즙에 대한 저항성이 확보되어야 살아 있는 유산균 주들이 장관 계열에 도달할 수 있다[2, 13]. 따라서 사람 및 영장류 유래 모든 유산균 주들에 대해 인공 위액(pH = 2) 및 담즙액(0.3% w/v)에 대한 저항성을 측정하였다. 기존 논문에서는 위액에서 106 CFU/mL 이상, 담즙액에서도 107 CFU/mL 이상의 세균 생균수를 기준으로 유산균이 위액과 담즙액에 저항성 여부를 판단하였다[5]. 그 결과, 이번 연구에서 측정한 사람 유래 유산균 및 신규 영장류 유래의 유산균 들은 모두 위액과 담즙액에 대해 저항성을 가지고 있음을 확인하였다. 그러나 인공 위액 및 담즙액 처리 후 감소율은 유산균주마다 다르게 나타났다. 영장류 유래 유산균주들은 인공 위액 처리시 모든 유산균주에서 90% 이상의 생존율이 관찰되었으나, 사람 유래 유산균 L. plantarum은 위액에 다소 낮은 저항성을 보이는 것으로 측정되었다. 이와 반대로 인공 담즙 처리시 사람 유산균주들은 모두 80% 이상의 생존율을 보였으나 영장류 유래 L. johnsonii LF1과 L. salivarius 1052S 각각 1개 균주에서 75.9%와 75.6%의 생존율이 관찰되었다. 특히 동일한 유산균종에 속한 유산균주마다 담즙액에 대한 다양한 저항성이 관찰되었다. 예를 들어 L. johnsonii종에 속하는 8개의 세균주는 인공 위액에 대해서는 93.0%–98.6%의 감소율이 관찰되었지만 인공 담즙액 처리시에는 75.9%–92.7%로 넓은 범위의 감소율이 관찰되었다. 기존 논문에서도 유산균 균주에 따라 다양한 위액 및 담즙액에 대한 저항성이 보고되었다[5, 14]. 이번 연구에서도 위액 및 담즙액에 대한 유산균주의 저항성은 동일한 유산균종 안에서도 유산균주별로 다양하게 관찰됨을 확인할 수 있었다.
유산균주의 이종간 항균효과 비교 분석에 관한 연구는 그동안 보고되지 않았다. 사람과 영장류 간의 마이크로바이옴 비교 분석 결과, 영장류는 다른 실험동물과 비교 시 사람과 가장 유사한 마이크로바이옴 특성을 보이는 것으로 보고되었다[15]. 이러한 이유로 일부 국외 영장류센터에서는 상업화된 사람 유래 유산균 주를 현재 프로바이오틱스 요법으로 사용하고 있다. Antibiotic disc diffusion 실험 결과, 사람 유래의 유산균주 중 L. plantarum을 제외한 다른 4개의 유산균주는 C. perfringens를 제외한 나머지 영장류 유래 병원성 장내세균에 대해 항균 효과가 관찰되지 않았다. 기존 연구결과에 따르면 E. coli와 Salmonella spp.에 비해 C. perfringens에 대한 Lactobacilli spp.의 높은 항균효과가 관찰되었다[16]. 이와 같이 사람 유래 유산균은 모두 C. perfringens에서만 항균 효과가 관찰되었고 다른 병원성 장내세균에 대한 항균효과는 관찰되지 않았다. 이러한 동종 또는 이종간 유산균의 항균효과 차이를 정량적으로 분석하기 위해 Broth culture inhibition assay를 수행하였다. 그 결과 사람 유래 유산균과 비교 시 영장류 유래 유산균이 C. perfringens 2균주와 E. coli 1균주에 대해 통계학적으로 유의미하게 더 높은 항균 효과를 보이는 것을 확인하였다. 그러나 C. freundii, S. Enteritidis, S. aureus, P. mirabilis 등의 병원성 장내세균에 대한 항균 효과의 차이는 관찰되지 않았다. Agar disc diffusion assay 결과에서는 C. perfringens를 제외한 병원성 장내세균에 대해 주로 영장류 유래 유산균에서만 억제 효과가 확인되었지만 정량적인 분석 시 통계적으로 유의미한 차이는 관찰되지 않았다. 이는 영장류 유래 유산균의 약한 항균작용으로 인하여 Broth culture inhibition assay에서의 증식을 억제하지 못한 것으로 추정된다.
유산균 종(species)과 주(strain) 간의 항균 효과에 대한 비교 분석을 수행하였다. 영장류 유래의 유산균 종간 비교에서 L. johnsonii, L. reuteri, L. sarivarius의 항균 효과를 병원성 장내세균별로 통계 분석한 결과, C. perfringens에 대한 항균 효과 차이는 관찰되지 않았지만 통계적으로 나머지 5개 병원성 장내세균에 대해 L. johnsonii가 L. reuteri와 L. sarivarius에 비해 항균 효과가 높은 것으로 나타났다. 동일종 유산균주 간의 항균효과 차이는 L. johnsonii와 L. reuteri에 속하는 유산균주에서는 C. perfringens에 대해서만 항균 효과 차이가 확인되었다. 이러한 유산균주별 항균효과 차이는 기존 논문에서도 보고되어 왔으며 그 기초 기전에 대한 연구분석이 추가로 필요하다.
현재 전 세계적으로 영장류 장질환 예방을 위한 프로바이오틱스 제품은 영장류 유래의 L. reuteri 1개의 균주만을 사용한 제품이 유일하며, 차선책으로 사람용 프로바이오틱스 제품을 사용하고 있는 실정이다. 이번 연구를 종합해보면 전반적으로 영장류 유래 병원성 장내세균에 대해 사람 유래 유산균보다 영장류 유래 유산균이 높은 항균 효과를 나타낸다는 것을 확인하였다. 또한 병원성 장내세균에 대해 유산균 종 및 주마다 구별되는 항균효과를 나타냈다. C. perfringens에 대한 항균 효과를 위해서는 높은 항균 효과를 나타내는 유산균주(118R, 118J, 227J)를 선정해야 하고, E. coli, S. Enteritidis, S. aureus, P. mirabilis에 대해서는 같은 종 내에서는 균주 간의 차이가 관찰되지 않았지만 유산균 종간 항균력 비교 시 L. johnsonii가 가장 뛰어난 효과를 나타내는 것으로 밝혀졌다. 따라서, 계통분석학적으로 유사한 사람과 영장류 사이의 유산균주의 항균 효과 차이가 명확히 밝혀진 사실을 바탕으로 영장류의 장건강을 위한 프로바이오틱스로 사람유래의 유산균 및 기타 다른 유산균주들보다 L. johnsonii를 사용하는 것이 바람직하며, 영장류 개체별 장형(enterotype) 등의 기준으로 유산균주의 항균력 차이를 다양하게 비교 분석해봐야 할 것으로 판단된다. 이번 연구를 통해 영장류 병원성 장내세균에 대한 다양한 사람 및 영장류 유래 유산균의 항균 효과 차이를 심도 있게 분석해봤으며 이를 통해 신규 영장류용 유산균주 개발에 중요한 연구 자료로 활용될 수 있을 것으로 판단된다.







