Original Article
Synergistic effect of probiotic HP7 and the extracts of Perilla frutescens and Glycyrrhiza glabra to alleviate Helicobacter pylori-induced damages
Hyun-A Lee1
,
Okjin Kim1,*
Author Information & Copyright ▼
1Center for Animal Resource Development, Wonkwang University, Iksan 54538, Korea
*Corresponding author: Okjin Kim, Center for Animal Resource Development, Wonkwang University, Iksan 54538, Korea Tel: +82-63-850-6668, Fax: +82-63-850-7308, E-mail:
kimoj@wku.ac.kr
© Research Institute of Veterinary Medicine, Chungbuk National University. All rights reserved.
Received: Jul 13, 2020; Accepted: Aug 06, 2020
Published Online: Sep 30, 2020
Abstract
The efficacy of standard therapeutic strategies for Helicobacter pylori infection is decreasing over time due to the emergence of drug-resistant strains. At the our previous study, we reported that the lactic acid bacterium Lactobacillus paracasei HP7 isolated from kimchi - a fermented vegetable dish widely consumed in Korea - had inhibitory effects against H. pyloriin vitro and in vivo. In this study, we are aimed to investigate the synergistic effect of probiotic HP7 and the extracts of Perilla frutescens (PFE) and Glycyrrhiza glabra (GGE) to alleviate Helicobacter pylori-induced damages. H. pylori infection in KATO III cells decreased mucin gene expression over time. The reduction of mucin gene expression was significantly recovered at 6 hours when GGE, PFE, and Lactobacillus HP7 were co-treated. H. pylori infection of C57BL/6 mice was demonstrated by H. pylori-IgG concentration, and results showed significant increase in mice post-infected with H. pylori. Blood Tumor Necrosis Factor (TNF)-α levels were elevated 4 weeks after H. pylori inoculation. However, the treatment of a combined mixture of HP7 including GGE and PFE induced significant decrease of TNF-α level (p<0.01) and showed significant decrease of TNF-α level as compared as the level by the positive control Glycyrrhiza glabra acetone extract (Deglycyrrhizinated Licorice, DGL) treatment (p<0.05). Additionally, the treatment of a combined mixture of HP7 including GGE and PFE decreased gastric inflammation and mucosal lesions in the stomach of H. pylori-infected mice. These results demonstrate that he treatment of a combined mixture of HP7 including GGE and PFE treatment can inhibit H. pylori growth and is thus a promising treatment for patients with gastric symptoms such as gastritis that are caused by H. pylori infection.
Keywords: probiotic; HP7; Helicobacter pylori; Perilla frutescens; Glycyrrhiza glabra
Introduction
Helicobacter pylori는 Gram-negative의 세균으로 만성 위염[1], 위궤양[2], 위암의 발암인자[3, 4]로 알려져 있다. 치료법으로 항생제를 이용한 H. pylori 세균을 제균하는 요법들을 통하여 H. pylori 감염과 관련된 위장 질환을 감소시킬 수 있고[5, 6], 위암 발병의 위험을 감소시킬 수 있다[7]. H. pylori 제균 요법으로 표준 요법으로 사용되는 3제 요법은 clarithromycin과 amoxicillin과 같은 2종의 항생제와 proton pump inhibitor인 metronidazole의 복합처방을 통하여 효과적인 H. pylori 감염 치료가 이루어지는 것으로 알려져 있다[8, 9]. 그러나 임상에서 3제요법의 효과가 점점 줄어들어 80% 미만의 치료율이 보고되고 있고, 이러한 이유는 metronidazole과 clarithromycin 약제 내성 H. pylori 균주들의 증가 때문으로 알려져 있다[10–12]. 더욱이 H. pylori 감염 환자들 중에서 3제 요법 약제들에 대한 알레르기 부작용으로 H. pylori 치료 실패 사례들이 보고되고 있다[13]. H. pylori 감염 환자들에 오랜 기간 항생제의 적용은 권장되지 않아 H. pylori 감염에 효율적인 새로운 항균 대체제의 개발이 매우 중요한 상황이다[14].
최근 Lactobacillus(L.) spp. 유산균들이 H. pylori 치료의 보조제로서 권장되고 있고, 3제요법의 부작용을 경감시킬 수 있는 것으로 보고되고 있다[15, 16]. 최근 선행으로 연구한 결과로 김치에서 분리한 L. paracasei HP7 유산균이 H. pylori 감염 억제에 효과가 있는 것을 in vitro와 in vivo 연구를 통하여 확인하고 보고한 바가 있다[17].
최근, 다수의 식물 추출물들이 부작용이 경감된 항생제 대체제로서 주목을 받고 있다[18]. 이러한 연구들 중 하나로 감초(Glycyrrhiza glabra) 추출물(Glycyrrhiza glabra extract, GGE)에 의한 H. pylori 억제 효과와 감염 환자에서의 치료 효과들이 보고되고 있다[19–21]. 또한 차조기(Perilla frutescens var. acuta) 추출물(Perilla frutescens extract, PFE)에 의한 항균 효과 [22, 23]와 염증 억제 효과[24–26]가 보고되고 있다.
이전에 우리가 보고한 연구 결과에 의하면, L. paracasei HP7 단독으로 H. pylori 감염을 다소 억제할 수 있었다[17]. 본 연구에서는 L. paracasei HP7에다가 항균 효과와 위점막 보호 효과가 있는 것으로 보고되고 있는 차조기 추출물인 PFE와 감초 추출물인 GGE를 복합적으로 처방한 시료의 상승된 효과를 확인하고자 연구가 수행되었다.
Materials and Methods
L. paracasei HP7 및 시험 물질
L. paracasei HP7은 한국야쿠르트(Korea Yakult, Seoul, Korea)에서 제공받아 0.2% dipotassium hydrogen phosphate, 0.5% sodium acetate, 0.8% meat extract, 0.1% Tween 80, 0.4% yeast extract, 2% d(þ)-glucose, 0.02% magnesium sulfate, 1% peptone, 0.2% diammonium hydrogen citrate, 0.004% manganese sulfate를 포함한 Man-Rogosa-Sharpe broth(Difco Laboratories, Detroit, MI, USA)에서 35℃로 24 h을 배양하였다. 감초와 차조기 추출물인 GGE와 PFE는 한국야쿠르트(Korea Yakult)에서 제공받아 실험에 사용하였다. 양성대조군으로는 헬리코박터 파이로리 증식억제 개별인정 소재인 감초 아세톤 추출물(Deglycyrrhizinated Licorice, DGL)을 사용하였다.
Mucin 유전자 발현 회복 시험
KATO III 세포에 H. pylori 감염 후 mucin 발현을 측정하기 위하여 Mucin 1과 Mucin5AC 유전자 발현 측정을 하였다. KATO III 세포는 95% air/5% CO2 (v/v) 가습 배양기에서 10% FBS를 포함하는 Ham’s F-12 medium에 37℃로 6-well plates에서 24시간 배양하였다. 1 × 106 cells/mL KATO III 세포에 H. pylori SS1 세균을 1 × 107 CFU/mL로 감염시키고, L. paracasei HP7(1 × 107 CFU/mL), PFE(25 μg/mL) 및 GGE(3 μg/mL) 처치하고, 12시간 배양 후 TRIzol reagent(Sigma-Aldrich, St. Louis, MO, USA)를 사용하여 total RNA를 추출하였다. 시료에서 추출한 RNA를 TaqMan probe(ThermoFisher, Muc 1: Hs00159357_m1, Muc5AC: Hs01365616_m1)과 mouse leukemia virus reverse transcriptase, 1 mM dNTP, 0.5 μg/μL oligo(dT12-18)를 가지고 Mucin 1과 Mucin 5AC 유전자 발현 측정을 하였다.
실험동물
본 연구에 사용한 실험동물은 샘타코(Samtako, Osan, Korea)에서 Specific pathogen free(SPF) 상태로 유지되는 수컷 4주령의 C57BL/6 Mouse를 공급받아 1주일 동안 순화 사육하여 실험에 사용하였다. 동물사육 및 실험 실설은 원광대학교 동물자원개발연구센터 실험동물사육실(III)을 이용하였다. C57BL/6 Mouse 선택의 이유는 H. pylori SS1 감염에 위한 colonization이 C57BL/6 마우스에서 유도되어 H. pylori 제균 효능 시험에 적합하기 때문이었다[17]. 실험에 이용된 실험동물 사육실은 12시간 간격으로 명암을 조절하였고, 사육실의 온도는 23 ± 1℃, 습도 50 ± 5%, 소음 60 phone 이하, 조도 150–300 Lux, 환기는 시간당 10–12회의 환경에서 사육하였다. 사료는 실험동물 전용사료(Samtako, Osan, Korea)를 급여하고, 음수는 filter 및 자외선 살균시킨 정제수를 자유급수하였다. 본 연구에 사용된 동물실험에 관련된 모든 실험과정과 절차는 원광대학교 동물실험윤리위원회의 사전심의와 윤리 규정을 준수하여 수행되었다(Approval No. WKU 19-49).
H. pylori 배양 및 감염 유발
H. pylori SS1(B0890, Helicobacter pylori Korean Type Culutre Collection, HPKTCC) 균주를 10% bovine serum이 첨가된 Brucella Agar 배지에 도말 후, 37℃ 10% CO2 및 100% 습도 유지되는 incubator에서 2–3일간 배양하였다. 배양된 H. pylori를 멸균된 Brucllela broth에 현탁하여 모은 후, 2.0 × 109 colony forming unit(CFU)/mL의 균수를 포함하게 준비하여 실험에 사용하였다.
1주일간 순화 사육한 4주령의 건강한 수컷 C57BL/6 Mouse를 비감염 정상군인 1군을 제외한 감염군 개체들의 선발을 위해 12시간 절식시킨 후 정상군을 제외한 동물들에게 H. pylori를 2.0 × 109 CFU/mL의 균수가 포함되게 준비된 배양액을 각 마우스에게 0.5 mL씩 마우스용 존대를 이용하여 경구 투여(p.o.) 투여하여 H. pylori 감염을 유발하였다.
H. pylori 항체가 측정
H. pylori 접종 종료 1주 후에 모든 마우스의 혈액을 안와정맥총(Ophthalmic venous plexus)으로부터 Heparinized capillary microtube 이용하여 혈액을 채취 후 혈청을 분리하여 각 개체들의 혈청 내 IgG 1 항체가를 측정하였다. H. pylori 항체가 측정은 Mouse Helicobacter pylori antibody(IgG) ELISA kit(Cusabio Biotech, Houston, TX, USA)를 이용하여 분리된 각 개체의 혈청으로부터 ELISA reader(INFINITE M200PRO, Tecan, Switzerland)를 이용하여 450 nm 흡광도로 H. pylori 항체가를 측정하였다.
군 구성
실험군은 10두씩 한 군으로 하여 6개의 실험군으로 분류하였다. 군 구성은 H. pylori 비감염 무처치 대조군인 정상군(NC), H. pylori 감염 후 무처치 대조군인 음성대조군(C), H. pylori 감염 후 감초 아세톤추출물(30 mg/kg) 처치군인 양성대조군(Deglycyrrhizinated Licorice, DGL), H. pylori 감염 후 PFE 5 mg/kg +GGE 1.2 mg/kg 투여군(COM1), H. pylori 감염 후 PFE 10 mg/kg+GGE 1.2 mg/kg 투여군(COM2), H. pylori 감염 후 HP7+PPE 10 mg/kg+GGE 1.2 mg/kg 투여군(COM 3)으로 분류하였다. 투여량은 마우스 kg당 10 mL의 농도로 D.W에 현탁하여 각 군에 해당되는 약물을 시험 당일 조제하여 마우스용 경구용 존데를 이용하여 매일 일정한 시간대에 경구 투여(p.o.)하였고, 투여 용량은 최근의 체중을 기준으로 산출하였다.
NC군과 C군에는 시험물질 처치군인 다른 4개군과 동일한 양의 증류수를 시험기간 동안 동일한 조건으로 투여하였다.
위점막 병리조직학적 검사
시험 종료일에 위(stomach)를 적출하여 생리식염수로 세척 후 여과지로 수분을 제거하여 병리조직학적 검사를 위해 적출된 위 조직을 10% 중성 포르말린에 고정하고, 병리조직학적 검사를 위한 통상적인 방법을 사용하여 파라핀 포매 후, 4 μm의 두께로 절편한 뒤 슬라이드를 제작하여 H&E stain을 마친 뒤 Nikon Eclipse E200(Nikon, Tokyo, Japan) 광학 현미경을 통해 병리조직학적 검사를 수행하였다. 위점막의 병리조직학적 점수 산정은 Updated Sydney system[27]의 방법을 따라 수행하였다.
혈중 tumor necrosis factor-α검사
실험 종료 시 실험에 사용된 마우스를 12시간 절식시킨 후 ether 마취시킨 후 마우스 혈액을 안와정맥총(Ophthalmic venous plexus)으로부터 Heparinized capillary microtube를 이용하여 혈액을 채취하고, 4℃에서 정체하여 혈액을 응고시킨 후 4℃ 3,000 rpm으로 15분간 원심분리하여 혈청을 분리한 후 Mouse tumor necrosis factor-α (TNF-α) Immunoassay(R&D system, Minneapolis, MN, USA)와 Mouse Interleukin 8(IL-8) ELISA Kit(R&D system)를 이용하여 ELISA reader(INFINITE M200PRO, Tecan, Switzerland)로부터 450 nm 흡광도로 염증 관련 사이토카인 TNF-α와 IL-8의 군간 변화를 측정하였다.
통계학적 분석
각 실험군의 양성률에 대한 통계는 Repeated Measured ANOVA SPSS v.22 USA(Duncan’s 사후검정)을 실시하였으며, p<0.05 이하일 때 통계적으로 유의한 것으로 판단되었다.
Results
H. pylori 감염 후 항체 검사
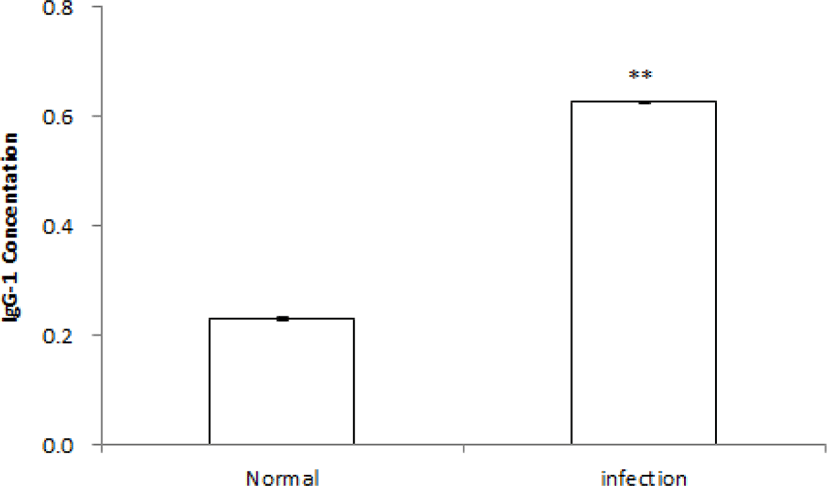
마우스에 H. pylori 감염 후 혈중 IgG 항체가를 측정한 결과, 비감염 정상군 NC군(n = 10)의 평균값은 0.23 ± 0.004 pg/mL이었고, 감염군(n = 50)의 평균값은 0.63 ± 0.002 pg/mL이었다. 비감염 정상군에 비교하여 H. pylori 감염군은 유의적으로 H. pylori 항체가 상승을 확인할 수 있었다(p<0.01)(Fig. 1).
Fig. 1.
Change of Helicobacter pylori-IgG concentration in the serum of H. pylori-infected mouse. ** Significantly different from the non-infection of H. pylori (Normal) (p<0.01).
Download Original Figure
Mucin 유전자 발현 회복 시험 결과
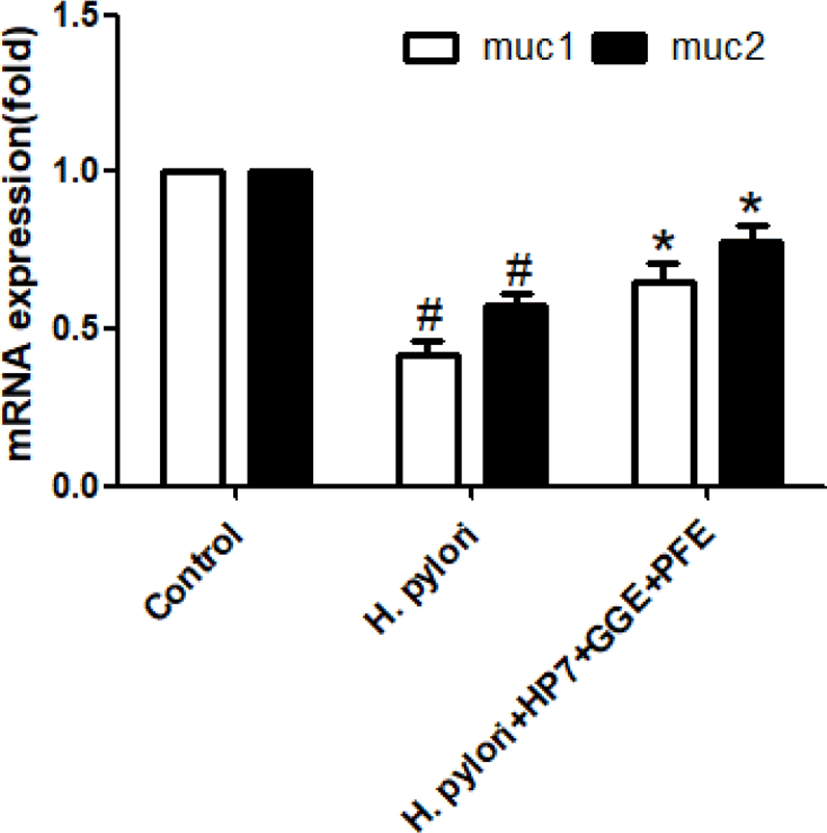
KATO III 세포에 H. pylori SS1 세균을 감염 후 위점막 방어 인자인 mucin 관련된 Mucin 1과 Mucin5AC 유전자 발현이 현저히 감소하는 것을 확인하였다(Fig. 2). 반면 H. pylori 세균을 감염시키고, 천연물 PFE와 GGE를 포함한 유산균 L. paracasei HP7을 적용한 세포들에서는 Mucin 1과 Mucin 5AC 유전자 발현이 회복되는 것을 확인하였다(Fig. 2).
Fig. 2.
Effect of herbal extracts on mucin gene expression by Helicobacter pylori infection. H. pylori infection in KATO III cells decreased mucin gene expression over time. The reduction of mucin gene expression was significantly recovered at 6 hours when Glycyrrhiza glabra extract (GGE), Perilla frutescens extract (PFE) and Lactobacillus HP7 were co-treated. #Significantly different from the control Group (p< 0.01). *Significantly different from the H. pylori treated Group (p<0.05).
Download Original Figure
병리조직학적 점수
H. pylori 감염 후 마우스의 위점막을 채취하여 병리조직학적 점수(histopathological lesions scores)를 산정한 결과는 Table 1과 같았다. H. pylori 비감염 무처치 정상군인 NC 군의 모든 개체에서 위점막 상피세포 증식에 병변은 관찰되지 않았다. NC 군의 위점막의 병리조직학적 점수는 0 ± 0이었다.
Table 1.
Histopathological lesions scores o of gastric mucosa from mice infected with Helicobacter pylori followed by treatment with Lactobacilllus paracasei HP7 and herbal extracts
| Group |
Treatment |
n |
Histopathological lesions scores |
| NC |
Normal control |
10 |
0 ± 0 |
| C |
H. pylori
|
10 |
5.8 ± 0.79 |
| DGL |
H. pylori+GGAE |
10 |
2.0 ± 0.67** |
| COM1 |
H. pylori+PFE5+GGE1.2 |
10 |
3.2 ± 0.79* |
| COM2 |
H. pylori+PFE10+GGE1.2 |
10 |
3.9 ± 0.74* |
| COM3 |
H. pylori+HP7+PFE10+GGE1.2 |
10 |
1.9 ± 0.99** |
Download Excel Table
H. pylori 감염 후 무처치 대조군인 음성대조군인 C군은 위점막 융모세포 길이가 짧아지고, 융모의 위축, 점막하직에 염증세포의 침윤과 불규칙학 융모의 구조가 관찰되며, 위점막 병리조직학적 점수는 5.8 ± 0.79이었다.
H. pylori 감염 후 감초 아세톤추출물(30 mg/kg) 처치군인 DGL군의 병리조직학적 점수는 2.0 ± 0.67, H. pylori+ PPE5+GGE1.2(COM1)군은 3.2 ± 0.79, H. pylori+PPE10+ GGE1.2(COM2)군은 3.9 ± 0.74, H. pylori+HP7+PPE5+ GGE1.2(COM3)군은 31.9 ± 0.99의 결과를 확인할 수 있었다.
병리조직학적 검사 결과, 시험물질 투여군 모두에서 H. pylori 감염에 따른 위점막 상피세포의 손상과 위축 및 점막하직의 염증세포 침윤 등을 완화 및 예방하는 효과가 통계적으로 유의한 것을 확인할 수 있었다(p<0.05). 특히 Lactobacillus HP7과 차조기 추출물 및 감초 추출물의 복합제제인 COM3군의 완화 및 예방 효과는 특히 더 우수한 것으로 판단되어졌다(p<0.01).
혈중 TNF-⍺ 농도 변화
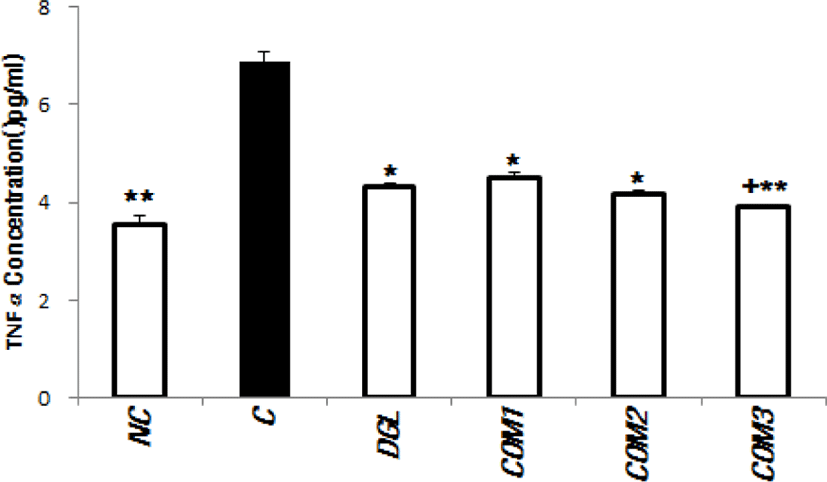
Mouse TNF-α ELISA kit(R&D system)를 이용하여 염증 관련 사이토카인 TNF-⍺의 군간 변화를 측정한 결과는 Fig. 3과 같았다.
Fig. 3.
Results of TNF-α concentration evaluation in the bloods of experimental animals. *Significantly different from the infection control Group C (p<0.05). **Significantly different from the infection control Group C (p<0.01). †Significantly different from the positive control Group DGL (p<0.05). TNF-α, tumor necrosis factor-α.
Download Original Figure
시험 종료 시점에 TNF-⍺ 측정 결과 H. pylori 비감염 무처치 정상군인 NC군은 3.54 ± 0.73 pg/mL, H. pylori 감염 후 무처치군인 C군은 6.87 ± 0.76 pg/mL이었다.
H. pylori 감염 후 감초 아세톤추출물 처치군인 DGL군의 TNF-⍺ 측정결과는 4.32 ± 0.13 pg/mL, COM1군은 4.52 ± 0.41 pg/mL, COM2군은 4.19 ± 0.15 pg/mL, COM3군은 3.91 ± 0.19 pg/mL이었다.
감초 아세톤추출물 투여군인 DGL군과 Lactobaciilus HP7과 차조기 추출물 및 감초 추출물의 복합제제인 COM3군은 감염 대조군 C군에 비교하여 TNF-⍺ 측정값이 통계적으로 유의하게 감소한 것을 확인할 수 있었다(p<0.05, p<0.01). COM3군은 양성대조 DGL군보다 통계적으로 유의하게 더 낮은 TNF-⍺ 측정값을 보였다(p< 0.05).
Discussion
유산균이 사람의 위장관 내 병원성 세균의 감염을 억제할 수 있다는 결과들이 보고되고 있는데, 이러한 기전은 유산균이 분비하는 항생물질, 유기산, bacteriocins과 같은 물질들과 장내 pH를 낮추기 때문인 것으로 알려져 있다[28, 29]. 최근 H. pylori 감염 억제 효과를 보이는 L. acidophilus [29], L. casei [30], L. johnsonii [31], L. reuteri [32] 및 L. salivarius와 같은 유산균들이 보고되고 있다[33].
L. paracasei HP7은 H. pylori 감염 억제 효과를 보이는 한국의 전통 발효 음식인 김치로부터 한국야쿠르트가 분리한 새로운 유산균으로 김치에는 다양한 유산균들과 비타민 A, B, C 및 섬유질이 풍부한 건강식품으로 알려져 있다[34].
본 연구에서는 H. pylori 감염 억제 효과를 보이는 L. paracasei HP7에 항균 및 위점막 보호효과가 기대되는 천연물 감초와 차조기 추출물의 혼합 시 H. pylori 감염 억제와 위점막 병변의 경감 효과가 상승되는 시너지 효과를 확인하였다.
감초는 H. pylori 세균을 포함한 다양한 gram-negative와 gram-positive 세균들에 항균효과가 보고되고 있다[35]. 또한 감초는 H. pylori 세균의 위점막 부착 억제 효과[36], H. pylori 감염에 의해 유발되는 위궤양 치료 효과[37, 38]가 보고되고 있다. 감초의 위궤양 예방 및 치료 효과는 강한 항산화 특성에 의한 세포보호 기전에 의한 것으로 알려져 있다[39].
차조기는 한의학에서 불안, 천식, 흉통, 구토, 감기, 가래, 항암, 알레르기, 해독, 해열, 두통, 변비, 복통, 소화불량, 진정 효과와 같은 다양한 증상의 개선을 위해 적용되는 약제로 알려져 있다[23]. 차조기는 또한 강한 항균 효과가 보고되고 있다[40].
H. pylori 에 감염된 위점막 세포는 mucin 합성이 감소되고 결과적으로 위점막 손상이 유발되는 것으로 알려져 있다[41]. 본 연구에서 위점막 보호에 중요한 역할을 하는 점액질의 구성분인 mucin 분비에 대한 mucin 유전자 발현의 정도를 측정한 결과, H. pylori 세균의 위점막 상피세포 유래 KATO III cell 감염 시 mucin 유전자 발현이 감소되었으나 L. paracasei HP과 천연물 감초와 차조기 추출물을 복합적으로 혼합하여 적용할 때, Mucin gene expression이 증가되는 효과를 확인하였다. 본 연구에서 L. paracasei HP7과 천연물 감초와 차조기 추출물을 복합제가 H. pylori 감염에 의한 mucin 유전자 발현 감소를 회복하는 효과를 확인할 수 있었다. 이러한 결과는 L. paracasei HP7과 천연물 감초와 차조기 추출물 복합제가 H. pylori 감염된 환자에서 유발되는 위점막 손상을 경감해 주는 위점막 보호 효과를 유도할 수 있음을 보여주고 있다.
이전에 우리가 보고한 연구 결과에 의하면, L. paracasei HP7 단독으로 H. pylori 감염을 다소 억제할 수 있었다[17]. 본 연구에서는 L. paracasei HP7에다가 항균 효과와 위점막 보호 효과가 있는 것으로 보고되고 있는 감초와 차조기 추출물을 복합적으로 처방한 시료의 상승된 효과를 확인할 수 있었다.
L. paracasei HP7 또는 감초 추출물, 차조기 추출물 단독 투여군보다는 L. paracasei HP7과 감초와 차조기 추출물을 복합적으로 처방하는 것이 H. pylori에 대한 보다 높은 항균 효과와 H. pylori에 의해 유도된 염증이나 점막 손상을 경감시키는 것으로 확인되었다. 이러한 결과의 mechanism은 L. paracasei HP7에 의한 H. pylori가 위점막에 부착하는 것을 억제하는 효과와 감초 및 차조기 추출물의 항균 효과와 항산화 효과 및 위점막 mucin 유전자 발현 회복 촉진 효과들이 복합적으로 상승된 H. pylori 감염 억제 효과와 위점막 보호 효과를 유도하는 것으로 추정할 수 있다.
결론적으로, 김치에서 분리한 L. paracasei HP7에 감초와 차조기 추출물을 복합적으로 처방한 제품은 H. pylori 감염 억제와 더불어 위점막 보호 효과에 의한 위장관 병변을 감소시키는 것을 본 연구에서 확인하였고, 이러한 결과를 바탕으로 H. pylori 감염에 효과적인 건강기능식품 개발이 가능할 것으로 판단된다.
Acknowledgements
The studies were sponsored by the Korea Yakult.
References
Blaser MJ. Helicobacter pylori and the pathogenesis of gastroduodenal inflammation. J Infect Dis 1990;161:626-633.


Everhart JE. Recent developments in the epidemiology of Helicobacter pylori. Gastroenterol Clin North Am 2000; 29:559-578.

Maruta F, Ota H, Genta RM, Sugiyama A, Tatematsu M, Katsuyama T, Kawasaki S. Role of N-methyl-N-nitrosourea in the induction of intestinal metaplasia and gastric adenocarcinoma in Mongolian gerbils infected with Helicobacter pylori. Scand J Gastroenterol 2001;36:283-290.


Sugiyama A, Maruta F, Ikeno T, Ishida K, Kawasaki S, Katsuyama T, Shimizu N, Tatematsu M. Helicobacter pylori infection enhances N-methyl-N-nitrosourea-induced stomach carcinogenesis in the Mongolian gerbil. Cancer Res 1998;58:2067-2069.
Asaka M, Sugiyama T, Kato M, Satoh K, Kuwayama H, Fukuda Y, Fujioka T, Takemoto T, Kimura K, Shimoyama T, Shimizu K, Kobayashi S. A multicenter, double-blind study on triple therapy with lansoprazole, amoxicillin and clarithromycin for eradication of Helicobacter pylori in Japanese peptic ulcer patients. Helicobacter 2001;6:254-261.


Salih BA, Abasiyanik MF, Saribasak H, Huten O, Sander E. A follow-up study on the effect of Helicobacter pylori eradication on the severity of gastric histology. Dig Dis Sci 2005;50:1517-1522.


Maruta F, Sugiyama A, Ishizone S, Miyagawa S, Ota H, Katsuyama T. Eradication of Helicobacter pylori decreases mucosal alterations linked to gastric carcinogenesis in Mongolian gerbils. J Gastroenterol 2005;40:104-105.


Malfertheiner P, Megraud F, O'Morain CA, Atherton J, Axon AT, Bazzoli F, Gensini GF, Gisbert JP, Graham DY, Rokkas T, El-Omar EM, Kuipers EJ. European Helicobacter Study Group. Management of Helicobacter pylori infection- the Maastricht IV/Florence consensus report. Gut 2012;61: 646-664.


Misiewicz JJ, Harris AW, Bardhan KD, Levi S, O'Morain C, Cooper BT, Kerr GD, Dixon MF, Langworthy H, Piper D, Lansoprazole Helicobacter Study Group. One week triple therapy for Helicobacter pylori: a multicentre comparative study. Gut 1997;41:735-739.



Midolo PD, Lambert JR, Turnidge J. Metronidazole resistance: a predictor of failure of Helicobacter pylori eradication by triple therapy. J Gastroenterol Hepatol 1996;11: 290-292.


Megraud F, Coenen S, Versporten A, Kist M, Lopez-Brea M, Hirschl AM, Andersen LP, Goossens H, Glupczynski Y. Study group participants. Helicobacter pylori resistance to antibiotics in Europe and its relationship to antibiotic consumption. Gut 2013;62:34-42.


Graham DY, Fischbach L. Helicobacter pylori treatment in the era of increasing antibiotic resistance. Gut 2010;59: 1143-1153.


Buenz EJ, Bauer BA, Schnepple DJ, Wahner-Roedler DL, Vandell AG, Howe CL. A randomized Phase I study of Atuna racemosa: a potential new anti-MRSA natural product extract. J Ethnopharmacol 2007;114:371-376.


Liu CS, Cham TM, Yang CH, Chang HW, Chen CH, Chuang LY. Antibacterial properties of Chinese herbal medicines against nosocomial antibiotic resistant strains of Pseudomonas aeruginosa in Taiwan. Am J Chin Med 2007; 35:1047-1060.


Franceschi F, Cazzato A, Nista EC, Scarpellini E, Roccarina D, Gigante G, Gasbarrini G, Gasbarrini A. Role of probiotics in patients with Helicobacter pylori infection. Helicobacter 2007;12 Suppl 2:59-63.


Kim MN, Kim N, Lee SH, Park YS, Hwang JH, Kim JW, Jeong SH, Lee DH, Kim JS, Jung HC, Song IS. The effects of probiotics on PPI-triple therapy for Helicobacter pylori eradication. Helicobacter 2008;13:261-268.


Asha MK, Debraj D, Prashanth D, Edwin JR, Srikanth HS, Muruganantham N, Dethe SM, Anirban B, Jaya B, Deepak M, Agarwal A. In vitro anti-Helicobacter pylori activity of a flavonoid rich extract of Glycyrrhiza glabra and its probable mechanisms of action. J Ethnopharmacol 2013; 145:581-586.


Rahnama M, Mehrabani D, Japoni S, Edjtehadi M, Firoozi MS. The healing effect of licorice (Glycyrrhiza glabra) on Helicobacter pylori infected peptic ulcers. J Res Med Sci 2013;18:532-533.
Yamamoto H, Ogawa T. Antimicrobial activity of perilla seed polyphenols against oral pathogenic bacteria. Biosci Biotechnol Biochem 2002;66:921-924.


Omer EA, Khattab ME, Ibrahim ME. First cultivation trial of Perilla frutescens L. in Egypt. Flavour Fragr J 1998;13: 221-225.

Banno N. Akihisa T. Tokuda H. Yasukawa K. Higashihara H. Ukiya M, Watanabe K, Kimura Y, Hasegawa JI, Nishino H. Triterpene acids from the leaves of Perilla frutescens and their anti-inflammatory and antitumor-promoting effects. Biosci Biotechnol Biochem 2004;68:85-90.


Wang XF, Li H, Jiang K, Wang QQ, Zheng YH, Tang W, Tan CH. Anti-inflammatory constituents from Perilla frutescens on lipopolysaccharide-stimulated RAW264. 7 cells. Fitoterapia 2018;130:61-65.


Dixon MF, Genta RM, Yardley JH, Correa P. Classification and grading of gastritis: the updated Sydney system. Am J Surg Pathol 1996;20:1161-1181.


Vandenbergh PA. Lactic acid bacteria, their metabolic products and interference with microbial growth. FEMS Microbiol Rev 1993;12:221-237.

Rolfe RD. The role of probiotic cultures in the control of gastrointestinal health. J Nutr 2000;130:396S-402S.


Lionetti E, Miniello VL, Castellaneta SP, Magistá AM, de Canio A, Maurogiovanni G, Ierardi E, Cavallo L, Francavilla R. Lactobacillus reuteri therapy to reduce side-effects during anti-Helicobacter pylori treatment in children: a randomized placebo controlled trial. Aliment Pharmacol Ther 2006;24: 1461-1468.


Ryan KA, Daly P, Li Y, Hooton C, O'Toole PW. Strain-specific inhibition of Helicobacter pylori by Lactobacillus salivarius and other lactobacilli. J Antimicrob Chemother 2008;61:831-834.


Ki MR, Ghim SY, Hong IH, Park JK, Hong KS, Ji AR, Jeong KS. In vitro inhibition of Helicobacter pylori growth and of adherence of cagA-positive strains to gastric epithelial cells by Lactobacillus paraplantarum KNUC25 isolated from kimchi. J Med Food 2010;13:629-634.


Gupta VK, Fatima A, Faridi U, Negi AS, Shanker K, Kumar JK, Rahuja N, Luqman S, Sisodia BS, Saikia D, Darokar MP, Khanuja SPS. Antimicrobial potential of Glycyrrhiza glabra roots. J Ethnopharmacol 2008;116:377-380.


Wittschier N, Faller G, Hensel A. Aqueous extracts and polysaccharides from Liquorice roots (Glycyrrhiza glabra L.) inhibit adhesion of Helicobacter pylori to human gastric mucosa. J Ethnopharmacol 2009;125:218-223.


Larkworthy W, Holgate PF. Deglycyrrhizinized liquorice in the treatment of chronic duodenal ulcer. A retrospective endoscopic survey of 32 patients. Practitioner 1975;215: 787-792.
Bennett A, Clark-Wibberley T, Stamford IF, Wright JE. Aspirin-induced gastric mucosal damage in rats: cimetidine and deglycyrrhizinated liquorice together give greater protection than low doses of either drug alone. J Pharm Pharmacol 1980;32:151.


Mukherjee M, Bhaskaran N, Srinath R, Shivaprasad HN, Allan JJ, Shekar D, Agarwal A. Anti-ulcer and antioxidant activity of GutGard. Indian J Exp Biol 2010;48:269-274.
Byrd JC, Yunker CK, Xu QS, Sternberg LR, Bresalier RS. Inhibition of gastric mucin synthesis by Helicobacter pylori. Gastroenterology 2000;118:1072-1079.