Introduction
비알코올성 지방간 질환(non-alcoholic fatty liver disease, NAFLD)은 과량의 알코올 섭취 없이도 정상 간 무게의 5% 이상에 해당하는 지방이 간 조직 내에 축적된 상태를 말하며, 전세계적으로 성인의 약 20%–30%에게서 발생하는 가장 흔한 만성 간 질환이다[1–3]. 최근 서구화된 식습관과 이로 인한 비만, 당뇨병, 고혈압, 고지혈증 등의 유병율이 높아지면서 비알코올성 지방간 질환의 유병율 역시 계속 증가하는 추세를 보이고 있는데, 실제로 비만이나 제2형 당뇨 환자의 약 70%–80%에서 비알코올성 지방간 질환의 발병이 보고되고 있다[4, 5].
비알코올성 지방간 질환은 초기 단계인 지방간(steatosis)부터 염증을 동반하는 지방간염(steatohepatitis), 간 섬유화에 의한 간경변(hepatic cirrhosis)은 물론 간암이나 간부전까지 진행될 수 있다[6]. 비록 경도의 비알코올성 지방간이 간경변증까지 진행될 확률은 낮으나, 전체 지방간염 환자의 10%–50%가 간경변증으로 발전한다는 사실을 고려하면, 초기 단계인 지방간 혹은 지방간염의 발생을 억제하는 것이 보건의료적인 측면에서 매우 중요함을 알 수 있다[3, 4]. 특히 비알코올성 지방간 질환의 가장 유력한 위험인자가 비만인데다, 비알코올성 지방간염(non-alcoholic steatohepatitis, NASH)의 발병 가능성 역시 비만의 중증도에 비례해서 증가하기 때문에 비알코올성 지방간 질환의 유병율을 감소시키기 위해서는 식이 조절, 규칙적인 운동과 같은 근본적인 노력과 함께 비만 및 이로 인한 지방간의 발생을 예방할 수 있는 건강기능식품 등의 섭취를 통한 관리가 필요하다.
최근 비만에 의한 지방간 유발 및 간의 지질 대사 관련 연구에서 가장 중요하게 다뤄지는 인자 중의 하나가 AMP-activated protein kinase(AMPK)인데, 인산화를 통한 AMPK의 활성화는 지방산의 합성과 분해를 매개하는 acetyl-CoA carboxylase(ACC), fatty acid synthase(FAS), sterol regulatory element-binding protein(SREBP-1) 등을 불활성화시키거나 유전자 발현을 억제함으로써 간 내의 지방산 산화를 증가시키고, 중성지방의 축적을 감소시켜 간의 지질대사 균형 조절에 중요한 역할을 하는 것으로 알려져 있다[7–9]. 실제로 간에서 AMPK를 과발현시킨 경우 혈중 중성지방 수치가 감소한 반면, 간 특이적으로 AMPK를 제거하자 간 내에서의 지질 합성 증가가 관찰되었다[10, 11].
개똥쑥(Artemisia annua L.)은 국화과에 속하는 쑥속의 한해살이풀로써 한국, 중국, 일본, 대만 등에 자생하는 것으로 알려져 있으며, 주로 지상부 전초를 식용이나 약용으로 사용하는데, 이를 청호 또는 황화호라고 부른다[12, 13]. 개똥쑥 전초는 예로부터 결핵, 학질, 열사병, 피부질환 등 여러 질환에 사용이 되어 왔으며, 1990년대부터는 아르테미시닌을 주성분으로 하는 항말라리아제의 원재료로서 주목을 받고 있다[14, 15]. 개똥쑥의 약리학적 효과는 국내외에서 다양한 질환을 대상으로 한 다수의 연구 논문들을 통해서도 확인되고 있는데, Mashati 등, Isani 등, Lang 등과 Kim 등은 leukemia, osteosarcoma, breast cancer, colon cancer 세포 등에서 개똥쑥추출물의 항암효과를 보고하였으며[16-19], Stebbings와 Hunt 등은 엉덩이 및 무릎 골관절염 환자에게 12주간 개똥쑥추출물을 투여했을 때 유의한 수준의 통증 및 염증 개선 효과를 나타냈다고 발표하였다[20, 21]. 또, Huang 등은 개똥쑥 클로로포름 추출물이 기도의 평활근세포를 이완시켜 천식을 개선시킨다는 결과를 보여주었으며[22], Deng 등은 전신적인 아나필락시스 랫드 모델에서 개똥쑥에탄올추출물이 아나필락시스 쇼크와 히스타민 방출 등을 감소시킴으로써 항알레르기 효과를 나타낸다고 하였고[23], Oh 등은 lipopolysaccharide(LPS)로 자극을 가한 Raw264.7 세포주에서 개똥쑥추출물이 NF-κB와 MAPKs 조절을 통해 항염증 효과를 보인다는 연구 결과를 발표하였다[24].
한편, 이러한 항암, 항염증 효과 외에도 일부 논문들은 개똥쑥추출물의 비만 및 간 손상 억제 효과를 보여주고 있는데, Baek 등은 diet-induced obesity(DIO) 마우스 모델에서 개똥쑥추출물이 지방 합성과 체중 증가를 감소시킬 뿐 아니라, 개똥쑥추출물과 주요 성분인 artemisinic acid가 3T3-L1 세포에서 지방세포의 분화를 조절한다고 하였으며[25], Kim 등은 고지방식이를 급이한 마우스에서 개똥쑥추출물이 인슐린 저항성과 지방간 형성 및 간 조직의 염증을 억제한다고 발표하였고[26], Hesham 등은 개똥쑥추출물이 사염화탄소(CCl4)에 의한 세포 독성으로부터 HepG2 세포를 보호하여 alanine transaminase(ALT)와 aspartate transaminase(AST)를 감소시키며, 이러한 효과가 추출물의 hydroxycinnamoyl quinic acids 및 flavonoids 함량과 밀접하게 연관되어 있다는 결과를 보고하였다[27]. 그러나 개똥쑥추출물이 세포 및 생체 내에서 간세포의 지방 합성 및 축적을 어떠한 경로로 억제하는지, 그 작용 기전에 관해서는 충분한 연구가 수행된 적이 없었다.
이에 본 연구에서는 고지방식이(high-fat diet, HFD)로 지방간을 유도한 마우스에 개똥쑥추출물(Artemisia annua extract, AAE)을 8주간 경구투여한 후, 간 조직의 지방 축적 및 이를 조절하는 유전자로써 AMPK와 함께 ACC, FAS, SREBP-1c의 발현을 측정하였고, high glucose로 지방증을 유도한 HepG2 세포에서 이들 유전자의 활성화 또는 발현에 대한 영향을 조사함으로써 개똥쑥추출물의 지방간 억제 기전을 규명하고자 하였다.
Materials and Methods
세포 배양에 필요한 Dulbecco’s modified Eagle’s medium(DMEM), fetal bovine serum(FBS)과 penicillin-streptomycin은 Gibco-BRL(Grand Island, NY, USA) 제품을 사용하였고, 세포 시험에 사용한 methyl thiazolyl tetrazolium(MTT), AMPK inhibitor(AMPKI)인 compound C는 Sigma Chemical(St. Louis, MO, USA) 제품을 구입하였다. 그리고 Western blot analysis를 위한 phosphorylated-AMP-activated protein kinase(p-AMPK), phosphorylated-acetyl-CoA carboxylase(p-ACC), total AMPK, total ACC와 SREBP-1c, FAS, β-actin에 대한 일차 항체는 각각 Cell Signaling Technologies(Beverly, MA, USA)와 Santa Cruz Biotechnology(Santa Cruz, CA, USA)에서, 2차 항체인 anti-rabbit IgG conjugated horseradish peroxidase antibody는 Cell Signaling Technologies(Beverly, MA, USA)에서 구입하여 사용하였다.
개똥쑥은 경남생약농업협동조합(Sancheong, Korea)에서 국내산 개똥쑥의 지상부 전초 건조물을 구입하였으며, 이를 칭량 및 세척하고 충분한 양의 정수를 투입하여 85 ± 2°C의 조건에서 4시간 동안 환류 추출한 후, 10 μm 카트리지 필터를 이용하여 추출물을 여과한 다음, 고형분 함량이 25 ± 5%가 될 때까지 감압 농축하였다. 농축액은 살균과정을 거친 후 수분측정기로 정확한 고형분 함량을 측정한 다음, 냉장 보관하면서 실험에 사용하였다.
개똥쑥추출물(AAE)의 고지방식이에 따른 지방간 개선 효능을 확인하기 위하여 한국국제대학교 연구윤리위원회의 승인(IUK-M-1301/01)을 받아 동물 실험을 진행하였다. ICR 수컷 마우스(20–25 g), 6주령을 SAMTAKO (Osan, Korea)에서 15두를 구입하여 1주 동안 고형사료와 물을 자유롭게 섭취시키면서 일정한 습도(60 ± 5%)와 일정한 온도(22 ± 2°C) 및 12시간 주기로 명암이 조절되는 실험 환경에 1주간 적응시켰다. 1주일 동안 적응 기간을 거친 후, 마우스는 난괴법에 따라 정상군(normal diet, ND), 고지방식이대조군(HFD), 개똥쑥추출물(AAE) 투여군(HFD + AAE)의 총 3군(군당 5수)으로 나눈 다음, 8주간 일반식이 또는 고지방식이를 급이하면서 사육하였다. 고지방식이는 Research Diets(New Brunswick, NJ, USA)의 45% high-fat diet(D12451)를 구입하여 사용하였다. AAE 투여군의 경우 8주간 1일 1회씩 50 mg/kg의 용량으로 마우스당 0.1 mL의 AAE를 경구 투여하였으며, 정상군과 고지방식이대조군은 AAE 대신 동일한 양의 생리식염수를 투여하였다. 전 실험기간에 걸쳐 물과 식이는 제한 없이 공급하였고, 사육실 온도는 22 ± 2°C로 유지하였으며, 조명은 12시간 주기(08:00–20:00)로 조절하였다. 또, 8주의 실험기간 동안 매주 1회씩 체중과 사료섭취량을 측정하였으며, 57일째에 동물을 치사 시켜 혈액을 채취하고 간 조직 및 지방조직을 분리하여 무게를 측정한 다음, 혈청생화학적, 분자생물학적 분석 및 조직학적 분석에 사용하였다.
사육이 끝난 실험동물로부터 채취한 혈액은 혈청분리용 원심분리관(BD vaccutainer, USA)에 넣어 실온에 30분간 방치한 다음, 원심분리(4,000 rpm, 15 min) 과정을 거쳐 혈청을 분리하였다. 분리한 혈청은 초저온 냉동고(–80°C)에서 보관한 후 혈청생화학적 분석에 사용하였다. 혈청 내의 중성지방(triglycerides), 총 콜레스테롤(total cholesterol, TC) 농도는 Asan Pharma(Seoul, Korea)의 assay kit로 분석하였고, ALT, AST 및 glucose는 Sigma-Aldrich (St. Louis, MO, USA)의 assay kit를 사용하여 측정하였다.
실험동물로부터 얻은 간 조직 시료를 4%의 paraformaldehyde에서 24시간 동안 고정한 다음, 수세-탈수-투명-파라핀침투-포매의 조직처리과정을 거쳐 5 μm의 조직 절편 슬라이드를 제작한 뒤 H&E(Sigma-Aldrich, St. Louis, MO, USA)로 염색하고 이를 광학현미경(Axiovert 200M microscope, magnification ×200; Carl Zeiss, Jena, Germany)으로 관찰하였다. 현미경으로 관찰된 간 조직의 변화는 조직의 지방증 및 염증 정도에 따라 다음과 같이 점수화 하였다(0 = no steatosis; 1 = minimal steatosis; 2 = slight steatosis; 3 = moderate steatosis; 4 = marked steatosis; 5 = severe steatosis).
인간 간암세포인 HepG2 세포주는 American Type Culture Collection(Manassas, VA, USA)로부터 분양을 받아 사용하였다. HepG2 세포는 10% FBS과 1% penicillin-streptomycin가 첨가된 DMEM 배지를 이용하여 37°C, 5% CO2 조건에서 배양하였다. 이때 일반적인 배양조건에서는 5.5 mM D-glucose(Sigma Chemical, USA)를 배지에 첨가하였고, 지방증(steatosis)을 유도하기 위한 high glucose 배양조건에서는 30 mM D-glucose를 사용하였다. HepG2 세포에서 배양조건에 따른 AAE의 세포독성을 평가하기 위해 MTT assay를 시행하였다. HepG2 세포를 96-well plate에 1 × 104 cells/well의 밀도로 분주하고, 24시간 동안 안정화를 시킨 다음, 5.5 mM 또는 30 mM의 D-glucose를 함유한 serum free media에 AAE를 여러 가지 농도(0, 10, 100, 250, 500 μg/mL)로 희석하여 처리한 뒤, 다시 24시간 동안 배양하였다. 배양이 끝난 후 각 well에 MTT 500 μg/mL를 4시간 동안 처리한 다음, 세포들이 생성한 formazan crystal을 DMSO를 사용하여 용해하고, 그 발색 정도를 정량하기 위해 570 nm에서 흡광도(absorbance)를 측정하였다.
간세포에 지방증(steatosis)을 유도하기 위해 Kuo 등의 방법에 따라 HpeG2 세포를 24 well plate에 1 × 105 cells/well의 밀도로 분주하고, 24시간 동안 안정화한 다음, 5.5 mM 또는 30 mM D-glucose를 함유한 serum free media에 AAE를 0, 10, 30, 100 μg/mL 농도로 희석하여 처리한 후 24시간 동안 세포를 배양하였다[28]. 한편, AAE의 작용이 AMPK 활성에 의존적인지를 확인하기 위하여 HepG2 세포를 위와 동일한 방법으로 분주하여 안정화한 다음, AMPKI인 compound C(10 μM)를 1시간 동안 처리한 후 AAE를 30 mM D-glucose가 함유된 serum free media에 희석하여 100 μg/mL로 처리하고, 24시간 동안 배양하였다. 이후 각각의 실험에서 획득한 HepG2 세포를 이용하여 AAE가 간세포의 지방증에 미치는 영향을 관찰하였다.
일반 또는 high glucose 배양조건에서 AAE를 0, 10, 30, 100 μg/mL로 24시간 동안 처리한 HepG2 세포를 상온에서 4% paraformaldehyde로 15분간 고정한 다음, PBS로 세척하고, 1 μg/mL의 Nile red solution(Sigma-Aldrich, St. Louis, MO, USA)을 37°C에서 90분간 반응시켜 세포 내 중성 지방을 염색하였다. 염색된 세포는 광학현미경으로 촬영을 하였고, Nile Red fluorescence의 강도는 microplate fluorescence reader(Varioskan, Thermo Electron, Vantaa, Finland)를 이용하여 정량적으로 측정하였다(emission = 530 nm, excitation = 485 nm).
상기 실험에서 얻어진 HepG2 세포에 protease inhibitor와 phosphatase inhibitor를 포함하는 RIPA buffer(Abcam, Cambridge, UK)를 넣어 균질화 한 다음, 이를 원심분리(12,000 × g, 10 min, 4°C)하여 상층액을 취하고 bicinchoninic acid(BCA) 법으로 cell lysate의 총 단백질량을 측정하였다. 측정된 단백질량을 기준으로 cell lysate의 농도를 동일하게 맞춘 후, Asan Pharm(Seoul, Korea)의 assay kit를 이용하여 간세포 내 중성지방 및 총콜레스테롤 양을 분석하였다.
고지방식이를 급이한 실험동물 및 HepG2 세포의 지질대사 관련 유전자들의 발현을 확인하기 위해 동물의 간 조직 및 세포를 RIPA buffer로 균질화하여 상기와 동일한 방법으로 cell lysate를 획득하였다. 단백질 농도를 동일하게 맞춘 cell lysate에 sample buffer를 혼합하여 100°C에서 7분간 가열하고, 이렇게 준비된 단백질 시료를 10% SDS-PAGE로 전기영동한 후, polyvinylidene difluoride (PVDF) membrane에 옮기고 5% bovine serum albumin를 함유한 tris-buffered saline(TBS)를 사용하여 1시간 동안 blocking하였다. 이후 p-AMPK, total AMPK, p-ACC, total ACC, FAS, SREBP-1c 및 β-actin 단백질에 상응하는 각각의 1차 및 2차 항체를 순차적으로 반응시킨 다음, membrane을 세척하고, ECL 용액으로 X-ray 필름에 감광을 시킨 다음, 발색된 밴드의 강도를 Chemidoc(Bio-rad, USA)으로 분석하였다.
Results
고지방식이를 마우스에게 8주간 급이하여 체내 지방 축적을 유도한 고지방식이대조군(HFD)의 경우, 일반식이를 섭취한 정상군(ND) 대비 약 41% 정도 유의하게 체중이 증가되어 44.04 ± 3.7 g을 기록한 반면(p<005), AAE를 50 mg/kg으로 투여한 군(HFD + AAE)에서는 약 20%의 유의한 체중 감소를 보였다(Fig. 1A, p<0.05). 또, 8주간의 투여가 종료된 후 간과 지방조직을 적출하여 무게를 측정한 결과, 고지방식이대조군에서 정상군보다 약 60%와 170% 이상 간과 지방조직 무게가 유의하게 증가된 것을 확인할 수 있었다(p<0.05). 그러나, 이러한 고지방식이대조군에 비해 AAE 투여군의 경우 간 무게는 약 22%, 지방조직 무게는 약 28% 정도가 유의하게 감소되어(p<0.05, p<0.05) AAE가 고지방식이에 의한 체중 증가뿐 아니라, 간과 지방조직의 비대 역시 의미 있는 수준으로 억제하고 있음을 보여주었다(Fig. 1B, 1C).
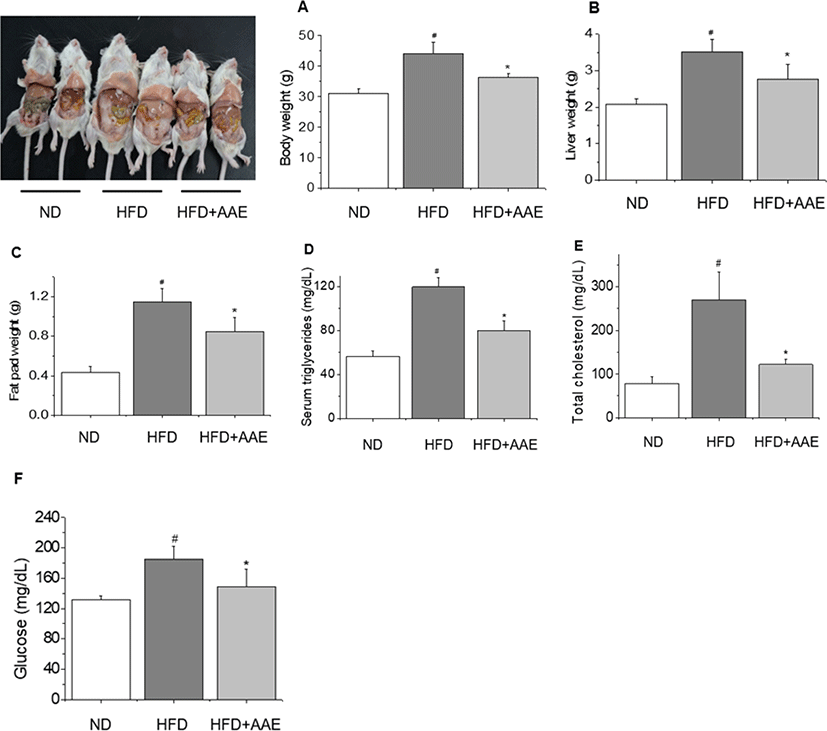
이러한 체중 및 지방의 증가 조절과 더불어 AAE의 섭취가 혈청 내 중성지방, 총 콜레스테롤 및 포도당 농도 변화에 미치는 영향을 확인하기 위해 혈청생화학적 검사를 실시한 결과, Fig. 1D에서와 같이 고지방식이대조군의 혈청 중성지방은 정상군 대비 약 222% 증가된 119.8 ± 8.37 mg/dL로 측정된 반면(p<0.05), AAE 투여군은 고지방식이대조군 대비 약 33% 감소된 수치를 나타냈다(p<0.05). 중성지방과 함께 체내 지방 축적의 중요한 지표 중 하나인 총 콜레스테롤의 경우, 고지방식이대조군에서 정상군보다 약 245% 이상 높은 총 콜레스테롤이 확인되었으나(p<0.05), 이러한 총 콜레스테롤의 증가는 AAE 섭취에 의해 약 54% 정도 유의하게 억제되었으며(Fig. 1E, p<0.05), 중성지방 및 총 콜레스테롤에 대한 AAE의 감소 효과는 공복 혈당 농도 측정에서도 동일하게 관찰되었다(Fig. 1F, p<0.05).
8주간의 투여 종료 후 마우스의 간 조직을 채취하여 H&E로 염색하고, 염색된 조직을 현미경으로 관찰한 결과, 정상군의 간 조직은 지방 축적이나 이로 인한 염증반응이 거의 나타나지 않았으나, 고지방식이대조군은 간에 지방증이 뚜렷하게 나타난 것을 확인할 수 있었다. 이와 달리 AAE 투여군의 경우 정상군과 유사한 수준의 조직학적 소견을 보였을 뿐 아니라, steatosis score에서도 고지방식이대조군 대비 43% 가까이 수치를 감소시켜 통계학적으로 유의한 지방증 감소 효과를 나타냈다(Fig. 2A, p<0.05).
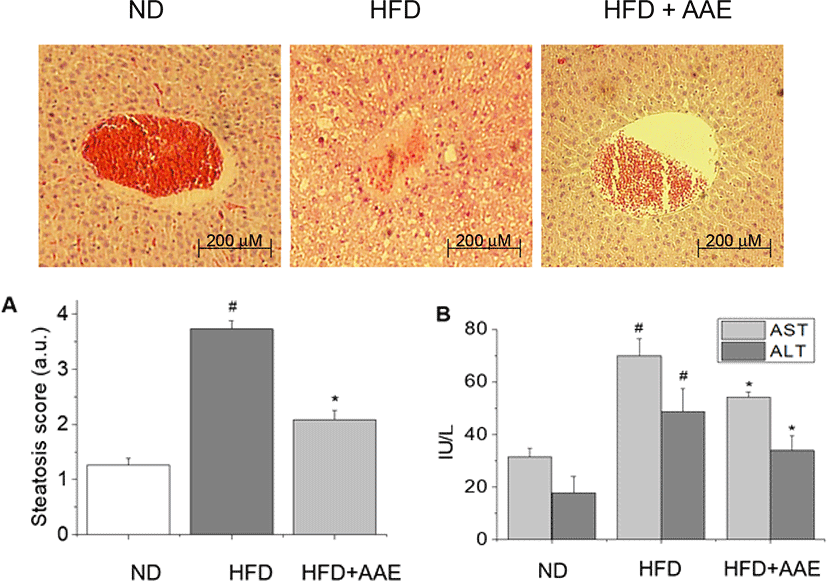
한편, 간의 지방증 발생 및 이로 인한 조직 손상의 지표로써 혈청 내 AST 및 ALT 수준을 분석한 결과는 Fig. 2B와 같다. 고지방식이대조군의 혈청에서 AST는 정상군보다 2배 이상 상승된 69.9 ± 8.7 IU/L로 나타나 현저한 수준의 증가를 보였다. 반면, AAE 투여군의 경우 54.1 ± 5.7 IU/L로 유의하게 감소하였다(p<0.05). 간 조직 외에 심장이나 근육에서도 생산되는 AST와 달리 간 특이적인 효소인 ALT의 경우, 고지방식이대조군의 혈청에서 48.6 ± 6.6 IU/L로 나타나 정상군에 비해 170% 이상 증가하였으나(p<0.05), AAE를 8주간 투여한 마우스의 혈청에서는 약 30% 줄어든 33.8 ± 2.0 IU/L로 측정되어 유의한 수준의 감소 효과를 보였다(p<0.05).
고지방식이로 지방증을 유도한 마우스에서 간의 지질대사 조절에 관여하는 주요 인자에 대한 AAE의 영향을 평가하기 위해 간 조직으로부터 cell lysate를 얻은 다음, Western blot analysis를 실시하여 유전자의 활성화 또는 발현 분석하였다. 정상군과 달리 고지방식이에 의해 간내 지방 축적이 발생한 마우스에서는 대표적인 지방 합성 관련 유전자인 SREBP-1c 및 이로 인한 FAS 단백질의 발현이 유의하게 증가되었으나(p<0.05), AAE 투여군에서는 이들 유전자의 발현이 통계학적으로 의미 있게 감소된 것으로 나타났다(Fig. 3A, p<0.05).
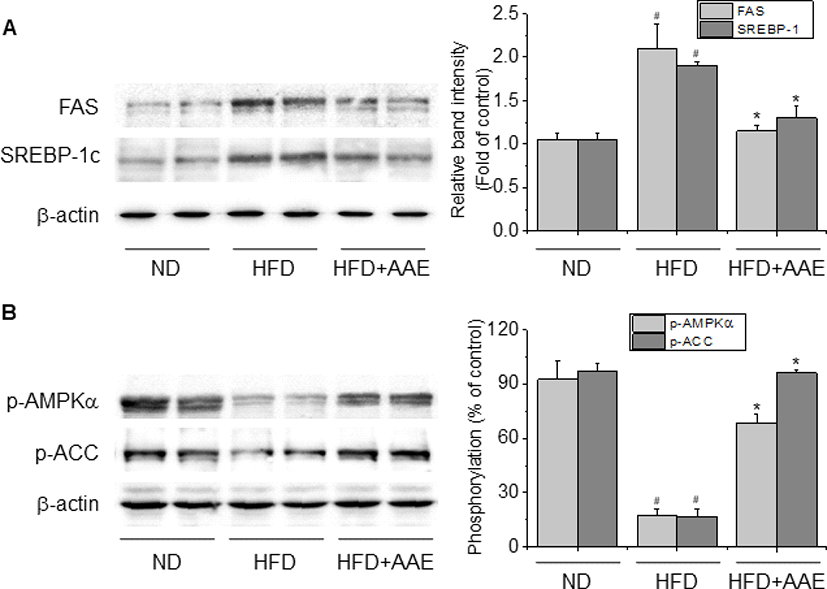
AAE에 의한 SREBP-1c 및 FAS의 발현 억제의 작용 기전을 확인하기 위해 이들 유전자의 상위 단계 조절 인자로 알려진 AMPK와 함께 AMPK에 의해 조절되는 또다른 지질 합성 관련 효소인 ACC의 인산화 수준을 확인하였다. AMPK가 인산화되어 활성화되면 acetyl-CoA를 malonyl-CoA로 만드는 효소인 ACC는 반대로 인산화되면서 불활성화되는데[9, 11], Fig. 3B에서와 같이 정상군에 비해 고지방식이 대조군의 p-AMPK와 p-ACC는 유의하게 감소된 반면(p<0.05), AAE 투여군의 p-AMPK와 p-ACC 발현은 모두 의미 있는 수준으로 증가된 것으로 나타났다(p<0.05). 이는 AAE가 인산화를 통해 AMPK를 활성화시킴으로써 ACC를 불활성화 시킴과 동시에 AMPK에 의해 조절되는 SREBP-1c, FAS 등의 유전자 발현을 조절함으로써 간의 지질대사를 조절함을 시사한다.
고지방식이로 지방간을 유도한 마우스 모델 시험에서 나타난 AAE의 생체 내 지방 축적 억제 및 간내 지질대사 조절 효과를 세포 수준에서 한 번 더 확인하기 위해 인간 간암세포인 HepG2 세포에 high glucose로 지방증을 유도하면서 AAE를 농도별로 처리하여 지방 축적 정도 및 지질 합성 관련 유전자의 발현을 확인하였다. AAE의 처리 농도는 MTT assay를 통해 세포 독성이 없는 범위 내에서 결정하였다(data not shown). HepG2 세포에 30 mM D-glucose를 가하여 지방 축적을 유도하면서 AAE를 0, 10, 30 및 100 μg/mL로 처리하여 배양한 후, 세포 내 지방 축적 정도를 Nile red fluorescence 측정을 통해 확인한 결과, 30 mM D-glucose를 처리한 세포의 지방 축적 정도는 정상 세포 대비 2.5배 가까이 증가되었으나, AAE를 처리한 세포에서는 그 축적 정도가 농도의존적으로 감소되는 경향을 보였으며, 특히 30 μg/mL과 100 μg/mL 처리군에서 통계학적으로 유의한 수준의 감소 효과를 보였다(Fig. 4A, p<0.05). 이러한 결과는 HepG2 세포 내 중성지방과 총 콜레스테롤 농도를 측정했을 때에도 동일한 경향으로 나타나 AAE 30 μg/mL와 100 μg/mL 처리군에서 중성지방과 총 콜레스테롤이 모두 p<0.05 수준으로 유의하게 억제되었다(Fig. 4B).
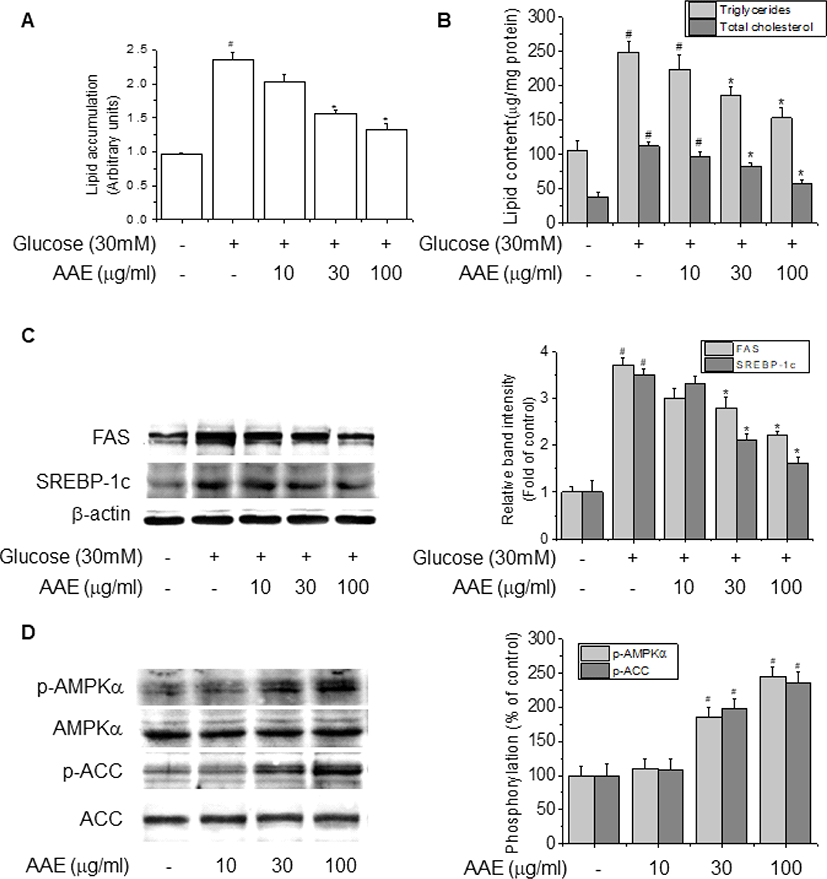
한편, AAE에 의한 간세포 내 중성지방 및 총콜레스테롤의 감소가 고지방식이 유도 지방간 마우스에서와 마찬가지로 FAS나 SREBP-1c의 발현 조절에 따른 것인지를 관찰하기 위해 HepG2 세포의 cell lysate를 이용하여 Western blot analysis를 수행한 결과, high glucose 처리에 의해 증가된 이들 유전자의 단백질 발현이 AAE에 의해 농도의존적으로 유의하게 감소됨을 확인하였다(Fig. 4C, p<0.05). 또, AAE에 의한 FAS 및 SREBP-1c의 발현 감소가 앞서 지방간 마우스의 간 조직에서 확인된 것처럼 AMPK나 ACC의 활성 조절에 의한 것인지를 일반 조건으로 배양한 HepG2에서 확인한 결과, AAE는 Fig. 4D에서와 같이 정상 세포 대비 AMPK 및 ACC의 인산화를 농도의존적으로 증가시켰으며, 이를 인산화 비율로 표시했을 때 AAE 30 μg/mL와 100 μg/mL 처리군에서 p<0.05 수준으로 유의한 증가 효과를 보여 AAE가 AMPK의 활성화와 이를 통한 ACC의 불활성화를 통해 간세포의 지질대사를 조절할 수 있음을 보여주었다.
고지방식이로 지방간을 유도한 마우스 및 간세포에서 확인된 AAE의 AMPK 활성화 및 이로 인한 지방 합성 관련 유전자의 조절과 간 조직 또는 간세포 내 지방 축적 억제가 AMPK에 의존적인 효과인지 살펴보기 위해 high glucose 조건에서 배양한 HepG2 세포에 AMPK 특이적인 억제제인 compound C를 처리하고, 1시간 후 AAE를 처리한 다음, 세포 내 지방 축적 정도와 함께 FAS, SREBP-1c의 단백질 발현을 분석하였다. 우선 세포 내 지방을 Nile red solution으로 염색하고 발광 정도를 측정한 결과, high glucose에 의해 2배 이상 증가된 지방 축적이 AAE에 의해 유의하게 감소되는 효과를 보였으나(p<0.05), AAE의 이러한 효과는 AMPK 억제제인 compound C 처리에 의해 상쇄되는 것으로 나타났다(Fig. 5A, p<0.01). Compound C에 의한 AAE의 효과 억제는 세포 내 중성지방과 총 콜레스테롤 농도를 분석한 결과에서도 동일한 양상으로 나타나, AAE에 의해 감소된 중성지방과 총 콜레스테롤 수준이 compound C에 의해 다시 회복되는 결과를 보여주었다(Fig. 5B, p<0.05, p<0.01).
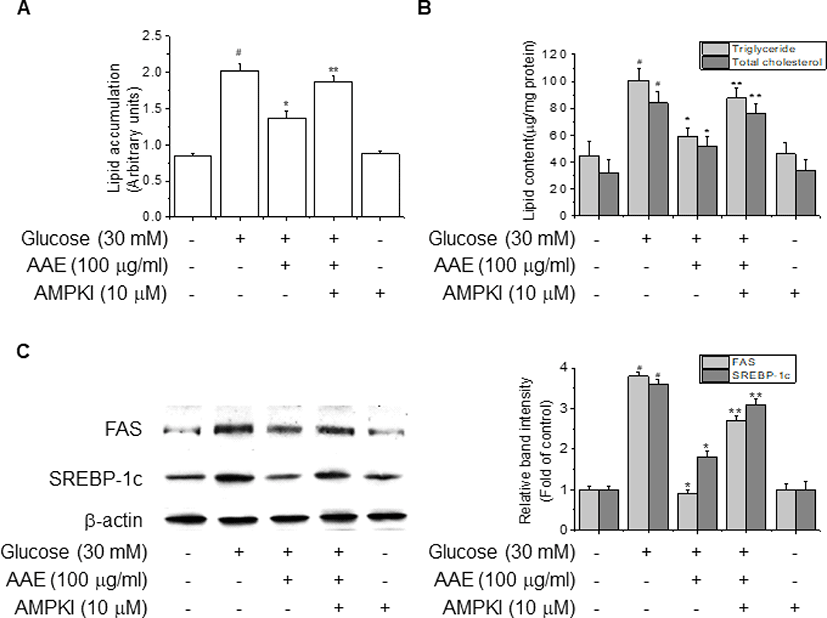
뿐만 아니라, 지방 합성을 조절하는 FAS와 SREBP-1c 발현에 있어서도 AAE가 high glucose에 의해 증가된 이들 단백질의 생산을 p<0.05 수준으로 유의하게 감소시킨 데 반해, compound C를 처리하여 AMPK의 활성화를 억제시킨 경우에는 AAE가 FAS와 SREBP-1c의 단백질 발현을 낮추지 못함으로써 두 단백질의 발현이 다시 의미 있는 증가를 보이는 것으로 나타났다(Fig. 5C, p<0.01). 이러한 결과는 AAE가 AMPK에 의존적으로 지방 합성 관련 유전자들을 조절함으로써 간 조직 및 간세포 내 지방의 합성 및 축적을 억제함을 시사한다.
Discussion
비알코올성 지방간 질환(NAFLD)은 과다한 알코올 섭취 없이 발생하는 간의 지방증(hepatic steatosis)을 말하며, 단순지방증(simple steatosis), 지방간염(steatohepatitis), 섬유화(fibrosis) 및 간경변(cirrhosis)을 포함하는 만성 간 질환으로서 전세계적으로 비만과 제2형 당뇨병의 유병률이 증가하면서 NAFLD 환자 또한 계속 늘어나고 있다[29, 30]. 우리나라의 경우, NAFLD 유병률이 성인 인구의 18%를 차지하는 것으로 보고되고 있는데, 서구화된 식습관과 운동 부족, 비만 인구의 증가 등으로 인해 앞으로도 우리나라의 만성 간질환 유병율 중 NAFLD가 차지하는 비중은 계속 증가할 것으로 예상된다[31].
현재 전세계적으로 NAFLD에 대해 공인된 치료제는 없으며, 대부분의 경우 운동, 식이, 체중감량 등 생활 습관의 개선과 함께 증상에 따라 비만 치료제, 인슐린저항성 치료제(글리타존류), 고지혈증 치료제(스타틴 계열), 항산화제 등을 사용하는 대증요법에 의존하고 있다[32]. 이러한 대증요법 약물들 중 비알코올성 지방간염 환자를 대상으로 가장 많이 연구된 약물은 피오글리타존(pioglitazone)과 비타민 E(vitamin E)인데 각각 체내의 인슐린 민감도를 개선시키고 중성지방을 감소시킨다거나, 간세포의 풍선 변성(ballooning degeneration) 및 염증에 효과적이라는 보고들이 있으나, 그 효과가 부분적이고 장기 복용 시 안전성 우려가 있어 사용이 매우 제한적인 상황이다[33–35]. 따라서 이처럼 명백한 치료적 한계가 존재하는 현재의 상황을 개선하기 위해서는 NAFLD의 출발점인 지방증 단계에서 체내의 지방 합성 및 축적을 억제하여 지방간염으로 진행하는 것을 막을 수 있는 새로운 개념의 간질환 개선제의 개발이 필요하다.
항말라리아제인 아르테미시닌의 주요 공급원으로 알려진 개똥쑥은 결핵, 학질 등 다양한 질환에 사용되어져 온 전통 식물로서, 최근 개똥쑥추출물을 대상으로 한 다양한 연구에서 고지방식이에 의해 증가된 마우스의 체중, 체지방과 함께 인슐린 저항성을 감소시키고, 지방간 형성 및 간 조직의 염증을 억제할 뿐 아니라, CCl4를 처리한 HepG2 세포의 ALT, AST의 상승을 방지함으로써 지방간 억제 및 간 손상 보호 효과가 있음이 확인되었다[25–27].
이를 토대로 본 연구에서는 고지방식이로 지방간을 유도한 마우스에 개똥쑥추출물(AAE)을 8주간 경구투여한 후, 체중, 체지방의 증가와 함께 간 조직의 지방 축적 및 이를 조절하는 유전자로써 AMPK, ACC, FAS, SREBP-1c의 활성화 또는 발현을 측정하였다. 그 결과, AAE는 고지방식이에 의해 증가된 체중 및 간과 지방조직의 무게를 감소시켰고, 혈청 중성지방 및 총 콜레스테롤의 농도를 낮췄을 뿐 아니라, 간 조직의 지방 축적 및 이로 인한 AST, ALT의 증가를 유의적으로 억제하였다. AAE에 의한 간 조직의 지방 축적 억제 기전을 확인하기 위해 생체 내 지방 합성의 핵심 조절인자인 AMPK의 인산화 및 AMPK에 의해 조절되는 ACC, FAS, SREBP-1c를 분석한 결과, AAE가 AMPK의 인산화를 촉진함으로써 지방 합성에 관련된 유전자인 ACC를 불활성화시키고, FAS 및 SREBP-1c의 발현을 억제함을 확인할 수 있었다. 뿐만 아니라, 고지방식이로 유도한 지방간 마우스 모델 시험에서 확인된 AAE의 이러한 효과가 세포 수준에서도 재현되는지 확인하기 위해 high glucose로 지방증을 유도한 HepG2 세포에 AAE를 처리하여 이들 유전자의 활성화 또는 발현에 대한 영향을 평가한 결과에서도 AAE는 AMPK를 활성화시켜 SREBP-1c의 발현을 감소시켰으며, ACC를 불활성화시키고, FAS의 발현을 낮춤으로써 간세포 내 중성지방과 총 콜레스테롤을 포함한 지방 축적을 억제하였다.
AMPK는 세포 내의 에너지 항상성 유지에 센서 역할을 하는 효소로서 세포 내 에너지가 감소하는 경우, 즉 ATP가 고갈되는 경우 활성화되어 ATP를 소비하는 지방산 합성과 콜레스테롤 합성 등을 억제하고, ATP를 생산하는 지방산 산화와 해당과정 등을 촉진함으로써 지방 및 탄수화물 대사 조절에 중요한 역할을 한다[36–38]. AMPK의 활성화로 인한 효과는 에너지 대사 조절을 담당하는 간, 근육, 지방, 췌장 등 표적 장기와 밀접하게 관련되어 있는데, 특히 간에서 AMPK가 활성화되면 지방산과 콜레스테롤의 합성이 억제되고 지방산의 산화가 촉진되기 때문에 이러한 AMPK의 조절이 지방간 질환을 치료하는데 있어 중요한 표적으로 여겨지고 있다[39]. Malonyl-CoA를 합성하는 ACC 효소는 미토콘드리아의 지방산 산화에 대한 잠재적인 억제자로 작용하는데, AMPK 활성화에 의한 ACC의 인산화, 즉 ACC의 불활성화는 malonyl-CoA의 농도 저하를 초래하고 carnitine palmitoyltransferase-1(CPT-1)의 활성도를 증가시켜 지방산의 산화를 증가시킨다[40]. SREBP-1은 간에서 지질을 합성하는 유전자들을 조절하는 주요 전사인자로서 AMPK에 의해 발현이 조절되는데, SREBP-1이 증가되면 ACC, FAS 및 stearoyl-CoA desaturase-1(SCD-1)과 같은 유전자들의 발현이 유도되어 간 내 지방 합성 및 축적이 촉진된다[41].
AMPK와 지방 합성 관련 유전자들의 이러한 상호작용을 고려할 때, AAE에 의한 AMPK의 활성화는 SREBP-1c의 발현을 억제시킴으로써 ACC를 불활성화시켜 malonyl-CoA의 농도를 낮추고, FAS를 감소시켜 지방산의 합성을 방지함으로써 간 조직의 지방 축적을 억제하는 것으로 판단된다. 한편, 지방증이 유도된 마우스와 간세포에서 확인된 AAE의 AMPK 활성화 및 이로 인한 지방 합성 관련 유전자의 조절 및 지방 축적 억제 효과가 AMPK에 의존적인 현상인지 확인하기 위해 high glucose를 처리하여 지방증을 유도한 HepG2 세포에 AMPK 특이적인 억제제인 compound C를 처리하고 나서 AAE를 처리하여 배양한 다음, FAS, SREBP-1c의 단백질 발현과 함께 세포 내 지질 축적 정도를 분석한 결과, compound C가 high glucose 처리에 의해 증가된 FAS와 SREBP-1c의 발현을 낮추는 AAE의 효과를 상쇄시킬 뿐 아니라, 이로 인한 중성지방 및 총 콜레스테롤 생산에도 영향을 미쳐 AAE의 간세포 내 지질 축적 억제 효과도 약화시키는 것으로 나타났다. AMPK 활성화 억제에 따른 이러한 결과는 AMPK가 간세포 내 지질 축적에 관여하는 유전자들의 조절에 핵심인자로 작용하며, AAE가 이러한 AMPK에 의존적인 방식으로 지질대사 관련 유전자들의 활성화 또는 발현을 조절함으로써 간세포, 나아가 간 조직의 지방증 억제에 효과적으로 작용할 수 있음을 시사한다.
다만, 세포 및 생체 수준에서 확인된 개똥쑥추출물의 뚜렷한 지방간 개선 효과에도 불구하고, 이러한 효과를 나타내는 유효성분에 대한 연구는 아직까지 미미한 수준에 머무르고 있는데, 비록 최근에 발표된 Rho 등의 연구를 통해 개똥쑥열탕추출물에 1,3-di-O-caffeoylqunic acid, 3,4-di-O-caffeoylquinic acid, 3,5-di-O-caffeoylqiunic acid, 1,5-di-O-caffeoylquinic acid, 4,5-di-O-caffeoylquinic acid 및 scopoletin이 함유되어 있음이 밝혀졌으나[42], 이들 각 성분이 개똥쑥추출물의 지방간 개선에 있어 어떠한 역할을 하는지 추가적인 연구가 필요한 실정이다.
이상의 내용을 종합할 때, 개똥쑥추출물은 간의 지방증을 포함한 비알코올성 지방간 질환의 예방을 위한 신규 건강기능식품의 기능성 원료는 물론, 비알코올성 지방간염 치료를 위한 의약품의 후보물질로서 충분한 가치를 가지며, 향후 유효성분 규명 및 이들 성분의 작용기전 확인을 통하여 최종 제품 개발 및 상용화 가능성 제고에 기여할 수 있을 것으로 사료된다.







