Introduction
쑥은 500종 이상의 종류가 있으며, 유럽, 아시아, 미국 등 다양한 지역에 분포되며, 단년생, 다년생 등 다양한 형태로 서식하고 있다[1–6]. 이 중 개똥쑥은 말라리아 치료제인 artemisinin의 재료로 잘 알려져 있다. 전통적으로는 한국과 중국에서 해열제나 지혈제로 많이 사용되었으며, 여러 문헌에서 항염, 항균, 항바이러스, 항산화 작용이 알려져 있다[7–14]. 최근 개똥쑥 추출물이 지방생성을 억제하여 비만을 예방할 수 있다는 보고가 있으며, 특히, 본 개똥쑥열수추출물(water extract of Artemisia annua, WEAA)은 전임상 시험 기관에서 객관적으로 실시한 유효성 시험에서 고지방식이 마우스에서 체중을 감소시키고, 간내 지방 축척을 억제하고, 간손상지표를 감소시키는 효과가 증명되었다[15]. 본 전임상 안전성 연구는 인체적용시험 전 유효성 시험에서 효능을 보인 50 mg/kg의 20배 용량을 13주간 경구투여하여 안전성을 확인하였다.
Materials and Methods
본 시험에 사용한 개똥쑥열수추출물(water extract of Artemisia annua, WEAA)은 이미, 이취가 없고 개똥쑥 교유의 향미가 있는 흑갈색의 액상으로 건강기능식품 GMP 시설을 갖춘 삼영식품원료공업주식회사에서 제조하였다. 시험물질의 조제는 액상 개똥쑥열수추출물을 고형분 함량(459 mg/mL)을 기준으로 멸균증류수에 용해하여 1,000 mg/ 5 mL로 적용하였다. 시험물질은 매 투여 직전 조제하여 사용하였으며, 장기간 정치 시 침전이 생기므로 사용 전 충분히 혼합한 후 투여하였다.
Sprague-Dawley(SD)계 6주령 암수 랫드 44수(수컷 22수, 암컷 22수)를 ㈜오리엔트바이오로부터 구입하였다. 동물입수 후 사육실에 5일간 순화기간을 거치면서 일반증상을 관찰하여 40수(수컷 20수, 암컷 20수)의 건강한 동물만을 시험에 사용하였다. 사료는 감마선조사 멸균된 실험동물용 고형사료(Teklad Certified Irradiated Global 18% Protein Rodent Diet, 2918C, ENVIGO, Indiana, IN)를 자유급이하였으며, 음수는 상수도수를 고온고압멸균하여 공급하였다. 사료의 오염물질 분석은 생산공급처에서 실시한 자료를 이용하였으며, 음수의 요염물질 분석은 서울보건환경연구원에 의뢰하여 시설 운영 기준에 적합함을 확인하였다. 본 시험은 서울대학교병원 동물실험윤리위원회 승인(IACUC No. 17-0212-S1A0)하에 OECD Guideline(1998)과 식품의약품안전처고시 의약품 등의 독성시험기준 중 반복투여독성시험(제2017-71호) 및 서울대학교병원 의생명연구원 표준작업지침서(SNUH-BRI/LAR/GTR)에 따라 실시하였다[16–18].
시험군은 선발된 암수 각 20마리를 각 군당 암수 10마리씩 총 2개 군으로 군간 체중이 고르게 분배하였다. 투여량 설정은 본 시험물질을 단회투여 독성시험 결과를 바탕으로 전임상실험 유효용량인 50 mg/kg의 20배 용량인 1,000 mg/kg을 단일 용량으로 설정하였다. 대조군은 같은 부피의 멸균증류수만을 투여하였다.
시험물질이 투여경로는 임상 적용 경로인 경구투여를 선택하였고, 투여방법은 경구투여용 존데를 이용하여 경구로 투여하였다. 시험물질 투여횟수 및 기간은 1일 1회, 주 7회, 13주간 투여하였고, 매주 화요일과 금요일에 주 2회 체중을 측정한 결과를 토대로 투여량(5 mL/kg)을 환산하여 투여하였다.
시험물질을 투여한 모든 동물에 대하여 매일 빈사동물 및 사망 여부를 확인하고, 매주 1회 외관적 이상 및 임상증상, 이상 징후의 발생 여부와 그 정도를 관찰하였다.
모든 동물에 대하여 시험물질의 투여개시일과 투여개시 후 시험 종료 시까지 매주 1회씩 부검 전일까지 체중을 측정하여 시험기간 중 동물의 체중변화를 관찰하였고, 부검 직전에 체중을 측정하여 상대장기중량을 구하였다. 또한, 사육상자별로 사료 및 음수의 급여총량과 잔량을 투여개시 후부터 종료 시까지 매주 1회 측정하였다.
시험기간 중 투여개시 후 13주째에 무작위로 각 군당 암수 각각 5마리씩의 동물에 대하여 신선뇨를 채뇨한 후, 뇨검사용 시험지(SIEMENS, Multistix® 10 SG, USA)를 사용하여 Urine Analyzer(Siemens, USA)로 pH, leukocyte, nitrite protein ketone body, urobilinogen bilirubin, glucose, 잠혈검사를 실시하였고, 굴절계(URC-NE, ATAGO, USA)를 이용하여 specific gravity를 검사하였다.
혈액학적 검사를 위하여 부검 당일 복대정맥에서 혈액을 채혈하고, Animal Blood Counter(Siemens, USA)와 Coagulation Analyzer(Instrumentation Lab., USA)를 이용하여 백혈구수, 적혈구수, 혈색소량, 적혈구백분율, 혈소판수, 평균적혈구용적, 평균혈색소량 평균적혈구혈색소농도, 백혈구감별 백분비, 망상적혈구백분율, 혈액응고시간 검사 등을 검사하였다.
혈청생화학적 검사를 위하여 부검 당일에 복대정맥에서 혈액을 채혈하여 실온에 30분간 방치하여 응고 후 원심분리(3,000 rpm, 15분)하여 얻은 혈청으로 검사하였다. 검사항목인 urea nitrogen, cholesterol, total protein, albumin, total bilirubin, alkaline phosphatase, aspartate aminotransferase, alanine aminotransferase, γ-glutamyl transferase, creatinine, triglycerides, glucose, A/G ratio, potassium, chloride, sodium, calcium, inorganic phosphorus 등을 측정하였다.
동물의 부검 시 우선 피부, 구강 및 눈 등을 조사한 후, 박피하여 피하조직의 상태를 관찰하였다. 그 후 복강, 흉강 및 두개강을 열고, 내부기관 및 조직의 상태를 조사하였다. 간장, 신장, 부신, 방광, 비장, 췌장, 흉선, 갑상선, 부갑상선, 기관, 식도, 폐장, 심장, 침샘, 경부 림프절, 장간막림프절, 위장, 소장, 대장, 피부, 유선, 안구, 뇌, 뇌하수체, 대퇴골 및 골수, 비강, 고환, 부고환, 혀 및 후두, 대퇴근육, 좌골신경, 흉골, 척수, 전립선, 정낭, 난소, 자궁, 질 등의 적출한 조직은 건조를 피하기 위해 신속하게 육안적 관찰을 실시하고, 10% 중성 포르말린액, Davison액, Bouin액 등 적절한 고정액에 침적하였다.
부검 시 모든 시험동물에 대하여 간장, 비장, 신장(좌우), 부신(좌우), 흉선, 폐장, 심장, 고환(좌우), 난소(좌우), 뇌, 뇌하수체를 측정하였고, 체중에 대한 상대중량비도 계산하였다.
Results
시험기간 중 빈사 또는 사망개체가 발견되지 않았다. 임상증상 관찰결과, 시험기간 중 모든 동물에서 본 시험물질에 의한 것이라고 인정되는 임상증상, 행동이상 등은 관찰되지 않았다. 체중변화 관찰결과, 암수 모두에서 전 기간 동안 대조군과 비교하여 통계학적으로 유의한 체중 증감은 관찰되지 않았다. 사료섭취량, 사료효율 및 사료요구율 비교 결과, 암수 모두에서 대조군과 비교하여 통계학적으로 유의한 변화는 관찰되지 않았다. 음수섭취량 비교 결과, 암수 모두에서 대조군과 비교하여 통계학적으로 유의한 변화는 관찰되지 않았다(data not shown).
혈액학적 검사 결과, 수컷에서는 모든 검사 항목에서 대조군과 비교하여 통계학적으로 유의한 변화는 관찰되지 않았다. 암컷의 경우 시험물질투여군에서 대조군과 비교하여 적혈구수 감소 및 호중구 비율의 증가가 유의하게 변화되었다(Table 1). 혈액응고 검사 결과, 암수 모두에서 대조군과 비교하여 통계학적으로 유의한 변화는 관찰되지 않았다. 혈청생화학적 검사 결과, 모든 검사 항목에서 암수 모두 대조군과 비교하여 통계학적으로 유의한 변화는 관찰되지 않았다(Table 2). 13주째 실시한 뇨검사 및 안검사에서는 암수 모두에서 시험물질과 관련된 특징적인 변화는 관찰되지 않았다(data not shown).
부검시 육안병변 관찰 결과, 수컷의 경우 대조군에서는 폐장의 붉은 반점 2례 및 미색 반점 2례, 공장과 회장의 부분적 변색 1례가 관찰되었다. 시험군에서는 폐장의 미색 반점 2례 및 부분적 변색 1례, 흉선의 국소적 붉은 반점 1례, 간장의 부분적 변색 1례, 신장의 선형 함몰 및 부분적 지방 침착 각 1례, 공장과 회장의 부분적 변색 1례가 관찰되었다. 암컷의 경우 대조군에서는 육안적 병변이 관찰되지 않았고, 시험군에서는 폐장의 붉은 반점 3례, 미색반점 1례 및 부분적 변색 1례, 경부림프절의 일부 변색 1례가 관찰되었다(data not shown).
대조군 및 시험물질투여군에 대하여 병리조직학적 검사 결과, 아래와 같은 비종양성 병변이 관찰되었다.
간장: 대조군(수컷 5례, 암컷 6례) 및 시험물질투여군(수컷 5례, 암컷 6례)에서 간실질 및 중심 정맥 주위로 국소적 림프구 및 대식세포의 침윤이 미약하게 관찰되었다. 일부 개체에서는 염증이 여러 부위에서 관찰되거나, microgranuloma를 형성하기도 하였다. 다만 대조군과 시험물질투여군 간의 염증소견 및 정도에는 차이가 없었다(Fig. 1).
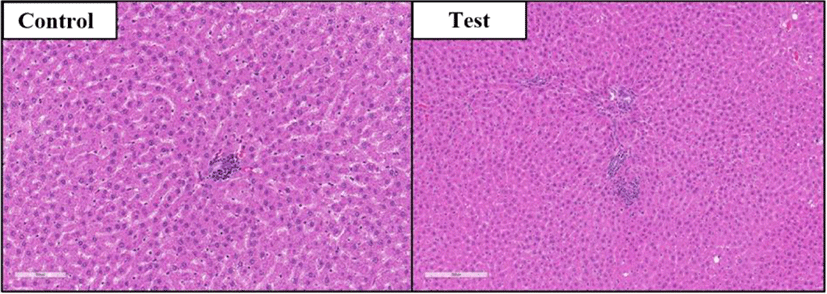
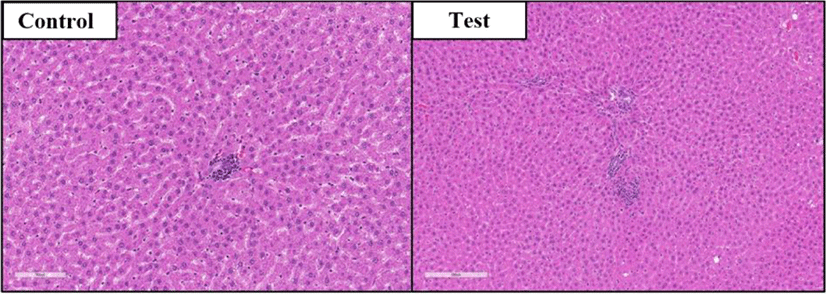
신장: 대조군(수컷 5례, 암컷 2례)과 시험물질투여군(수컷 2례)에서 국소적으로 미약한 림프구 침윤이 관찰되었(Fig. 2). 염증의 정도가 미약하고 국소적이며 대조군과 시험물질투여군 모두에서 관찰됨으로 약물 투여와의 관련성은 없는 것으로 판단된다.
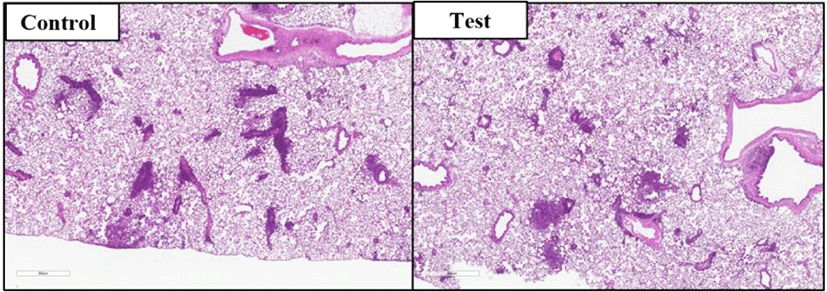
폐와 주 기관지: 대조군(수컷 2례)과 시험물질투여군(암컷 3례)에서 기관지 주위로 미약한 염증세포의 침윤이 관찰되었다. 또한, 대조군(수컷 6례, 암컷 3례)와 시험물질투여군(수컷 2례, 암컷 4례)에서 폐실질 여러 곳에 다양한 정도의 림프구 침윤이 다발성으로 관찰되었다(Fig. 3). 그러나, 폐의 염증병변은 시험물질투여군뿐 아니라, 대조군에서도 광범위하게 관찰되어 시험물질 투여에 의한 변화라기보다 환경적 요인에 의한 개체 특이 반응으로 생각된다.
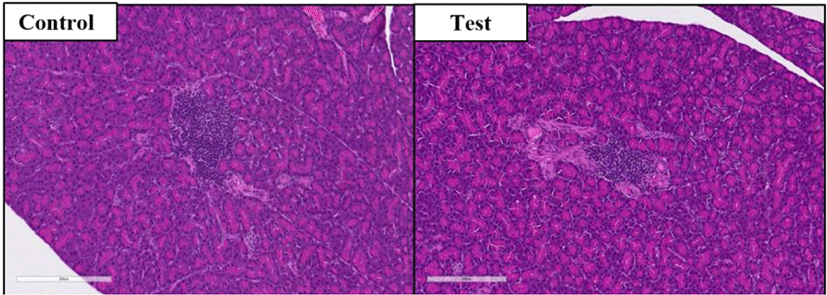
췌장: 대조군(수컷 1례, 암컷 1례)과 시험물질투여군(암컷 2례)에서 췌장의 국소적 염증 등이 관찰되었으나, 이는 국소적이며 대조군과 시험물질투여군 모두에서 관찰됨으로 약물 투여와의 관련성이 없는 개체 특이 반응으로 생각된다(Fig. 4).
Discussion
본 시험의 시험용량은 이전 진행한 SD랫드와 비글견에서 단회 경구투여독성시험을 통해 5,000 mg/kg에서 독성이 없음을 확인하였고(not published reports), 원료물질인 개똥쑥이 식품원료이고 개똥쑥열수추출물의 제조공정 및 성분 상 특이사항이 없는 점을 감안하여 전임상시험의 유효용량인 50 mg/kg의 20배 용량인 1,000 mg/kg으로 설정하였다. 대조군으로 용매대조군을 두고 군당 7주령의 SD 랫드 암수 각각 10마리로 구성하였다. 시험물질은 경구로 1일 1회, 주 7회, 13주간 경구 반복 투여하였다.
시험물질을 투여한 모든 동물에서 시험 전 기간을 통해 사망한 동물은 없었으며, 본 시험물질에 의한 것으로 인정되는 임상증상, 행동이상 등은 관찰되지 않았다. 또한, 체중변화, 사료섭취량, 사료효율, 사료요구율 및 음수섭취량 관찰 결과, 암수 모두에서 대조군과 비교하여 유의한 변화는 관찰되지 않았다.
혈액학적 검사 결과, 암컷군에서 적혈구수와 호중구비율의 변화가 관찰되었으나 정상범위 이내의 변화였으며, 혈액응고시간, 혈청생화학적, 뇨 및 안검사에서는 모든 항목에서 대조군 대비 유의한 증감이나 변화가 관찰되지 않았다. 또한, 부검 시 장기에 대한 절대중량 및 체중 대비 상대중량도 대조군과 비교하여 유의한 증감은 관찰되지 않았다.
부검시 육안병변 관찰 결과, 경부림프절, 간, 흉선, 폐, 신장, 공장 및 회장 등에서 육안병변이 관찰되었으나, 이는 배경병변과 유사한 수준으로 시험물질에 의한 특이한 병변은 관찰되지 않았다.
모든 동물의 전 장기에 대하여 조직병리학적 검경 결과, 대부분의 조직학적 소견은 비종양성 병변으로 대조군과 시험물질투여군 간 차이가 없었으며, 투여물질과 관련이 없는 비특이적 소견으로 시험물질 투여로 인한 독성병변 및 표적장기는 관찰되지 않았다.
개똥쑥이 속하는 Artemisia종의 추출물에 대한 독성 시험은 현재까지 두 건이 수행되었는데, Muto 등은 랫드에서 Artemisia absinthium 추출물에 대한 독성을 연구하였고, Mukinda 등은 마우스와 랫드에서 Artemisia afra 수용성 추출물에 대한 독성을 연구하였다[19, 20]. 먼저 Muto 등의 연구에서 단회투여시 마우스에서 4,000 mg/kg이 무독성량(NOAEL)이었으며, 3개월 반복투여시 랫드에서 1,000 mg이 무독성량으로 관찰되었고, Mukinda 등의 연구에서는 수컷 랫드에서 1,000 mg/kg이가, 암컷 랫드에서는 2,000 mg/kg이 무독성량이었다. 또한 두 논문에서도 비특이적인 조직병리학적 소견이 관찰되었으나 전반적으로 미약하고, 대조군과 차이가 없어 시험물질과의 관련성이 없다고 보고하였다. 이는 본 시험에서 시행한 개똥쑥 수용성 추출물의 안전성 결과와 유사하게 판단된다[19, 20].
상기 소견 및 기존문헌을 종합해 볼 때, 독성평가 측면에서 개똥쑥열수추출물 투여에 의한 특이적 독성 반응 은 관찰되지 않았다. 일부 개체에서 관찰된 폐장의 염증성 병변은 시험물질 투여군뿐 아니라, 대조군에서도 관찰되고, 그 심한 정도도 시험물질투여군에서 더 현저하지는 않았다. 이는 동물 개체의 감수성 문제이거나 환경적 요인일 가능성이 더 클 것으로 판단된다. 그 외 여러 장기에서 관찰되는 국소적 염증 병변은 그 정도가 미미하고 대조군과 시험물질투여군 간에 차이를 보이지 않아, 환경 요인에 의한 비특이적 반응으로 생각된다.
결론적으로 본 연구에서는 시험물질인 개똥쑥열수추출물을 SD 랫드에 경구로 13주간 반복 투여하고 적용한 결과, 본 시험 조건 하에서 개똥쑥 열수추출물이 무독성량은 암수 모두에서 1,000 mg/kg 이상으로 판단하였으며, 이는 유효용량의 20배 이상 섭취량에서도 안전하므로 안전성이 높은 건강기능식품으로 개발할 수 있다고 사료된다.
Conclusion
본 시험은 개똥쑥열수추출물의 13주간 경구 반복 적용시 안전성을 평가하기 위하여 SD 랫드에서 13주 경구 반복투여 독성시험을 ‘의약품 등의 독성시험기준, 식품의약품안전고시 제2017-71호:반복투여독성시험’에 따라 실시하였다.
본 시험은 유효용량인 50 mg/kg의 20배 용량인 1,000 mg/kg으로 설정하였고, 대조군으로 용매대조군을 두고 군당 7주령의 SD 랫드 암수 각각 10마리로 구성하였다. 시험물질은 경구로 1일 1회, 주 7회, 13주간 경구 반복 투여하였다.
시험물질을 투여한 모든 동물에서 시험 전 기간을 통해 사망한 동물은 없었으며, 본 시험물질에 의한 것으로 인정되는 임상증상, 행동이상 등은 관찰되지 않았다. 또한, 체중변화, 사료섭취량, 사료효율, 사료요구율 및 음수섭취량 관찰 결과, 암수 모두에서 대조군과 비교하여 유의한 변화는 관찰되지 않았다.
혈액학적 검사 결과, 암컷군에서 적혈구수와 호중구비율의 변화가 관찰되었으나 정상범위 이내의 변화였으며, 혈액응고시간, 혈청생화학적 뇨 및 안검사에서는 모든 항목에서 대조군 대비 유의한 증감이나 변화가 관찰되지 않았다. 또한, 부검 시 장기에 대한 절대중량 및 체중 대비 상대중량도 대조군과 비교하여 유의한 증감은 관찰되지 않았다.
부검시 육안병변 관찰 결과, 경부림프절, 간, 흉선, 폐, 신장, 공장 및 회장 등에서 육안병변이 관찰되었으나, 이는 배경병변과 유사한 수준으로 시험물질에 의한 특이한 병변은 관찰되지 않았다.
모든 동물의 전 장기에 대하여 조직병리학적 검경 결과, 대부분의 조직학적 소견은 비종양성 병변으로 대조군과 시험물질투여군 간 차이가 없었으며, 투여물질과 관련이 없는 비특이적 소견으로 시험물질 투여로 인한 독성병변 및 표적장기는 관찰되지 않았다.
결론적으로 본 연구에서는 시험물질인 개똥쑥열수추출물을 SD 랫드에 경구로 13주간 반복 투여하고 적용한 결과, 본 시험 조건 하에서 개똥쑥열수추출물이 무독성량은 암수 모두에서 1,000 mg/kg 이상으로 판단하였으며, 이는 유효용량의 20배 이상 섭취량에서도 안전하므로 안전성이 높은 건강기능식품으로 개발할 수 있다고 사료된다.







