Introduction
아토피 피부염은 만성 피부 염증 질환으로서 유전적, 환 경적, 정신적 요인들 간의 다양한 상호작용에 의해 발생된 다[1]. 아토피 피부염은 주로 소아에서 많이 발병되고, 지난 30년간 선진국에서의 유병률이 3배 이상 증가하였으며, 부 모 중 1인이 아토피 피부염이 있을 경우, 자녀에게서 아토피 피부염이 나타날 확률은 50%에 이를 정도로 유전적 요인이 많은 영향을 미친다. 또한, T 세포가 항원에 노출되면 Th1 세포 또는 Th2 세포로 분화되어 면역반응이 유발되는데, 일 반적으로 아토피 피부염은 Th2-polarized disease로 알려져 있으며[2, 3], 아토피 피부염이 급성으로 나타낼 때는 Th2 세포의 활성이 지배적이나, 만성일 경우, Th1 세포의 활성이 지배적이다. 또한, 혈중 면역글로불린E(Immunoglobulin E, IgE)의 발현이 증가되면 아토피 피부염이 발병되는 것으로 알려져 있다. 이러한 아토피 피부염의 치료제로는 대부분 스테로이드제 계열을 사용하여 일시적으로 알러지 유발을 차단할 뿐, 아토피 피부염이 근본적으로 치료되는 것은 아 니다. 최근 연구 결과에 따르면 아토피 피부염의 주된 증상 인 소양증의 원인이 Interlukin-31(IL-31)로 알려져 있으며, EPSA1이라는 면역세포 단백질이 가려움증을 일으키는 근 원이라고 알려져 있으나[4, 5], 정확한 발병원인에 대해 규 명하지 못하고 있는 실정이다. 이러한 이유로 인위적 치료 제가 아닌 천연물을 활용하여 아토피 피부염에 대한 근본적 치료제를 개발하고자 본 연구를 진행하였다.
한국은 예로부터 대두를 이용하여 청국장을 만들어서 섭 취해 왔다[6]. 청국장의 주 원료인 대두는 항암, 항고혈압, 혈중 콜레스테롤 저하 및 항산화 활성 등의 여러 생리활성 을 갖는 성분을 다양하게 함유하고 있다고 알려져 있으며, 청국장 분말을 장기 섭취하였을 때, 당뇨 환자의 혈중 중성 지질 농도가 유의적으로 감소하였다는 보고[7]가 있으며, 이 외에도 산화적 스트레스를 감소시킴으로써 항염증 활성이 있다고 알려져 있다[8–10].
대두 발효에 사용되는 B. amyloliquefaciens는 Bacillus 속에 속하는 세균의 한 종으로, 탄저균(Bacillus anthracis)에 대한 선택적 활성을 가진 항생제 Plantazolicin과 자연적으로 잘 알 려져 있는 ribonuclease라는 천연 항생 물질 단백질인 barnase 를 합성하는 것으로 알려져 있다[11]. 이러한 이유로 농업 및 수경양식에 주로 항생균주로 많이 사용되어지고 있고, 높 은 염분을 잘 견디며, 식물 조직의 염분 농도 또한 감소시키 는 특징을 가지고 있다[12].
이에 항염증 활성이 있다고 알려져 있는 대두와 천연 항생 물질 생성 및 염분에 저항력을 가지고 있는 B. amyloliquefaciens SCGB 1(KCCM11964P)균을 이용하여 대두 발효를 진행하 여 과민성 피부 염증 반응인 아토피성 피부염 개선 효과를 확인하고자 본 실험을 진행하였다.
청국장 유래 유익균인 B. amyloliquefaciens SCGB 1(KCCM 11964P) 균을 사용하여 60℃에서 36시간 동안 대두 발효 를 진행한 후, 24시간 동안 열풍건조하고 분말화 하였다. 이 후, 분말을 열수추출을 진행하여 최종 시료로 사용하였다 (SCGB1). 이후, 아토피 피부염 개선 효과를 확인하기 위하 여 Balb/c 웅성 마우스를 사용하여 실험을 진행하였다. 발효 대두 분말(SGCB1) 및 대두 분말(NC)을 100, 200, 400 mg/kg 으로 14일 동안 경구투여한 후, 검체를 채취하여 아토피 피 부염 관련 인자 개선 효과를 확인하였다. 그 결과, 발효대두 분말 및 대두분말 경구투여시 체중 변화에는 영향을 주지 않음을 확인하였고, DNCB로 아토피 피부염 유발시 피부 소 양증 및 홍반이 증가함을 확인하였으며, 발효대두분말 경구 투여시 피부 소양증 및 홍반이 감소하는 것을 확인하였다. 또한, DNCB로 아토피 피부염 유발시 혈중 IgG 농도가 증 가함을 확인하였으며, 발효대두분말 및 대두분말 경구투여 시 혈중 IgG의 발현이 감소됨을 확인하였다.
Materials and Methods
청국장 제조에 사용된 대두는 전북 순창군에서 수확되는 백태를 구입하여 사용하였으며, 균주는 (재)발효미생물산업 진흥원이 보유하고 있는 항균활성과 프로바이오틱스 특성을 가지는 B. amyloliquefaciens SCGB 1(KCCM11964P)을 사 용하였다.
청국장은 백태 3.5 kg을 24시간 동안 침지하여 충분히 불 린 후 체로 걸러 물기를 제거하여 autoclave에서 121℃로 30 분간 증자하였다. 증자된 백태는 40℃ 이하로 냉각시킨 후 tryptone soya broth(TSB, Oxoid LTD., England)에서 30℃, 24시간 배양한 배양액을 멸균수로 균체를 세척한 후 백태 전 무게의 0.5%(v/w)로 접종 및 혼합하였다. 청국장은 항온항습 기를 이용하여 37℃에서 80% 습도로 36시간 동안으로 발효 하였다. 제조된 청국장을 추출하기 위하여 발효가 끝난 청 국장을 60℃에서 24시간 건조한 후 파쇄하여 청국장 분말 시료로 사용하였다. 청국장 분말 시료의 10배수 증류수를 이 용하여 80℃에서 3시간 열수추출을 진행하였으며, 저온 감 압농축하여 동결건조 후 분말화하여 열수추출물 시료로 사 용하였다.
소재의 아토피 피부염 개선 효능을 확인하기 위하여 동물 실험을 진행하였다. Balb/c 수컷 마우스(20–25 g), 6주령을 SAMTAKO(Osan, Korea)에서 80두를 구입하여 1주 동안 고 형사료와 물을 자유롭게 섭취시키면서 일정한 습도(60 ± 5%) 와 일정한 온도(22 ± 2℃) 및 12시간 주기로 명암이 조절되 는 실험 환경에 1주간 적응시켰다. 1주일 동안 적응 기간을 거친 후, 각 군당 10마리씩 총 8군으로 나눈 후 정상대조군 (Normal), 아토피 유발군(Negative), 발효 대두 처리군(SCGB1, 100, 200 및 400 mg/kg), 대두 가루 처리군(NC, 100, 200 및 400 mg/kg)으로 나누었다. 아토피 유발을 위하여 클리퍼를 이용하여 마우스의 등 쪽 피부를 1차적으로 제모하고, 제모 용 면도기와 크림을 사용하여 깨끗하게 제모한 뒤, 미세상 처가 치유되도록 24시간 방치하였다. 이후 실험에서 사용 할 아토피 유발 시약인 DNCB(2,4-Dinitrochloro benzene)를 2%의 농도가 되도록 용매(acetone:olive oil = 4:1 혼합)에 용해하고 제조해 정상 대조군을 제외한 모든 군에게 3일 동 안 도포하였다. 3일 후, 지속적인 아토피 유발을 위하여 0.5%의 DNCB를 실험이 종료될 때까지 3일 간격으로 제모 된 등쪽 피부에 도포하였다. SCGB1 및 NC는 각각의 용량 으로 0.3% CMC에 현탁하여 1일 1회 경구투여 하였으며, 정 상대조군 및 아토피 유발군은 0.3% CMC를 경구투여 하였다. 본 연구는 원광대학교 연구윤리위원회의 승인(WKU18-89) 을 받아 시행하였다.
실험 종료일 18시간 전에 마우스를 절식시켜 부검 준비 를 진행하고 실험 종료일에 에테르를 이용하여 흡입 마취한 후 마우스의 심장으로부터 혈액을 0.7 mL 채취하였다. 이후 경추탈골법으로 마우스를 희생한 후, 마우스의 등쪽 피부를 약 2 × 3 cm의 크기로 적출하여 4등분한 뒤 3개의 조직은 각각의 1.5 mL 튜브에 담아 —80℃에 보관하여 이후 실험 에 사용하였고, 나머지 1개의 조직은 10% 중성 포르말린 용 액에 담아 조직 염색을 준비하였다.
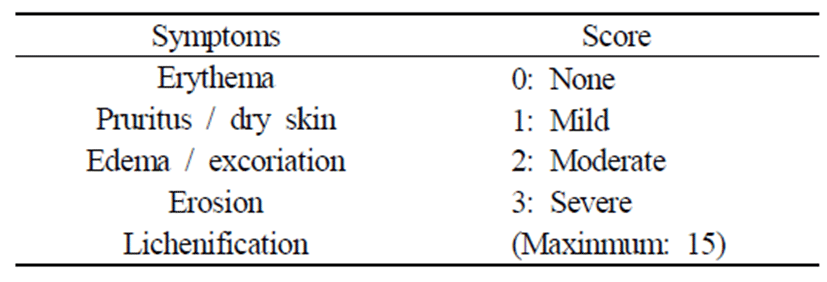
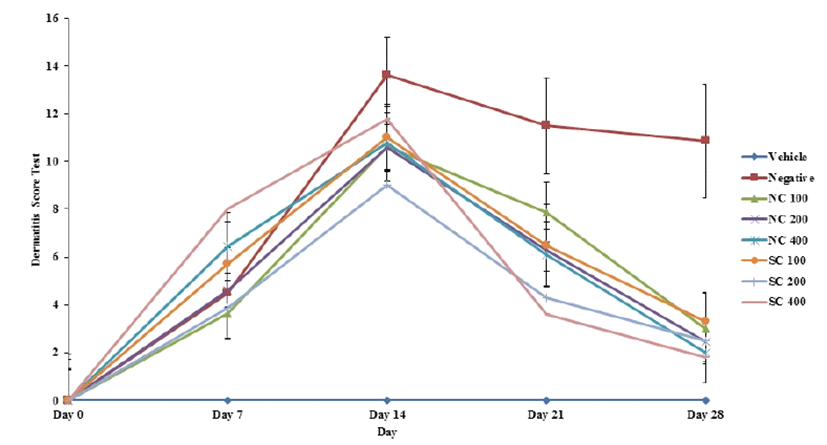
DNCB 도포 후 3일 간격으로 아토피성 피부염에서 일반 적으로 사용되는 임상적 육안평가법으로 관능평가를 실시하 였다. 평가 방법은 아토피성 피부염에서 일반적으로 사용 되는 임상적 육안 평가 방법으로써[13, 14] 아토피성 피부 염의 심각성 정도를 다음의 5가지 항목을 각각 평가한 점수 의 총합으로 나타내었다. Table 1에 나타난 바와 같이, 홍반 (erythema), 가려움과 건조피부(pruritus & dry skin), 부종과 혈 종(edema & excoriation), 짓무름(erosion) 및 태선화(lichemification) 로 나누어 평가하였고, 각각의 항목을 없음(0), 약함 (1), 보통(2), 심함(3)으로 채점한 후 합산함으로써 최소 0점 에서 최고 15점 사이의 점수를 부여하였다.
실험 종료일에 마우스를 diethyl ether로 마취시키고, 심장 으로부터 혈액을 0.7 mL 채취하였다. 이후 혈액은 12,000 × g, 4℃에서 5분간 원심 분리하여 혈청을 분리하였다. 분리한 혈청은 실험에 사용하기 전까지 —80℃에서 보관하였으며, 마우스 혈청 내 total IgE 함량은 ELISA kit(BD Biosciences, San Jose, CA, USA)를 이용하여 측정하였다. 실험방법은 제 공된 매뉴얼을 숙지하여 측정하였으며, microplate reader를 이용하여 450 nm에서 흡광도를 측정하였다.
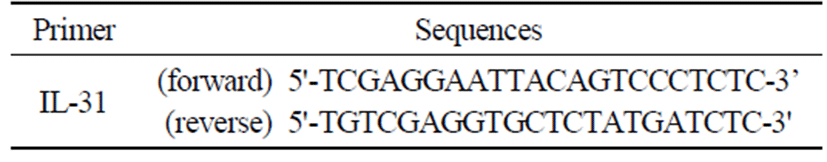
마우스의 등 피부조직을 적출하여 각각에 Trizol 용액 1 mL를 넣고 용해될 때까지 homogenizer로 분쇄하였다. 이 조직분쇄 혼합 부유액에 chloroform(CHCl3) 100 μL를 첨 가한 후 15초간 다시 혼합하였다. 이를 얼음에 15분간 방치 한 후 12,000 × g에서 원심분리한 후 약 300 μL의 상층액을 회수하여 isopropanol 300 μL와 동량 혼합 후 천천히 흔들 고 얼음에서 15분간 방치하였다. 이를 다시 12,000 × g에서 원심분리한 후 80% EtOH로 수세하고 3분간 건조하여 RNA 를 추출하였다. 추출된 RNA 펠릿을 RNase free water에 녹 여 Nanodrop으로 총 RNA를 정량하였으며, 2 μg의 RNA를 Prime Script™Ⅱ1st strand cDNA Synthesis kit(Takarabioinc, Otsu, Shiga, Japan)로 cDNA를 합성하였다. Real-time PCR 은 StepOne™Real-Time PCR system(Applied Bio system)으 로 comparative CT method로 PCR을 수행하여 mRNA 발현 수준을 비교하였다. PCR의 조건은 95℃에서 초기 변성 후, 95℃에서 15초, 60℃에서 1분의 조건으로 40 cycles로 수행 하였다. PCR시 GAPDH 유전자로 각 샘플의 RNA량을 보정 하였으며, 각 유전자 검출을 위한 프라이머의 염기서열은 Table 2에 표시하였다.
피부 조직에서의 아토피 병변을 확인하기 위하여 Hematoxylin & Eosin 염색법으로 형태학적 분석을 실시하였다. 실 험 종료 후 실험동물의 피부 조직을 10% 포름알데히드에 고정하고, 저농도에서부터 고농도 에탄올 용액으로 단계적 인 탈수 과정을 거친 뒤 파라핀 블록을 제작하였다. 각 조직 블록을 4 μm의 두께로 박절하여 슬라이드에 조직 절편을 붙인 후, 각 조직 슬라이드를 xylene으로 탈파라핀을 한 뒤 에 함수시켰다. Hematoxylin 시액을 슬라이드에 1분, Eosin 시액은 3분 처리하여 염색하였으며, 염색이 끝나고 탈수시 켜 봉입하고, 광학현미경(CX21, Olympus, Tokyo, Japan)을 이용해 관찰하였다.
Results
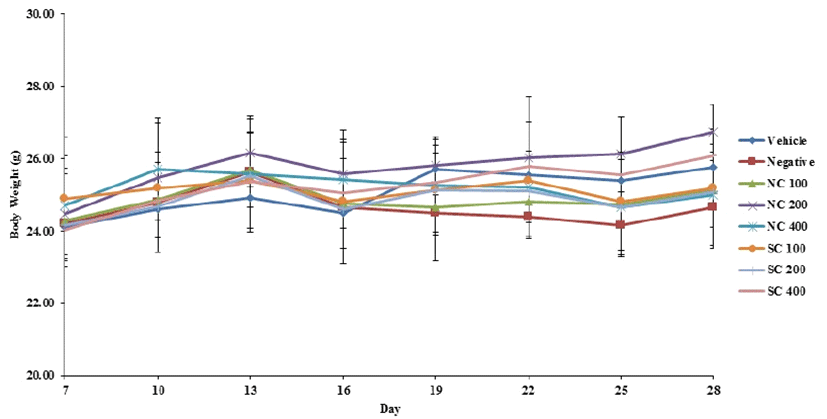
본 실험기간 동안 1일 1회, 경구 투여 전에 체중 측정을 하였으며, 그 결과를 7일씩 나누여 그래프로 표시하였다. Fig. 1에 나타낸 바와 같이 적응기간 동안에는 체중이 지속 적으로 증가하였으며(Day 7), 0.5%의 DNCB로 2차 도포를 시작하는 시점부터(Day 13) 체중의 감소하는 경향을 보이기 시작했으나, 크게 유의성은 없었다. 실험기간이 종료될 때까 지 체중은 크게 유의성이 나타나지 않았으며, 이는 시료에 의한 독성은 나타나지 않는다는 것으로 확인된다.
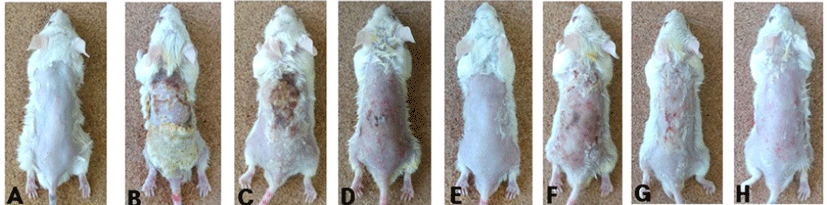
Balb/c 마우스에서 DNCB로 유도한 아토피 육안소견을 확인한 결과, 음성대조군의 경우 심각한 피부조직의 각질 및 상처가 발생하였으며, NC 및 SCGB1의 경우 농도가 증가 함에 따라 아토피 피부 병변이 적어지는 것을 육안으로 확 인할 수 있었다(Fig. 2). 특히 SCGB1 400 mg/kg의 경우, 육 안적으론 Vehicle 군과 구분하기 힘들 정도로 그 효과가 탁 월하였다.
2주동안 SCGB1 및 NC 경구투여 후, SCORAD test를 진 행하여 그 결과를 Fig. 3에 나타내었다. 2% DNCB를 연속 하여 3일 동안 1차 도포 후, 3일에 한번씩 2주 동안 0.5% DNCB를 도포함과 동시에 SCGB1 및 NC를 각각의 용량으 로 경구투여하였다. 그 결과, DNCB 도포 후 1주 동안 지속 적으로 피부 손상이 증가되다가(Day 0–14) 이후, 1주 동안 점차적으로 감소하는 경향을 나타내었다. 이는 SCGB1 및 NC에 의하여 아토피 피부염에 의한 가려움 및 홍반 등이 감소되는 것으로 확인된다.
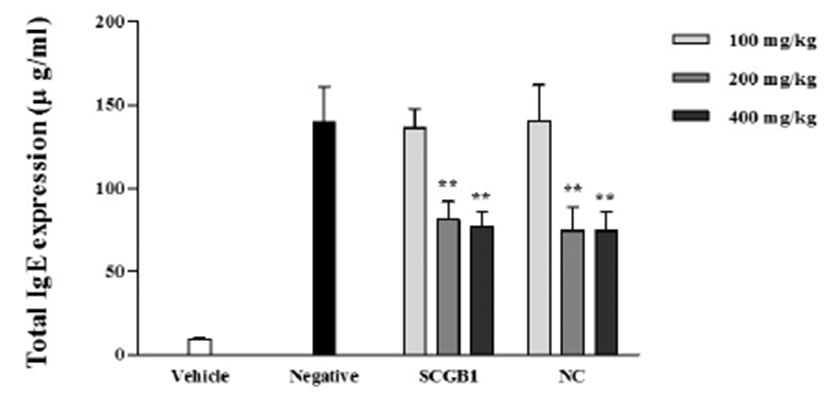
아토피 피부염의 대표적인 바이오마커인 혈중 IgE 발현 량을 ELISA kit을 이용하여 확인하였다. IgE의 경우, 아토피 및 알레르기 관련 인자로서 아토피 발병 시 혈중 IgE 함량 이 크게 증가하는 것으로 보고되어 있다[15].
혈중 IgE 발현을 확인한 결과, Fig. 4에 나타난 바와 같이, 음성대조군에서 혈중 IgE의 발현이 증가함을 확인하였다. 이후, SCGB1 및 NC 경구투여시 혈중 IgE 발현량이 감소함 을 확인하였으며, 특히 SCGB1 및 NC 모두 200, 400 mg/kg 에서 현저히 감소함을 확인하였다. 이러한 결과로, DNCB로 인해 증가된 과발현된 혈중 IgE 발현량을 SCGB1 및 NC 경 구투여시 감소시킴으로써, 아토피 피부염 치료 효과가 있는 것으로 사료된다.
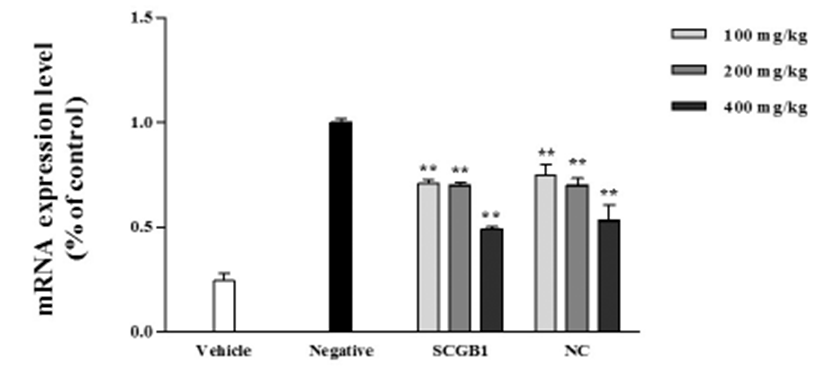
마우스의 피부조직에서 RNA를 분리하여 cDNA를 합성 하고, 합성한 cDNA의 정량하여 Real-time PCR을 진행하였 다. IL-31은 아토피에서 활성화된 CD4+T 세포와 Th2세포 에서 많이 발현된다는 보고가 있으며, 이를 통하여 T세포에 서 IL-31의 발현 조절을 통한 아토피 피부염의 치료기술에 개발도 보고되고 있다[16]. 또한, 다수의 연구 결과에 따르 면, 아토피 피부염의 특징적 증상인 소양증에 대한 발병 기 전은 정확히 밝혀지지는 않았으나, IL-31이 피부 소양증과 관 련되어 있음을 나타내고 있다[17]. Fig. 5에 따르면, IL-31의 mRNA 발현을 확인한 결과, 음성 대조군에서 IL-31의 발현 이 증가됨을 확인하였으며, SCGB1 및 NC 경구투여시 IL-31 mRNA 발현이 현저히 감소함을 확인하였다. 이는 SCORAD Test에서 확인한 결과와 비슷한 양상을 보이며, 이러한 결과 로 볼 때, SCGB1과 NC가 아토피의 특징적인 증상인 소양 증을 완화시킴으로써, 아토피 피부염 치료 효과가 있는 것 으로 사료된다.
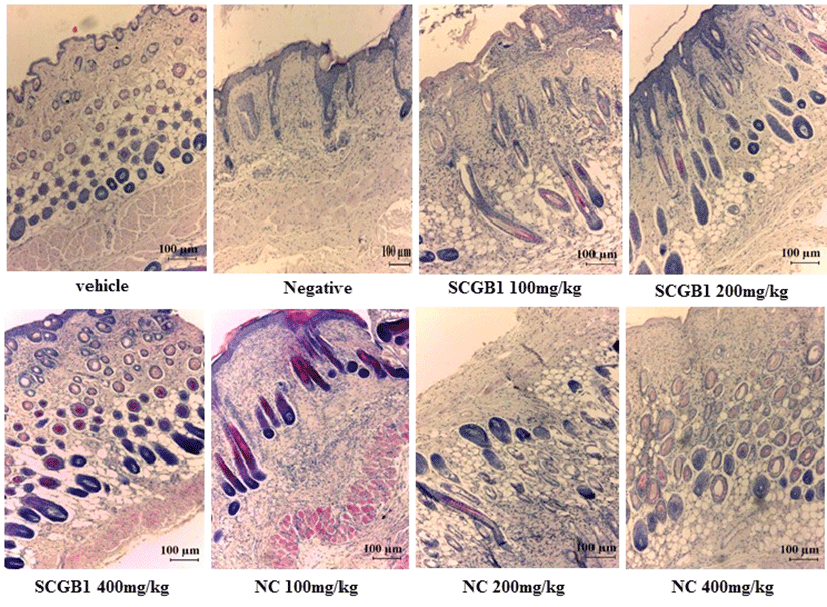
10% 중성 포르말린에 고정해 놓은 등쪽 피부 조직을 이 용하여 H&E 염색을 진행하여 마우스 등쪽 피부 조직 내에 침윤된 염증 세포를 확인하였다. Fig. 6에 나타낸 바와 같이 음성대조군에서 피부조직의 형태가 흐트러짐과 동시에 염증 세포의 침윤이 증가함을 확인하였으며, SCGB1 및 NC 경구 투여시 피부 조직의 형태가 정상대조군과 비슷한 수준으로 회복됨을 확인하였으며, 염증세포의 침윤이 감소됨을 확인 하였다. 이러한 결과를 토대로, SCGB1 및 NC는 피부조직 에서 염증세포의 침윤을 감소시킴으로써 아토피 피부염 치 료 효과가 있는 것으로 사료된다.
Discussion
청국장 속 유익균인 Bacillus amyloliquefaciens를 활용 하여 발효 대두분말(SCGB1) 및 대두(NC)를 이용하여 아토 피 피부염 개선 효과에 대하여 확인하였다. DNCB를 이용 하여 아토피 피부염을 유도하였고, 실험기간동안 체중 및 SCORAD test를 진행하였으며, 실험 종료 후, 혈액을 채취 하여 혈중 IgE의 발현을 확인하고, 피부 조직을 채취하여 소 양증에 영향을 주는 IL-31 mRNA 발현 및 피부조직 변화를 확인하였다. 그 결과, DNCB로 유도한 아토피 피부염 마우 스에서 DNCB 및 소재에 의한 체중 변화는 유의적으로 나 타나지 않음을 확인하였다. 아토피 피부염 중증도를 평가하 기 위해 현재 널리 사용되어지고 있는 SCORAD index를 이 용하여 아토피 중증도를 평가한 결과, DNCB 도포시 아토피 피부염 발현으로 인하여 SCORAD score가 증가되었으며, SCGB1 및 NC 경구투여시 1주 후, 점차적으로 감소되는 것 을 확인하였다. 또한 알레르겐에 의해 염증 반응을 일으키 는 것으로 알려져 있는 IgE의 발현량을 확인하기 위하여 혈 액에서 혈청을 분리하여 확인한 결과, SCGB1 및 NC 경구 투여시 100 mg/kg을 제외한 나머지 군에서 음성대조군 대 비 유의성 있게 감소하는 것을 확인하였으며, 피부 소양증 을 유발하는 IL-31의 mRNA 발현을 확인한 결과, SCGB1 및 NC 경구투여시 mRNA 발현이 감소됨을 확인하였다. 마 지막으로 피부조직에서 염증 정도를 확인하기 위하여 H&E 염색을 통한 피부조직학적 분석을 진행한 결과, 음성 대조군 에서는 표피의 이상증식 및 해면화, 과각화 증상들이 두드 러지게 나타났으며, SCGB1 및 NC 경구투여시 400 mg/kg 에서 이러한 증상들이 억제됨을 확인하였다.
종합적으로, 천연 항생물질을 생성하는 Bacillus amyloliquefaciens를 활용하여 발효시킨 SCGB1은 알레르겐에 의해 염 증 반응을 일으키는 IgE의 발현량을 감소시키고, 피부 소양 증의 주원인인 IL-31의 mRNA 발현을 억제시킴으로써 아토 피 피부염을 개선시키는 것을 확인하였다. 이러한 결과로 비추어 볼 때 SCGB1은 향후 아토피 치료제로서 개발이 가 능할 것으로 사료된다.