Original Article
Effect of glycyrrhizin on nicotine-induced behavioral disturbance of planarian, Dugesia japonica
Yong-Jin Kim1

,
Juneno So2

,
Young-Joo Yi1
,*

,
Sang-Myeong Lee1
,*

Author Information & Copyright ▼
1Division of Biotechnology Chonbuk National University, Iksan 54596, Korea
2Department of Pharmaceutical Engineering, Woosuk University, Wanju 55338, Korea
*Corresponding author: Young-Joo Yi Division of Biotechnology, Chonbuk National University, Iksan 54596, Korea Tel: +82-63-850-0835, Fax: +83-63-850-0834, E-mail:
yiyj@jbnu.ac.kr Sang-Myeong Lee Division of Biotechnology, Chonbuk National University, Iksan 54596, Korea Tel: +82-63-850-0843, Fax: +83-63-850-0834, E-mail:
leesangm@jbnu.ac.kr
© Research Institute of Veterinary Medicine, Chungbuk National University. All rights reserved.
Received: Mar 12, 2019; Accepted: Jun 10, 2019
Abstract
Nicotine is a component of tobacco products and is one of the most commonly abused substances that leads to addiction. Therefore, the present study was performed to investigate the behavioral pattern and toxicity by nicotine exposure in planarians. Basically, planarians were exposed to different concentration of nicotine for 5 min. To investigate detoxification effect, planarians were exposed to nicotine for 5 min, and treated glycyrrhizin for 5 min, then motility and seizure-like behavior were observed for 5 min. As a result, the motility of nicotine-exposed planarians decreased approximately more than 50% compared to freshwater control. However, the motility of glycyrrhizin-exposed planarians recovered than nicotineexposed planarians. In the assessment of seizure-like behavioral pattern, planarians exposed to nicotine showed head-bop or c-like type rather than screw-like or snake-like patterns. However, planarians exposed to glycyrrhizin showed no seizure-like behavior. To examine the oxidative stress response, planarians were cultured in fresh water containing 1 mM nicotine for 1 day. Planarians were homogenized and extracted to assay the contents of reactive oxygen species (ROS), lipid hydroperoxides (LH), glutathione (GSH), catalase (CAT), and superoxide dismutase (SOD). The result showed that a significantly higher level of ROS, LH indicated in planarians exposed to nicotine, on the other hand, glycyrrhizin-exposed planarians were significantly decreased ROS, LH levels. In conclusion, the motility decreased when planarians were exposed to nicotine, in a dose-dependent manner, whereas seizurelike behavior increased. Nicotine induced behavioral disturbances and cell toxicity in planarians were recovered by glycyrrhizin, suggesting a candidate substance for nicotine addiction treatment.
Keywords: planarian; nicotine; seizure-like behavior; glycyrrhizin; oxidative stress
Introduction
니코틴(nicotine)은 중독증상을 일으키는 대표적인 물질들 중 하나로[1], 니코틴에 의한 중독은 체내의 니코틴성 아세 틸콜린 수용체(nicotinic acetylcholine receptors, nAChRs)와 니코틴의 상호작용에 의해서 도파민(dopamine, DA) 시스템 을 포함한 중추신경계의 보상 센터를 활성화시켜 발생된다 [2]. 이러한 nAChRs와 니코틴의 상호작용이 신경 전달 물질 방출에 관여하여 만성 니코틴 노출 반응인 금단 현상을 유 발하는데[3], 그 증상으로는 불안, 우울한 기분, 식욕 증가, 좌절감, 불면증 등이 있다[4]. 이러한 금단 현상은 니코틴을 함유하지 않은 담배를 피우는 것으로 일시적으로 억제할 수 있으며[5], 니코틴 투여량 및 노출 기간이 금단 현상의 기간 에 영향을 주는 것으로 보고되었다[6]. 또한 니코틴은 전압 의존성 칼슘 채널(L형 칼슘 채널)이 열리는 막 탈분극을 유 도하여 직접 또는 간접적으로 흥분성 신경전달물질인 글루 타메이트(glutamate)의 방출을 증가시켜 발작을 유발하는 것 으로 알려져 있는데[7], 플라나리아(Dugesia japonica)는 발 작을 유발할 수 있는 글루타메이트의 수용체를 적어도 2가 지 유형(DjGluR1, DjGluR2)을 발현하고[8], L-글루타메이트 에 노출되었을 경우 농도 의존적인 발작 형태를 보이는 것 으로 보고되었다[9].
근래 니코틴 유발성 발작을 포함한 중독 및 해독에 관하 여 실험 동물을 이용한 다양한 연구들이 진행되고 있다[10, 11]. 예시로, 랫드(rats)에서 니코틴 중독이 도파민 시스템을 매개한다는 증거들이 제시되었고[12–14], 니코틴성 아세틸콜 린 수용체가 결핍된 마우스에서는 니코틴에 의한 흥분성 도 파민의 활성화가 일어나지 않는 것으로 보고되었다[15]. 원 숭이 실험에서는 파킨슨병 치료 약물로 사용되는 레보도파 (levodopa)가 유도한 운동 이상증(dyskinesias)이 니코틴 전 처리를 통하여 감소시킬 수 있다는 것을 확인하였다[16].
플라나리아는 하천, 계곡 및 강에 서식하고, 환경에 따라 무성생식과 유성생식을 병행하는 무척추 동물이다[17]. 이 러한 플라나리아의 생식 특성으로 인하여 발달 및 재생 연 구를 통한 생물학적 기능을 조절하는 분자 및 세포 수준의 연구가 진행되고 있다[18, 19]. 또한 플라나리아의 신경계는 포유류의 뇌와 비슷한 구조 및 중추 신경계를 가지고 있어 서 동물의 약리학적 반응 실험에 유용하다[20, 21]. 예로써 제브라피시 유충(zebrafish larvae) 및 선충(nematodes)과의 독성 비교실험에서 플라나리아는 페르메트린(permethrin)과 디클로르보스(dichlorvos) 독성 성분에 대한 반수 치사 농도 (lethal concentration 50, LC50)가 더 민감한 것으로 나타났 다[22]. 또한 플라나리아(Dugesia tigrina)는 신경전달물질 억 제 역할을 하는 감마 아미노뷰티르산(γ-aminobutyric acid, GABA)의 평균 농도가 신경전달물질인 DA와 세로토닌(serotonin) 의 농도보다 높은 수치를 보였고, GABA 합성 능력을 가지고 있음을 보여주었다[23]. 따라서 플라나리아를 이용한 신경전달물질의 조절에 대한 연구는 행동 치료와 신경 장애 의 치료를 위한 약물 연구에 용이하다고 할 수 있겠다[24].
감초(Glycyrrhizae radix [licorice])는 발열, 천식, 기관지염 등의 질병 치료를 위해 자주 처방되는 한약재 중 하나이며 [25, 26], 그 성분으로는 플라보노이드(flavonoid), 사포닌 (saponin), 리퀴틴(liquitin), 아이소리퀴리티게닌(isoliquiritigenin), 글리시리진(glycyrrhizin) 등을 포함하고 있다[27]. 랫 드에서 감초의 활성 성분 중 하나인 아이소리퀴리티게닌이 GABAB 수용체를 조절하여 코카인(cocaine)에 의해 유도된 DA 방출을 억제함으로써 약물중독 치료제로의 이용 가능 성이 시사되었고[28], 알레르기성 비염을 유발시킨 마우스 에 글리시리진 처리가 자유 라디칼(free radical)에 의해 유 도된 지질 과산화 발생을 감소시키고, 혈액 및 비 점막(nasal mucosa)의 면역 활성을 개선한 것으로 나타났다[29]. 또한 글리시리진은 납(lead acetate)에 대한 해독 및 배출에 관여하 는 제2상 효소(phase II enzyme)를 유도하여 간세포 산화 스 트레스 및 종양 등을 예방할 수 있는 것으로 보고되었다[30]. 따라서, 본 연구에서는 플라나리아(D. japonica)를 이용하여 니코틴에 노출된 플라나리아의 운동성 변화, 발작을 조사하 고, 니코틴에 장시간 노출된 플라나리아에 글리시리진을 처 리하였을 때 발작 완화 및 세포 스트레스로부터의 회복 여 부를 조사하였다.
Materials and Methods
실험 동물과 시약
본 실험에 이용되는 플라나리아(D. japonica)는 우석대학 교 제약공학과 생물의약실험실에서 분양 받아와 전북대학교 환경생명자원대학 생명공학부 세포생물학 및 분자 면역학 실험실에서 유지, 관리한 플라나리아를 실험에 사용하였다. 1주일에 2회, 반죽 형태의 소의 간을 먹이로 주고, 18℃ 생수 를 이용하여 사육하였으며, 플라나리아를 실험에 사용하기 전 최소 1주일 전부터 먹이 공급을 하지 않았다[31]. 본 실 험에 사용된 시약은 별도로 언급하지 않는 한 Sigma-Aldrich (Seoul, Korea)에서 구입하여 사용하였다.
플라나리아의 운동성과 발작 형태 측정
플라나리아의 운동성 측정은 실험동물의 자연 상태의 유 영 능력을 응용한 방법[32]을 이용하여 측정하였다. 플라나 리아를 petri dish(p-dish)에 옮긴 후 생수를 채우고 p-dish를 0.5 cm 간격의 격자판 위로 옮겨 5분 동안 관찰하면서 플라 나리아가 통과하는 격자 선의 수를 세어 운동성을 평가하였 다. 본 실험에서는 생수에서 플라나리아의 운동성을 측정하 고, 니코틴 또는 글리시리진이 처리된 생수에서 5분 동안 배 양한 후 다시 생수로 옮겨서 운동성을 측정하였다. 플라나 리아의 발작 형태는 운동성 측정과 함께 5분 동안 관찰하였 으며, c-like, snake-like, screw-like, head-bop 형태의 4가지로 분류하여 측정하였다[33, 34] (Fig. 1).
Fig. 1.
Representative photographs of the planarians seizure-like behaviors. Seizure-like behavior was classified by 4 types (A) snake-like, (B) screw-like, (C) c-like, and (D) head-bop in nicotine exposed planarian.
Download Original Figure
플라나리아 세포의 산화적 스트레스(oxidative stress) 반응 측정을 위한 샘플 처리
플라나리아는 100 mM potassium phosphate buffer(pH 7.0) 를 이용하여 균질화(homogenization)하고, 4℃에서 5분 동안 16,000 × g에서 원심분리 하였다. 그 후 상층액만을 취하여 coomassie(Bradford) protein assay kit(Thermo, Rockford, IL, USA)를 이용해 단백질 농도를 측정하고, 동일한 농도로 희 석하여 실험에 사용하였다.
Catalase assay(CAT)
과산화수소분해효소(catalase)의 활성을 측정하기 위하여, 준비된 샘플에 과산화수소(H2O2)를 넣어준 후 5% potassium dichromate와 acetic acid(1:3 ratio) 용액으로 반응을 종료시키 고, 100℃에서 10분간 가열하고 상온에서 식혀준 후, microplate reader(BioTek Instruments, Inc. Winooski, VT, USA)를 사용하여 570 nm에서 광학밀도(absorbance)를 측정하였다.
Superoxide dismutase assay(SOD)
클로로포름(chloroform), 100% 에탄올, 샘플이 혼합된 용액 을 4℃에서 5분 동안 1,500 × g로 원심분리를 한 후, 샘플의 상층액과 0.052 M sodium pyrophosphate buffer(pH 8.3), 186 μM phenazine methosulfate(PMS), 300 μM nitroblue tetrazolium(NBT), 780 μM nicotinamide adenine dinucleotide (NADH) reduced disodium salt를 이용하여 30℃에서 90초 반응을 시킨 후, acetic acid로 반응을 종료하였다. 그 다음, n-butanol을 추가해준 후, 4℃에서 10분 동안 1,500 × g로 원심 분리를 한 뒤, butanol 층만 분리하여 microplate reader 를 이용하여 560 nm에서 광학 밀도(absorbance)를 측정하 였다.
Lipid hydroperoxides assay(LH)
자유 라디칼에 의한 세포 손상 반응을 확인하기 위하여, 반응 시약인 FOX reagent(4 mM butylated hydroxytoluene [BHT], 250 μM ferrous ammonium sulfate hexahydrate, 100 μM xylenol orange)를 90% methanol과 10% sulfuric acid (250 mM)에 녹인 후 준비된 샘플과 혼합하여 상온에서 30 분 동안 반응을 시켰다. 반응 후, microplate reader를 이용하 여 560 nm에서 absorbance의 광학 밀도를 측정하였다.
Reactive oxygen species(ROS) 측정
활성산소종 생성 수준을 측정하기 위하여 준비된 샘플과 1 μM carboxy-DCFDA(Invitrogen, Eugene, OR, USA)를 37℃에서 20분 동안 반응시킨 후, multimode microplate reader(SparkTM 10M, Tekan, Männedorf, Switzerland)를 이 용하여 485 nm(excitation)와 520 nm(emission) 파장대에서 형광 강도(fluorescence intensity)를 측정하였다.
Glutathione assay
준비된 샘플과 5% trichloroacetic acid(TCA) 용액을 tube 에 넣고 섞어준 후 4℃에서 5분 동안 1,500 × g 원심 분리 를 하였다. 그 다음 상층액과 300 mM potassium phosphate buffer(pH 7.0), 10 mM 5,5’-dithiobis-2-nitrobenzoic acid (DTNB)를 섞어준 후, microplate reader를 이용하여 412 nm 에서의 광학 밀도(absorbance)를 측정하였다.
통계분석 및 유의성 검정
실험 결과는 Mean ± S.E.M.으로 나타내었으며, 각 데이터 의 통계분석은 GraphPad PRISM5 software(San Diego, CA, USA)를 이용하여 one-way ANOVA 분석하고, Tukey test와 Dunnett test로 검정하여, *p<0.05, **p<0.01, ***p<0.001 경우 를 유의성이 있는 것으로 판단하였다.
Results and Discussion
니코틴이 플라나리아의 운동과 발작 행동에 미치는 영향
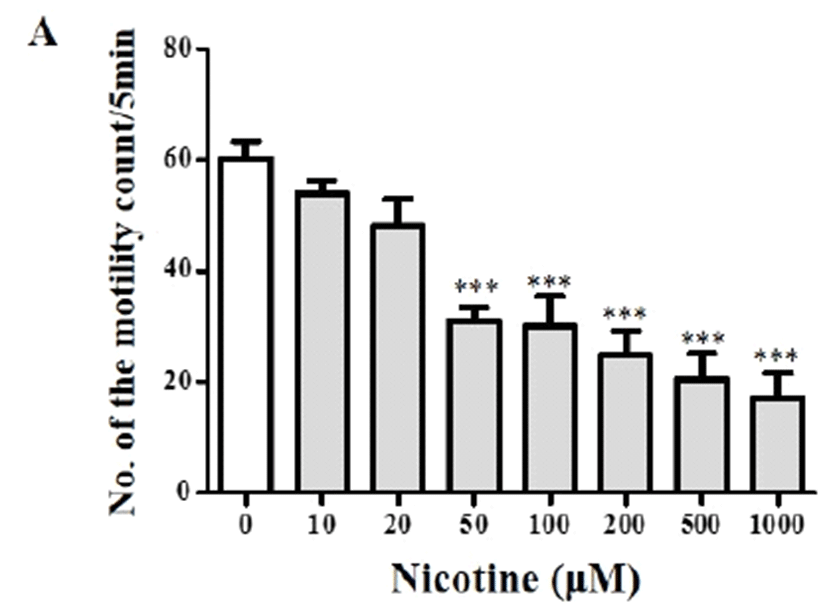
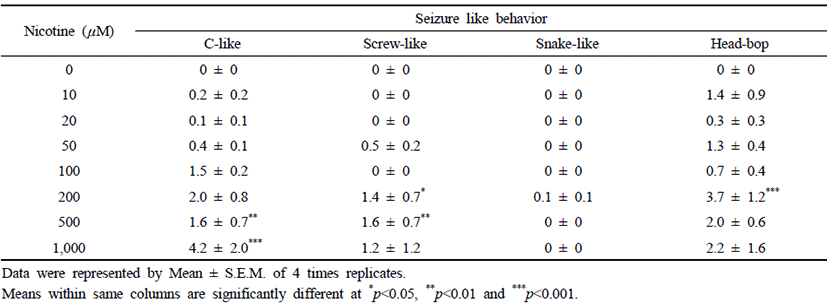
니코틴이 플라나리아의 운동에 미치는 영향을 조사하기 위하여 다양한 농도의 니코틴(0–1,000 μM)이 처리된 생수 에 플라나리아를 5분간 배양한 뒤, 다시 생수로 옮겨 5분 동 안 운동수와 발작 행동 빈도수를 각각 조사하였다(Fig. 2 & Table 1). 플라나리아의 운동수를 측정한 결과, 니코틴 처리 농도가 증가할수록 운동수는 점차 감소하기 시작하였는데, 0부터 20 μM 처리에서는 통계적 유의차는 보이지 않았으나, 50 μM의 처리 농도 이상부터 운동수가 평균 31–60회 이하 로 감소하여 무처리군에 비하여 약 50% 이상 감소하였다 (p<0.001; Fig. 2). 니코틴에 의한 발작 행동은 무처리군에서 는 나타나지 않았으나, 10 또는 20 μM 농도에서부터 c-like 와 head-bop 형태의 행동이 관찰되기 시작하였고, 니코틴 농 도가 증가할수록 screw-like와 snake-like 발작 행동도 보이 기 시작하였다(Table 1). 전체적으로 니코틴의 처리 농도가 증가할수록 발작행동의 빈도수는 무처리군과 비교하여 유의 적으로 증가하는 것을 알 수 있었다(p<0.05, p<0.01, p<0.001; Table 1).
Fig. 2.
Effect of nicotine on motility of planarian. Number of the motility (A) was counted in planarians after exposing of different concentrations of nicotine. Data were presented by Mean ± S.E.M. of 4 times replicates. ***p<0.001 indicate significant differences.
Download Original Figure
이전 연구들에서도 니코틴 처리에 따른 운동성 변화 결과 들이 보고되었는데, 상기 결과(Fig. 2)에서는 10 μM 처리 농 도부터 농도 의존성 운동성 감소가 나타났으나, Rawls 등 [35]은 10 μM에서는 다소 증가된 운동성을 보이다가 0.3– 10 mM 처리농도에서 감소하는 것으로 보고하였다. 그러나 Pagán 등[36]의 결과에서는 Fig. 2의 결과와 마찬가지로 니 코틴 농도가 증가함에 따라 운동성 감소가 나타난 바, 각 실 험 방법 및 환경에 따른 미세한 차이가 반영되어 결과 간 차이가 있는 것으로 보인다. 결과적으로 플라나리아에 급성 니코틴 노출은 처리 농도가 증가함에 따라 운동성을 둔화시 키고, 반대로 발작행동은 니코틴 처리 농도가 증가할수록 빈도수와 이상 형태가 증가하는 것을 알 수 있었다(Table 1). Pagán 등[36]의 연구에서도 0.1 mM 니코틴 처리에서 headbops, head-swings, tail twists 및 corkscrews와 같은 발작 행 동이 유발됨과 동시에 니코틴 처리 농도가 증가할수록 c-형 태의 과민반응(c-shape hyperkinesias)이 증가한다고 보고되 어[35], 이번 실험과 일치하는 결과임을 볼 수 있다. 플라나 리아와 동물 간의 니코틴에 대한 민감 반응의 상관관계 여 부는 아직까지 확실하지 않다. 이번 연구에서는 다양한 농 도의 니코틴을 단시간 노출시켜 플라나리아의 운동 형태를 관찰하였으나, 과거 관련 연구들에서 낮은 니코틴 농도를 반복적, 간헐적으로 노출하여 행동 민감성(sensitization)을 유발하였고, 연속적인 니코틴 노출은 내성(tolerance)을 일으 킨다고 보고하였다[37]. 이러한 결과는 쥐[38, 39]와 랫드[40, 41]를 이용한 실험에서도 낮은 복용량의 니코틴에 의해 더 강한 민감 반응이 나타났으며, 이것은 플라나리아에서 관찰 된 효과와 일치하는 결과였다[35]. 따라서 니코틴에 대한 플 라나리아의 운동 형태는 니코틴의 농도, 노출 시간 및 환경 에 의하여 다양하게 나타날 수 있으므로[35], 이에 대한 동 물 행동과의 연관성을 규명하기 위한 추가적인 연구가 더 필요하다고 할 수 있다.
글리시리진이 플라나리아의 운동과 발작에 미치는 영향
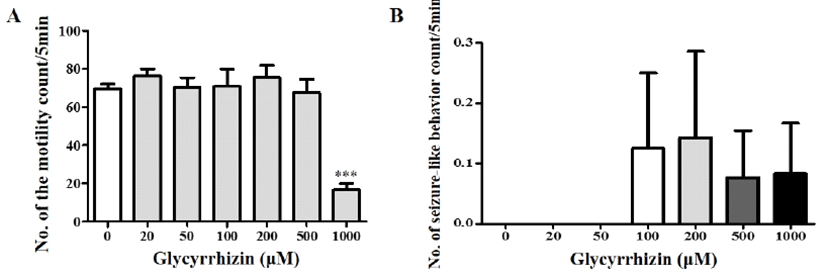
플라나리아의 운동성에 글리시리진이 미치는 영향을 조 사하기 위하여 다양한 농도(0–1,000 μM)의 글리시리진이 포함된 생수에 플라나리아를 5분간 배양한 뒤, 다시 생수로 옮겨 5분 동안 운동수와 발작 행동 빈도수를 각각 측정하였 다(Fig. 3). 이에 운동수를 관찰한 결과, 글리시리진 농도 0– 500 μM에서의 처리 농도별 운동수 차이는 나타나지 않았 다(Fig. 3A). 그러나 글리시리진 1,000 μM에서 운동수는 약 16회로 유의적으로 감소하여 플라나리아의 운동에 영향을 미치는 것을 알 수 있었다(p<0.001; Fig. 3A). 마찬가지로 글리시리진 처리 후 발작 행동 빈도수를 확인한 결과, 글리 시리진 농도 0–50 μM에서는 발작 행동이 관찰되지 않았으 며, 100–1,000 μM 농도 처리에서 평균 0.1회의 head-bop 형 태 발작 행동만이 관찰되었고, 이에 대한 통계적 유의차는 나타나지 않았다(Fig. 3B).
Fig. 3.
Effects of glycyrrhizin on motility and seizure-like behavior of planarians. Number of the motility count (A) and seizure-like behavior (only head-bop; B) were counted in planarians after exposing of different concentrations of glycyrrhizin. Data were presented by Mean ± S.E.M. of 4 times replicates. ***p<0.001 indicates significant differences.
Download Original Figure
글리시리진은 감초 뿌리(licorice)의 주요 활성 성분이며, anti-inflammatory, anti-virus, anti-tumor, antioxidant 및 간 보 호 활성과 같은 수많은 약리학적 효과가 있다고 알려져 있 다[30, 42]. 또한 중금속 해독에 관여하는 효소 방출을 유도 하여 간세포의 산화적 스트레스를 막는 것으로 보고되었다 [30]. 마우스에 0.04%–0.3%의 disodium glycyrrhizinate를 장 기간 급여하였을 때 유해한 영향은 나타나지 않았으나[43], 고농도의 글리시리진은 고혈압, 저칼륨혈증, 부종 등의 독 성 징후를 나타낼 수 있다고 하였다[44]. 본 실험에서는 100 μM 이상의 농도에서부터 플라나리아의 발작행동이 미약하 게 관찰되었으나, 처리 농도 500 μM까지 플라나리아 운동 성에는 영향을 미치지 않는 것을 확인할 수 있었다(Fig. 3).
니코틴에 노출된 플라나리아에 글리시리진 처리가 미치는 영향
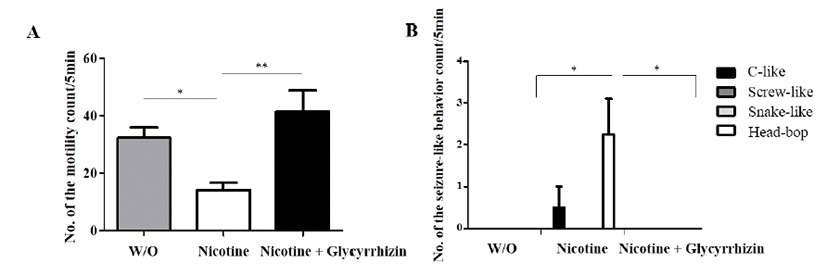
이번 실험에서는 니코틴에 노출된 플라나리아를 글리시 리진 처리를 하였을 때 플라나리아의 운동에 미치는 영향을 관찰하였다. 플라나리아를 10 μM 니코틴이 처리된 생수에 5분 배양하고, 50 μM 글리시리진이 처리된 생수에 옮겨 5 분 배양한 후, 다시 생수로 옮겨 5분 동안 운동수와 발작 행 동 빈도수를 측정하였다(Fig. 4). 그 결과, 니코틴과 글리시 리진을 처리하지 않은 대조군(W/O)에서는 평균 32회, 니코 틴만을 처리한 그룹에서는 14회의 운동성을 나타내었으며, 니코틴 노출 후 글리시리진을 처리한 그룹의 플라나리아 운동수는 평균 41회로 무처리한 대조군과 차이가 없었다 (Fig. 4A). 또한 발작 행동을 관찰한 결과, 오직 니코틴 처리 그룹에서만 c-like, head-bop의 발작 행동을 확인할 수 있었 다(p<0.05; Fig. 4B).
Fig. 4.
Effects of glycyrrhizin on motility and seizure-like behavior in nicotine-exposed planarians. The motility (A) and seizure-like behavior (B) were counted in group of fresh water (W/O), nicotine or glycyrrhizin after nicotine treatment, respectively. Data were presented by Mean ± S.E.M. of 4 times replicates. *p<0.05 and **p<0.01 indicate significant differences.
Download Original Figure
감초는 근래 신경 보호 작용, 항우울제 작용, 불안 완화 효과와 같은 신경약리학적인 특성을 가지고 있음이 밝혀졌 으며[45], glutamate를 이용한 플라나리아의 발작유발실험에 서 감초 추출물(1 μg/mL)을 처리할 경우 발작행동의 억제 가 보고되었다[31]. 본 실험에서는 단시간 니코틴에 노출된 플라나리아를 글리시리진이 포함된 생수에 배양하였을 때 니코틴이 단일 처리된 플라나리아에 비하여 정상 운동수로 회복되고, 발작행동이 나타나지 않는 것을 알 수 있었다. 따 라서 글리시리진이 니코틴 급성 노출에 의한 독성 완화에 효과가 있음을 확인되었다.
니코틴에 노출된 플라나리아에 글리시리진 처리가 세포의 산화적 스트레스 반응에 미치는 영향
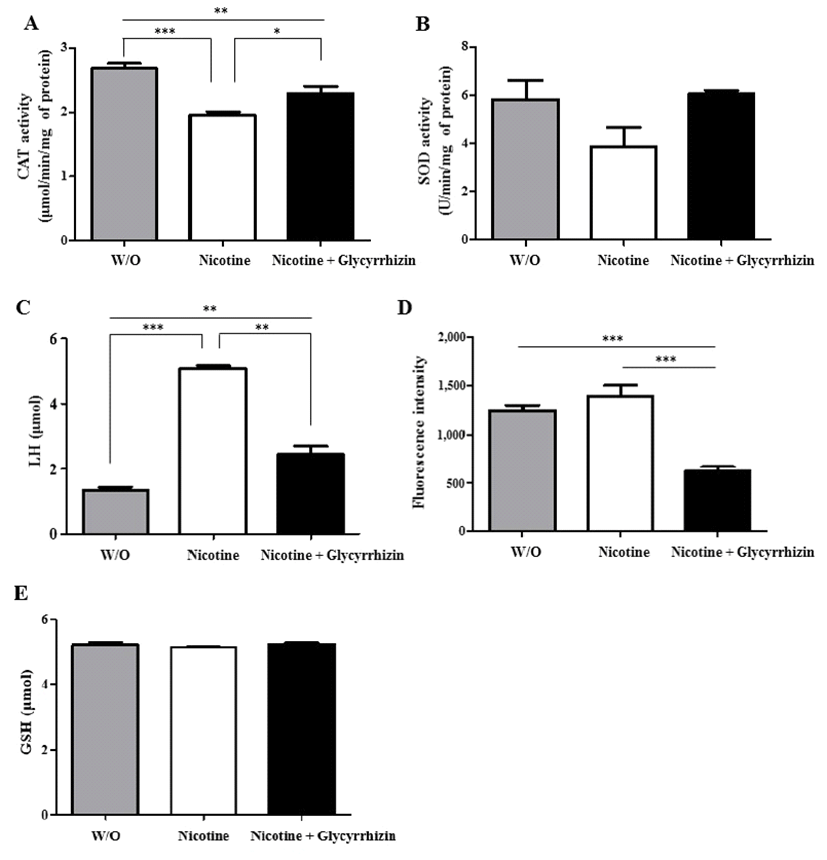
니코틴(1 mM)이 포함된 생수에 플라나리아를 24시간 배 양한 후 글리시리진(50 μM)이 포함된 생수에 옮겨 24시간 동안 추가 배양하였다. 그 후 세포의 산화적 스트레스 반응 을 조사하기 위하여 catalase(CAT), superoxide dismutase (SOD), LH, ROS 및 glutathione(GSH) assay를 각각 실시하 였다(Fig. 5). 그 결과, 과산화수소분해효소(CAT) 활성에서 는 니코틴과 글리시리진이 처리되지 않은 대조군(W/O)과 니코틴 노출 후 글리시리진이 처리된 플라나리아 그룹이 2.68과 2.29의 수치를 보이며, 니코틴 단일 처리 그룹(1.94) 에 비하여 유의성 있게 높은 것을 확인할 수 있었다(p<0.05, p<0.001; Fig. 5A). SOD 활성 비교에서도 대조군(5.81)과 니 코틴 노출 후 글리시리진 처리그룹(6.06)이 니코틴 단일 처 리그룹(3.87)에 비하여 높게 나타났다. 그러나 통계적 유의 차는 확인되지 않았다(Fig. 5B). 자유라디칼에 의한 세포손 상 확인(LH) 실험에서는 니코틴만이 처리된 플라나리아에서 유의적으로 높게 나타나 니코틴에 의한 플라나리아의 산화 적 스트레스가 발생하고, 이는 글리시리진에 의하여 완화된 것을 확인할 수 있었다(p<0.01, p<0.001; Fig. 5C). 마찬가지 로 활성산소종 생성 조사에서도 니코틴에 노출된 플라나리 아에서 높게 나타났으며, 글리시리진에 의한 세포 내 활성산 소종 제거 효과를 알 수 있었다(p<0.001; Fig. 5D). 그러나 GSH 분석에서는 그룹 간 차이가 나타나지 않았다(Fig. 5E). 각각의 실험 결과들을 종합하였을 때, 니코틴이 플라나리아 의 세포 내 산화적 스트레스를 유발하고, 니코틴에 의한 산 화적 스트레스 반응은 글리시리진 처리를 통하여 완화될 수 있는 것을 확인할 수 있었다.
Fig. 5.
Measurement of oxidative stress in planarians after incubation in fresh water (W/O), nicotine or glycyrrhizin after nicotine treatment. The level of (A) catalase (CAT) activity, (B) superoxide dismutase (SOD) activity, (C) lipid hydroperoxides (LH), (D) reactive oxygen species (ROS), and (E) glutathione (GSH) were measured after each treatment. Data were presented by Mean ± S.E.M. of 3 times replicates. *p<0.05, **p<0.01 and ***p<0.001 indicate significant differences.
Download Original Figure
Chen 등[46]은 니코틴과 니코틴 주요 대사산물인 코이틴 (coitine)이 알코올성 지방간을 강화시키고, 대사과정 동안 미 세소체 내 ROS 수준을 증가시킨다고 하였고, Lan 등[47]은 니코틴이 신장(kidney) 세포 내 산화적 스트레스를 증가시켜 podocyte apoptosis를 유발하여 만성 신장질환과 관련이 있 다고 보고하였다. 한편, 랫드에 니코틴과 커큐민(curcumin)을 처리하였을 경우, 간, 폐, 신장에서의 GSH, CAT, SOD 수준 이 니코틴만 처리한 랫드의 수치보다 증가한 것을 확인할 수 있었다[48]. 본 실험에서는 플라나리아에 니코틴을 24시 간 처리한 후 다시 글리시리진을 24시간 동안 처리한 결과, 니코틴에 의한 세포 내 산화적 스트레스가 억제됨을 확인할 수 있었다. 이는 니코틴 중독이나 금단현상 치료를 위하여 글리시리진이 유용하게 이용될 수 있음을 예측할 수 있다.
플라나리아는 주로 재생생물학과 발생생물학 연구에 있 어서 선호되는 동물모델이었으나, 최근 환경독성물질에 대 한 높은 민감성으로 인해 생물학적 분석에 적합한 유기체로 제안되고 있다. 따라서 플라나리아를 이용한 중금속, 제초제 및 다양한 약제에 대한 행동, 형태 변화, 조직 및 세포 DNA 손상 등을 평가하기에 적합하다[49]. 본 연구에서는 플라나 리아를 이용하여 니코틴에 의한 행동 양상을 분석하고, 이 를 완화시키기 위하여 글리시리진을 처리한 결과, 효과적으 로 운동성과 발작행동을 회복시킬 수 있음을 확인하였다. 앞으로 니코틴에 의한 반응에 있어서 동물과 플라나리아의 연관성 확인을 위한 추가 실험이 수행되어야 할 것이다.
Acknowledgement
본 연구를 수행한 Y.J. Kim과 Y.J. Yi는 BK21 Plus 사업 의 지원을 받아 이에 감사드립니다.
References
Mansvelder HD, McGehee DS. Cellular and synaptic mechanisms of nicotine addiction. J Neurobiol 2002;53:606-617.


Francis K. Planaria as a model for the effects of the co-use of alcohol and nicotine [Ph.D. dissertation]. Sudbury (ON): Laurentian University of Sudbury; 2015.
West R, Ussher M, Evans M, Rashid M. Assessing DSM-IV nicotine withdrawal symptoms: a comparison and evaluation of five different scales. Psychopharmacology 2006;184: 619-627.


Butschky MF, Bailey D, Henningfield JE, Pickworth WB. Smoking without nicotine delivery decreases withdrawal in 12-hour abstinent smokers. Pharmacolo Biochem Behav 1995;50:91-96.

Skjei KL, Markou A. Effects of repeated withdrawal episodes, nicotine dose, and duration of nicotine exposure on the severity and duration of nicotine withdrawal in rats. Psychopharmacology 2003;168:280-292.


Damaj MI, Glassco W, Dukat M, Martin BR. Pharmacological characterization of nicotine-induced seizures in mice. J Pharmacol Exp Ther 1999;291:1284-1291.
Cebria F, Kudome T, Nakazawa M, Mineta K, Ikeo K, Kazuho G, Gojobori T, Agata K. The expression of neuralspecific genes reveals the structural and molecular complexity of the planarian central nervous system. Mech dev 2002; 116:199-204.

Park KM, Hwang JK, Shin KM, Kim HS, Song JH. Detoxicating effects of oriental herb extract mixtures on nicotine and dioxin. Korean J Food Sci Technol 2003; 35:980-987.
Corrigall WA, Coen KM, Adamson KL. Self-administered nicotine activates the mesolimbic dopamine system through the ventral tegmental area. Brain Res 1994;653:278-284.

Mereu G, Yoon KWP, Boi V, Gessa GL, Naes L, Westfall TC. Preferential stimulation of ventral tegmental area dopaminergic neurons by nicotine. Eur J Pharmacol 1987;141: 395-399.

Nisell M, Nomikos GG, Svensson TH. Nicotine dependence, midbrain dopamine systems and psychiatric disorders. Pharmacol Toxicol 1995;76:157-162.

Picciotto MR, Zoli M, Rimondini R, Lena C, Marubio LM, Pich EM, Fuxe K, Changeux JP. Acetylcholine receptors containing the β2 subunit are involved in the reinforcing properties of nicotine. Nature 1998;391:173-177.


Quik M, Cox H, Parameswaran N, O'Leary K, Langston JW, Di Monte D. Nicotine reduces levodopa-induced dyskinesias in lesioned monkeys. Ann Neurol 2007;62:588-596.


Izawakatsu M. On the ecology and distribution of freshwater planarians in the Japanese Islands, with special reference to their vertical distribution. Hydrobiol 1965;26:349-408.

Alvarado AS. Planarian regeneration: its end is its beginning. Cell 2006;124:241-245.


Raffa RB. Planaria: a model for drug action and abuse. Boca Raton (FL): CRC Press; 2008.

Ross KG, Currie KW, Pearson BJ, Zayas RM. Nervous system development and regeneration in freshwater planarians. Wiley Interdiscip Rev Dev Biol 2017;6:266.


Eriksson KS, Panula P. Gamma aminobutyric acid in the nervous system of a planarian. J Comp Neurol 1994;345: 528-536.


Gether U, Andersen PH, Larsson OM, Schousboe A. Neurotransmitter transporters: molecular function of important drug targets. Trends Pharmacol Sci 2006;27:375-383.


Isbrucker RA, Burdock GA. Risk and safety assessment on the consumption of Licorice root (Glycyrrhiza sp.), its extract and powder as a food ingredient, with emphasis on the pharmacology and toxicology of glycyrrhizin. Regul Toxicol Pharmacol 2006;46:167-192.


Wang ZY, Nixon DW. Licorice and cancer. Nutr Cancer 2001;39:1-11.


Fenwick GR, Lutomski J, Nieman C. Liquorice, Glycyrrhiza glabra L.—Composition, uses and analysis. Food Chem 1990;38:119-143.

Jang EY, Choe ES, Hwang M, Kim SC, Lee JR, Kim SG, Jeon JP, Buono RJ, Yang CH. Isoliquiritigenin suppresses cocaine-induced extracellular dopamine release in rat brain through GABAB receptor. Eur J Pharmacol 2008;587:124-128.


Rahman S, Sultana S. Chemopreventive activity of glycyrrhizin on lead acetate mediated hepatic oxidative stress and its hyperproliferative activity in Wistar rats. Chem Biol Interact 2006;160:61-69.


Park W, Yoo DM, So JN. Effects of Ukgansan (Yokukansan in Japanese, Yigansan in Chinese) on the locomotor velocity and glutamate-induce paroxysm in planarian. Korean Soc Biotechnol Bioeng 2014;29:67-71.

Raffa RB, Holland LJ, Schulingkamp RJ. Quantitative assessment of dopamine D2 antagonist activity using invertebrate (Planaria) locomotion as a functional endpoint. J Pharmacol Toxicol Methods 2001;45:223-226.

Raffa RB, Desai P. Description and quantification of cocaine withdrawal signs in Planaria. Brain Res 2005;1032:200-202.


Ramakrishnan L, DeSaer C. Carbamazepine inhibits distinct chemoconvulsant-induced seizure-like activity in Dugesia tigrina. Pharmacol Biochem Behav 2011;99:665-670.


Itzhak Y, Martin JL. Effects of cocaine, nicotine, dizocipline and alcohol on mice locomotor activity: cocaine-alcohol cross-sensitization involves upregulation of striatal dopamine transporter binding sites. Brain Res 1999;818:204-211.

Kim HS, Kim KS. Inhibitory effects of ginseng total saponin on nicotine-induced hyperactivity, reverse tolerance and dopamine receptor supersensitivity. Behav Brain Res 1999; 103:55-61.

Domino EF. Nicotine induced behavioral locomotor sensitization. Prog Neuro-Psychopharmacol Biol Psychiatry 2001; 25:59-71.

Villegier AS, Blanc G, Glowinski J, Tassin JP. Transient behavioral sensitization to nicotine becomes long-lasting with monoamine oxidases inhibitors. Pharmacol Biochem Behav 2003;76:267-274.

Sato H, Goto W, Yamamura JI, Kurokawa M, Kageyama S, Takahara T, Watanabe A, Shiraki K. Therapeutic basis of glycyrrhizin on chronic hepatitis B. Antivir Res 1996; 30:171-177.

Kobuke T, Inai K, Nambu S, Ohe K, Takemoto T, Matsuki K, Nishina H, Huang IB, Tokuoka S. Tumorigenicity study of disodium glycyrrhizinate administered orally to mice. Food Chem Toxicol 1985;23:979-983.

Carmines EL, Lemus R, Gaworski CL. Toxicologic evaluation of licorice extract as a cigarette ingredient. Food Chem Nicotine-induced behavioral disturbance on D. japonica 29 Toxicol 2005;43:1303-1322.


Zhao ZL, Kim SC, Liu HF, Wu YY, Li LB, Wang YH, Jiao Y, Fan Y, Lee CW, Lee BH, Cho IJ, Yang CH, Zhao RJ. Blockade of nicotine sensitization by methanol extracts of Glycyrrhizae radix mediated via antagonism of accumbal oxidative stress. BMC Complement Altern Med 2017;17:493.



Chen X, Owoseni E, Salamat J, Cederbaum AI, Lu Y. Nicotine enhances alcoholic fatty liver in mice: role of CYP2A5. Arch Biochem Biophys 2018;657:65-73.


Kalpana C, Menon VP. Modulatory effects of curcumin on lipid peroxidation and antioxidant status during nicotineinduced toxicity. Pol J Pharmacol 2004;56:581-586.
Zhang HC, Shi CY, Sun LQ, Wang F, Chen GW. Toxic effects of ionic liquid 1-octyl-3-methylimidazolium bromide on the antioxidant defense system of freshwater planarian, Dugesia japonica. Toxicol Ind Health 2016;32:1675-1683.