Introduction
현대인들은 평균 수명이 늘어났고 예전과 달리 질병이 있음에도 불구하고 장기간 생존하는 사람들이 많아지면서 건강에 대한 관심이 높아지고 있다. 환경과 식생활의 변화, 흡연과 음주, 과로와 스트레스로 인해 면역력이 떨어지고 이로 인해 대상포진, 알레르기, 과민성대장증후군, 고혈압과 당뇨와 같은 생활습관병에 시달리고 있어 면역증진에 대한 관심과 필요성이 연령, 성별 구분 없이 증대되고 있다.
면 역 이 란 인 체 내 의 자 기 ( s e l f ) 와 비 자 기 ( n o n - self)를 구별하여 인체 내에서 자연적으로 발생하거나 외부에서 들어온 유해 물질을 인지한 후 제거하여 신체의 항상성(homeostasis)을 유지시키는 반응을 뜻한다[1]. 면역은 크게 항원 비특이적인 방어기작인 선천성면역과 항원 특이적인 방어기작인 후천성 면역으로 나눌 수 있다. 선천성 면역은 외부로부터 항원이 들어오기 전에 이미 존재하는 면역체계로 외부로부터 침입한 미생물에 즉각 반응하며 동일한 항원에 대한 반복적 노출에 대해 일정한 수준의 면역반응을 유도한다[2]. 반면에 후천성 면역은 항원이 침입하게 되면, 면역반응을 유도한 항원에 대해서만 나타나는 특이적인 기억면역을 획득하여 동일 항원에 대한 반복적 노출에 대해 처음보다 빠르고 강력한 면역반응을 유도하는 특징을 가지고 있다[3].
그 중 선천성 면역 반응에 관여하는 면역세포들은 병원체 연관성 분자 유형(pathogen-associated molecular p a t t e r n ) 을 인식하는 수 용 체 ( p a t t e r n - r e c o g n i t i o n receptor)을 인식하여 활성화되는데 이들 수용체들의 활성화는 선천성 면역 반응을 매개할 뿐만 아니라, 그 이후에 일어나는 후천성 면역을 유도하는 역할도 한다. 또 한 , 선천성 면역 관련 수용체들의 과도한 활성화는 각종 만성 염증성 질환 또는 자가 면역질환을 일으키는 원인으로서 작용하기 때문에 이들 수용체들을 적절하게 조절하는 것은 병원균에 대한 방어뿐만 아니라 면역과 염증 질환 발병 억제에 필수적이다[4, 5]. 면역세포에는 대식세포, 단핵구, 백혈구 및 비만세포 등이 있으며,대식세포는 휴지상태에는 면역반응의 여러 자극에 의해 활성화되어 세포독성 단백질을 분해하고, 인체 내에서 우수한 항원제시 세포로 작용한다. 그리고 대식세포는 모든 조직에 존재하며 체내 유입된 염증의 원인을 가장 먼저 인식한 후 그것에 대항하는 면역정보를 림프구에 전달하고 염증매개물질을 생성하여 다른 면역세포의 활성화 및 주화성을 유도시켜 염증원인을 제거하고 염증부위를 복구시키는 등 염증과정에 필수적인 역할을 수행한다[6, 7 ] . 대식세포는 내독소로 잘 알려진 그람 음성세균의 세포벽 성분인 lipopolysaccharide(LPS) 처리 시 proinflammatory cytokine인 tumor necrosis factora l p h a ( T N F - α ) , i n t e r l e u k i n - 1 b e t a ( I L - 1 β ) 및 interleukin-6(IL-6)와 염증성 효소인 inducible nitric oxide synthase(iNOS) 및 cyclooxygenase-2(COX- 2)를 발현시킨다[3, 8].
현재 면역기능을 개선하는 것은 다른 어떤 건강기능보다도 영 양 상 태 에 영 향 을 많 이 받 기 때 문 에 관 련 된 제품 개발이 빠르게 이루어져 시중에 다양한 상품이 판매되고 있으며, 연구도 지속적으로 이루어지고 있다. 식약처의 ‘건강기능식품공전’에 서 는 면 역 기 능 에 도 움 을 주는 건강기능성 원료를 고시형과 개별인정형으로 구분하고 있으며, 고시형은 인삼, 홍삼, 알콕시글리세롤을 함유한 상어간유, 그리고 알로에겔이 있다. 개별인정형으로는 게르마늄효모, 금사상황버섯, 클로렐라, 표고버섯균사체, L-글루타민, 다래추출물, Lactobacillus plantarum 등이 있다. 천연물 소재가 가지고 있는 면역증진 기능성에 관한 연구는 이미 많이 보고되어 있는데, 최근에 발표된 바에 따르면 도라지 추출물이 마우스 비장세포의 증식과 대식세포의 활성화를 유도함으로써 면역기능을 증강시킨다는 연구 결과가 발표되었다[9]. 그리고 흑마늘 추출물이 마우스 비 장 세 포 에 서 T 림 프 구 의 T h 1 세 포 와 T h 2 세포를 활성화시켜 면역계의 세포성 면역과 체액성 면역반응을 활성화하여 면역조절에 관여한다는 보고도 있으며[10], 표고버섯(Letino edodes)의 letinan과 잎새버섯의 grifolan 등과 같은 polysaccharide와 polysaccharide-peptide 복합체, 단백질 등이 뛰어난 항암성과 면역 활성 효과를 나타낸다고 밝혀진 바 있다[11, 12]. 또한 산채류 중 천년초에서 우수한 면역계를 자극하는 점질 다당을 상업용 효소와 에탄올의 침전을 이용해 분리하여 다양한 면역 활성능을 평가하여 보고한 사례도 있다[13].
따라서 본 연구에서는 우리나라 국민들이 자주 섭취하고 있 는 식품인 다빈도 식 품 중에서 면역활성에 도움을 주는 소재를 탐색하여 농산물의 소비촉진 및 부가가치를 높이고자 in vitro상에서 면역세포를 이용하여 세포증식능 및 활성물질 생성량 등을 측정하였다.
Materials and Methods
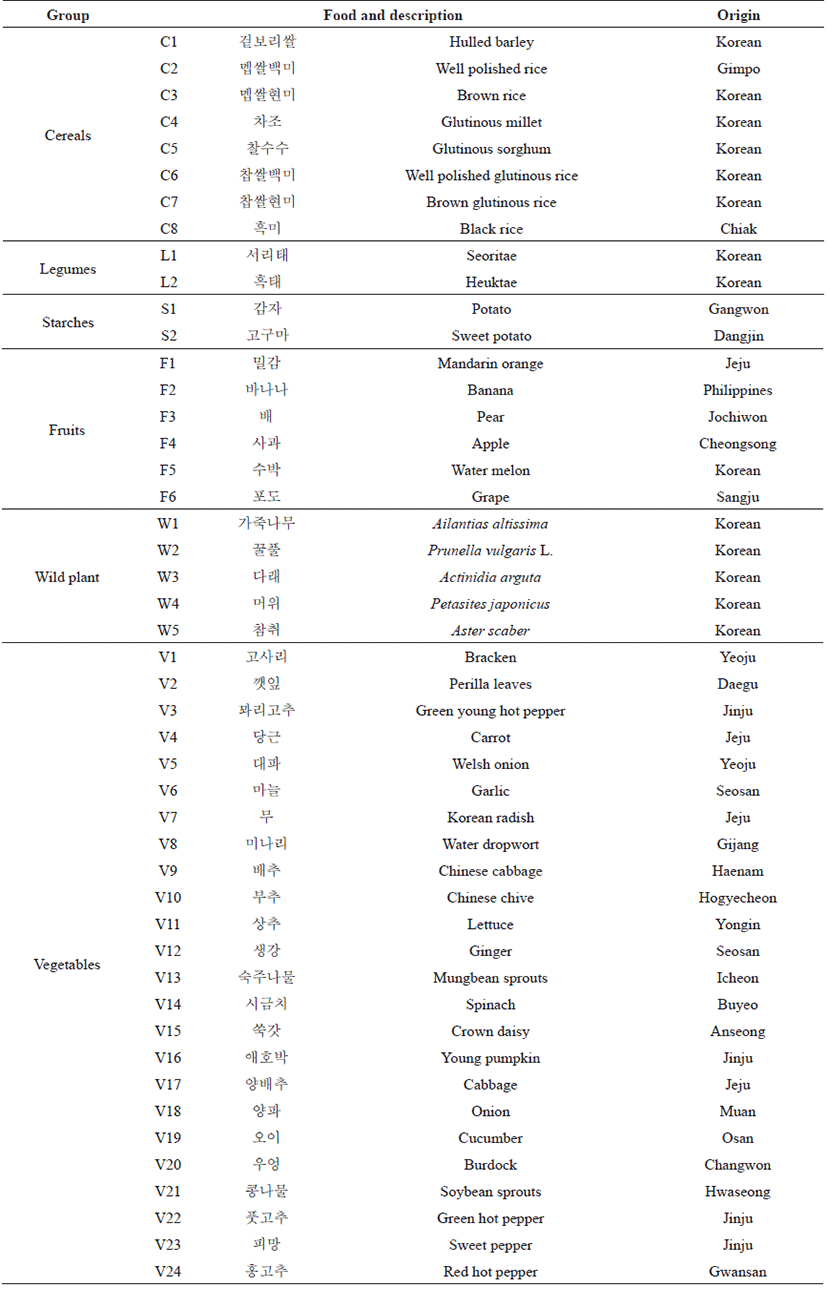
본 실험에 사용된 식물소재는 2010년 국민건강영양조사 [ 1 4 ] 에 서 보고된 3 0 빈 도 이 상 식 품 중 4 2 순 위 내 식 품 들 과 선 행 연 구 [ 1 5 ] 를 통 해 선 발 된 면 역 활 성 우수 소재로 산채류 5종을 포함하여 총 47종을 가지고 수행하였다. 모든 시료는 대형마트에서 구입하였으며, Table 1에 사용 시료명과 생산지 정보를 제시하였다. 수분함량이 10% 이하로 낮은 곡류 8종과 두류 2종은 생시료를 그대로 분쇄하여 사용하였고, 수분함량이 높은 과일류 6종, 전분류 2종, 채소류 24종 및 산채류 5종은 동결 건조기(Ilshin Lab Co., Korea)를 이용하여 동결 건조 과정(5-7 days, 20 torr, rack temp. -45℃, trap temp. -70℃)을 거친 후 분쇄하여 사용하였다.
동결건조 분말시료를 일정량 칭량한 후 그 중량의 10배에 해 당 하 는 양 만 큼 7 0 % 에 탄 올 을 첨 가 하 여 상온에서 2 4 시 간 동 안 1 7 0 r p m 속도로 교 반 추 출 기 ( S K - 7 1 , J e i o t e c h , K o r e a ) 를 이용하여 추출하였다. 상층액은 모으고 잔여물은 처음에 사용한 만큼의 70% 에탄올을 다시 첨가하여 처음 단계를 반복하는 과정을 거쳐 2회 추출한 것을 모아 여과지(No. 6, Advantec, Japan)로 여과한 다 음 , 회 전 진 공 농 축 기 ( C C A - 1 1 0 , E Y E L A , Japan)를 이용하여 용매를 제거하며 농축하였고, 다음의 조건(5-7 days, 20 torr, rack temp. -45℃, trap temp. - 7 0 ℃ ) 에 서 동결건조하였다. 이렇게 얻어진 에탄올 추출물의 건조분말은 실험을 시작하기 전까지 -70℃ deep freezer에 보관하였다.
본 연구에서 사용한 RAW-Blue™ 세포(InvivoGen, USA) 는 1 0 % f e t a l b o v i n e s e r u m ( F B S , G i b c o - BRL, USA)과 1% penicillin-streptomycin(Gibco- BRL, USA)을 포함한 Dulbecco’s Modified Eagle Medium(DMEM, Gibco-BRL, USA) 배지를 이용하여 37℃, 5% CO2 조건에서 배양하였다. 계대는 2일에 한 번씩 시행하였으며, RAW-Blue™ 세포를 활성화시키기 위해 주 1회는 Zeocin™(InvivoGen, USA)이 첨가된 D M E M 배 지 를 사 용 하 여 배 양 하 였 다 . 양성대조군은 lipopolysaccharide(LPS, Escherichia coli O11:B4, Sigma Chemical Co., USA) 100 ng/mL의 농도를 처리한 것으로 사용하였다.
대식세포의 증식능은 3-(4,5-dimethylthiazole-2- yl)-2,5-diphenyl-tetrazolium bromide(MTT, Sigma- Aldrich Co., USA) 환원 방법을 이용하여 측정하였다[16]. RAW-Blue™ 세포는 1 × 105 cell/mL의 농도로 96 well plate에 분주하였고, 24시간 동안 배양한 후 50, 100, 500 μg/mL 농도의 시료 추출물을 처리하였으며, 대조군에는 배지를 동량으로 처리하였다. 각 plate는 37℃, 5% CO2 조건에서 24시간 배양하여 MTT assay를 수행하였다. 배양 완료 후 PBS(Gibco, USA)를 이용하여 5 mg/mL 농도로 제조한 M T T 용액을 각 w e l l 에 2 0 0 μL씩 첨가하여 알루미늄 호일로 빛을 차단한 상태에서 4시간 동안 다시 배양하여 MTT가 환원되도록 하였다. 배양 후 배지를 제거하고 DMSO(Dimethyl sulfoxide, Sigma Chemical Co., USA) 150 μL를 각 well에 첨가하여 생성된 불용성의 formazan 결정을 용해시킨 뒤 microplate reader(SpectraMax M2, USA)로 540 nm에서 흡광도를 측정하였다. 세포 증식률은 각각 시료의 흡광도를 대조군의 흡광도에 대한 백분율(%)로 나타내었다.
세포 증식률(%) = (시료의 흡광도값 / Blank의 흡광도값) × 100
대 식 세 포 가 활 성 화 되 어 나 타 나 는 면 역 반 응 은 주로 NF-κB/AP-1 pathway 전사인자 활성화 측정을 통해 알아보았다[17]. 본 실험에 사용된 대식세포는 NF-κB/ AP-1 reporter cell line(RAW-Blue™ cells, InvivoGen, USA)으로 m o u s e RAW 2 6 4 . 7 m a c r o p h a g e s 에 서 유 래 된 세 포 로 N F - κ B / A P - 1 - i n d u c i b l e S E A P reporter 유전자를 가지고 있어 면역반응에 의해 자극되면 활성화되어 지시약(Quanti blue)에 의해 색이 분홍색에서 파란색 계열로 변화한 것으로 활성화 여부를 판단할 수 있다. RAW-Blue™ 세포는 1 × 105 cell/mL의 농도로 9 6 w e l l p l a t e 에 분주하여 24시간 동안 배양하였고, 그 다음 100 μg/mL 농도의 시료 추출물을 처리하여 다시 24시간 배양하였다. 그리고 나서 상층액 20 μL와 Quanti blue(InvivoGen, USA) 시약 200 μL를 혼합하여 암실에서 10분 반응시킨 후 microplate reader를 이용하여 650 nm에서 흡광도를 측정하여 NF-κB 활성화 정도를 분석하였다.
식물 추출물에 의한 면역증강 기능성을 확인하기 위하여 R A W - B l u e ™ 세 포 의 배 양 상층액을 취 하 여 N O 의 생성량을 측정하였다[18]. 먼저 RAW-Blue™ 세포를 1 × 105 cell/mL의 농도로 96 well plate에 분주하여 24시간 배양 시킨 후 100 μg/mL 농도의 시료 추출물을 처리하여 다시 24시간 동안 배양하여 상층액을 얻었다. 이 상층액 50 μL와 Griess reagent(Promega, USA) Ⅰ(Sulfanilamide solution)과 Ⅱ(NED solution)를 동량으로 섞어 제조한 시약 100 μL를 혼합하여 상온에서 10분 반응시킨 후 microplate reader를 이용하여 540 nm에서 흡광도를 측정하였다. N i t r i c o x i d e 의 농도는 아질산나트륨의 표준곡선을 이용하여 계산하였다.
대 식 세 포 가 활 성 화 되 면 분 비 되 는 세 포 활 성 물 질 ( c y t o k i n e ) 의 생 성 량 을 알 아 보 기 위 하 여 R A W - B l u e ™ 세 포 와 식 물 소 재 를 함 께 처 리 한 후 얻 은 배 양 액 으 로 부 터 사 이 토 카 인 ( T N F - α 와 I L - 1 β ) 생성량을 측정하였다. 먼저 R A W - B l u e ™ 세포를 1 × 105 cell/mL의 농도로 96 well plate에 분주하여 24시간 배양하였고, 그 다음 100 μg/mL 농도의 시료 추출물을 처리하여 다시 24시간 배양하였다. 그리고 나서 상층액만을 취하여 효소결합면역흡착검사(enzymelinked immumosorbent assay, ELISA)를 이용한 ELISA kit(ebioscience, USA)로 사이토카인 함량을 측정하였다. 사이토카인(TNF-α와 I L - 1 β ) 의 항체가 코팅되어 있는 각각의 well plate에 상층액 시료 100 μL를 넣어 상온에서 2시간 반응시킨 후, 상층액을 제거하고 PBS와 Tween 20(Sigma Chemical Co., USA)을 섞어 만든 washing buffer로 5회 이상 세척하였다. Detection antibody 용액을 넣어 항체와 반응시킨 후, Avidin과 결합된 Horseradish Peroxidase(HRP) 효소를 넣어 상온에서 15분 반응시켰다. 이 후, HRP 효소에 대한 기질로 TMB 용액을 넣어 반응시켜 색상의 변화를 확인하였다. 시료에 사이토카인이 생성되어 존재하면 색상의 변화가 나타나므로, 이 변화를 통해 사이토카인(TNF-α와 IL- 1β) 생성량을 측정하였다. Stop solution(H2SO4)을 넣어 HRP 효소와 TMB 기질의 반응을 종결시킨 후, microplate reader를 이용하여 450 nm에서 흡광도를 측정하였다.
Results
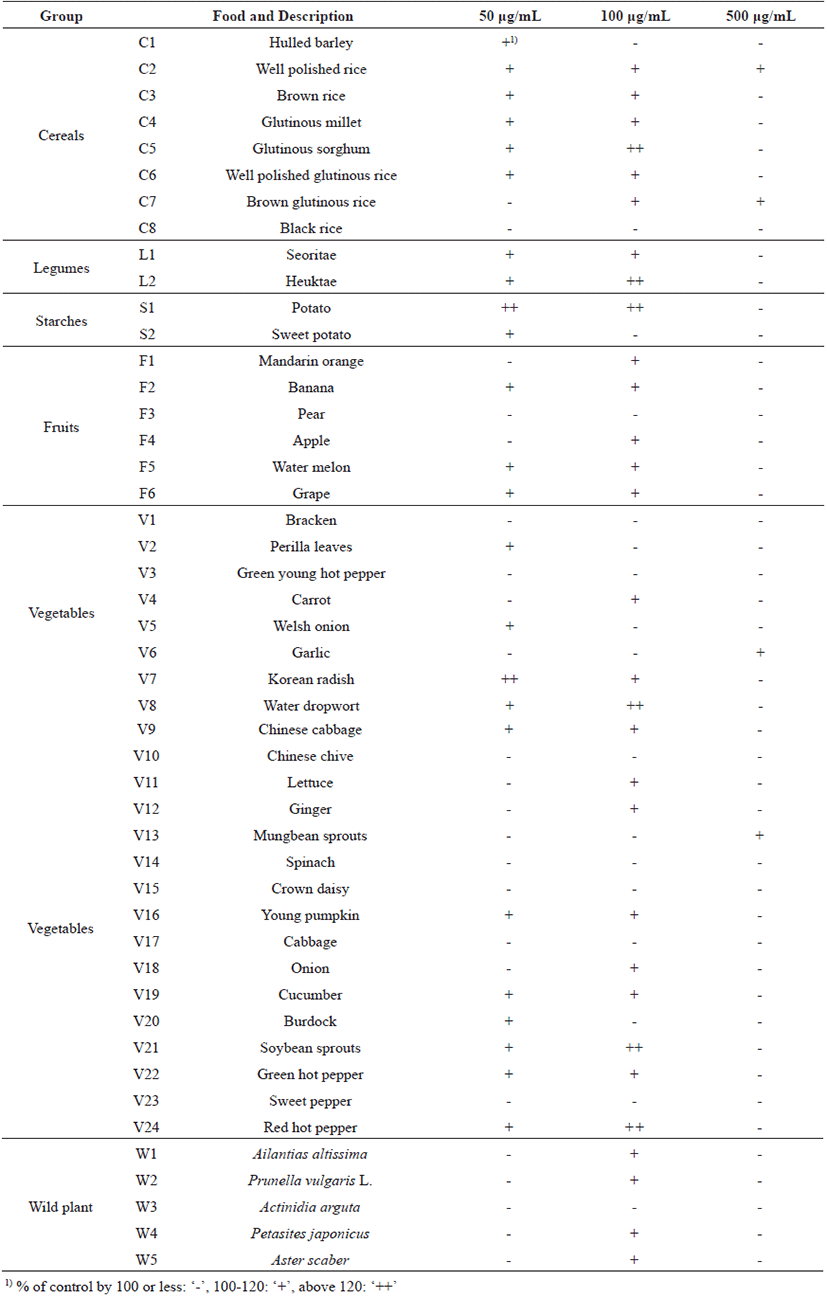
식물자원 중 면역활성 우수 소재를 발굴하기 위하여 총 47종을 가지고 대식세포 증식능을 평가하였다. 각 시료들은 70% 에탄올 용매로 추출한 것을 사용하여 농도를 각각 50, 100, 그리고 500 μg/mL로 대식세포에 처리하여 세포증식능을 살펴보았다(Table 2).
곡류군에서는 겉보리쌀과 멥쌀백미 추출물 시료를 제외한 모든 시료에서 100 μg/mL 농도에서 가장 높은 증식능을 보였으며 전분류 중 감자 추출물은 고구마에 비해 모든 농도에서 높은 증식능을 보였고, 두류군과 과일류군에서는 배를 제외한 시료가 100 μg/mL에서 가장 높은 증식을 보였다. 채소류군에서는 마늘, 숙주나물 그리고 시금치 추출물에서 농도 의존적으로 증식능이 점차 증가하였고, 산채류군의 5종 추출물 중 다래를 제외하고 100 μg/mL 농도에서 가장 높은 증식을 보였다. 결론적으로 총 47종 시료 중 감자, 붉은 고추, 흑태, 미나리, 찰수수 및 콩나물 순으로 100 μg/mL 농도로 처리하였을 때 높은 세포증식 효과를 보였으며, 500 μg/mL 농도로 처리한 경우에 멥쌀백미, 찹쌀현미 , 마늘 그리고 숙주나물 등 4종을 제외하고 대부분이 세포증식율이 100% 미만을 나타내어 세포 독성을 가지고 있을 것으로 사료되어(data n o t shown) 가장 높은 세포증식 효과를 나타낸 100 μg/mL 농도를 선택하여 다음 실험을 진행하였다.
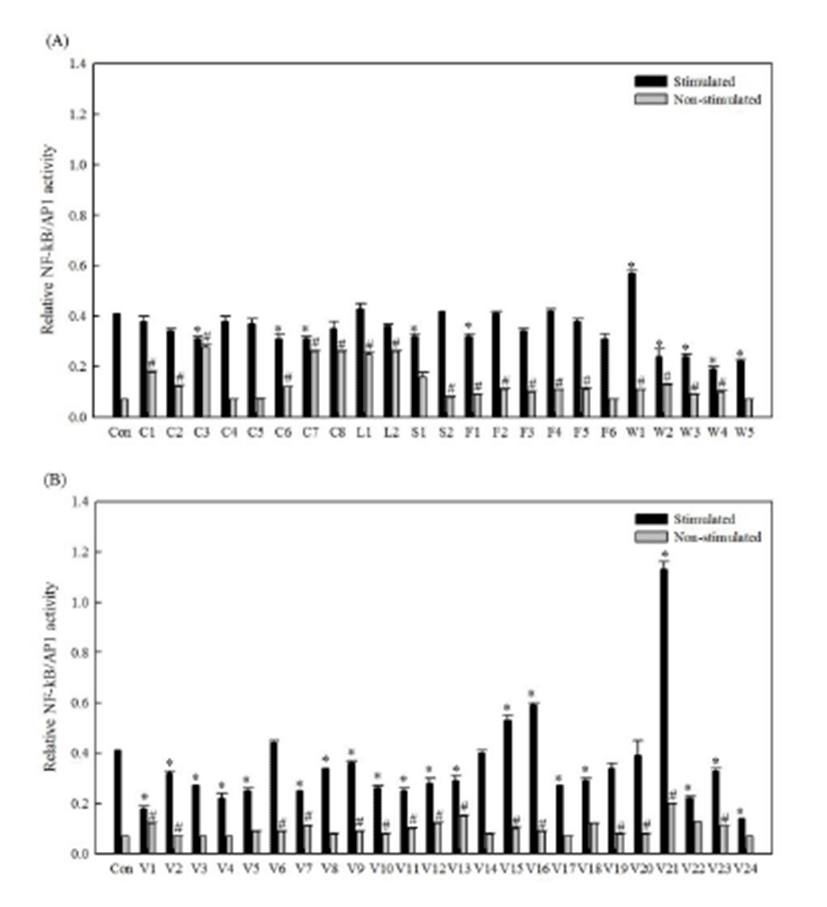
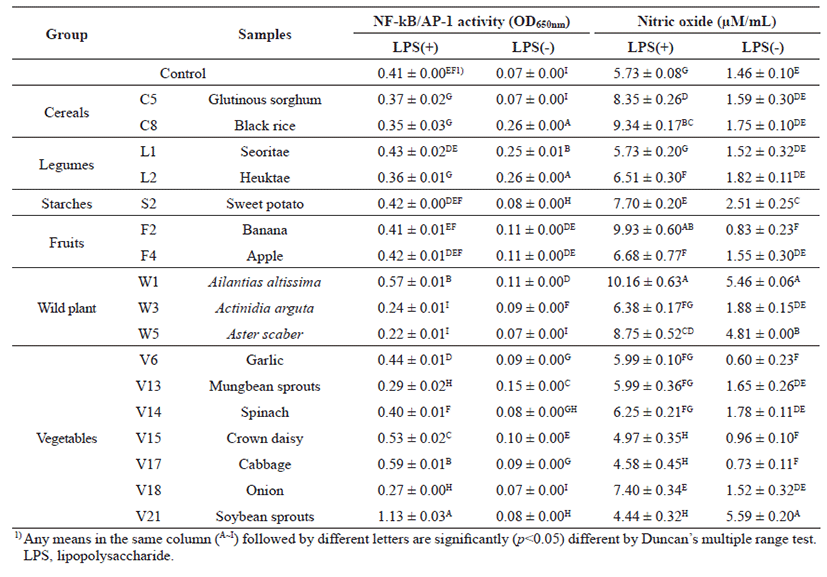
대 식 세 포 에 서 N F - κ B 는 c y t o k i n e s 와 lipopolysaccharide(LPS)와 같은 toll like receptor l i g a n d s 를 포 함 한 다 양 한 자 극 인 자 들 에 노 출 되 면 IκB(inhibitor of NF-κB)의 인산화에 의하여 빠르게 활성화되어 핵 안으로 이동됨으로써 면역반응에 관여하는 유전자들의 t r a n s c r i p t i o n a l a c t i v a t o r 로 작용하는 것으로 알려져 있다[19]. 또한 AP-1은 NF-κB와 함께 대식세포의 활성화에 관여하는 주요 전사조절인자이다. 따 라 서 N F - k B / A P - 1 에 의 한 유 전 자 발 현 조절은 대식세포 활성화를 평가하는데 보편적으로 활용된다. 47종의 추출물 시료와 대조군(LPS 처리와 비처리)을 RAW-Blue™ 세포에 처리하여 발현되는 NF-κB/AP1 전사인자의 활성을 측정한 결과는 Fig. 1에 나타내었다. 각 시료들과 대조군은 LPS를 100 ng/mL농도로 처리한 것과 처리하지 않은 것으로 구분하여 비교하였다. LPS를 처리한 경우 에탄올 추출물 시료에 의해 유도된 NF-κB/AP1 전사인자 활성화 정도를 비교한 결과 곡류군에서는 8종 시료 모두가 시료를 처리하지 않은 대조군보다 활성이 낮았고, 전분류 중 고구마 추출물은 감자에 비해 약간 높은 활성을 보였는데, 두류군의 서리태와 함께 대조군과 유사 활성을 나타냈다. 과일류군에서는 바나나와 사과 추출물에서 대조군과 유사한 활성을 보였고, 5종의 산채류 중에서는 가죽나무 추출물 시료에서만 대조군보다 높은 활성을 나타내었다. 채소류군에서는 콩나물 추출물이 대조군보다 대 략 4 배 정도로 가 장 활성이 높았으며, 다음으로 양배추, 쑥갓, 그리고 마늘 추출물 순으로 높은 활성을 보였다. LPS를 처리하지 않은 경우에는 대부분 추출물 시료의 처리에 의 해 대조군보다 활성이 약간 높아졌거나 유 사 한 활 성 을 보 였 다 . 곡류군은 차조와 찰수수를 제외하고 나머지 6종은 높았는데, 멥쌀현미, 찹쌀현미, 흑미가 높아 백미보다 현미가 활성을 높여줌을 알 수 있었다. 2종의 두류는 현미 추출물들만큼의 활성을 보 였 고 , 전분류군에서는 고 구 마 추출물에 비 해 감자 추출물이 활성을 2배로 높여주었으나, 과일류는 그다지 큰 차이를 나타내지 않았다. 산채류 중에는 꿀풀, 가죽나무, 머위, 다래, 참취 추출물 순으로 활성이 높았지만, 곡류와 채소류에 비해 높지는 않았다. 채소류의 경우 곡류만큼의 활성을 보여준 것은 없었으며 LPS로 자극을 주지 않은 대조군에 비해 큰 활성을 나타내지 않았다. NF-κB/ AP1의 전사인자 활성능 비교를 통해 총 47종의 식물 추출물 중 대조군보다 같거나 높은 두류군 1종(서리태), 전분류군 1종(고구마), 과일류군 2종(바나나, 사과), 산채류군 1종(가죽나물), 채소류군 4종(마늘, 쑥갓, 양배추, 콩나물)을 NF-κB /AP 1의 전사인자 활성능이 높은 면역활성 소재로 발굴하였다.
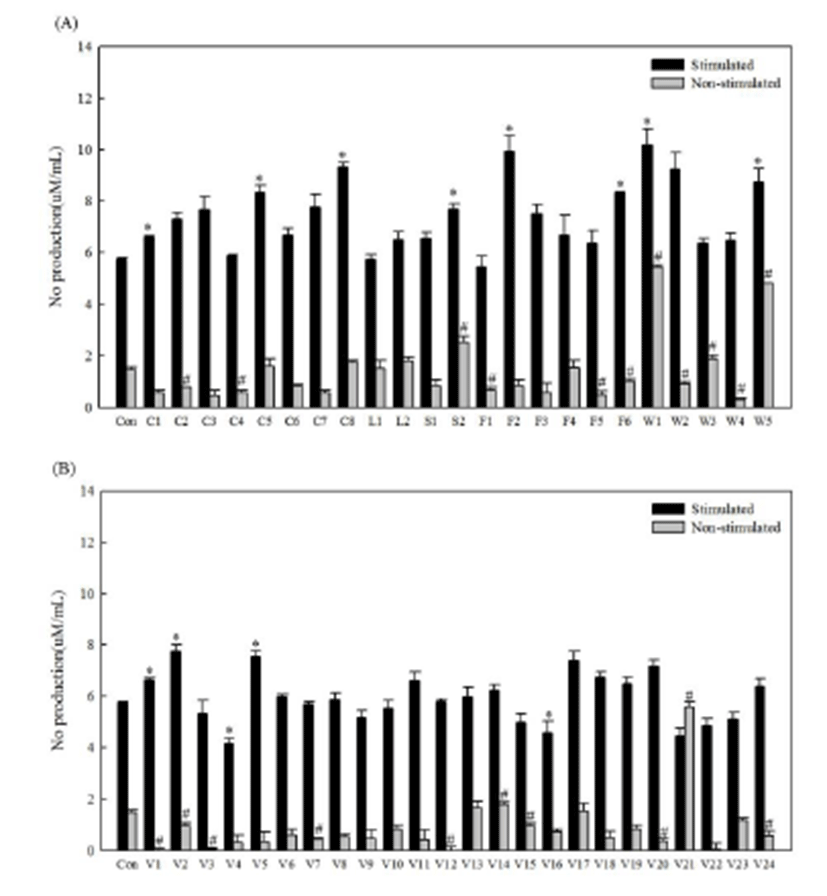
NO는 nitric oxide synthase에 의해 L-arginine으로부터 생성되는 무기 유리체로 면역반응, 세포독성, 신경전달계 및 혈관이완 등 여러 가지 생물학적인 과정에 관여하여 것으로 알려져 있으며 세포기능 유지와 세포독성 및 염증을 유발하는 신호전달 물질로 알려져 있다[20]. RAWB l u e ™ 세포에 4 7 종 에탄올추출물 시료와 대조군을 처리하여 NO 생성량을 측정한 결과는 Fig. 2에 제시하였다. 4 7 종 시 료 의 단 독 처 리 또 는 L P S 와 함 께 처 리 한 시험군은 L P S 자극만으로 유도된 대조군과 비교하여 NO 생성량을 평가하였다. LPS 처리 조건에서는 곡류군, 두류군, 전분류군, 과일류군의 시료들 중 밀감을 제외하고 대조군보다 LPS와 함께 처리하였을 때 NO 생성량이 모두 증가하였는데, 특히 바나나와 가죽나물 추출물이 각각 9.93 ± 0.60 μM/mL와 10.16 ± 0.63 μM/mL로 가장 높았고, 흑미와 꿀풀 추출물이 그 다음으로 높은 값을 나타내었다. 반면 LPS를 처리하지 않고 시료만 단독으로 처리하였을 때는 곡류군의 찰수수(1.59 ± 0.30 μM/mL)와 흑미 에탄올추출물(1.75 ± 0.10 μM/mL), 두류군의 서리태(1.52 ± 0.32 μM/mL)와 흑태 추출물(1.82 ± 0.11 μM/mL), 전분류의 고구마 추출물(2.51 ± 0.25 μM/mL) 그리고 과일류의 사과 추출물(1.55 ± 0.30 μM/mL)만이 대조군(1.46 ± 0.10 μM/mL)보다 NO 생성량이 높았다. 산채류군과 채소류군간에 NO 생성량을 비교하여 보 면 L P S 와 동시에 추출물을 처리한 경우 산채류는 5종 모두, 채소류 24종 중 14종만이 대조군에 비해 높은 값을 나타내었다. 산채류 중에는 가죽나무, 꿀풀, 참취 추출물 순으로 높았고, 채소류 중에는 깻잎, 파, 양파, 그리고 우엉 추출물 순으로 높은 NO 생성량을 보였다. 반면 에탄올추출물 시료만 단독 처리하였을 때 콩나물 추출물(5.59 ± 0.20 μM/mL)과 가죽나무(5.46 ± 0.06 μM/mL), 참취(4.81 ± 0.00 μM/mL) 순으로 가장 높은 NO 생성능을 보였다. 특히 콩나물과 가죽나무 추출물의 경우 LPS 처리 대조군(5.73 ± 0.06 μM/mL)과 유사하게 높은 값을 나타내었다. 그 외에도 숙주나물, 시금치, 양파 추출물 시료들에서 LPS를 처리하지 않은 대조군보다 높은 NO 생성을 보였으며, 산채류군에서는 다래 추출물이 조금 높았다. 그러나 에탄올추출물 단독처리로 생성능이 높았던 콩나물 추출물의 경우 LPS와 함께 처리하였을 때는 그다지 높은 값을 보이지 않았고, 가죽나무 추출물만이 두 조 건 에 서 모 두 높 은 N O 생 성 량 을 보 였 다 . 위의 결과를 토대로 47종에서 대조군보다 NO 생성량이 높은 곡류군의 2 종 ( 찰 수 수 , 흑 미 ) , 두류군의 2 종 ( 서 리 태 , 흑태), 전분류군(고구마)과 과일류군(사과)의 각각 1종, 채소류군의 3종(숙주나물, 시금치, 양파), 산채류군의 3종(가죽, 다래, 참취)으로 총 12종을 면역 활성이 높은 식품소재로 발굴하였다.
면역 활성 우수소재로 기대되는 후보소재를 선정하기 위하여 NF-κB/AP1 전사인자 활성능과 NO 생성량 측 정 결 과 를 토 대 로 두 실 험 에 서 중 복 으 로 선 정 된 서 리 태 , 고 구 마 , 사 과 및 가 죽 나 무 추 출 물 시료들과 각각에서 높은 활성을 보인 시료를 포함하여 47종 중 17종 에탄올추출물을 1차 후보소재로 선정하여 면역세포 활성물질 생성량을 조사하였다(Table 3).
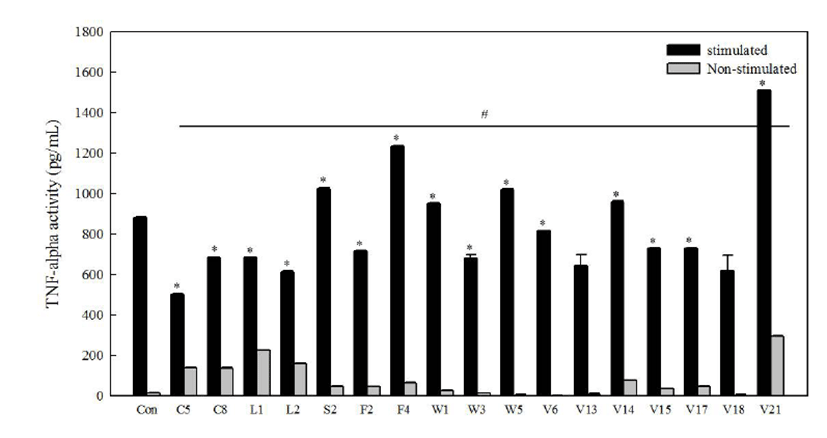
인체에서 염증반응이 진행되기 위해서는 NO와 PGE2와 같은 염증 매개물 이외에 TNF-α 및 IL-1β와 같은 염증성 c y t o k i n e 이 동반되어 감염 초기에 생체 방어 역할을 한다[21]. 그 중 TNF-α는 종양괴사 인자로 대식세포나 림프구에서 생성되어 LPS 등에 의한 자극으로 합성되어 분 비 되 고 , I L - 1 β 는 N O 를 생성하게 하는 매개물질로 국소염증을 발생시키고 T 세포의 활성화, B 세포의 성숙 및 NK cell을 활성화시키는 cytokine으로 알려져 있다[22, 23]. 1차 스크리닝을 통해 선정된 17종의 시 료 중 대식세포에 L P S 와 함 께 처리하면 생성되는 세포활성물질 중 TNF-α와 IL-1β의 생성량을 측정하여 Fig. 3과 Table 4에 각각 제시하였다. LPS 처리 유무로 대조군을 구분하여 LPS와 함께 처리한 시료와 시료만 단독으로 처리한 것을 각각 비교하였다. 먼저 TNF-α 생성량을 살펴본 결과 LPS와 함께 처리한 경우 콩나물 에탄올추출물이 1,509.55 ± 1.38 pg/mL로 가장 높은 T N F - α 생 성 량 을 보 였 으 며 , 시 료 단독처리에서도 292.02 ± 3.27 pg/mL로 가장 높은 생성량을 보였다. 그 다음으로 사과, 고구마, 참취, 시금치, 가죽나무 추출물 순 으 로 높 은 생 성 을 보 였 지 만 , 시 료 단독처리에서는 매우 낮은 생성량을 나타내었다. 추출물 시료 단독으로 처리하였을 경우, 곡류군인 찰수수와 흑미, 그리고 두류군인 흑태 추출물에서는 높은 생성을 보였지만, LPS와 함께 처리 시 대조군에 비해 생성량이 감소하였다. Table 4에 제시한 것처럼 IL-1β 생성량을 측정하였을 때 콩나물, 찰수수 및 가죽나무 에탄올추출물 시료들에서만 IL-1β 사이토카인이 생성되었는데, LPS와 함께 처리하였을 때 각각 54.56 ± 1.08, 34.10 ± 1.08 및 26.10 ± 0.81 pg/mL의 생성량을 보였다. 그러나 나머지 시료에서는 IL-1β 사이토카인이 생성되지 않았다. 이상의 in vitro상 기능성 평가 결과를 토대로 콩나물 에탄올추출물 시료가 대식세포를 증식시켜 면역 증강 사이토카인들의 생성량을 높일 뿐만 아니라, NF-κB/AP1 전사인자 활성능과 NO 생성능도 뛰어나 면역 활성 우수소재로 최종적으로 선정되었다.
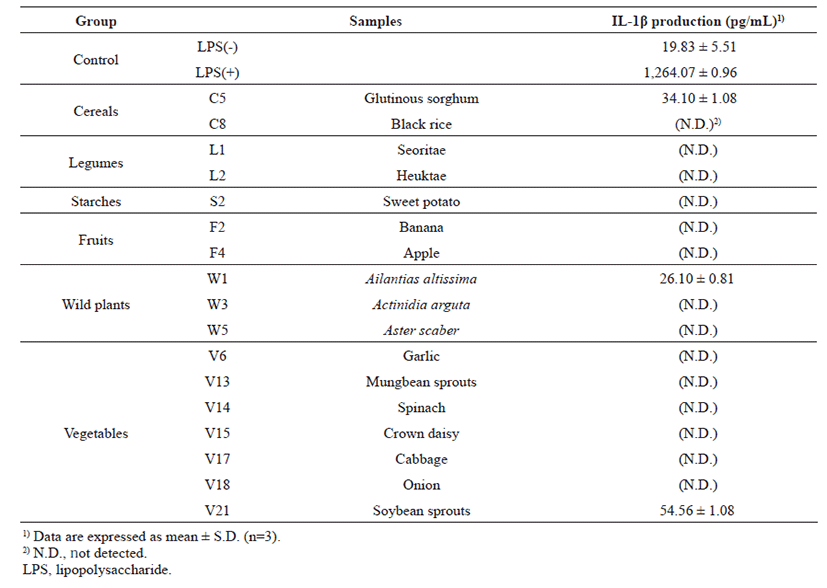
Discussion
본 연구는 식물 자원으로부터 in vitro상에서 대식세포를 자극하여 생성하는 NF-κB/AP1 전사인자 활성능, NO 생성능 그리고 cytokine 생성량과 같은 세포활성물질들을 측 정 함 으 로 써 면 역 활 성 능 을 갖 는 식 품 소 재 를 선정하고자 하였다. 식물자원 47종은 1차 실험인 NF- κB/AP1 전사인자 활성화를 통해 두류군 1종(서리태), 전분류군 1종(고구마), 과일류군 2종(바나나, 사과), 채소류군 4종(마늘, 쑥갓, 양배추, 콩나물), 산채류군 1종(가죽나물)을 선정하였고, nitric oxide 생성 평가를 통하여 곡류군의 2종(찰수수, 흑미), 두류군의 2종(서리태, 흑태), 전분류군(고구마)과 과일류군(사과)의 각각 1종, 채소류군의 3종(숙주나물, 시금치, 양파), 산채류군의 3종(가죽, 다래, 참취) 선정하여 총 곡류 2종(찰수수, 흑미), 두류 2종(서리태, 흑태), 전분류 1종(고구마), 과일류 2종(바나나, 사과), 채소류 7종(마늘, 숙주나물, 시 금 치 , 쑥 갓 , 양 파 , 양 배 추 , 콩 나 물 ) 그리고 산채류 3종(가죽마물, 다래, 참취) 등 17종을 선정하였다. 2차 실험으로 대식세포의 활성화에 의해 분비된 cytokine 생성량을 측정해 본 결과 TNF-α의 경우 LPS와 함께 처리한 경우 콩나물 에탄올추출물이 1,509.55 ± 1.38 pg/mL로 가장 높은 TNF-α 생성량을 보였으며, 시료 단독처리에서도 292.02 ± 3.27 pg/mL로 가장 높은 생성량을 보였다. IL-1β의 경우 LPS와 함께 처리하였을 때 각각 54.56 ± 1.08 pg/mL의 생성량으로 가장 높은 값을 보였다. 따라서 17종 에탄올 추출물들 중 TNF-α와 IL-1β의 사이토카인 생성량이 가장 높은 콩나물 에탄올 추출물을 면역활성이 높은 식품소재로 최종 선정하였다.