Original Article
The immune enhancing effects and characteristics of Bifidobacterium longum and Bifidobacterium breve for the probiotic use in humans and animals
Ho-Eun Park
,
Hyun-Bum Um,
Wan-Kyu Lee*

Author Information & Copyright ▼
Laboratory of Bacteriology College of Veterinary Medicine Chungbuk National University , Cheongju 28644, Korea
*Corresponding author: Wan-Kyu Lee Laboratory of Bacteriology College of Veterinary Medicine Chungbuk National University , Cheongju 28644, Korea Tel: +82-43-261-2960, E-mail:
wklee@cbu.ac.kr
© Research Institute of Veterinary Medicine, Chungbuk National University. All rights reserved.
Received: Aug 28, 2018; Accepted: Sep 20, 2018
Abstract
The purpose of this study was to investigate probiotic characteristics and immune enhancing effects of Bifidobacterium (B.) longum KBB1-26 and BIF-4, B. breve KBB5-22 isolated from human intestine for probiotic use in humans and animals. We measured acid, bile and heat tolerance, antimicrobial activity against pathogenic bacteria, Escherichia (E.) coli, Salmonella (S.) Enteritidis, Staphylococcus (S.) aureus, and Listeria (L.) monocytogenes. Immune enhancing effects of B. longum and B. breve were investigated by measuring nitric oxide (NO), nuclear factor (NF–κb), interleukin-1ß (IL-1ß), interleukin-6 (IL-6), interleukin-12 (IL-12) and tumor necrosis factor- α (TNF- α) in RAW 264.7 cells or RAW BLUE cells. B. longum KBB1-26 was survived at pH 2.0. B. longum KBB1-26 and BIF-4, B. breve KBB5-22 also showed tolerance to 0.3% of oxgall bile salt. B. longum KBB1-26 was able to survive at 70 °C and 80 °C for 20 min. KBB1-26 showed the antimicrobial inhibition zone to pathogenic bacteria such as E. coli (12 mm), S. Enteritidis (14 mm), S. aureus (14 mm) and L. monocytogenes (41 mm). The production of NO (4.5 ± 0.00μM/mL) and IL-1β (39.7 ± 0.55pg/mL) of KBB1-26 significantly higher than BIF-4 and KBB5-22, respectively. In addition, KBB1-26 and KBB5-22 induce the production of high level of TNF-α and IL-6 in macrophages. Collectively, B. longum KBB1-26 have acid, bile, heat tolerance, antimicrobial activity and immune enhancing effects. These results suggest that KBB1-26 can be used as probiotics for humans and animals.
Keywords: probiotics; Bifidobacterium breve; Bifidobacterium longum; immune enhancing effects; KBB1-26
Introduction
Bifidobacterium은 역사적으로 모유영양아로부터 처음 분리 되어 당시에는 Lactobacillus bifidus로 분류되었으나, 균 형태 및 세포벽 성분이 Lactobacillus와는 차이가 있다고 밝혀져, 현재는 Lactobacillus 속에서 독립되어 Bifidobacterium속으로 분류되고 있다[1, 2]. Bifidobacterium는 Gram positive의 혐 기성 세균으로 간균이며, Y자 모양 혹은 곤봉 모양인 무포 자 세균이다[3]. Bifidobacterium은 운동성이 없으며 일반적 으로 20℃~41℃에서 생육하고 최적온도는 37℃, 최적 pH 는 6~7이다[4]. Bifidobacterium은 장내세균총에서 높은 비 율을 점유하고 있는 우점 세균 중의 하나로, 모유수유 태아 와 건강한 성인에게서 중요한 유산균으로 알려져 있다[1]. Bifidobacterium 중 많은 균종이 외인성 병원체에 대해 방어능 력을 갖고 있는 것으로 밝혀지고 있는데[5], 이 과정은 Bifidobacterium이 침입자의 군체 형성을 지연시키거나, 젖산과 아세트산과 같은 유기산을 3:2의 비율로 장관내에 방출하여 장내 pH를 조절하는 것에 기인하는 것으로 알려지고 있다 [1]. Bifidobacterium은 과산화수소, 유기산 및 박테리오신 등 과 같은 항균물질 생산을 통해 유해균의 생장을 억제해주고 장관 상피세포에 유해세균이 부착되는 것을 경쟁을 통해 막 아주거나 숙주의 점액 분비를 증가시키는 것 등을 통해 장 점 막의 유익한 환경을 유 지해 주는 역할을 하고 있다[6]. 또한 유당불내증의 완화, 혈중 콜레스테롤의 감소, 항암작용, 면 역 조절 작용, 혈중 지방 농도 개선, 비타민 B군 등 합성, 식 품의 영양학적 가치의 증진 등의 유익한 효과를 나타내어 장 내 세균 중 가장 대표적인 유익균으로 알려지고 있다[6-9] 많은 유익한 기능들을 지니는 Bifidobacterium이지만 장관용 생균제(probiotics)로 선발되기 위해서는 이론적 근거가 필 요하다. 예를 들어 생균제는 안전성, 생존성, 장내정착성, 항 미생물제 생성능, 면역 증강능, 병원성균 억제능, 관능적 특 성, 박테리오파지 저항성, 제조 과정 중의 생존성 등을 지녀 야 한다[10]. 특히 미생물이 생균제로 이용되기 위해서는 내 산성과 내담즙성을 지녀야 한다. 생균제 섭취 후 위산에 대한 내성을 지녀야 위를 통과한 후 소장에 도달할 수 있으며, 담 즙 내성을 통해 췌장효소 및 쓸개에서 분비되는 담즙산에 견 디고 생존한 상태로 장관에 도달하여 내인성 미생물의 균형 과 대사에 영향을 줄 수 있다[11]. 실제로 생균제로서의 기 능을 수행하려면 장내 담즙의 농도(0.3%)의 oxgall이 함유 된 배지에서 성장할 수 있는 내성을 가지고 있어야 한다[12]. 이와 같은 필요성 때문에 생균제 균주의 선발 시 균주의 내산 성 및 내담즙성 실험이 필요하다. 몇몇 생균제의 또 다른 특 성으로는 in vitro 조건에서 생균제가 장내 병원성균과 부패균 의 생육을 억제하는 것이다. 이들의 유해균 억제기작은 유기 산 (초산과 젖산), hydrogen peroxide, 박테리오신과 같은 항균물질의 생산, 장내 상피세포의 부착장소 경쟁 등이 작용 하는 것으로 알려져 있다[13].
생균제는 대식세포를 활성화시켜 동물과 사람의 면역효과 를 증진시키는 효능이 있다. 대식세포는 인체 내의 면역시 스템 항상성 유지의 중요한 역할을 하는 포식세포로 lipoteichoic acid(LTA), lipopolysaccharides(LPS), nitric oxide(NO), interleukin-1ß(IL-1ß), interleukin-6 (IL-6), interleukin-12(IL-12) 등에 의해 활성화된 다. 대식세포가 외부의 자극이나 침입한 병원체에 의해 활 성화되면 염증유발인자인 TNF-α, IL-1ß 및 IL-6같 은 cytokine을 생성하고 inducible nitric oxide synthase (iNOS)와 cyclooxygenase=2(COX-2)의 합성을 거쳐 NO를 생성한다[12]. 이렇게 생성된 NO는 박테리아와 종 양의 성장을 억제하거나 제거하는 등 여러 역할을 수행한다 [12]. IL-1ß는 중요한 전염증성인자로 다른 cytokine들 과 chemokine들을 분비하도록 유도한다. 또한 세포증식, 분 화, 사멸같은 세포반응에도 관여한다[14]. TNF-α는 전형 적인 다기능적 cytokine으로 조혈작용, 면역반응 그리고 염 증을 조절하고, 대식세포로부터 분비되거나 세포 면역 활성 과정에서 분비되어 염증과정과 병원성 세균 감염을 억제한 다[15-17]. 이와 같은 NO나 IL-1ß, IL-6, TNF-α 등 의 cytokine이 활성화된 대식세포로부터 분비되어 면역력 을 조절하고 박테리아, 곰팡이, 바이러스와 같은 외부 침입요 소들로부터 지켜준다[18, 19]. 따라서 이 논문에서는 선별 된 Bifidobacterium의 생균제로의 활용 여부 확인을 위해 NO, IL-1ß, TNF-α를 측정하여 면역증진효과를 확인하였다.
Bifidobacterium은 과거에는 다른 유산균에 비해 영양 요구 가 복잡하고 생육환경이 혐기성 조건이기 때문에 그 배양 과 이용에 어려움이 있었지만 점차 장내 세균에 대한 혐기 배양법이 발달됐고 Bifidobacterium의 여러 기능성이 알려져 생균제로의 활용 가능성이 더욱 높아진 실정이다. 이러한 추 세에 따라 최근 들어 한국 유아 및 성인의 장관에서 분리된 Bifidobacterium을 생균제로 이용하려는 연구가 점차 진행되 어 왔다[1].
본 연구에서도 실험실에서 확보하고 있는 사람의 장내에서 분리한 Bifidobacterium의 생균제 사용가능성을 확인하기 위 해 실험을 진행하였다. 사람의 장에서 분리한 Bifidobacterium(B.) longum KBB1-26 그리고 BIF-4, B. breve KBB5-22 를 대상으로 내산성, 내담즙성, 내열성, 병원성 억제능을 실 험하여 생균제적 특성을 확인하였으며, 면역 증진효과를 확 인하기 위해 NO 및 Cytokine 측정을 진행하였다.
Materials and Methods
공시 유산균
본 연구에 사용한 유산균주는 본 연구실에서 사람장내에서 분리한 Bifidobacterium(B.) longum BIF-4 균주와 모유영양 아의 분변에서 분리한 B. longum KBB1-26 그리고 B. breve KBB5-26균주이다.
내산성 및 내담즙성 검사
분리된 유산균주들의 내산성을 평가하기 위하여 pH 농도 별로 생존여부를 확인하였다. 각 유산균들은 BL broth에서 37℃, 17시간 혐기배양하여 준비하였다. 그 후, 0.05M sodium phosphate buffer를 HCl로 보정하여 만든 pH 7, 6, 5, 4, 3, 2 완충용액 속에 각각 접종하여 37℃에서 2시간 정 치 배양하였다. 배양 후 균주의 생존여부를 확인하기 위하여 각 용액을 단계 희석하여 균수 측정을 진행하였고, 생존한 균주를 내산성 균주로 판정하였다. 내담즙성을 확인하기 위 해 Oxgall(pH 7.0; Difco, USA)이 0%, 0.3%씩 첨가된 BL agar배지에 각 유산균주들을 도말하여 37℃에서 48시간 동 안 혐기배양한 후, 생존한 집락을 계수하여 생존한 균주를 내 담즙성 균주로 판정하였다[20].
내열성 검사
유산균주들을 BL broth에 37℃, 17시간 혐기배양하여 L-cysteine(Sigma, USA)이 0.05% 첨가된 BL broth에 1.0ⅹ107 CFU/mL가 되도록 접종하였다. 희석된 유산균주 들을 70℃, 80℃에 각각 5, 10, 15, 20분간 노출시킨 후 BL agar 배지에서 37℃, 48시간 동안 배양하였다. 초기 생균수 와 열 처리 후 형성된 집락 수의 차이를 확인하여 내열성 여 부를 판정하였다[20].
병원균 억제능 검사
병원균 억제능을 검사하기 위하여 Flemming 등에 의해 언 급된 agar spot assay를 변형하여 사용하였다[20]. Agar spot assay의 병원균으로는 Escherichia coli KCTC 1682, Salmonella Enteritidis KCCM 12021, Staphylococcus aureus KCTC 1621, Listeria monocytogenes KCTC 3569 균주를 사 용하였다. 각 병원균을 10mL Brain heart infusion broth (BBL, USA)에 접종한 후 37℃에서 24시간 호기배양하 였다. BL agar배지에 배양된 Bifidobacterium(KBB1-26, BIF-4 그리고 KBB5-22)을 2μL 점적하여 spot이 형성되 도록 37℃에서 24시간 혐기배양하였다. 배양 후 각 agar에 7ml BHI agar(0.7%) 혼합된 병원균을 pouring하여 37℃ 에서 24시간 혐기배양한 후 억제환을 측정하였다. Spot 주 위의 형성된 억제환의 직경을 mm단위로 측정하여 병원균의 억제정도를 평가하였다[21].
Heat-killed 유산균 준비
실험에 사용할 유산균(KBB1-26, BIF-4, 그리고 KBB5 -22)들을 BL broth에서 37℃, 17시간 혐기배양한 후, BL agar 배지를 이용하여 균수를 측정하였다. 배양액 전체를 12,000rpm에서 10분 간 원심분리하여 상층액은 버리고 균 체만을 phosphate buffered saline(PBS; pH7.2)으로 세척 하였다. 세척 후 PBS로 1.0 × 108 CFU/mL 균수를 희석하 고 110℃에서 15분 간 열처리하여 유산균을 사멸시켜 면역 활성 측정 시료로 사용하였다[22].
세포배양
Dulbecco’s modified Eagles’s medium(DMEM; Hy- Clone, USA) 배지에 10% FBS(Gibco, USA), 1% Penicillin/Streptomycin(Gibco, USA)을 첨가하여 37℃ water bath에 실험 전 30분 정도 보온하였다. RAW 264.7 세포와 RAW BLUE 세포수를 5.0 × 105 cell/mL가 되도록 12 well pate에 분주한 후 heat-killed cell을 접종하여 48h 배양하였다. 배양 후 상층액 900μL를 회수하여 NO, NF- κB 및 cytokine의 농도를 각각 측정하였다[22].
NO 측정
NO의 농도는 Griess reagent(Promega, USA)를 이용하 여 측정하였다. 배양액 시료 50μL와 nitrite standard(0- 100μM sodium nitrite)를 96-well plate에 분주한 후, 1% sulfanilamide가 함유된 5% phosphoric acid 50μL와 0.1% N-1-naphthyl ethylenediamine dihydrochloride 50μL를 동량으로 섞어 각 well에 분주하여 실온의 암실에 서 10분간 방치하였다. 반응이 끝난 후 540nm에서 흡광도 를 측정하였다. 측정한 흡광도 값을 standard 표준곡선을 이 용하여 NO의 농도를 계산하였다[22].
NF-κB 측정
유산균주들의 NF-κB pathway 활성화정도를 확인하기 위하여 secreted alkaline phosphatase reporter gene이 안정적으로 transfection된 RAW BLUE cells(InvivoGen, USA)을 사용하였다. RAW BLUE cells을 96-well-plate 의 각 well당 5.0 × 105 cell/mL가 되도록 분주한 후, 1.0 × 108 CFU/mL 농도로 맞춘 heat-killed 유산균 100 µL 를 첨가하여 배양하였다. 48시간 배양 후, 상층액 20 µL와 QUANTI-Blue(InvivoGen, USA) 시약 180µL를 37℃에 서 15분간 암실에서 반응시켰다. 모든 시료는 3회 반복으로 620 nm 파장에서 측정하였다[23].
Cytokine 측정
TNF-α, IL-1β, IL-6 그리고 IL-12와 같은 cytokine 농도는 ELISA kit (BD, USA)를 이용하여 측정하였다. 각 cytokine의 capture antibody가 coating된 96-well-plate 에 비특이적인 반응을 억제하기 위해 1시간동안 Blocking 작업을 진행하였다. Plate를 washing한 후, 유산균 sample (KBB1-26, BIF-4 그리고 KBB5-22)과 standard용액 을 각 well에 200µL씩 분주하여 실온에서 2시간 배양하 였다. Washing을 실시한 후, detection antibody를 각 well 에 분주하여 1시간 동안 반응시키고, 그 후 Avidin-HRP 를 30분간 실온에서 반응시켰다. 마지막으로 발색시약인 Teteramethylbenzidine(TMB)를 암실에서 15분 반응시 키고, 50µL H2SO4 stop solution 로 반응을 중지시켰다. 반응이 끝난 plate를 30분 이내에 450nm에서 흡광도를 측 정하였다. 측정한 흡광도 값을 standard 표준곡선을 이용하 여 계산하였다[22].
통계분석 및 유의성 검정
통계처리는 SPSS(Window ver. 12.0; SPSS, USA)를 이 용하였으며 그룹간의 유의성 검정은 ANOVA와 Duncan’s tests를 사용하였다(p<0.05).
Results
내산성 및 내담즙성 결과
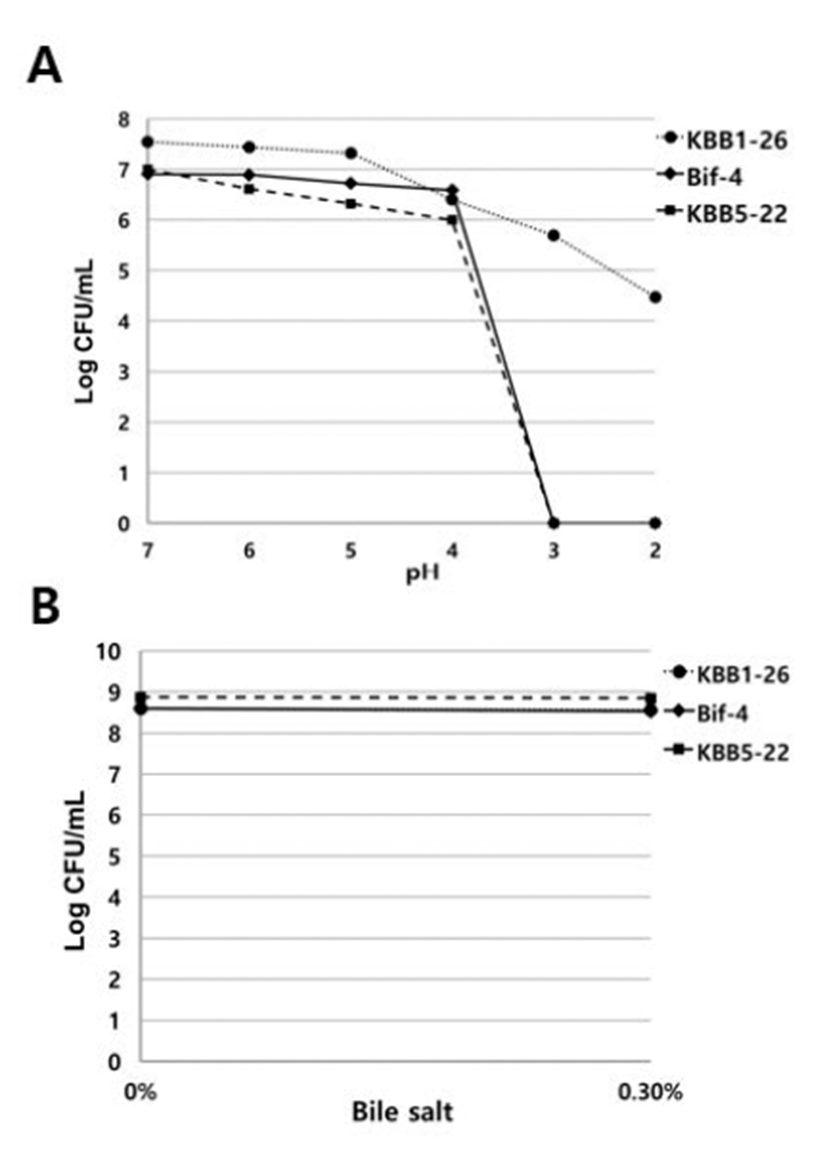
Bifidobacterium 균주들의 내산성 및 내담즙성 검사 결과를 Fig. 1에 나타내었다. 실험 결과 pH 2에서 B. longum KBB1- 26이 생존하여 가장 우수한 내산성을 나타내었다. B. breve KBB5-22균주는 pH 4에서 생존하는 것이 확인되었다(Fig 1A). 내담즙성 실험 결과 B. longum KBB1-26과 BIF-4, B. breve KBB5-22 모두 0.3% Oxgall에서 생존하여 내담즙성 을 지니는 것으로 확인되었다(Fig 1B).
Fig. 1.
Acid and bile-salt tolerance of Bifidobacterium spp. A Acid; B bile-salt tolerance of KBB1-26, BIF-4 and KBB5-22. Freshly prepared lactic acid bacteria were inoculated of the sodium phosphate buffer from pH2 to pH7 and 0.3% (w/v) oxgall broth. KBB1-26; Bifidobacterium longum KBB1-26, BIF-4; Bifidobacterium longum BIF-4, KBB5-22; Bifidobacterium breve KBB5-22.
Download Original Figure
내열성 확인 결과
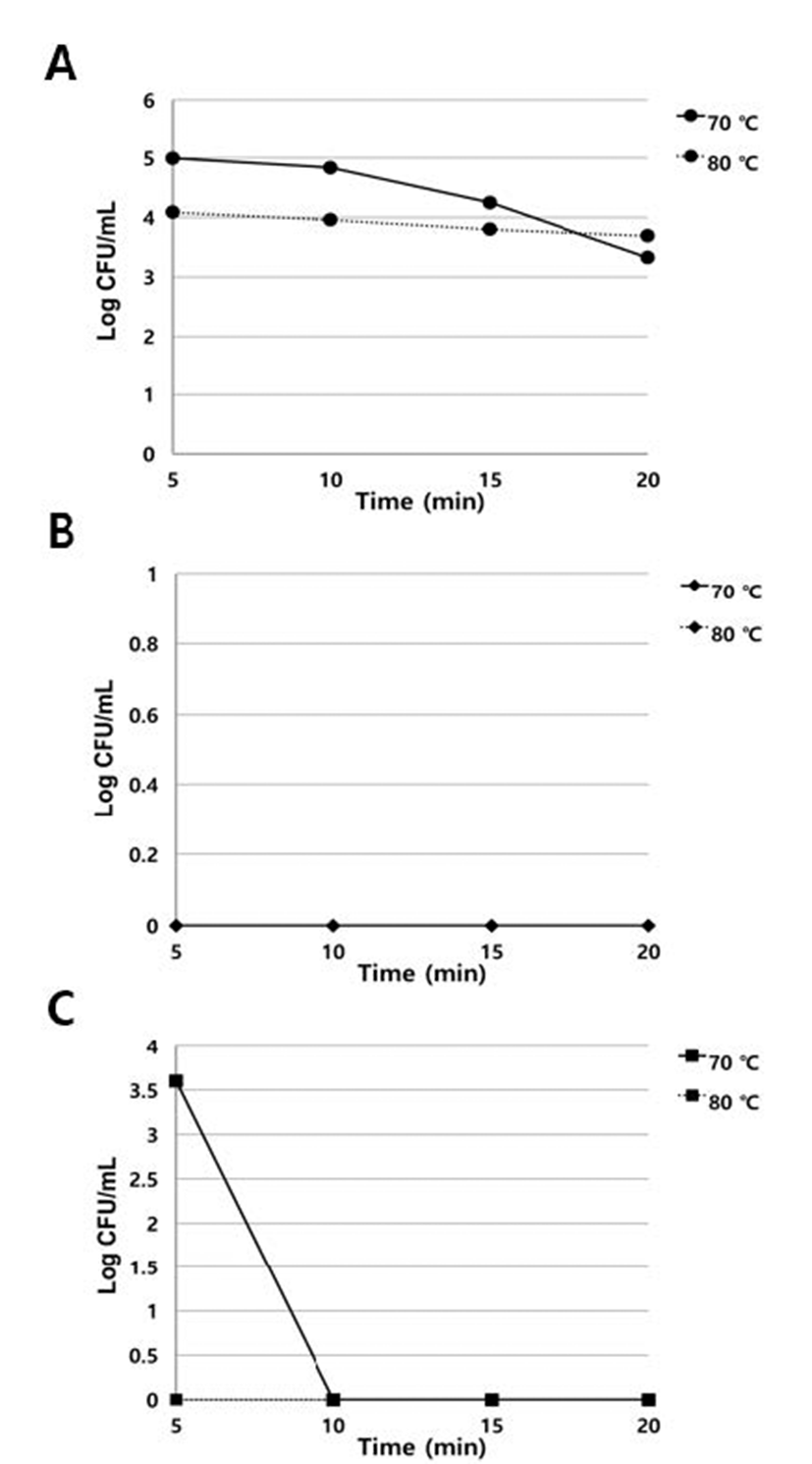
내산성 및 내담즙성을 확인한 Bifidobacterium 균주들의 내열 성을 확인한 결과 B. longum KBB1-26 균주가 80℃에서 20 분동안 살아남아 우수한 내열성을 지닌 것으로 확인되었다. B. breve KBB5-22는 70℃에 67서 5분간 생존하여 KBB1- 26균주보다는 약한 내열성을 보였으며, B. longum BIF-4는 모든 조건에서 내열성을 보이지 않았다(Fig. 2)
Fig. 2.
Heat tolerance of Bifidobacterium spp. A KBB1-26; B BIF-4 and C KBB5-22. Freshly prepared lactic acid bacteria were inoculated of broth and exposed in 70℃ and 80℃ for 5, 10, 15, 20 minute. KBB1-26; Bifidobacterium longum KBB1- 26, BIF-4; Bifidobacterium longum BIF-4, KBB5-22; Bifidobacterium breve KBB5-22.
Download Original Figure
병원균 억제능
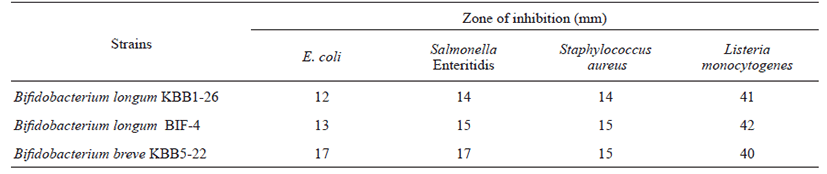
Bifidobacterium 균주들의 병원균 억제능 실험결과를 Table 1에 나타내었다. Bifidobacterium 3균주 모두 E. coli KCTC 1682, Salmonella Enteritidis KCCM 12021, Staphylococcus aureus KCTC 1621, Listeria monocytogenes KCTC 3569에 대해 비슷한 수치로 항균활성을 나타내었다. 특히 3균주 모 두 Listeria monocytogenes에 대하여, 가장 높은 병원균 억제 능을 보였다.
NO 및 NF-Κb 활성 확인
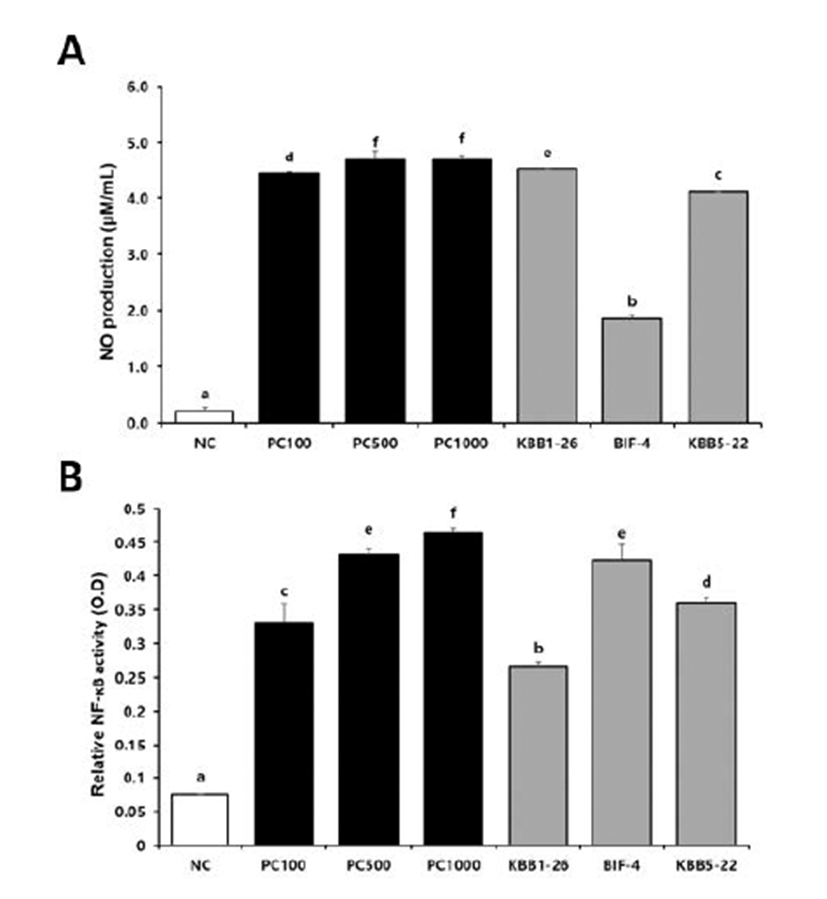
열처리하여 사멸시킨 유산균주들의 NO 생성능을 측정한 결과, B. longum KBB1-26(4.5 ± 0.00μM/mL)이 B. longum BIF-4(1.8 ± 0.07μM/mL)와 B. breve KBB5-22(4.1 ± 0.02μM/mL) 균주보다 유의적으로 높은 수준의 NO를 생성하여 뛰어난 NO생성량을 유도하는 것으로 확인되었다. NF-κβ 활성을 흡광도로 측정한 결과, B. breve KBB5- 22(0.361 ± 0.01)가 가장 높은 활성을 보였다. B. longum KBB1-26(0.267 ± 0.01μM/mL)과 B. longum BIF-4 (0.423 ± 0.02μM/mL) 또한 NF-κB의 활성을 높은 수 준으로 유도하였다 (Fig. 3).
Fig. 3.
Effect of KBB1-26, BIF-4 and KBB5-22 on cytokines in RAW 264.7 cell. Production of A NO B NF-κB in RAW 264.7 cells. RAW 264.7 cells (5 × 105 cells/mL) were cultured with probiotic cells for 48h. Culture supernatants were collected and analyzed for cytokine induction. NC, negative control; PC100, LPS at 100 ng/mL; PC500, LPS at 500 ng/mL; PC1000, LPS at 1000 ng/mL; KBB1-26, Bifidobacterium longum KBB1-26 at 1 × 108 CFU/mL; BIF-4, Bifidobacterium longum BIF-4 at 1 × 108 CFU/mL; KBB5-22, Bifidobacterium breve KBB5-22 at 1 × 108 CFU/mL. Different superscript letters (a, b, c, d, e, and f) indicate statistical differences as determined by ANOVA (p<0.05).
Download Original Figure
Cytokine 생성능 확인
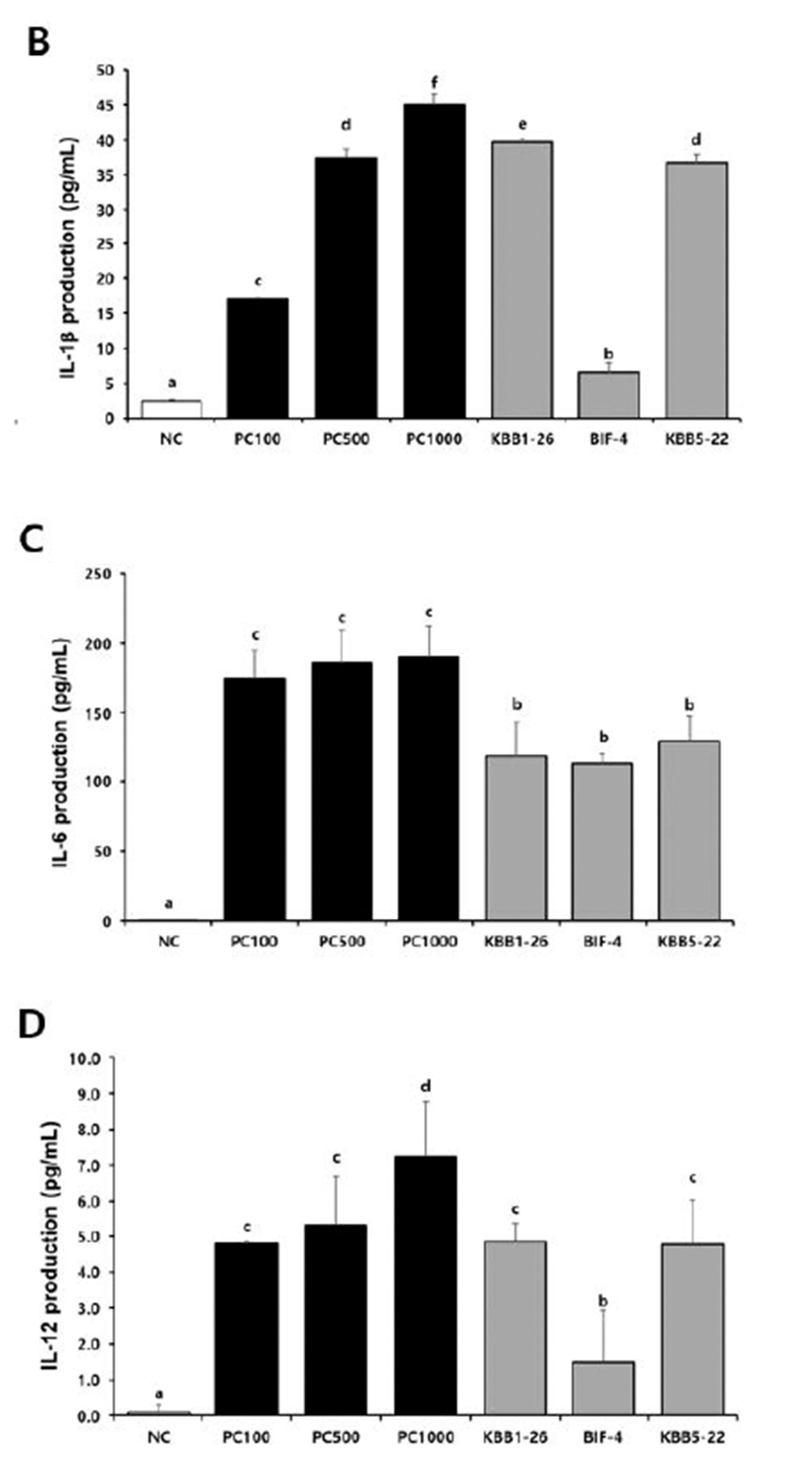
TNF-α 생성량의 경우 유산균주들 모두 높은 수준의 TNF-α 생성을 유도하는 것이 확인되었으며, 그 중에서 도 B. longum KBB1-26(3746.4 ± 167.33 pg/mL)과 B. breve KBB5-22(3971.0 ± 131.49 pg/mL)가 B. longum BIF-4(2865.9 ± 103.69 μM/mL)보다 유의적으로 증가 한 형태를 보였다(Fig 4A). 또한 B. longum KBB1-26 균 주는 9.7 ± 0.55 pg/mL로 높은 IL-1β를 생성하여 B. breve KBB5-22(36.5 ± 1.26 pg/mL)와 B. longum BIF- 4(6.6 ± 1.45 pg/mL)보다 유의적인 차이를 보였다(Fig 4B). IL-6 측정 결과에서는 3균주 모두 유의적으로 비슷하 게 IL-6를 생성하였다(Fig. 4C). 마지막으로 IL-12 측정 결과, B. longum KBB1-26(4.8 ± 0.09 pg/mL)과 B. breve KBB5-22(4.8 ± 0.30 pg/mL)이 B. longum BIF-4(1.48 ± 0.17μM/mL)보다 유의적으로 IL-12 생성수준을 높였 다(Fig. 4D).
Fig 4.
Effect of KBB1-26, BIF-4 and KBB5-22 on cytokines in RAW 264.7 cell. Production of A TNF-α; B IL-1β; C IL-6; D IL-12 in RAW 264.7 cells. RAW 264.7 cells (5 × 105 cells/mL) were cultured with probiotic cells for 48h. Culture supernatants were collected and analyzed for cytokine induction. NC, negative control; PC100, LPS at 100 ng/mL; PC500, LPS at 500 ng/ mL; PC1000, LPS at 1000 ng/mL; KBB1-26, Bifidobacterium longum KBB1-26 at 1 × 108 CFU/mL; BIF-4, Bifidobacterium longum BIF-4 at 1 × 108 CFU/mL; KBB5-22, Bifidobacterium breve KBB5-22 at 1 × 108 CFU/mL. Different superscript letters (a, b, c, d, e, and f) indicate statistical differences as determined by ANOVA (p<0.05)
Download Original Figure
Discussion
본 연구에서는 사람의 장내와 모유영양아의 분변에서 독자 적으로 분리한 Bifidobacterium의 probiotics 사용가능성을 확 인하기 위해 내산성, 내담즙성, 내열성, 병원성 억제능 및 면 역효과 확인을 위한 NO 및 cytokines 그리고 NF-κB 측정 실험을 진행하였다. Probiotics는 경구로 투여되어 소화관을 경유하므로, 위 내의 낮은 pH에서 생존할 수 있는 내산성, 소 장내의 담즙에 저항하는 내담즙성을 갖추어야 하며 가공시의 열처리에 견딜 수 있는 내열성, 치료용으로 투약되는 항생제 에 대한 내성도 요구된다[11]. 내산성 실험 결과 B. longum KBB1-26이 pH 2에서 생존하여 높은 내산성을 보였고, 그 외의 B. longum KBB1-26과 BIF-4는 pH 4에서 안정성을 보이다가 pH3부터 생존하지 못하였다. 이러한 내산성 결과 는 Matosumoto 등의 연구보고와 유사한 결과를 나타내는데 Matosumoto 등에 따르면, B. lactis와 B. animalis가 pH 3-5 에서 3시간동안 높은 생존력을 보여 가장 안정적이었고, B. longum 및 B. breve는 pH 3부터 낮은 생존력을 보였다[24]. 또한 모든 균주는 0.3% Oxgall 에서 우수한 내담즙성을 보 였다. 따라서 본 연구에서 사용된 유산균주들은 위산과 같은 낮은 pH에서 생존할 수 있으며 쓸개에서 분비되는 담즙에 대 한 내성을 지니는 것으로 확인되었다. 이와 같은 결과는 Ryu 등과 Lin등의 연구에서 사용한 모든 Bifidobacterium 속 세균 이 0.3% oxgall에서 생존한 연구결과와 유사하다[20, 25]. 또한 내열성 실험에서 B. longum KBB1-26이 70℃, 80℃에 서 20분간 생존하여 높은 내열성을 지닌 것으로 확인되었고 B. breve KBB5-22는 70℃에서 5분간 생존하여 KBB1-26 균주보다는 낮은 내열성이 확인되었다. Ding 등의 연구에서 Lactobacillus, Bifidobacterium 속 8균주들의 내열성을 비교한 결과, 65℃에서 30분이 경과되었을때 대부분의 균의 60% 만 생존하였다[26]. 본 연구에서 KBB1-26균주는 70℃에 서 20분 경과 후, 50%정도 생존하여 다른 유산균주들과 비 교하였을 때 우수한 내열성을 가지는 것으로 생각된다. 이 와 같은 결과로 보아 선별된 Bifidobacterium 중 KBB1-26 이 Probiotics로의 활용가능성이 가장 높은 것을 확인할 수 있었다. E. coli KCTC 1682, Salmonella Enteritidis KCCM 12021, Staphylococcus aureus KCTC 1621, Listeria monocytogenes KCTC 3569, 4종류의 병원균에 대한 병원균 억제능 을 측정한 결과 선별된 3균주 모두 병원균에 대해 억제 활성 을 나타내었다. El-kholy 등과 Sarinena 등의 연구에서는 B. longum을 포함한 여러가지 유산균주들의 병원균 억제능을 확인하였고 억제환의 직경이 11-17mm 일 경우 억제능이 높다고 판단하였다. 또한 17mm를 넘는 경우 우수한 항균활 성을 갖는 것으로 평가하였다 [27,28]. 본 연구에서도 3균주 모두 모든 병원균에 대해 11mm이상의 억제환을 생성하였음 으로 높은 병원균 억제능을 갖는 것으로 보여진다.
이러한 연구결과는 이전 연구결과들과 유사하며, 일반적으 로 Bifidobacterium을 포함한 많은 젖산균이 유기산, hydrogen peroxide, bacteriocin과 같은 항생물질을 생산 및 장내 상피세포와의 경쟁을 통해 병원균을 억제하는 특성을 가지고 있다고 알려져 있다[20,29,30].
최근에 유산균의 많은 유익한 생리적 역할 중에서, 면역 기능 강화에 대한 관심이 높아지고 있다. 특히 유산균이 대 식세포를 자극하여 활성화되면 탐식작용, 각종 cytokine 생 산, 항종양활성, 항원제시 등의 기능으로 숙주의 방어와 감염 에 중요한 역할을 한다는 다수의 보고가 있다[31]. 본 연구 에서는 heat-killed 처리한 유산균주들의 NO, NF-κB 및 cytokine(TNF-α, IL-1β, IL-6 그리고 IL-12)의 생성 능을 측정하였다. 열처리 된 유산균을 실험에 사용한 이유 는 유산균이 성장하면서 산을 생성하기 때문에 그로 인한 대 식세포의 죽음을 방지하고 균이 죽은 상태에서도 균체 자체 가 내는 면역활성을 알 수 있는 장점이 있기 때문이다[32]. 실험 결과, KBB1-26은 다른 유산균주들 보다 높은 수준 의 NO, IL-1β를 생성하였다. 과거의 많은 연구들에서도 heat-killed Bifidobacterium과 Lactobacillus species이 대식세 포에서 hydrogen peroxide와 NO, IL-6 그리고 TNF-α 를 높은 수준으로 생성하는 것을 확인하여 heat-killed 유산 균주들의 면역증강효과를 입증한 바가 있다[33-36]. 또한 Fang 등은 사람의 장내에서 분리한 Bifidobacterium species가 J774.1 대식세포에서 다양한 cytokine생성의 증가를 유도 한다는 연구결과를 보고하였다[37]. 마찬가지로 본 실험에 서도 heat-killed한 B. longum KBB1-26 균주가 직접 대식 세포를 자극하여 NO와 염증성 cytokine을 생산하여 면역활 성을 보이는 것을 확인하였다.
결론적으로 선별된 유산균주 중 B. longum KBB1-26이 내 산성, 내담즙성, 내열성, 병원성 억제능 등을 고려했을 때 생 균제로서의 활용가능성이 가장 높은 것으로 확인되었다. 또 한 KBB1-26의 면역증강효과가 NO, IL-1β 생성량이 다 른 유산균주들보다 뛰어나 높은 면역증강효과 역시 입증되었 다. 그러나 생체내에서의 면역활성 효과를 확인하기 위하여 는 향후 추가적인 동물실험을 통해 이러한 면역 증강 활성을 재확인하는 추가연구가 필요할 것으로 생각된다. 따라서 이 번 결과를 바탕으로 생균제 특성을 가지고 면역활성이 뛰어 난 B. longum KBB1-26이 사람 및 동물의 건강기능성 식품 소재로 활용될 수 있는 우수한 유산균주로 생각된다.
Acknowledgements
본 논문은 농촌진흥청 공동연구사업(과제번호: PJ012834)의 지원에 의해 수행되었으며, 이에 감사드립니다.
References
Sarkar A, and Mandal S. Bifidobacteria-Insight into clinical outcomes and mechanisms of its probiotic action. Microbiological Research 2016;192:159-171.


Felis GE, and Dellaglio F. Taxonomy of Lactobacilli and Bifidobacteria. Current Issues in Intestinal Microbiology 2007;8:44-61.

Mitsuoka T, and Kaneuchi C. Ecology of the bifidobacteria. The American Journal of Clinical Nutrition 1977;30:1799-1810.


Gibson GR, and Wang X. Enrichment of bifidobacteria from human gut contents by oligofructose using continuous culture. FEMS Microbiology Letters 1994;118:121-127.


Gibson GR, and Wang X. Regulatory effects of bifidobacteria on the growth of other colonic bacteria. The Journal of Applied Bacteriology 1994;77:412-420.

Russell DA, Ross RP, Fitzgerald GF, and Stanton C. Metabolic activities and probiotic potential of bifidobacteria. International Journal of Food Microbiology 2011;149:88-105.


Xiao JZ, Kondo S, Takahashi N, Miyaji K, Oshida K, Hiramatsu A, Iwatsuki K, Kokubo S, and Hosono A. Effects of milk products fermented by Bifidobacterium longum on blood lipids in rats and healthy adult male volunteers. Journal of Dairy Science 2003;86:2452-2461.

He T, Priebe MG, Zhong Y, Huang C, Harmsen HJ, Raangs GC, Antoine JM, Welling GW, and Vonk RJ. Effects of yogurt and bifidobacteria supplementation on the colonic microbiota in lactose-intolerant subjects. Journal of Applied Microbiology 2008;104:595-604.

Le Leu RK, Hu Y, Brown IL, Woodman RJ, and Young GP. Synbiotic intervention of Bifidobacterium lactis and resistant starch protects against colorectal cancer development in rats. Carcinogenesis 2010;31:246-251.


Ranadheera RDCS, Baines SK, and Adams MC. Importance of food in probiotic efficacy. Food Research International 2010;43:1-7.

Hyronimus B, Le Marrec C, Sassi AH, and Deschamps A. Acid and bile tolerance of spore-forming lactic acid bacteria. International Journal of Food Microbiology 2000;61:193-197.

George Kerry R, Patra JK, Gouda S, Park Y, Shin HS, and Das G. Benefaction of probiotics for human health: a review. Journal of Food and Drug Analysis 2018;26:927-939.


Oh S, Kim SH, and Worobo RW. Characterization and purification of a bacteriocin produced by a potential probiotic culture, Lactobacillus acidophilus 30SC. Journal of Dairy Science 2000;83:2747-2752.

Choi HJ, Kim JY, Shin MS, Lee SM, and WK. L. Immuno- enhancing Effects of Lactobacillus salivarius JWS 58 and Lactobacillus plantarum JWS 1354 isolated from duck. Korean Journal of Veterinary Research 2011;51:281-288.
Choi HJ, Shin MS, Lee SM, and Lee WK. Immunomodulatory properties of Enterococcus faecium JWS 833 isolated from duck intestinal tract and suppression of Listeria monocytogenes infection. Microbiology and Immunology 2012;56:613-620.


Akira S, Hirano T, Taga T, and Kishimoto T. Biology of multifunctional cytokines: IL 6 and related molecules (IL 1 and TNF). FASEB Journal : Official Publication ofthe Federation of American Societies for Experimental Biology 1990;4:2860-2867.

Tejero-Sarinena S, Barlow J, Costabile A, Gibson GR, and Rowland I. Antipathogenic activity of probiotics against Salmonella Typhimurium and Clostridium difficile in anaerobic batch culture systems: is it due to synergies in probiotic mixtures or the specificity of single strains? Anaerobe 2013;24:60-65.


Yasui H, Kiyoshima J, and Hori T. Reduction of influenza virus titer and protection against influenza virus infection in infant mice fed Lactobacillus casei Shirota. Clinical and diagnostic laboratory immunology 2004;11:675-679.


Park HE, and Lee WK. Immunomodulatory effects of mixed Weissella cibaria JW15 with water extract of black soybean and burdock on Listeria monocytogenes infection in mice. J Biomed Transl Res 2017;18:1-6.
Ryu JS, Han SK, Shin MS, and WK. L. In vitro selection of lactic acid bacteria for probiotic use in pig. KoreanJournal of Veterinary Service 2009;32:33-41.
Fleming HP, Etchells JL, and Costilow RN. Microbial inhibition by an isolate of Pediococcus from cucumber brines. Applied Microbiology 1975;30:1040-1042.


Ahn SB, Park HE, Lee SM, Kim SY, Shon MY, and Lee WK. Characteristics and immuno-modulatory effects ofWeissella cibaria JW15 isolated from Kimchi, Korea traditional fermented food, for probiotic use. J Biomed Res 2013;14:206-212.

Park SM, Park HE, and Lee WK. Selection and immunomodulatory evaluation of lactic acid bacteria suitable for use as canine probiotics. Korean J Vet Res 2015;55:81-88.

Matsumoto M, Ohishi H, and Benno Y. H+-ATPase activity in Bifidobacterium with special reference to acid tolerance. International Journal of Food Microbiology 2004;93:109-113.


Lin WH, Hwang CF, Chen LW, and Tsen HY. Viable counts, characteristic evaluation for commercial lactic acid bacteria products. Food Microbiology 2006;23:74-81.


Ding WK, and Shah NP. Acid, bile, and heat tolerance of free and microencapsulated probiotic bacteria. Journal of Food Science 2007;72:M446-450.


El-Kholy, AM., El-Shinawy SH., El-Shinawy, AMS. Meshref, and Korny AM. Screening of antagonistic activity of probiotic bacteria against some food-borne Pathogens. Journal of Food Biosciences and Technology 2014;4:1-14.
Tejero-Sarinena S, Barlow J, Costabile A, Gibson GR, and Rowland I. In vitro evaluation of the antimicrobial activity of a range of probiotics against pathogens: evidence for the effects of organic acids. Anaerobe 2012;18:530-538.


Forestier C, De Champs C, Vatoux C, and Joly B. Probiotic activities of Lactobacillus casei rhamnosus: in vitro adherence to intestinal cells and antimicrobial properties. Research in Microbiology 2001;152:167-173.

Erickson KL, and Hubbard NE. Probiotic immunomodulation in health and disease. The Journal of Nutrition 2000;130:403S-409S.


Kim DW, Cho SB, Lee HJ, Chung WT, Kim KH, Hwangbo J, Nam IS, Cho YI, Yang MP, and Chung IB. Comparison of cytokine and nitric oxide induction in murine macrophages between whole cell and enzymatically digested Bifidobacterium sp. obtained from monogastric animals. Journal of Microbiology 2007;45:305-310.

Kim DW, Cho SB, Yun CH, Jeong HY, Chung WT, Choi CW, Lee HJ, Nam IS, Suh GH, Lee SS, and Lee BS. Induction of cytokines and nitric oxide in murine macrophages stimulated with enzymatically digested lactobacillus strains. Journal of Microbiology 2007;45:373-378.

Park SY, Ji GE, Ko YT, Jung HK, Ustunol Z, and Pestka JJ. Potentiation of hydrogen peroxide, nitric oxide, andcytokine production in RAW 264.7 macrophage cells exposed to human and commercial isolates of Bifidobacterium. International Journal of Food Microbiology 1999;46:231-241.

He F, Morita H, Hashimoto H, Hosoda M, Kurisaki J, Ouwehand AC, Isolauri E, Benno Y, and Salminen S. Intestinal Bifidobacterium species induce varying cytokine production. The Journal of Allergy and Clinical Immunology2002;109:1035-1036.