Introduction
Mycoplasma spp.는 호흡기나 생식기 등의 각종 장기에 감염되어 심각한 질병을 유발하는데, 특히 사람과 동물에서 폐렴에 의한 사망을 유발하기 때문에 인체 병원체로도 중요하지만 농축산 산업에도 막대한 손실을 초래할 수 있는 세균이다[1-3]. Mycoplasma spp.는 세포벽이 없어 세포벽 합성을 저해하는 페니실린이나 스트렙토마이신과 같은 항생물질에 내성이 있고, 크기가 0.15~0.8 ㎛정도로 작고 다형적(pleomorphic)으로 변형되기 때문에 여과멸균에 의하여 제거되기 어려운 것으로 알려져 있다[4,5].
수의학적 측면에서 돼지 Mycoplasma spp. 감염에 의한 폐렴은 전세계적으로 발생되고 있으며 돼지를 생산하는 거의 모든 나라에서 양돈 산업의 생산성을 떨어뜨리는 중요한 병원체로 문제가 되고 있어 Mycoplasma spp. 감염 여부를 신속히 진단하고 야외 임상 균주를 분리 배양하는 것은 경제적 측면이나 질병 관리 측면에서 매우 중요하다[2,6,7]. Polymerase chain reaction (PCR) 방법은 Mycoplasma spp.의 적은 DNA 양도 검출할 수 있기 때문에 민감도가 높은 방법이다. 따라서 최근 Mycoplasma spp. 감염을 진단하는 수단으로써 널이 사용되어 왔다[8- 10]. 국가검정동물용의약품검정 기준에 따르면 약품에서 Mycoplasma spp. 오염 여부를 확인하기 위한 세균시험으로 직접배양법을 이용한 Mycoplasma spp. 부정시험법을 적용하고 있다[11]. Mycoplasma spp.의 분리 배양은 시간이 많이 소요될 뿐만 아니라, 분리배지의 조성, 시료의 특성 및 배양조건 등 많은 요인에 의해 영향을 받을 수 있다는 단점이 있다[9,11]. 그러나 Mycoplasma spp.세균의 연구와 백신 개발 등의 관련 연구를 위해서는 야외에서 임상 감염된 개체들로부터 Mycoplasma spp.의 분리 배양이 필요하다[7,12-14].
본 연구는 분리 배양이 어려운 Mycoplasma spp.를 야외 임상 감염된 개체들로부터 신속 분리 배양할 수 있는 방법을 개발하고자 계획되었다.
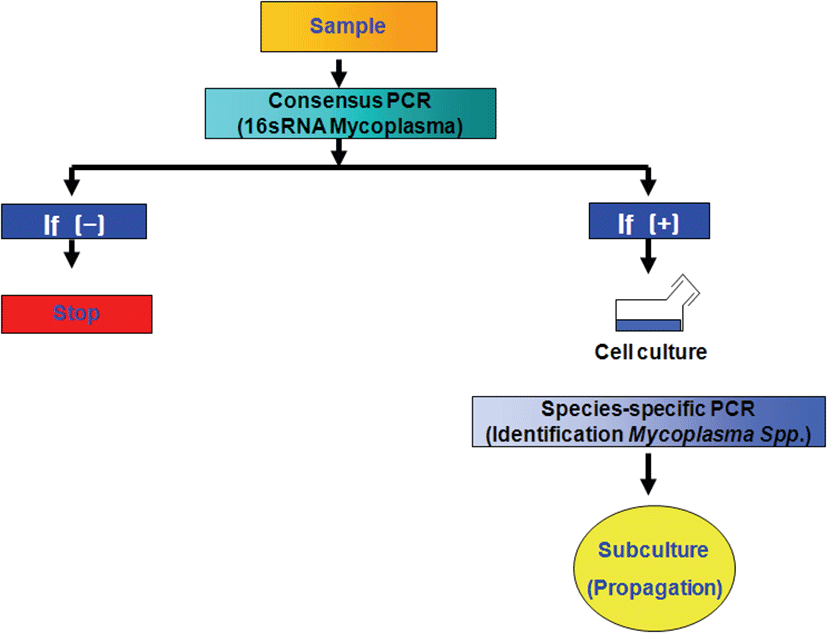
본 연구에서는 Mycoplasma spp.를 야외 임상 감염된 개 체 들 로 부 터 신 속 분 리 배 양 할 수 있 는 방 법 으 로 검체로부터 DNA 추출 없이 d i r e c t P CR을 수행 후 Mycoplasma spp. 감염이 확인된 폐장의 병 변 부위 샘플로부터 최적화 배지를 이용하여 2회 계대 배양 후 분리 배양의 성공 여부를 PCR 결과를 확인하는 방법을 고안하여 수행하였다(Fig. 1). 폐렴이 있는 돼지의 폐장을 샘플링 하기 위해서 전북 익산시에 소재하고 있는 (주)축림 도축장과 협약을 통하여 도축 돼지의 폐장으로부터 가검물 샘플링을 하였다. 도축 돼지의 폐장으로부터 Mycoplasma spp. 육안 병변이 확인된 폐장의 일부를 샘플링하여 실험실 내에서 무균적으로 재료를 채취하고 0.1g의 가검물 일부를 이용하여 Mycoplasma spp. 신속진단을 수행하고 음성 결과 샘플 가검물은 폐기하고, Mycoplasma spp. 신속진단 결과가 양성인 가검물만 분리배양 샘플로 사용하였다. 야외 샘플에서 Mycoplasma spp. 신속 진단은 PhireⓇ Animal Tissue Direct PCR Kit (Thermo Fisher Scientific Dharmacon Products, Lafayette, USA)를 이용하였다. Mycoplasma spp.에 감염된 돼지 폐장의 폐렴 병변 부위 일부를 채취하여 Kit의 tube 안에 넣고 개발한 Mycoplasma universal primer 쌍과 kit buffer를 넣은 후 Mycoplasma consensus PCR을 바로 실시하였다. Mycoplasma consensus PCR은 DNA thermal cycler (PTC-100 Thermocycler, MJ Research, USA)를 이용하여 반응을 실시하였다. Mycoplasma spp. PCR을 위한 시발체는 Forward primer (F; 5' CTC TTT GTA CCG GCC ATT GT 3')와 Reverse primer (R; 5' GAA TGA CAG ATG GTG CAT GG 3')로 증폭크기는 215 bp이었다. PCR을 위한 반응시약의 조성은 1 ㎕ Forward와 Reverse primer (10 pmol/㎕), 2.5 ㎕ 10× reaction buffer, 500 ㎛ dNTPs, 1.5 U Taq polymerase를 각각 넣고, 25 ㎕의 반응량이 되도록 멸균된 증류수를 첨가하였다. PCR 반응조건은 95℃ 5분 (predenaturation), 95℃ 1분 (denaturation), 55℃ 1분 (annealing), 72℃ 1분 (extension), 30 cycles과 72℃ 3분 (post-polymerization)의 조건으로 thermal cycler (Gene Amp 9,700, Perkin Elmer, USA)를 사용하였다. PCR 증폭 산물은 1.5% agarose에 넣고 100 volt에서 20분간 전기영동하여 ethidium bromide로 염색한 후 Gel- Documentation system (Uvitec cambridge, EEC)을 이용하여 Mycoplasma spp.들에 특이적인 215 bp의 밴드 유무를 확인하였다.
개발된 M y c o p l a s m a s p p . 신속진단법을 수행하여 함유되지 않은 샘플 가검물은 폐기하고, Mycoplasma 양성인 가검물을 실험실 내 무균 작업으로 폐장샘플의 1 g을 무균적으로 채취하여 사전 멸균된 유발에 넣고 멸균 가위로 세절하고 2 ㎖의 Mycoplasma spp. 배지를 넣은 후, 멸균 막대로 갈아 유제(homogenate)를 만들었다. 유제화된 가검물은 상온에 1분간 정체하여 폐장 조직 잔여물을 침전시킨 후, 상층액은 Mycoplasma spp. 분리 배지에 접종하였다. Mycoplasma spp. 분리 배지는 Hanks' Balanced salt solution (Gibco, Korea), Mycoplasma Broth Base (Oxoid, USA), Brain Heart Infusion (Oxoid, USA), Yeast Extraction (Duchefa, USA), Thalium Acetate (Sigma, USA), Ampicillin (Sigma, USA), Porcine serum (Gibco, Korea), Glucose (Sigma, USA), Phenol red (Sigma, USA)를 함유하여 조제하였다. 가검물 유제를 분리 배지에 접종한 후, 37℃에서 5% CO2 함유 incubator에서 4일 동안 배양하고 계대 배양을 하였다. 계대 배양은 2번에 걸쳐 추가로 새로운 Mycoplasma spp. 배지에 접종하여 수행한 후, 배지의 색깔이 붉은색에서 노란색으로 변하면 Mycoplasma spp.가 자란 것으로 추정할 수 있었다. Mycoplasma spp. 배양의 육안적 추정으로 배지의 색깔이 변한 최대희석 배수의 역지수를 Color Change Unit (CCU)로 활용하는 방법을 이용하였다.
계대 배양 후 Mycoplasma spp.의 분리 배양 성공 여부는 개발된 M y c o p l a s m a u n i v e r s a l p r i m e r s 를 이용한 Mycoplasma consensus PCR을 실시하여 확인하였다. 배양액으로부터 DNA 추출은 b e a d b e a t e r - p h e n o l e x t r a c t i o n m e t h o d 를 사용하였다. 배양된 균주들을 13,000 g에서 30분 동안 원심분리하여 얻은 펠렛 검체를 1 ml 멸균 증류수가 들어있는 mini-Bead Beater (Biospec product) 전용 2 ㎖ 튜브에 무균 채취하여 세절한 후 멸균 3차 증류수에 부유시킨 glass bead (0.1 mm size, Biospec product) 200 ㎕와 phenol-chlorform-isoamyl alcohol 용액 [50:49:1 (v/v/v)] 200 ㎕를 넣어 mini-Bead Beater (Biospec product)로 30초간 5,000 rpm으로 진탕하였다. 진탕 후 4 ℃에서 12,000 rpm으로 15분간 원심분리한 후 상층액을 멸균 2 ㎖ 튜브에 옮겼다. 3 m 초산나트륨(sodium acetate) 10 ㎕와 ice-cold 에탄올 250 ㎕를 넣어 -20℃에서 10분간 정체시킨 후, 15,000 rpm으로 15분간 원심분리 하였다. 침전물은 70% 알코올로 세척하여 실온에서 건조시키고 Tris EDTA (pH 8.0) 60 ㎕에 용해시켜 실험에 사용하였다. 배양액으로부터 추출한 DNA 샘플들은 앞서 서술한 Mycoplasma consensus PCR 조건으로 반응 후 PCR 증폭 산물은 1.5% agarose에 넣고 1 0 0 v o l t 에 서 20분간 전기영동하여 e t h i d i u m bromide로 염색한 후 Gel-Documentation system (Uvitec cambridge, EEC)을 이용하여 Mycoplasma spp.에 특이적인 215 bp의 밴드 유무를 확인하였다.
육안적으로 Mycoplasma spp. 감염 병변이 확인된 도축 돼지 폐장으로부터 폐렴 병소의 조직을 채취하여 PhireⓇAnimal Tissue Direct PCR Kit를 이용하여 별도의 DNA 추출과정 없이 DNA thermal cycler를 이용하여 반응을 PCR 반응을 실시한 결과, Mycoplasma spp.에 특이적인 215 bp의 산물의 증폭을 확인할 수 있었다 (Fig. 2). Mycoplasma spp. 감염 소견을 보이는 도축 돼지의 폐장 샘플 유제(homogenate)를 만들어 Mycoplasma spp. 분리 배지에 접종하고 4일 후 계대 배양을 실시한 후 분리 배양 배지의 색깔이 붉은색에서 노란색으로 변하는 것을 확인하여 Mycoplasma spp.의 배양 시 증가되는 CCU의 변화를 확인할 수 있었다(Fig. 3). 계대 배양 후 Mycoplasma spp.의 분리 배양 성공 여부를 확인하기 위하여 배양액으로부터 D N A 추출 후 M y c o p l a s m a universal primers를 이용한 Mycoplasma consensus PCR을 실시한 결과 Mycoplasma spp.들에 특이적인 215 bp의 밴드를 확인할 수 있었다(Fig. 4).
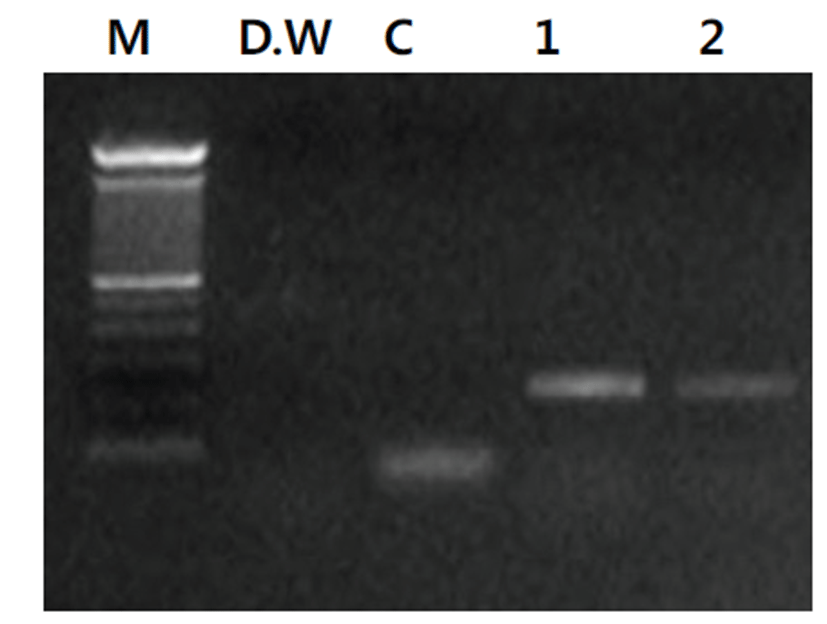

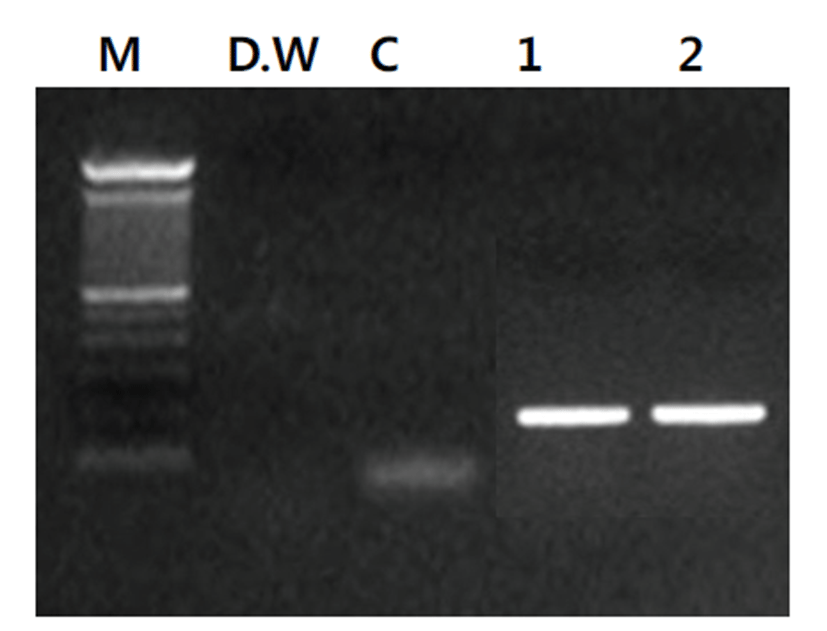
Mycoplasma spp.들은 세포 배양이 까다롭고 분리가 어려우며 검출에 오랜 시간과 노력이 소모된다[9,11,15- 1 8 ] . 그 러 나 Mycoplasma spp.의 백 신 주 확 보 나 관 련 연 구 들 을 위 해 서 는 야 외 에 서 임 상 감 염 된 개 체 들 로 부 터 Mycoplasma spp.의 분 리 및 배양이 필 수 적 이 다 [ 1 2 - 1 4 , 1 8 ] . 본 연 구 에 서 육 안 적 으 로 Mycoplasma spp. 감 염 에 의 한 폐 렴 으 로 의심되는 도 축 돼 지 의 폐 장 조 직 검체로부터 D N A 추 출 없이 PhireⓇAnimal Tissue Direct PCR Kit를 이용하여 direct PCR을 수행 후, Mycoplasma spp. 감염을 확인하는 전략을 수행하여 조직 처리에 소요되는 시간을 절약하고 Mycoplasma spp.가 검체에 들어있는지를 정확히 예측할 수 있었다. 이후 Mycoplasma spp.의 분리 배양에 최적화된 배지를 이용하여 배양 시간을 단축할 수 있었다. 육안적으로 Mycoplasma spp. 감염의 소견을 보이는 도축 돼지의 폐장 샘플을 일부 채취하여 PhireⓇ Animal Tissue Direct PCR Kit를 이용하여 별도의 DNA 추출과정이 필요 없이, 순수하게 Mycoplasma universal primer 쌍에 기초한 PCR 반응으로 Mycoplasma spp. 감염 여부를 확인할 수 있었다. 별도의 DNA 추출과정이 필요 없는 이유는 kit에 포함되어 DNA Release™ Additive의 작용에 의해서 별도의 과정 없이 Thermocycler에서 바로 DNA 추출이 이루어질 수 있기 때문이었다. 또한 PCR 과정에 DNA binding domain과 함께 특별히 고안된 PhireⓇ Hot Start II DNA Polymerase는 동물조직 내에 다량 존재하는 많은 량의 PCR inhibitors들의 영향을 효과적으로 제거해준다[19]. 본 연구에서 샘 플 폐 장 조 직 을 D N A 추출과정 없이 PhireⓇAnimal Tissue Direct PCR Kit에 들어있는 buffer에 넣고 각각 1 ㎕의 Mycoplasma universal primer (10 pM/㎕) 쌍을 추가한 후 DNA thermal cycler를 이용하여 반응을 실시하여 Mycoplasma spp. 감염 여부를 2시간 내에 확인할 수 있었다.
본 연구에서 확립한 방법으로 도축장에서 육안적으로 확인한 돼 지 폐장의 Mycoplasma spp. 병 변 부위의 샘플로부터 Mycoplasma spp. 함유 여부를 신속히 확인할 수 있기 때문에, 분리 배양 대상 가검물 샘플의 선정이 용이하며, 분리 배양 성공 가능성을 극대화할 수 있다. 또한 개발된 Mycoplasma universal primer를 이용한 Mycoplasma spp. 신속진단을 통하여 Mycoplasma spp.에 감염되지 않은 샘플 가검물은 폐기하고, Mycoplasma spp.에 양성이 확인된 가검물만을 유제로 만들어 Mycoplasma spp. 분 리 배양을 위 한 샘플로 사용하는 프로토콜을 확립하였다. 기존 Mycoplasma spp.의 분리 배양에 14일 이상의 시간이 소요되고 배양 또한 잘 되지 않아 야외 임상 감염 돼지로부터 Mycoplasma spp.의 분리가 어려운 것으로 알려져 있다[2,18,20,21]. 본 연구에서는 Mycoplasma spp. 감염을 신속히 확인하고 유제 샘플을 Mycoplasma spp. 배양에 최적화된 배지에 접종하여 배양함으로써 분리 배양 성공률이 높아질 수 있고 분리에 소요되는 시간도 단축될 수 있는 것으로 확인되었다.
본 연구의 결과 돼지 Mycoplasma spp.의 신속 분리 배양을 위한 방법을 개발하였다. 이러한 결과의 활용을 통하여 양돈 농가에 막대한 경제적 손실을 유발하는 Mycoplasma spp.의 신속한 분리 배양이 가능하고 백신 후보주 확보와 관련 연구에 기여할 것으로 판단되었다.







