A형 인플루엔자 바이러스는 Orthomyoxoviridae과에 속하는 RNA 바이러스로 사람, 가금, 돼지, 말 등에 감염성을 가지며, 전 세계적으로 유행하여 연간 약 250,000명이 사망하는 등 사람과 가축에 공중보건학적 및 경제적 피해를 야기한다 [1,2]. 이로 인해 A형 인플루엔자 바이러스에 대한 항바이러스제의 개발은 세계적으로 지속적인 관심사가 되어 왔으며, 보다 안전하고 광범위한 항바이러스제의 개발을 위한 다양한 방법들이 시도되고 있고, 그 중에서 천연 물질들 중 항바이러스 물질의 탐색 역시 한가지의 방법으로 지속적으로 연구되어 왔다 [3]. 이러한 천연 물질들 중 식물성 천연물들은 역사적으로 경험적 지식에 기반하여 바이러스 감염에 대한 치료 및 예방 목적으로 사용되어 왔고, 현대 의약품 자원의 약 40%를 차지하는 식물성 천연물은 분 석 기술의 발전에 힘입어 다양한 바이러스들에 대한 항바이러스제로서의 응용 가능성이 밝 혀 지 고 있 다 [ 4 - 8 ] . 하 지 만 아 직 도 많 은 식물성 천연물들은 그 활용의 역사가 지엽적이고, 구체적인 작용 기전이 검증되지 않아 많은 추가 연구가 필요한 실정이다 [9]. 즉, 기존의 합성 항바이러스제들의 이용과 더불어 이를 효율적으로 대체할 수 있는 자원인 식물성 천연물과 그 유래 물질들의 탐색 및 연구의 필요성이 점차 커지고 있다 [10-12].
본 연구에서는 인플루엔자 바이러스에 대 한 새로운 항바이러스 제제를 발견하기 위해 200여 가지의 천연 한방 생약을 탐색하였고, 그 중 단삼(Salvia miltiorrhiza)이 인플루엔자 바이러스에 대해 항바이러스 효능이 있다는 것을 확인하였다. 단삼은 S a l i v a 속에 속하는 다년생 식물로, 단삼의 뿌리가 약 이천년에 걸쳐 전통 의학에서 약재로 이용되어 왔다 [13,14]. 단삼은 관상동맥질환, 급성 심근성 경색 등의 심혈관계 및 뇌혈관 질환에 대한 치료제로 사용되어 왔을 뿐 아니라 [15], 항산화효과와 항염증 효과가 밝혀지는 등 임상적으로 다양한 질환에 대해서 응용될 수 있음이 연구되었다 [16]. 또한, 단삼에 의한 면역 조절 효과를 비롯해 Enterovirus-71이나 SARS-associated coronavirus에 대한 항바이러스 효과 역시 보고된 바 있다 [17-19]. 따라서 이러한 연구 결과와 방향에 대한 확장으로 본 연구에서는 지금껏 연구되지 않은 단삼의 항-인플루엔자 효능을 in vivo에서 다양한 혈청형 (H1N1, H5N2, H7N3, H9N2)의 인플루엔자 바이러스에 대해 검증하였다.
본 연 구 의 주 재 료 인 건 조 단 삼 은 제 천 약 제 시 장 (Jaecheon, Korea) 에서 구매한 뒤 품질 검증 과정을 거 쳐 수 용 성 추 출 에 사 용 하 였 다 ( K i - H w a n B a e , College of Pharmacy, Chungnam National University, Korea). 건조 단삼의 열수 추출은 1L의 증류수에 100g의 건조 단삼을 혼합한 뒤 중탕기(Gyeongseo Extractor Cosmos-600, Incheon, Korea)를 이용해 105℃에서 2 시 간 3 0 분 동 안 가 열 시 키 는 방 법 으 로 수행하였다 (Vitabio Corporation, Daejeon, Korea). 추출물은 0.45 ㎛ 필터(MillexⓇ, Darmstadt, Germany)에 통과시켜 4도에서 24시간 동안 보관한 후 12,000rpm에서 15분간 원심분리하여 pH를 7.0으로 조절하였다. 이후 추출물을 0.22 ㎛ 필터(MillexⓇ, Darmstadt, Germany)에 통과한 뒤 동결건조 했으며 실험 농도에 맞게 PBS에 용해해 실험에 사용하였다. 실험용 BALB/c 마우스는 샘타코(Samtako, Korea)에서 구매한 5주령 암컷을 그룹당 5마리로 구성해 실험에 이용하였다. 단삼 추출물은 0.1㎎/㎖의 농도로 2 0 0 ㎕씩 3 번 , 격일로 경구투여 했으며(20㎍/head) 대조군에는 같은 용량의 PBS를 투여하였다. 단삼 추출물의 마지막 투여 후 24시간째에 마우스를 Avertin(2,2,2- tribromoethanol, 2-methyl-2-buranol, Sigma)을 이용해 마취하였으며 마우스 반수치사량(LD50; Lethal D o s e 5 0 % ) 의 5 배 에 해당하는 용량의 마우스 특이 인플루엔자 바이러스 {A/Aquatic bird/Korea/W81/2005 ( H 5 N 2 ) } , { A / P R / 8 / 3 4 ( H 1 N 1 ) } , { A / A q u a t i c bird/Korea/W44/2005 (H7N3)}, or {A/Chicken/ Korea/116/2004 (H9N2)} 들을 각각 30 ㎕에 희석하여 비강 내 접종으로 감염시켰다. 감염 후 13일 동안 마우스의 체중을 확인하였으며, 인도적인 동물실험을 위해 25% 이상의 체중 손실이 확인된 마우스는 안락사 후 바이러스에 의한 폐사로 간주하였다.
마우스 폐에서 증식한 바이러스의 양은 세포감염용량 (TCID50; Tissue Culture Infective Dose 50%)을 측 정 하 여 확 인 하 였 다 . 마 우 스 생 존 율 비 교 시 험 과 마찬가지로 단삼 추출물을 투여한 그룹과 PBS를 투여한 그 룹 의 마 우 스 를 A 형 인 플 루 엔 자 바 이 러 스 ( H 1 N 1 혈청형)에 감염시키고 감염 후 3일째와 5일째에 마우스의 폐를 무균적으로 분리하였다. 분리된 폐 샘플은 항생제 (penicillin and streptomycin, Gibco)와 항진균제 (Fu n g i z o n e , Gi b c o )가 함유된 PBS 500 ㎕와 함께 조직파쇄기(TissueLyser, Qiagen)에서 파쇄시킨 후 12,000 rpm에서 15분간 원심분리 후 상층액을 분리해 실험에 이용되었다.
TCID50의 측정은 Madin-Darby Canine Kidney (MDCK) 세포주에서 수행하였다. 9 6 - w e l l p l a t e 에 70~80%의 정도로 세포를 분주한 뒤 분리한 폐의 상층액 샘플을 DMEM에 10배 희석배수로 희석하여 50 ㎕를 희석 배수당 4 well씩 감염시켜 37℃에서 배양하였다. 한 시간 후 DMEM을 제거하고 L-1-tosylamido-2- phenylethyl chloromethyl ketone (TPCK) trypsin (Thermo Fisher Scientific)을 함유한 배지를 넣어 이후 72시간 동안 배양하였다. 또한, 단삼 추출물의 세포독성을 MTT assay를 이용하여 HEK293T와 HeLa 세포주에서 측정하였다. 96-well plate에 세포를 분주 한 후 단삼 추출물을 농도별로(1-100㎍/㎖) 처리해 37℃에서 24시간 배양하였다. 모든 실험은 3 반 복 수행하였다. 24시간 후 MTT assay 시약을 각 well에 10 ㎕씩 처리 한 후 37℃ 인큐베이터에서 1시간 반응을 시킨 후 450㎚ 분광 광도계를 이용하여 흡광도 값을 측정하였다.
본 실 험 의 결 과 로 서 , 단 삼 추 출 물 의 항인플루엔자 효능을 확인하기 위해 단삼 추출물을 투여한 마우스와 PBS를 투여한 마우스에 다양한 혈청형의 인플루엔자 바이러 스 들 을 감염시킨 후 바이러스 감염으 로 인해 나타나는 마우스의 변화를 확인하였다. 실험에 사용된 혈청형이 다른 인플루엔자 바이러스 H 1 N 1 , H 5 N 2 , H7N3, H9N2등은 마우스 특이적인 바이러스들로 모든 혈청형의 바이러스가 마우스에 치명적인 호흡기 증상을 유도해 폐사시키는 것이 선행 실험에서 확인되었다(data not shown). 실험 결과, 바이러스 감염 후 3~4일째부터 PBS를 투여한 대조군 마우스에서 활력 저하, 피모 상태의 불량과 같은 바이러스 감염에 대한 증세를 나타내었으며 9 일 째 에 모 든 마 우 스 에 서 치 명 적 인 체 중 의 감 소 가 확인되었다. 반면 단삼 추출물을 경구투여한 실험군에서는 대부분의 마우스에서 7일째까지의 체중 감소가 20% 이하로 나타났으며 8일째부터 체중의 회복이 시작되어 13일째에는 완전히 회복하였다. 상기와 같은 실험결과는 모든 혈청형에 대한 감염에서 비슷하게 확인되었다. 단삼 추출물 투여군은 H1N1, H7N3 감염에 대해서는 80%의 생존율을 나타내었고 (Fig. 1A and 1C), H5N2, H9N2 감염에 대해서는 100%의 생존율을 나타내었다 (Fig. 1B and 1D). 이후 13일째까지 회복한 마우스들은 감염 증상을 나타내지 않았으며 지속적인 체중의 증가가 확인되었다. 반면, PBS를 투여한 대조군에서는 H1N1 감염에 대해서 8일째에, H5N2, H7N2, H9N2 감염에 대해서는 10일째에 모든 마우스가 25% 이상의 체중 감소를 보여 실험동물 윤리지침에 따라 안락사 되어 폐사한 것으로 처리되었다. 두 그룹 간의 유의적인 차이는 단삼 추출물 투여에 의해 마우스가 A형 인플루엔자 바이러스 감염에 대해 보다 높은 저항성을 가지는 것을 나타내며, 이는 단삼 추출물이 인플루엔자 감염에 대한 생체의 방어능력을 증강시키는 천연 생약 물질임을 의미한다.
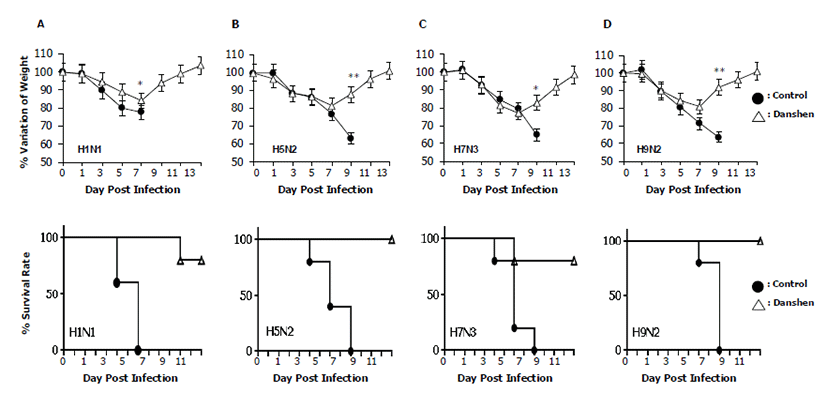
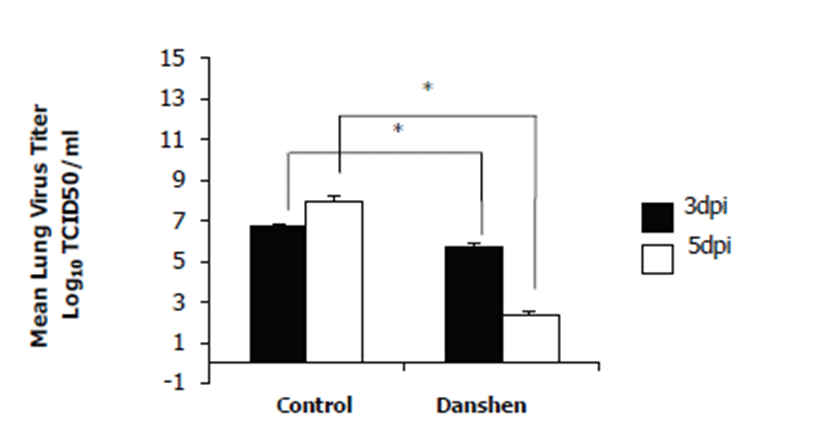
더 나아가서, 인플루엔자 감염에 대한 PBS 대조군과 단삼 추출물 실험군의 생존율 차이가 바이러스의 생체 내 증식의 차이로부터 초래하였음을 증명하기 위해 상기의 실험과 같은 방법으로 마우스군에 각각 PBS와 단삼 추출물을 투여한 다음, H1N1 인플루엔자 바이러스를 감염시켰다. 인플루엔자 바이러스는 주로 aerosol의 형태로 호흡기를 통해 전파되며 폐에서 증식이 이루어지기 때문에, 각 그룹에 속한 마우스의 폐를 3일째와 5일째에 샘플링 하였다. 폐 조직을 분쇄해 바이러스의 증식 정도를 TCID50 측정을 통해 확인한 결과, PBS 대조군에서의 바이러스 증식은 3일째와 5일째에서 각각 6.7 log TCID50/㎖, 7.9 log TCID50/㎖ 로 나타났으며, 단삼 추출물 실험군에서는 각각 5.5 log TCID50/㎖, 2.07 log TCID50/㎖ 로 나타났다 (Fig. 2). 즉, 감염 후 3일째와 5일째 모두 단삼 추출물 실험군에서 PBS 대조군에 비해 낮은 양의 바이러스가 증식했음을 확인하였다. 또한, PBS 대조군의 경우 3일째에 비해 5일째에 더 많은 바이러스가 확인되어 시간이 지남에 따라 바이러스의 증식이 늘어나는 것을 볼 수 있었으나, 단삼 투여군은 감염 후 3일째에 비해 5일째에 더 낮은 바이러스가 측정되어 마우스가 바이러스 감염으로부터 회 복 하 고 있 음 을 확 인 하 였 다 . 이 는 단 삼 추 출 물 투여군에서의 보다 높은 생존율이 생체 내의 바이러스 증식을 억제함으로써 나타난다는 것을 증명하는 결과이다. 본 동물실험 모두는 ㈜바이오리더스의 동물실험에 관한 위원회의 승인을 받아 수행하였다 (동물실험 승인번호: Protocol number: BSL-ABSL-16-004). 마지막으로, 단삼 추출물의 세포독성을 확인하기 위해 단삼 추출물을 각 세포에 농도별로 처리한 뒤 MTT assay를 수행하였다. 실험 결과, 단삼 추출물은 HEK293T 세포주에서는 19.55 ㎍/㎖ ± 0.02, HeLa 세포주에서는 63.66 ㎍/㎖ ± 0.06의 CC50를 나타내었다 (Table 1).
| NCell line. | CC50 ± S.D. (㎍/㎖) |
|---|---|
| HEK293T1 | 19.55 ± 0.02 |
| Hela | 63.66 ± 0.06 |
바 이 러 스 감 염 에 대 한 예 방 또 는 치 료 목 적 으 로 사용되어온 천 연 물질과 그 추출물들은 최근의 분석 기술 발달에 힘입어 현대 신약개발의 새로운 자원으로 주 목 받 고 있 다 [ 2 0 ] . 그 리 고 천 연 물 질 중 식 물 성 천연물은 다양한 감염성 질환에 대한 치료제로서 광범위한 가능성을 내포한다 [21]. 예를 들어, 감초(Glycyrrhiza uralensis fisch)의 성분인 Glycyrrhizin 이나 석산(Lycoris radiata)의 성분인 lycorine은 SARS-CoV을 억제하는 활성을 가지는 것으로 알려져 있다 [22]. 이러한 식물성 천 연 물 들 은 바 이 러 스 에 대 한 저 항 성 을 높 여 주 거 나 , 면역조절인자의 발현을 유도하는 등의 효과를 나타내며 역사적으로 바이러스 감염에 대한 백신이나 치료제가 없는 상황에서 질병 컨트롤의 중요한 옵션이 되어 왔다. 실제로 세계보건기구에 따르면, 이러한 식물성 의약 자원의 혜택을 받고 있는 인구는 전 세계의 80%로 추산된다. 즉, 광범위한 면 역 조 절 능 력 을 통 한 항바이러스제제 로 서 의 식물성 물질들은 끊임없는 바이러스 출현에 대한 항바이러스제 개발의 중요한 한 부분으로 포함되어야 한다 [23,24].
단 삼 역 시 이 러 한 식 물 성 천 연 자 원 의 하 나 로 전통 의학에서 수천 년간 바이러스 감염에 대한 항바이러스제로 사용되어 왔다 [13,14]. 또한 기존에 발표된 연구에서 단 삼 이 E n t e r o v i r u s - 7 1 과 S A R S - a s s o c i a t e d coronavirus를 억제하는 것이 밝혀져 있다 [18,19]. 본 연구에서는, 이러한 단삼의 특성에 기초하여 인플루엔자 감염에 대한 단삼의 예방적 효능을 확인하였다. 단삼의 투여가 선천면 역 혹은 적응면역과 관련한 인자들의 활성을 유도하여 바이러스에 저항성을 높여준다는 가설을 in vivo에서 증명하기 위해 다양한 종류의 인플루엔자 바이러스를 마우스에 감염시킨 후 대조군과 단삼 투여군을 비교했으며, 실험에 사용된 H1N1, H5N2, H7N3, H9N2 혈청형 모두에서 단삼 투여군의 높은 생존율을 확인하였다 (Fig. 1). 또한, 마우스 폐에서의 바이러스를 비교하였을 때 단삼 투여군이 대조군에 비해 낮은 바이러스의 증식을 나타냄 을 확인함으로써 단삼 투여에 의한 바이러스 증식의 억제를 직접적으로 확인하였다 (Fig. 2). 이러한 결과는 단삼이 바이러스 감염에 대 한 예방적 목적의 항바이러스제로써 사용될 수 있음을 의미하며 앞으로의 보다 심도있는 연구개발에 대한 하나의 가능성을 제시한다.
식물성 천연자원을 이용한 in vivo 실험에서의 효능 확인은 해당 자원이 실제로 바이러스 감염에 대한 제제로써 활용될 수 있는 가능성을 제시한다. 그 뿐만 아니라, 이는 해당 자원의 추출물, 즉 그 구성 요소들에 대한 구체적 효능 검증이 필요함을 의미한다. 단삼에는 50여 가지의 수용성 물질과 30여 가지의 지용성 물질을 포함해 대략 80가지의 다른 물질들이 포함된 것으로 알려졌다 [ 25 ]. 대표적 지용성 물질에는 tanshinone IIA와 cryptotanshinone이, 수용성 물질에는 salvianolic acids, protocatechuic aldehyde and acid, danshensu이 있으며 그 외의 물질로는 beta-sitosterol, ursolic acid, baicalin, vitamin E, tannin 등이 있다 [26,27]. Dihydrotanshinone, tanshinone I, tanshinone IIA는 항암 효능, tanshinone IIA (Tan IIA)는 심혈관계 질환에 효능을 가지는 것이 알려져 있다. 따라서 본 연구에서 증명된 단삼의 항바이러스 효능 역시 단삼의 추출물들에 대해서 증명되어야 한다. 이후 연구에서는 단삼의 성분 분석을 위한 HPLC 분석이 선행될 것이며 단삼의 항바이러스 효능을 담보하는 단일 추출물질의 개발이 목적이 될 것이다. 또한, 단삼은 특정 바이러스에 그 효과가 국한되지 않고 다양한 바이러스에 대해 그 효능이 나타나는 것으로 알려져 있다. 즉 특정 바이러스에 대한 기전보다는 숙주의 면역 기전을 자극해 전반적인 항바이러스 효능을 나타내는 것으로 예상된다. 이러한 사실들을 기반으로 in vitro 실험을 통해 분자세포학적 기전에 관한 연구가 수행되어야 할 것이다.







