Original Article
Passage-dependent expression of inward rectifying potassium current in human umbilical cord vein-derived mesenchymal stem cells
Kyung Sun Park1,
Young Gyu Chai1,
Yangmi Kim2
,*

Author Information & Copyright ▼
1Division of Molecular and Life Sciences, Hanyang University, Ansan, 15588, Korea
2Department of Physiology, College of Medicine, Chungbuk National University, Cheongju, 28644, Korea
*Corresponding author: Yangmi Kim, Department of Physiology, College of Medicine, Chungbuk National University, Cheongju, 28644, Korea +82-43-261-2855, +82-43-272-1603
yangmik@chungbuk.ac.kr
© Research Institute of Veterinary Medicine, Chungbuk National University. All rights reserved.
Received: Feb 15, 2017; Revised: Mar 15, 2017; Accepted: Mar 16, 2017
Abstract
Although stem cells are used as important cell therapies in regenerative medicine, the electrophysiological problems that arise in the expansion of cells have not been known much. This study was conducted to investigate the functional expression of inward rectifying K+ current (IKir) using a patch-clamp technique, and the change in the resting membrane potential and the membrane capacitance were investigated in mesenchymal stem cells derived from human umbilical vein (hUC-MSC). The IKir plays an important role in regulating the resting membrane potential in many cells and is known to contribute to the maintenance of intracellular K+ concentration. In this study, electrophysiologically recorded current exhibited typical IKir characteristics. The current shifted along the K+ equilibrium potential (Ek) with the extracellular K+ concentration change. In addition, IKir was blocked by the divalent Ba2+ in a dose-dependent manner. The frequency of functional expression of IKir changed with number of passages (P2: 5.3% vs P8: 77.8% vs P12: 34.5%). There was no significant change in the resting membrane potential of hUC-MSC (P2: -21.0 mV, P8: -20.1 mV and P12: -21.9 mV). However, the capacitance of the cell membrane was significantly changed after P9 (P2: 8.9 pF vs P9: 16.9 pF) compared to P2. All the results suggest that changes in electrophysiological distribution of IKir as the passages increase may cause changes in K+ permeability even in cell proliferation and differentiation, suggesting a possible physiological role in maintaining cell homeostasis and resting membrane potential (RMP).
Keywords: mesenchymal stem cells; inward rectifying K current (IKir); umbilical cord vein; passage; capacitance
Introduction
세포의 포타슘 이온(K+)은 세포에 존재하는 Na+, Ca2+과 같 은 다른 이온들 비해 세포막에 대한 투과성이 훨씬 커서 세포 막전위변화에 제일 큰 영향을 준다[1]. 세포막 단백질인 포 타슘 채널(K channel)이 열리면 농도 경사에 의해 K+ 이온 은 세포밖으로 나가며 세포막전위(membrane potential)를 K+ 평형 전위(K+ equilibrium potential)쪽으로 이동시킨다 [1]. K 채널의 종류는 매우 다양하나 막전위에 조절되는 K 채널(voltage dependent K channel, IKv)[2], 세포내 칼 슘에 의해 활성화 되는 K 채널(Ca2+-activated K channel, IKca)[3], 내향 정류성 K 채널(inward rectifier K channel, IKir) 등이 있다[4]. 이들 중 IKir 패밀리는 13 종류가 있고 IKir1.1~IKir7.1까지 다양하다. 세포내 ATP가 없으면 활성화 되는 K 채널(ATP dependent K channel, IKATP)은 IKir6.x 에 속하며 세포밖 아세틸콜린이 무스카리닉 수용체에 붙으 면 G-단백질 활성화에 의해 조절되는 K 채널(Acetylcholin activated K channel, IKAch)은 IKir3.x 에 속한다[4]. 본 연구에서 보고하는 내향 정류성 K 채널은 우리의 보고에 의 하면 IKir2.x 이다[5].
IKir은 2개의 transmembrane과 하나의 ion pore로 구성 된 채널 단백질로서 Ba2+과 같은 2가 이온에 의해 억제되며 tetraethylammonium (TEA)나 4-ampinopyridine (4- AP)과 같은 고전적 K 채널 차단제에 의해 거의 억제되지 않 는다[4]. IKir은 세포내 K+ 농도 유지와 안정막전위에 크게 기여하는 것으로 알려져 있다[4]. 그 예로 IKir 발현이 거의 없는 심장의 동방결절은 IKir이 많이 존재하는 심실보다 안 정막전위가 저분극 되어있다. 세포내 K+ 농도 유지를 위해 심장세포에서는 IKir가 없다면 ATP를 사용하는 Na-K 펌 프를 더 많이 사용하여야 하므로 더 많은 에너지가 필요하 다. 이러한 결과는 IKir이 세포내 에너지 보존 측면뿐 만 아 니라 안정막전위 유지에도 매우 유용한 채널이라는 것을 제 시한다[4, 6].
심장이나 신경과 같은 흥분성 세포의 이온채널은 흥분성 신호 전달에 매우 중요하다[1]. 비흥분성 세포에서의 이온 채널은 세포 증식, 이주, 세포 사멸에 결정적인 역할을 한다 [7]. 줄기세포에서는 종(species)이나 줄기세포의 기원( 골수, 제대혈 등)에 따라 약간의 차이는 있으나 다양한 이온 채널 즉 IKV, IKCa IKir, ICl, INa ICa, ITRP등이 보고되었다[8]. 줄기세포의 이온채널 또한 다른 세포에서처럼 세포 증식 조 절 및 분화에 관여할 가능성이 제기되어 왔다. [5, 9, 10]
사람의 중간엽 줄기 세포(mesechyaml stem cells, MSC) 는 다양한 조직으로 분화 할 수 있기 때문에 재생의학의 세포 치료분야에서 유망한 재료로 간주되고 있다[8]. 하지만 임 상시험을 하기에는 추출 가능한 줄기세포는 세포수가 적어 세포밖 즉 시험관(in vitro)에서 세포수를 늘려가야 하는 장 애물을 넘어야 한다[11]. 세포증식 과정은 계대배양(subculture) 이 필수적이며 계대배양 횟수 (passage)의 증가에 따라 줄기세포의 고유성질 즉 증식속도나 분화과정에 영향 주어 분화능이 저하될 수 있고[11, 12], 계대 배양시 텔로 미어(telomere) 길이가 짧아져 노화현상이 유발 되기도 한 다 [13].
우리는 이전 논문에서 사람의 제대정맥유래 줄기세포 (hUC-MSC)에서 일과성 외향 K 전류인 Ito는 52%, 막전압 의존성 Na 전류인 INa는 28%, 내향 정류성 K 전류인 IKir은 4.8% 정도 존재함을 확인하였다[5]. 그리고 막전압 의존성 지연성 K 전류인 IKDR과 칼슘에 의해 활성화되는 MaxiK를 항상 기록할 수 있음을 보고 하였다[5]. 또한 hUC-MSC에 서 관찰되는 MaxiK 전류는 플라보노이드(flavonoid)인 케 르세틴(quercetin)및 riluzole에 의해 활성화 됨도 확인하 였고 INa는 riluzole에 의해 억제됨을 보고하였다 [14, 15].
본 연구에서는 미분화 hUC-MSC의 이온채널발현에 대한 후속 연구로 passage 증가에 따라 IKir의 전기생리학적 발현 빈도, 안정막전위의 양상, 세포막의 축전능력(capacitance, Cm)의 변화 등에 대해 보고한다.
Materials and Methods
hUC-MSCs의 분리 및 배양
제대정맥을 모아 6-12 시간 이내에 phosphate buffered saline(PBS)로 세척하여 세포를 분리하였다[5]. 세척된 혈 관에 0.5% collagenase를 넣어 37℃에서 5 시간 동안 처리 후 부드럽게 마사지하여 떨어져 나온 세포를 수집하였다. 수 집된 세포를 10 분 동안 1000 rpm에서 원심 분리 후 약 5 × 105 개의 세포를 75 cm2 배양 플라스크에 넣어 37℃, 5% CO2 인큐베이터에서 배양하였다. 배지는 100 U/mL penicillin, 100 μg/mL streptomycin, 10% FBS (fetal bovine serum)가 포함된 Dulbecco's modified Eagle's mediumlow glucose (DMEM-LG) 배지를 사용하였다. 배양액은 2 일 마다 한 번씩 갈아주었다.
전기생리학적 기록
전기생리학적 실험을 위해 용액은 다음과 같이 구성하였 다. 세포밖 용액(bath 용액)으로 normal tyrode 용액을 사 용하였다. 그 용액은 143 mM NaCl, 5.4 mM KCl, 0.5 mM MgCl2, 1.8 mM CaCl2, 0.5 mM NaH2PO4, 10 mM glucose, 5 mM HEPES로 구성하였고 pH는 NaOH를 이용 하여 7.4로 적정하였다. 세포내 용액인 유리미세전극 용액 (pipette 용액)은 150 mM KCl, 1 mM MgCl2, 10 mM HEPES, 5.0 mM EGTA, 2.0 mM Mg-ATP로 구성하였고 pH는 KOH를 이용하여 7.2로 적정하였다.
전기생리학적 실험은 patch clamp 증폭기(Axopatch 200B, Axon Instruments, Foster City, CA)를 사용하 여 막전위 고정(voltage clamp) 및 막전류 고정(current clamp)법으로 기록하였다. 외경이 1.2 mm 되는 유리미세 전극(Warner Instrument, Hamden, CT)은 유리미세전극 제조기(PP-830, Narishige, Japan)로 제조하였고 유리미 세전극 저항(resistance)은 2~3MΩ이 되게 만들었다. 미세 조작기로 유리미세전극을 세포 근처에 접근 후 세포막에 붙 혀 gigaohm (GΩ) seal이 되게 하고 세포막 파열 후 전체 세 포의 전류(whole cell current)를 기록하였다. 기록된 전류 는 2kHz에서 필터링하고 digidata 1322A (Axon Instruments, Foster City, CA)를 사용하여 컴퓨터에 저장하였 다. 세포막의 커패시턴스 또한 GΩ seal을 만든후 음압으 로 세포막을 조심스럽게 파열하여 pCLAMP 프로그램의 막 테스트(membrane test) 상태에서 측정하였다. 커패시턴스 는 세포 표면적을 반영하므로 커패시턴스가 크다는 것은 세 포의 표면적이 커짐을 의미한다. 전기생리학적 기록과 분석 은 pCLAMP 프로그램(version 9.02, Axon Instruments, CA)을 사용하였다. GΩ seal이 되지 않았을 때 전류를 기록 하면 새어나가는 전류(leak current)가 많아 IKir 전류 분석 에 오류가 발생할 수 있기 때문에 GΩ seal이 되지 않았을 때 기록한 전류는 데이터 분석에서 제외하였다.
데이터 분석
평균 데이터는 Origin software (OriginLab, Corp, Northampton, MA, USA)를 사용하여 분석하고 그렸다. 데 이터는 평균 ± SE (standard error)으로 나타내었다. 계 대별 안정막전위(resting membrane potential, RMP)와 세포막 커패시턴스(capacitance, Cm)는 unpaired (independent) Student's t-test를 사용하였고, P값은 0.05 이 하로 통계학적으로 유의하였다.
Results
미분화 hUC-MSC에서 계대배양 횟수에 따른 안정막전위 및 세 포막 커패시턴스 변화
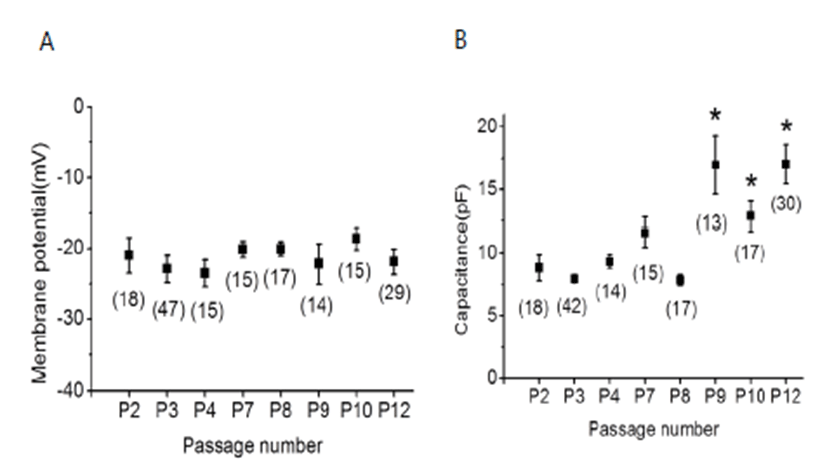
미분화 hUC-MSC에서 patch clamp 기법으로 안정막전 위를 측정하였다. 안정막전위는 전위 고정(current clamp, I=0)법으로 측정하였다. 2 번째 계대(P2) 에서부터 12 번 째 계대(P12)까지의 안정막전위는 Table 1에 나타내었다. P2의 안정막전위는 -21.0 ± 2.5 mV(평균 ± S.E, n=18), P9의 안정막전위는 -22.2 ± 3.8 mV(n=14), P12의 안정 막전위는 -21.9 ± 1.8 mV(n=29)로 passage에 따라 안 정막전위의 유의있는 변화는 관찰되지 않았다 (Fig. 1A와 Table 1).
Table 1.
Relation between number of passage and resting membrane potential in UC-MSC
| Passage |
Mean (mV) |
SE |
N |
| P2 |
-21.0 |
2.5 |
18 |
| P3 |
-22.9 |
1.9 |
47 |
| P4 |
-23.5 |
1.9 |
15 |
| P7 |
-20.2 |
1.1 |
15 |
| P8 |
-20.1 |
1.0 |
17 |
| P9 |
-22.2 |
2.8 |
14 |
| P10 |
-18.7 |
1.5 |
15 |
| P12 |
-21.9 |
1.8 |
29 |
Download Excel Table
Fig. 1.
Changes in resting membrane potential and capacitance with passage in undifferentiated hUC-MSC. (A) The resting membrane potential was measured using the current clamping method (I = 0). There was no significant difference with increasing passage. (B) The change in capacitance was observed to increase significantly from P9 with respect to P2. Data represent the mean ± SE. *, P < 0.05 ( P2 vs P9, P2 vs P10, P2 vs P12)
Download Original Figure
세포막은 인지질 이중층(lipid bilayer)이고 세포내외의 전 해질, 세포밖 공간 및 세포질을 분리하는 얇은 절연체로 축 전능력(capacitance)을 가지고 있는 커패시터(capacitor) 로 작용한다. 세포막 커패시턴스(membrane capacitance, Cm)는 1μF/1cm2 정도되며 세포 표면적에 비례한다. 본 연 구에서 P2~P12까지 계대배양하면서 커패시턴스를 측정하 였다. P9~P12의 커패시턴스가 P2의 커패시턴스보다 2배 이상 증가하였다 (P2:8.9 ± 1.0 pF vs P9:16.9 ± 2.3 pF) 이와 같은 실험 결과는 P9 이상에서는 세포의 크기가 증가되 고 있음을 보여준다(Fig. 1B와 Table 2).
Table 2.
Relation between number of passage and capacitance in undifferentiated hUC-MSC
| Passage |
Mean (pF) |
SE |
N |
| P2 |
8.9 |
1.0 |
18 |
| P3 |
8.0 |
0.3 |
42 |
| P4 |
9.4 |
0.5 |
14 |
| P7 |
11.6 |
1.2 |
15 |
| P8 |
7.8 |
0.4 |
17 |
| P9 |
16.9 |
2.3 |
13 |
| P10 |
12.9 |
1.2 |
17 |
| P12 |
17.0 |
1.6 |
30 |
Download Excel Table
미분화 hUC-MSC에서 내향 정류성 포타슘 채널(inward rectifying K channel, IKir)의 기능적 발현
우리는 2007년 미분화 hUC-MSC에서 이온채널의 기능적 발현을 보고하였고, IKDR이나 MaxiK와 달리 IKir은 4.8% 정도 기록되었다[5]. 본 연구에서는 IKir에만 집중하여 IKir 특성을 비교하였다. 계대배양시 나타나는 IKir의 전기적 특 징 성상은 강한 내향 정류성 경향을 보였다.
hUC-MSC에서 IKir 을 기록하기 위해 유지전압(holding potential)을 0 mV로 하고 -150 mV에서 + 60 mV의 램프 자극을 400 ms 동안 주어 전류-전압 곡선(current-voltage curve, I-V curve)을 기록하였다(Fig. 2 inset). 기록 된 전류가 IKir 인지 확인하기 위한 방법으로 hUC-MSC에 서 whole cell patch mode 에서 전체전류(whole cell current) 를 기록하였다. IKir 전류의 세포밖 K+ 농도([K+]o)의 존성을 조사하기 위해 K+ 농도를 5, 15, 30, 75 및 150 mM 증가시켜주며 기록하였다. Figure 2에서 보여지는 것처럼 [K+]o가 증가함에 따라 IKir의 특성인 내향전류가 증가되는 특징적인 양상을 보였고 역전전위(reversal potential)는 네른스트식(Nernst equation)에 일치하게 양전위로 이동 하였다(Fig. 2). Figure 2B는 [K+]o 변화에 따른 역전 전압 의 변화를 이론치와 실험치를 나타낸 것이다. 점선은 실험값 을 linear regression 한 것이다. 가로축은 [K+]o의 10 배 변 화를 나타낸 것이며 세로축은 막전압을 나타낸 것이다. 실험 값은 이론값(58 mV/decade)에 비해 49 mV의 경사(slop) 을 보여주고 있다. 미분화 hUC-MSC에서 기록한 내향 전류 는 K 전류임을 확인하였다.
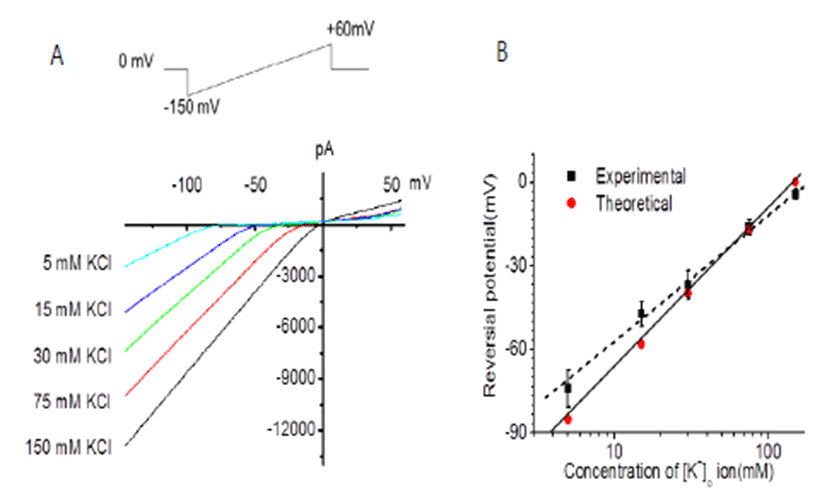
Fig. 2.
Typical IKir current-voltage (I-V) relationship curve and dependence of extracellular K+ concentration [K+]o of IKir in undifferentiated hUC-MSC. (A) It shows the typical characteristics of IKir current recorded in hUC-MSC. The IKir I-V curve shows a larger inward current than outward at negative voltage. The abscissa represents the voltage, and axis represents the current. The current recording was carried out with a holding potential of 0 mV and ramp pulse for 400 ms from -150 mV to + 60 mV. The inset shows voltage protocol. When the [K+]o was increased to 5, 15, 30, 75, and 150 mM, the inward current increased as the [K+] o increased at negative voltage and the reversal potential shifted toward the positive potential according to the Nernst equation. (B) Abscissa is on logarithmic scale. The logarithmic graph shows the reversal potential change with increasing [K+]o. The solid line (theoretical value) shows the slope from Nernst equation (slope, 58 mV/ decade). The dotted line (experiment value) were fitted by linear regression (slope, 49 mV/ decade).
Download Original Figure
미분화 hUC-MSC에서 Kir 전류에 대한 2가 양이온의 효과
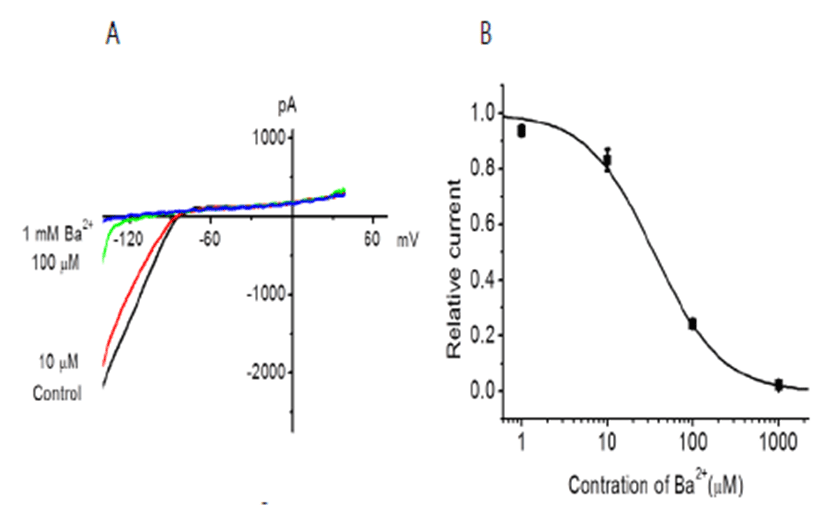
IKir 전류는 K 채널 차단제에 의해 거의 영향을 받지 않고 2가 양이온이나 polyamine에 억제되는 것으로 알려져 있 다[4]. Figure 3A는 IKir에 대한 세포밖 Ba2+ 의 효과를 보 여 준다. Ba2+ 농도가 1, 10, 100, 1000 μM으로 증가되었 을 때 전류는 농도 의존적으로 억제되었다. 전류가 50% 억 제되는 농도인 IC50은 35.2 ± 2.2 μM (n=4) 이었다(Fig. 3B). 이 때 세포막 전류는 400 ms 동안 -150 mV에서 + 50 mV까지의 램프 자극을 주어 기록하였다. K 채널 억제제 인 tetraethylamonium (TEA) 10 mM, 4-aminopyridine (4-AP) 500 μM를 처리하였으나 IKir에 영향을 주지 않았 다(data not shown).
Fig. 3.
Effect of Ba2+ on IKir. (A) Voltage ramp from -150 to + 50 mV lasting for 400 ms elicited membrane currents from an undifferentiated hUC-MSC that displayed inward rectification. (B) The current traces were obtained in the absence and presence of external Ba2+ (1, 10, 100, 1000 μM). Ba2+ inhibited the IKir in a concentration-dependent manner (n=4).
Download Original Figure
미분화 hUC-MSC에서 계대배양 횟수에 따른 IKir 전류의 기능적 발현 빈도변화.
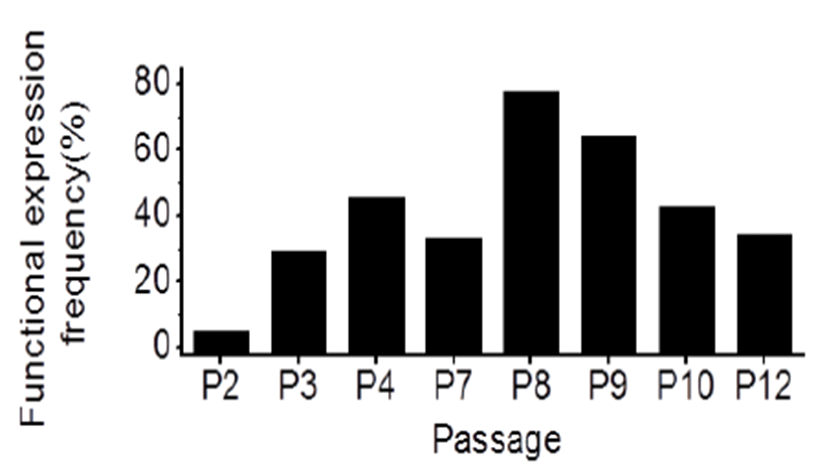
Passage에 따른 IKir 전류의 기록 빈도를 측정하였다. 기록 은 whole cell patch 모드로 기록되었고 유지전압은 0 mV 로 400 ms 동안 -150 mV에서 + 60 mV까지의 램프 자 극을 주어 기록하였다. IKir 전류는 GΩ seal과 멀어져 leak current 가 많을 경우 잘 구분할 수 없기 때문에 전류 기록 시 세포막저항이 800 MΩ 이상 되는 것만 기록하고 데이터 분석에 반영하였다. Passage가 증가될수록 IKir이 기록되 는 빈도가 증가하다가 P8을 정점으로 그 빈도가 감소하였다 (Fig. 4와 Table 3). 즉 IKir 전류는 hUC-MSC의 초기 계대 시(P2: 5.3%, 19번 중에 1번 기록)에서는 IKir의 기능적 발 현 빈도가 매우 낮았으나 계대 중간(P8: 77.8%, 18번 중에 14번 기록)에서 다수 관찰 되었다. 그러나 계대 후기(P12: 34.5%, 29번 중에 10번 기록)로 갈수록 IKir의 기능적 발현 빈도는 감소되었으나 계대 초기만큼 IKir의 기능적 발현 빈 도가 감소하지는 않았다.
Fig. 4.
Eletrophysiological expression frequency of IKir with passage in undifferentiated hUC-MSC. Functional expression of IKir was confirmed by patch clamp techniques. The current was almost unrecorded at P2, reaching a maximum at P8, and the frequency of IKir expression decreased as passage proceeded further.
Download Original Figure
Table 3.
Relation between number of passage and frequency of functional expression of IKir in undifferentiated hUC-MSC
| Passage |
N (A) |
IKi r expression (B) |
B / A (%) |
| P2 |
19 |
1 |
5.3 |
| P3 |
41 |
12 |
29.3 |
| P4 |
11 |
5 |
45.5 |
| P7 |
15 |
5 |
33.3 |
| P8 |
18 |
14 |
77.8 |
| P9 |
14 |
9 |
64.3 |
| P10 |
14 |
6 |
42.9 |
| P12 |
29 |
10 |
34.5 |
Download Excel Table
Discussion
우리는 미분화 hUC-MSC에서 passage 증가에 따라 IKir 의 전기생리학적 발현 빈도의 증감을 확인하였고, 안정막전 위 변화는 거의 없었으며 세포막 표면적과 비례하는 커패시 턴스는 P9 이상에서는 증가함을 확인하였다.
줄기세포는 재생의학에서 세포치료에 중요한 재료이나 passage가 증가되거나 장기배양을 하면 증식율이나 분화 능이 변하며 노화가 발생한다[16, 17]. 중간엽 기질세포 (mesenchymal stromal cell)에서 passage 증가 즉 P5에 서 P12까지 분화능의 감소를 보이고 [18], 골수나 지방에 서 유래된 줄기세포에서 P9에서 P12까지 노화 마커인 senescence- associated beta galactosidase (SA-β-Gal) 가 현저히 증가한다[19, 20]. 본 연구에서는 passage 증가 시 커패시턴의 변화가 나타나고 이것은 미분화 hUC-MSC 의 세포표면적이 증가하고 있음을 의미하는 것이기 때문에 이전 연구를 참고할 때 미분화 hUC-MSC도 passage가 증 가되면 분화능 감소나 노화가 발생할 것으로 예측된다. 세포 표면적의 증가 즉 세포크기의 증가는 분화능 감소나 노화로 이어 질 수 있기 때문이다[20]. 그러므로 hUC-MSC에서 는 P9 이전의 세포만을 세포치료에 사용하는 것이 좋을 것 으로 생각된다.
우리 연구에서 IKir이 세포내 K+ 농도([K+]i)조절과 안정막 전위 조절에 기여하기 때문에 IKir의 발현빈도 증감에 따라 막전위 변화가 나타날 것이라고 예상하였지만 안정막전위는 P2~P12까지 유의한 변화는 보이지 않았다(Fig. 1). 이것은 passage 증가에 따른 세포내 이온농도 변화에 따른 막전위 의 변동이 생길 경우 IKir이 K+ 농도를 조절하여 막전위가 일 정하게 유지 되도록 항상성을 유지해 주기 때문일 것이라고 사료된다. 즉 passage 증가에 따른 Na 채널과 같은 이온채 널의 활성[21]으로 인한 막전위의 탈분극 발생을 상쇄하거 나, 또는 passage 증가에 따른 K+ / Na+ 비율 변화에 의한 세포가 손상방지 기전으로 IKir 발현을 증가시켜 K+ 농도유 지를 위한 항상성 유지에 기여 할 것으로 생각된다[22, 23]. 즉 P8 이후 세포내 K+ 농도([K+]i)의 감소 및 Na+ 등의 증가 로 인한 탈분극이 일어날 수 있으므로 IKir의 기능적 발현빈 도 증가가 적절히 K+ 농도를 유지하려고 하는 세포의 방어기 재로서 작동할 수도 있다[22, 23]. 즉 IKir의 발현으로 [K+] i를 더 높은 농도로 올려 세포 손상시 나타날 수 K+ / Na+ 비 율을 안정막전위가 변화지 않는 선에서 조절할 것으로 예측 된다. Na+ 및 K+ 이온은 세포 생존에 중요한 영향을 미치는 데 K+ / Na+ 비율이 세포증식 및 세포 손상의 지표로 사용된 다는 논문은 우리의 이러한 가정을 지지한다[22, 23]. 그러 므로 미분화 hUC-MSC에서 IKir가 passage 증가시 나타나 는 이온불균형 해결사로 작동할 수 있음을 시사한다. 사람제 대 와튼젤리(Wharton's jelly)줄기세포에서 passage 증가 하면 [K+]i 변화되며 생존율을 결정한다는 보고는 우리의 가 설과 결과를 지지할 수 있다[24].
줄기세포 초기배양부터 배양시간이 늘어가면 증식 능력의 감소, 형태학적 변화, 텔로미어 및 기능 장애의 단축 노화에 대한 변화를 나타낼 수 있기 때문에[17], passage 증가에 따른 전기생리학적 데이터의 축적은 매우 필요하나 거의 없 는 실정이다. 그러므로 미분화 hUC-MSC에서 이러한 IKir 과 계대배양에 대한 관련 자료는 줄기세포에서 passage 증 가에 따른 분화능 감소 및 노화관련 데이터로 매우 중요하다 고 생각되며 IKir이 안정막 전위 유지 및 K+ 농도 유지에 필 수적인 생리학적인 역할을 할 것이라고 예상하며 앞으로도 줄기세포 연구에서 전기생리학적 데이터가 더욱 축적되어야 할 거라고 생각한다.
Acknowledgements
이 논문은 2014년도 충북대학교 학술연구지원사업의 연구 비 지원에 의하여 연구되었으며, 2016년도 정부(교육부)의 재원으로 한국연구 재단의 지원을 받아 수행된 연구임(NRF - 2016R1D1A1B03931790).
References
Hille B. Ionic channels: Molecular pores of excitable membranes. Harvey Lectures. 82 1986; :47-69

Zhao W., Chen Y. Progress in Research of KV1.1 and KV1.3 Channels as Therapeutic Targets. Current Topics in Medicinal Chemistry. 16(16) 2016; :1877-1885

1568-0266

Dong D. L., Bai Y. L., Cai B. Z. Calcium-Activated Potassium Channels: Potential Target for Cardiovascular Diseases. Advances in Protein Chemistry and Structural Biology. 104 2016; :233-261

1876-1623

Hibino H., Inanobe A., Furutani K., Murakami S., Findlay I., Kurachi Y. Inwardly rectifying potassium channels: Their structure, function, and physiological roles. Physiological Reviews. 90(1) 2010; :291-366

0031-9333

Park K. S., Jung K. H., Kim S. H., Kim K. S., Choi M. R., Kim Y., Chai Y. G. Functional expression of ion channels in mesenchymal stem cells derived from umbilical cord vein. Stem Cells (Dayton, Ohio). 25(8) 2007; :2044-2052

1066-5099

Anumonwo J. M., Lopatin A. N. Cardiac strong inward rectifier potassium channels. Journal of Molecular and Cellular Cardiology. 48(1) 2010; :45-54

0022-2828

Litan A., Langhans S. A. Cancer as a channelopathy: Ion channels and pumps in tumor development and progression. Frontiers in Cellular Neuroscience. 9 2015; :86

1662-5102

Li G. R., Deng X. L. Functional ion channels in stem cells. World Journal of Stem Cells. 3(3) 2011; :19-24

1948-0210

Li G. R., Deng X. L., Sun H., Chung S. S., Tse H. F., Lau C. P. Ion channels in mesenchymal stem cells from rat bone marrow. Stem Cells (Dayton, Ohio). 24(6) 2006; :1519-1528

1066-5099

Li G. R., Sun H., Deng X., Lau C. P. Characterization of ionic currents in human mesenchymal stem cells from bone marrow. Stem Cells (Dayton, Ohio). 23(3) 2005; :371-382

1066-5099

Youn S. W., Kim D. S., Cho H. J., Jeon S. E., Bae I. H., Yoon H. J., Park K. C. Cellular senescence induced loss of stem cell proportion in the skin in vitro. Journal of Dermatological Science. 35(2) 2004; :113-123

0923-1811

Crowder S. W., Horton L. W., Lee S. H., McClain C. M., Hawkins O. E., Palmer A. M., Bae H., Richmond A., Sung H. J. Passage-dependent cancerous transformation of human mesenchymal stem cells under carcinogenic hypoxia. FASEB Journal. 27(7) 2013; :2788-2798

0892-6638

Suhr S. T., Chang E. A., Rodriguez R. M., Wang K., Ross P. J., Beyhan Z., Murthy S., Cibelli J. B. Telomere dynamics in human cells reprogrammed to pluripotency. PLoS One. 4(12) 2009; :e8124

1932-6203

Park K. S., Kim Y. The Effect of Quercetin on the BK(Ca) in Umbilical Cord Vein-derived Mesenchymal Stem Cells. Laboratory Animal Research. 26(2) 2010; :203-209

1738-6055

Park K. S., Jung K. H., Chai Y. G., Kim C. H., Shin E.-Y., Kim Y. Riluzole-Induced Activation of BKCa Channels and Inhibition of Voltage-Gated Na Channel in Human Umbilical Cord Vein-Derived Mesenchymal Cells. Laboratory Animal Research. 24 2008; :287-2921738-6055

Bonab M. M., Alimoghaddam K., Talebian F., Ghaffari S. H., Ghavamzadeh A., Nikbin B. Aging of mesenchymal stem cell in vitro. BMC Cell Biology. 7(1) 2006; :14

1471-2121

Vidal M. A., Walker N. J., Napoli E., Borjesson D. L. Evaluation of senescence in mesenchymal stem cells isolated from equine bone marrow, adipose tissue, and umbilical cord tissue. Stem Cells and Development. 21(2) 2012; :273-283

1547-3287

Wagner W., Bork S., Lepperdinger G., Joussen S., Ma N., Strunk D., Koch C. How to track cellular aging of mesenchymal stromal cells?. Aging (Albany NY). 2(4) 2010; :224-230

1945-4589

Jin H. J., Bae Y. K., Kim M., Kwon S. J., Jeon H. B., Choi S. J., Kim S. W., Yang Y. S., Oh W., Chang J. W. Comparative analysis of human mesenchymal stem cells from bone marrow, adipose tissue, and umbilical cord blood as sources of cell therapy. International Journal of Molecular Sciences. 14(9) 2013; :17986-18001

1661-6596

Schellenberg A., Hemeda H., Wagner W. Tracking of replicative senescence in mesenchymal stem cells by colony-forming unit frequency. Methods in Molecular Biology (Clifton, N.J.). 976 2013; :143-154


Park K. S., Choi M. R., Jung K. H., Kim S., Kim H. Y., Kim K. S., Cha E. J., Kim Y., Chai Y. G. Diversity of ion channels in human bone marrow mesenchymal stem cells from amyotrophic lateral sclerosis patients. Korean Journal of Physiology & Pharmacology; Official Journal of the Korean Physiological Society and the Korean Society of Pharmacology. 12(6) 2008; :337-342


Lang F., Hoffmann E. K. Role of ion transport in control of apoptotic cell death. Comprehensive Physiology. 2 2012; :2037-2061

Lang F., Shumilina E., Ritter M., Gulbins E., Vereninov A., Huber S. M. Ion channels and cell volume in regulation of cell proliferation and apoptotic cell death. Contributions to Nephrology. 152 2006; :142-160


Garzon I., Perez-Kohler B., Garrido-Gomez J., Carriel V., Nieto-Aguilar R., Martin-Piedra M. A., Garcia-Honduvilla N., Bujan J., Campos A., Alaminos M. Evaluation of the cell viability of human Wharton’s jelly stem cells for use in cell therapy. Tissue Engineering. Part C, Methods. 18(6) 2012; :408-419