Introduction
Anthracycline 계열 항생물질, 예를들면 독소루비신, 다 우노루비신, 아클라시노마이신, 레트라세노마이신은 항암제 로서 임상적으로 유용하게 사용되고 있다[1,2]. 그러나 이 들 항생물질은 골수억제, 오심, 구토, 탈모 등 전신독성이 강 하기 때문에 임상적 사용에 많은 어려움을 나타내고 있다 [1,2]. 이러한 전신 부작용을 줄이기 위해 새로운 anthracycline 계열 항생물질들이 개발되고 있다[3-7]. 새로운 anthracycline 계열 항생물질 개발을 위한 연구의 하나로 11-hydroxyaclacinomycin X (HAMX)가 생합성을 통해 개발되어 보고되었다[8-10]. HAMX는 Streptomyces galilaeus ATCC 3113 (pMC213) 균주로부터 생합성되어 얻은 물 질로서 7-(O-rhodosaminly-deoxyfucosylrednosyl)- aklavinone이다(Fig. 1).
사람의 종양 배양세포를 사용한 in vitro 실험에서 HAMX는 MOLT-4 leukemia 세포 및 SK-MEL-2 melanoma 세포 에 대해 우수한 항 종양 효과를 나타내었다[8-10]. 저자 등 의 예비실험 결과(unpublished data)에서, 사람과 마우스로 부터 얻어진 14종의 종양 배양세포에 대해 HAMX는 독소루 비신, 다우노루비신, 아클라시노마이신 A에 비해 우수한 항 종양 효과를 나타내었다. 또한, 위장 종양 세포에 대해서도 HAMX는 다른 anthracycline 계열 항생물질에 비해 우수한 항 종양 효과를 보였다. 더욱, HAMX는 독소루비신에 비해 전신독성이 유의하게 낮음이 확인되었다. 이러한 HAMX의 높은 항 종양효과 및 낮은 독성으로부터, HAMX는 새로운 항 종양 물질로서 개발되고 있다[8-10].
HAMX는 새로운 anthracycline계열 항종양 물질로서 전 임상 및 임상 시험을 위해 약동력학 연구가 필수적이다. 저자 등[11]은 HAMX의 전임상시험의 하나로서 HAMX의 흡수, 분포, 대사 및 배설 과정의 약동력학 실험결과를 보고한 바 있다. 이 연구에서는 HAMX의 임상시험 진입의 성공 가능성 을 높이기 위해 전임상 동물 데이터로부터 사람의 데이터를 예측하는 것을 목표로 하였다. 즉, 마우스, 랫트, 토끼 및 비 글견 4종의 동물을 사용하여 클리어런스(CLt) 및 분포 용적 (Vdss)을 산출하여 사람의 각 파라미터를 예측하였다. 예측하 는 기술로서는 종차간 allometry 방법과 invariant time 방 법을 사용하였다. 동물 데이터로부터 사람 데이터를 예측하 는 것은 HAMX를 개발하는데 있어서 매우 중요한 정보를 제 공할 수 있다. 또한, HAMX가 새로운 항암제로 개발된 후 체 중이 서로 다른 동물들의 투여 복용량을 계산하는 데 중요한 역할을 할 것으로 생각된다.
Materials and Methods
11-Hydroxyaclacinomycin X (HAMX)는 ㈜일동제약 에서 공급받아 사용하였다. 에텔(Tedia Co., INC., 미국), 아세토니트릴(Fisher Scientific Co., Ltd., 미국), 메탄올 (Fisher Scientific Co., Ltd., 미국) 및 헤파린(Upjohn., No. 268-5, 미국)을 구입하여 사용하였으며, 기타 시약 은 모두 특급 또는 HPLC급을 사용하였다. 기기로는 HPLC (Jasco Co., 일본: Model PU-980 펌프 및 형광검출기, LC-Net Ⅱ control borwin 기록기, AS-950-10 자동주 입기), pH 미터(M520, Orion Research Inc., 미국), 저온 원심분리기(GS-6KR, Beckman Industries, 미국), 탁상 용원심분리기(Microfuge E, Beckman Industries, 미국), 냉동고(OPR-DFU-250, Operon ENG. Co., 한국), 초음 파세척기(M2010, Jinwoo ENG. CO., 한국), 진탕기(Eurostar, IKA-Labortechnic Co., 독일) 등을 사용하였다.
실험동물로는 체중 22-27 g 웅성 ICR 마우스, 체중 200- 250 g의 웅성 Sprague DawleyⓇ 랫트, 체중 2.0-2.5 kg 웅 성 토끼(New Zealand White rabbit) 및 체중 9-11 kg 웅 성 비글견을 샘타코(경기도 안성, 한국)로부터 구입하여 사 용하였다. 마우스, 랫트 및 토끼는 약학대학 동물사육장에서 항온, 항습 조건하에서 물(상수)과 사료(삼양유지사료, 강원 도, 원주, 한국)를 자유로이 공급하면서 약 1주간의 순화기 간을 거친 후, 실험에 사용하였다. 비글견은 충북대학교 동 물실험윤리위원회의 승인을 받은 후, 충북대학교 실험동물 연구지원센터에 사육 및 실험을 의뢰하여 약물 투약 및 채혈 을 진행하였다.
저자 등[11]은 신물질인 HAMX의 생체시료 중 분석조건 을 확립하여 정밀성과 정확성을 검증한 결과를 보고한 바 있 다. 이 연구에서는 확립된 동일한 방법에 따라 생체시료 중 HAMX를 분석하였다. 즉, 여기파장을 250 nm, 형광파장을 550 nm에 고정하였다. 이동상으로는 아세토니트릴 : 물 = 40 : 60 v/v% (pH 2.2)의 혼합액을 사용하였다. HPLC 칼 럼은 Luna C18 Column (4.6mm × 250mm, 5μM)을 사용 하였다. 채취한 혈장시료 100 μL에 메탄올 1.2 mL를 가한 다음 10분간 진탕기로 추출한 후 원심분리(12000 rpm, 10 분)하였다. 상징액을 모두 채취하여 다른 마이크로 튜브에 옮 겨 N2 가스로 증발시킨 후 이를 이동상 100 μL에 재용해 시 켰다. 이를 HPLC 에 주입하여 정량하였다.
마우스의 꼬리 정맥으로 HAMX을 투여(2 및 10 mg/kg) 하였다. 약물투여 후 1, 2, 3, 5, 10, 15, 30, 60, 120, 240, 360, 480 분에 에텔로 마취 후 복부를 열고 심장에서 혈액을 채혈하였다. 랫트의 대퇴정맥으로 HAMX을 투여(2 및 10 mg/kg)한 후 대퇴동맥으로부터 1, 3, 5, 10, 15, 20, 30, 60, 120, 240, 360, 480, 720 분에 혈액을 채혈하였다. 토끼 귀 정맥으로 HAMX을 투여(1 및 5 mg/kg) 후 귀동맥으로부터 1, 3, 5, 10, 15, 20, 30, 60, 120, 240, 360, 480, 720 분 에 혈액을 채혈하였다. 비글 견의 대퇴정맥으로 HAMX을 투 여(0.5 및 2.5 mg/kg) 후, 비글 견의 요측피정맥에서 1, 3, 5, 10, 15, 20, 30, 60, 120, 240, 360, 480, 720 분에 혈 액을 채혈하였다. 채취된 혈액 250 μL를 마이크로튜브에 받 아 원심분리 후 얻어진 혈장 100 μL를 정량에 사용하였다.
HAMX의 정맥주사 후 얻어진 혈장중 농도-시간 곡선을 비 선형 최소자승법(MULTI) [12]에 의해 모델 비의존 방법으 로 해석하여 약물동태학적 파라미터를 산출하였다. 시간 0 에서 무한대까지의 혈장중 농도-시간 곡선하 면적(AUC) 은 AUC = AUCt + Ct/ kel 식으로부터 산출하였다. 여기서 Ct는 최종 시간에서의 정량한계 농도를 나타내고 kel은 약 물 소실속도 정수를 나타낸다. kel은 혈장중 농도-시간 곡 선 후반부에서의 직선 기울기로부터 산출하였다. 시간 0에 서 최종 시료채취 시간까지의 혈장중 농도-시간 곡선하 면 적(AUCt)은 사다리꼴 면적 공식으로부터 산출하였다. 산출 된 AUC로부터 다음과 같은 파라미터를 산출하였다: 전신 클 리어런스(CLt) = Dose/AUC, 정상상태 분포용적(Vdss) = CLt × MRT, 평균체류시간(MRT) = AUMC/AUC. 여기 서 AUMC는 모멘트 곡선하 면적(the first moment of the concentration-time curve)를 나타낸다.
종차 간 파라미터를 예측하는 방법으로 체중과 파라미터 간에 다음과 같은 지수 함수인 allometry 식을 사용하였다 [13].
여기서 Y는 파라미터(CLt 또는 Vdss)를 나타내고, W는 체중 (kg)을, a와 b는 allometry 식의 정수 와 지수를 각각 나타 낸다. 지수(b)는 파라미터-체중 플롯의 직선의 기울기로부 터 다음 식으로 산출하였다.
사람의 CLt를 예측하는 데는 (1)식을 사용하는 경우 종종 오 차를 발생할 수 있다는 사실이 보고되고 있다[13,14]. 따라 서, allometry 식으로부터 사람의 CLt를 예측하는 개선된 방 법 중 하나로 다음과 같은 식이 제안되었다. 즉, 사람의 CLt 를 예측하기 위한 또 다른 방법으로 다음과 같은 allometry 보정식을 사용하였다.
여기서 MLP는 최대 예상 수명시간(maximum life-span potential)을 나타낸다. MLP는 다음과 같은 식으로 산출하 였다[13].
여기서 BrW 및 W는 뇌중량과 체중을 각각 나타낸다.
종차 간 약물동태학적 파라미터를 예측하는 다른 방법으 로 invariant time 방법이 보고되고 있다[15-17]. 따라서 이 연구에서는 종차 간 변동되는 시간을 다음과 같은 4종류 의 invariant time 방법에 의해 생리학적 시간(physiological time)으로 변환시켜 혈장중 약물농도-시간 곡선을 예 측하였다.
Equivalent time 모델식은 다음과 같이 나타낸다.
Elementary Dedrick plot (kallynochrons) 모델식은 다음 과 같이 나타낸다.
여기서 x는 CLt의 지수를 나타낸다.
Complex Dedrick plot (apolysichrons) 모델식은 다음과 같이 나타낸다.
여기서 x 및 y는 CLt 및 Vdss의 지수를 각각 나타낸다.
Dienetichrons 모델식은 다음과 같이 나타낸다.
여기서 x는 CLt의 지수를 나타낸다.
이 연구에서는 equivalent time, kallynochrons, apolysichrons 및 dienetichrons을 사용하여 마우스, 랫트, 토끼 및 비글견에서 파라미터의 종차 간 외삽(scaling)을 검토하였 다. 얻어진 사람의 혈장중 농도-시간 곡선으로부터 전술한 비선형 최소자승법(MULTI)[12]으로 해석하여 사람의 CLt 및 Vdss 를 예측하였다.
Results
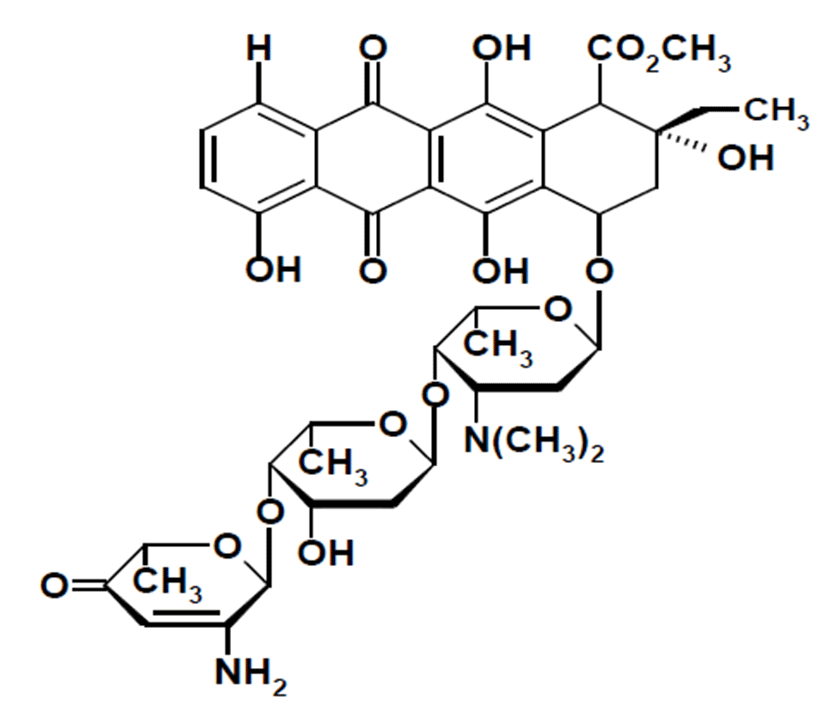
HAMX을 마우스, 랫트, 토끼 및 비글견에 정맥주사한 후 혈 장 중 소실 양상을 Fig. 2에 나타내었다. HAMX는 10-15분 대까지 빠르게 소실되었으며, 이후에는 서서히 소실되었다. 비글견의 경우 저용량 투여 60분 후에는 혈장 중 농도가 정량 한계 이하로서 검출되지 않았다. 혈장중 농도-시간 데이터 를 비선형 최소자승법으로 피팅하여 산출한 동태학적 파라미 터를 Table 1 에 나타내었다. 클리어런스(CLt) 및 분포용적 (Vdss)은 각 동물에서 저용량과 고용량 간 유의한 차이를 보 이지 않았으며, 이 연구에서는 혈장 중 농도 분석 감도를 고 려하여 고용량의 값을 사용하였다. CLt 및 Vdss는 마우스에서 73.7 mL/min/kg, 13.8 L/kg, 랫트에서 64.0 mL/min/kg, 13.6 L/kg, 토끼에서 47.2 mL/min/kg, 15.2 L/kg, 비글견 에서 27.1 mL/min/kg, 0.856 L/kg으로 나타났다.
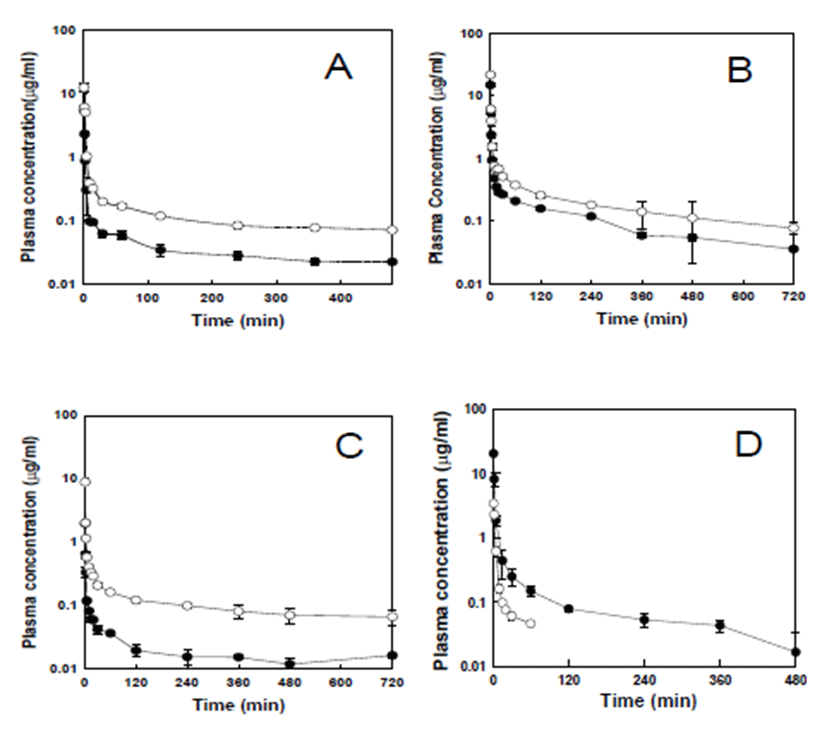
마우스, 랫트, 토끼 및 비글견에서의 CLt 및 Vdss 값(Table 1)을 전신 체중으로 환산하여 사람에서의 CLt 및 Vdss 값을 예측하였다 (Table 2). 각 동물의 CLt, CLt × MLP 및 Vdss 의 각 동물 전신 체중에 대한 로그-로그 스케일에서의 함수 를 그래프로 나타내었다(Fig. 3). 전신체중으로 환산한 CLt 및 Vdss 값은 동물의 체중이 증가함에 따라 각각 증가되었으 며, 사람의 체중은 70 kg으로 가정하고 외삽하여 사람에서 의 CLt 값을 예측할 수 있었다. 예측한 사람에서의 CLt 값은 MLP로 보정하지 않은 경우 및 보정한 경우에서 각각 24.1 및 6.99 mL/min/kg 이였다(Table 2). 지수법칙(rule of exponent)[13]에 의하면 allometric 식의 지수가 0.71에 서 0.99인 경우 CLt의 예측에 MLP를 곱해준 경우의 예측 값 이 더 정확하다고 보고되고 있다. 이 연구에서는 MLP를 사 용한 경우(r2=0.999) 및 사용하지 않은 경우(r2=0.995) 모 두 좋은 직선성을 보였으나, MLP로 보정한 경우 직선성이 약간 증가했음을 알 수 있었다. 각 동물의 Vdss 와 체중에 대 한 로그-로그 스케일에서도 양호한 직선성(r2=0.968)을 나 타내었으며, 예측한 사람에서의 Vdss 값은 5.72 L/kg이었다 (Table 2).
* Values from linear regression analysis of the parameter body weight plots on a log log scale (Fig. 3).
‡ Value from MLP-corrected allometry. The parameter was calculated as the human CLt × MLP divided by the human MLP of 93.4 years [14].
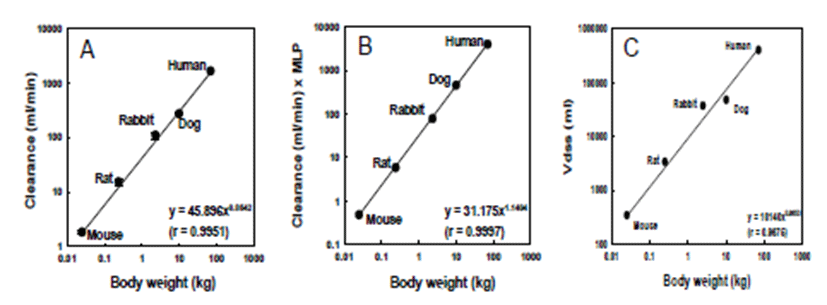
마우스, 랫트, 토끼 및 비글견의 혈장 중 약물 농도-시간 테이터를 invariant time 방법에 의해 보정하여 사람의 혈 장 중 약물 농도-시간 테이터를 예측하였다. 즉, equivalent time, kallynochrons (elementary Dedrick plot), apolysichrons (complex Dedrick plot) 및 dienetichrons 으로 각각 보정하여 각 동물들 간의 혈장 중 약물 농도-시간 곡선 을 일치시켜 나타내었다(Fig. 4). 각 동물들 간의 혈장 중 약 물 농도-시간 곡선은 양호한 상관성(r2=0.931-0.957)을 나타내었으며, 사람의 혈장 중 약물 농도-시간 곡선 데이터 를 예측할 수 있었다. 예측된 사람의 혈장 중 약물 농도-시 간 곡선으로부터 사람에서의 CLt 및 V dss 값을 예측하였다 (Table 3). Invariant time 방법에 의해 예측한 사람에서의 CLt는 MLP를 사용하지 않은 단순 allometry 식에 의한 예 측 값(24.1 mL/min/kg)과 유사한 값을 보였다(Table 2). Equivalent time, kallynochrons 및 apolysichrons 에 비 해 dienetichrons에서 1/2 낮은 값을 보였다. 분포용적의 경우 equivalent time, kallynochrons, apolysichrons 및 dienetichrons에서 상호간 유사한 값을 나타내었으나, allometric 식에 의한 예측 값(5.72 L/kg)에 비해 3배 이상 큰 값을 보였다(Table 2).
| Parameter | Equivalent time | Kallynochrons | Apolysichrons | Dienetichrons | |
|---|---|---|---|---|---|
| CLt | (mL/min/kg) | 36.3 | 42.1 | 34.7 | 17.0 |
| Vdss | (L/kg) | 19.2 | 18.2 | 19.4 | 15.4 |
| r 2 | 0.948 | 0.954 | 0.957 | 0.931 | |
Discussion
Anthracycline 계열 항생물질은 항암제로서 임상적으로 매 우 중요한 약물이다. 최근, 독성이 적은 새로운 anthracycline계열 유도체들이 전임상 단계에서 개발되고 있으며, 따 라서 anthracycline계열 유도체들의 동물 데이터로부터 사 람 데이터를 예측하는 것은 이러한 약물들을 개발하는데 있 어서 매우 중요한 정보를 제공할 수 있다. 또한 동물 파라미 터로부터 사람 파라미터를 예측하는 기술은 임상1상 시험 진 입시 안전한 복용량을 결정하는 데 중요한 역할을 한다. 이 연구에서는 HAMX를 마우스, 랫트, 토끼 및 비글견에 정맥투 여한 후 각각의 약물동태학적 파라미터를 산출하였다. 또한, 동물 파라미터로부터 사람의 CLt 및 Vdss 값을 allometry 방 법 및 4가지 invariant time 방법에 의해 예측하였다.
Mahmood[13]는 allometry 방법에 의해 사람의 파라미터 를 예측하기 위해서는 최소한 3종 이상의 동물을 사용하여 야 한다고 보고하였다. 이 연구에서는 사람의 CLt 및 Vdss 값 을 예측하기 위하여 4종의 동물을 사용하였다. 한편, Mahmood[13]는 allometry 식의 지수 값에 따라 동물 데이터로 부터 사람의 CLt를 예측하는 데는 다음의 3가지 법칙을 보 고하였다. 즉, allometry 식의 지수가 0.55-0.70인 경우 사 람의 CLt를 예측하기 위해서 단순 allometry 식을 사용하고, 0.71-0.99인 경우에는 CLt × MLP 보정식이 보다 정확하 고, 1.0보다 큰 경우에는 CLt x 뇌중량(BrW) 보정식이 유용 하다고 보고하였다[13]. 그들은 이를 지수의 법칙(the rule of exponents)라고 명명하였다. 이 연구에서는 사람의 CLt 를 예측하기 위한 단순 allometry 식의 지수 값이 0.845이었 으며(Table 2), 따라서 CLt × MLP 보정식의 결과가 보다 정확하다고 판단되었으며, 뇌중량(BrW) 보정식은 사용하지 않았다. CLt × MLP 보정식에 의해 예측한 사람의 CLt 값은 6.99 mL/min/kg(Table 2) 이었으며 단순 allometry 방법 및 invariant time 방법의 결과에 비해 낮은 값을 나타내었 다(Table 3). 그러나 임상 1상 시험 진입시 안전한 복용량의 산출을 위해서는 CLt × MLP 보정식에 의해 예측한 CLt 결 과가 보다 유용하다고 판단되었다.
4종의 동물에 있어서 체중과 Vdss의 로그-로그 플롯에서 양 호한 직선성(r2=0.968)을 나타내었다(Table 2). 일반적으 로 Vdss의 예측을 위한 allometry 식의 지수 값은 0.8-1.10 으로 CLt의 경우에 비해 변동이 적다고 보고되고 있다[13]. 이 연구에서는 allometry 식의 지수 값이 0.865의 값을 나 타내었다. Allometry 식에 의해 예측된 사람의 Vdss (5.72 L/kg)은 invariant time 방법의 결과(Table 3)에 비해 약 1/3 낮은 값을 보였다. HAMX 및 구조유사체인 epirubicin 은 독소루비신에 비해 지용성이 크며 다른 anthracycline계 열 유도체들에 비해 높은 Vdss 값을 나타낸다고 보고되고 있 다[18]. 이러한 높은 지용성 때문에 Vdss 와 생리학적 인자인 체중과의 상관성이 낮아진다고 판단된다. 그러나, Vdss는 CLt 에 비해 임상시험에서 사람에 대한 초회 복용량(the firstin- human dose; FIH dose)을 결정하는 데 중요한 인자는 아니라고 보고되고 있다[13].
CLt 및 Vdss 에 비해 반감기(t1/2)와 체중과의 상관성은 낮으 며, allometry 식의 지수 값의 변동도 크다고 보고되고 있다 [13]. 이 연구에서도 t1/2과 체중과의 상관성은 낮게 나타났 으며 사람의 t1/2을 예측하는 것은 불가능 하였다. 이는 t1/2이 신체의 생리학적 기능을 직접 나타내는 인자가 아니며 혼성 함수(hybrid parameter)이기 때문으로 판단된다. 일반적으 로 임상 1상 시험 진입시 사람에 대한 초회 복용량을 결정하 는 데 t1/2은 사용하지 않는다[13].
건강한 성인을 대상으로 하는 임상 1상 시험 진입시 항암제 의 초회 복용량을 예측하는 것은 매우 중요하다. 고전적인 방법으로 마우스의 LD10 또는 비글견의 독성 용량(TLD)의 1/3 용량을 임상 1상 초회 복용량으로 사용하고 있다[19]. 한편, Anthracycline 계열 항암제의 임상 1상 초회 복용량 예측에 종종 사용되고 있는 전신 표면적(BSA) 예측방법이 타당하지 않다는 보고도 있다[20]. 그들은 HAMX의 구조 유사체인 epirubicin의 파라미터와 전신 표면적과는 상관성 이 없다는 결과를 보고하였다. 저자 등[21]은 개발중인 anthracycline계 항암제의 임상시험 초회 복용량을 예측하는 방법을 확립하기 위해 HAMX 구조유사체인 epirubicin을 사 용하여 사람의 CLt 값을 allometry 방법 및 invariant time 방법으로 예측하고, 예측된 CLt 값으로 초회복용량을 산출 한 결과 실제 임상 복용량과 일치하는 결과를 보고하였다. 이 러한 방법에서 임상시험 초회 복용량은 동물에서 얻어진 혈 중농도 곡선하 면적(AUC)과 예측된 사람의 CLt 값의 곱으 로 산출할 수 있다. 따라서 이 연구에서 예측된 사람에 있어 서의 CLt 값은 새로운 anthracycline계 항암제로 개발 중인 HAMX의 임상 1상 시험 진입시 초회 복용량을 결정하는 데 활용될 것으로 기대되며, LD10 또는 전신 표면적을 사용하는 종래의 방법에 비해 유용할 것으로 판단된다. 또한, 체중이 서로 다른 동물들 간에 복용량을 결정하는 데 중요한 역할을 할 것으로 기대된다.