Introduction
생균제 (probiotics) 는 1989년 Fuller에 의해 장내미생물 총의 균형을 개선함으로써 숙주동물에게 유익하게 작용하는 살아있는 미생물 첨가물로 정의되었다 [1]. 현재 사람과 동물 의 생균제로 많이 사용하고 있는 유산균 (lactic acid bacteria) 은 대부분 탄수화물을 에너지원으로 사용하여 최종 대사 산물로 유산 (lactic acid) 을 생산하기 때문에, 보통 다른 미 생물에게는 치명적인 높은 산도에서 견디는 능력을 지니고 있 다 [1]. 또한 생균제는 면역조절인자에 작용하여 장내 면역반 응을 증가시키고 [2], 혈중 IgG의 수준을 높이며 [3], 식세포 의 활성과 면역기능을 개선시키는 등 면역조절 능력이 있는 것으로 알려져 있다 [1].
최근에 Weissella 속 세균은 유산균군에 포함되었는데, 1993년에 처음으로 Collins 등이 Leuconostoc 속 (Genus) 의 다른 종들과 차이를 보이는 Leuconostoc paramesenteroides와 Lactobacillus 속 5종을 모아서 6종으로 새로운 Weissella 속을 제안함으로써 만들어졌으며, 현재 14종의 Weissella 속 세균이 공식적으로 알려져 있다 [4]. Weissella 속은 그람 양성 무아포 형성균으로 카탈라아제 음성이며 이산 화탄소와 젖산을 생성하는 이상유산 발효경로 (heterolactic fermentation) 를 통해 포도당을 유산과 이산화탄소로 발효 시킨다. 또한 Weissella는 인간과 동물의 위장관, 김치와 같 은 발효야채, 그리스의 살라미 소시지, 스페인의 사탕수수와 같은 발효음식에서 많이 검출되고 있는 것으로 알려지고 있 다 [5].
Weissella cibaria는 2002년에 Björkroth 등에 의해 처 음으로 명명되었는데, 2004년 Ennahar 등은 2002년 한국 의 Choi 등이 김치에서 우점종으로 분리, 명명한 Weissella kimchii가 Björkroth 등이 명명한 Weissella cibaria와 동 일 균종임을 확인하여 보고하기도 하였다 [6]. Weissella cibaria는 김치와 같은 발효음식에서 우점종으로 분리되고 있 으며, weissellicin과 같은 항균물질 생산 및 avian influenza virus에 대한 항바이러스 효과도 보고되고 있으며, 염증 매개 물질의 생산에 관여하여 면역효과를 나타낸다는 연구결과 등 이 보고되고 있다 [7]. 김치에서 분리된 유산균주 Weissella cibaria JW15 (JW15) 는 선행연구에서 내산성, 내담즙성, 내열성, 병원성 억제능과 같은 생균제로서의 특성을 가지고 있는 것으로 보고되었으며 macrophages cell에서의 nuclear factor κB (NF-κB)를 활성화시키고 nitric oxide (NO), interleukin (IL)-1β 및 tumor necrosis factor (TNF)-α 생성 을 촉진시켜 면역조절 효과가 우수한 것으로 확인되었다 [8].
면역체계에서 macrophage는 monocyte로부터 분화된 세 포로 면역학적 항상성과 감염에 대한 숙주의 선천성 및 후 천성 면역반응에 있어서 중요한 역할을 하게 된다. Macrophage는 미생물이나 lipopolysaccharide (LPS), lipoteichoic acids (LTA) 같은 미생물 구성요소에 의해 활성화되 고, NO나 염증 초기에 작용하는 대표적인 IL-1β와 TNF-α 같은 염증성 cytokine을 분비하여 숙주의 면역을 조절하는 역할을 하고 있다 [9-12]. NO는 L-arginine의 nitric oxide synthetase 효소로부터 생성되는 물질로 단시간 동안 존재하 는 반응 중간산물이며, 암세포나 미생물의 성장을 저해하는 것으로 알려져 있다 [13, 14]. IL-1β는 감염이나 염증에 대 해 면역반응을 유발하는 초기 급성 반응의 중요한 매개물질 로 숙주세포의 증식, 분화, 소멸 등과 같은 다양한 세포반응 을 유도하고 다른 cytokine과 chemokine의 분비를 유도해 면역 연쇄반응을 촉발시키기도 한다 [15, 16]. TNF-α는 세 균감염과 악성종양 발생 시 염증과정을 조절하거나 intracellular pathogen을 억제하여 숙주의 면역체계 내에서 광범위 한 영향을 미친다 [17]. 이러한 cytokine들은 외부침입에 대 해 숙주의 면역 방어 기작에 기여하고, 종종 암 환자나 바이 러스 감염환자들은 cytokine에 의해 치료되기도 한다 [18]. NF-κB는 DNA 전사조절에 관여하는 단백질 복합체이다. 또 한 NF-κB는 염증성 cytokine 유전자의 발현에 관여하고 감 염을 방어하기 위한 cytokine 생산으로 면역반응을 조절하는 중요한 역할을 하기도 한다 [19].
서리태(검은콩, Glycine max (L.) Merr)는 예로부터 한국 인들이 해독제나 치료제 등의 건강식품과 전통 한방재료로 사 용하고 있는 다소비 식품소재 중의 하나이기도 하다. 서리태 에는 식이성 섬유, 올리고당, 이소플라본, 사포닌, 콩단백질, 식물성 스테롤과 페놀 화합물 등이 다량으로 함유되어 있으 며, 특히 종피에 다량으로 함유되어있는 안토시아닌은 항암, 항산화, 항바이러스, 면역증강 등의 다양한 생리활성 효과가 있는 것으로 알려지고 있지만, 서리태 추출물의 면역조절 효 과에 대해서는 많은 연구가 이루어지지 않은 상태이다. [20]
따라서 본 연구는 RAW 264.7 cells에서의 서리태 에탄올 및 열수추출물과 Weissella cibaria JW15 유산균의 면역활 성효과를 NO, NF-κB, cytokine (IL-1β와 TNF-α) 측정을 통해 확인하고, 추출물과 유산균 혼합의 면역증강 시너지 효 과를 검증할 목적으로 진행되었다.
Materials and Methods
김치에서 분리한 Weissella cibaria JW15 (KACC 91811) 균주는 De Man Rogosa and Sharpe (MRS) broth (BD, USA) 에서 30°C, 24시간 배양한 후, MRS plate를 이용하 여 균수를 측정하였다. 또한 배양액 전체를 4°C에서 12,000 rpm으로 10분간 원심 분리하여 상층액은 버리고 균체만을 멸균된 phosphate buffered saline (PBS; pH 7.2) 으로 2회 세척 후, 110°C에서 15분간 열처리하여 유산균을 사멸시킨 후, 1.0 × 108 CFU/mL로 희석하여 in vitro 면역활성 측정용 시료로 사용하였다 [8].
서리태 에탄올과 열수추출물은 충남 금산 소재 금산국제 인삼약초연구소에서 제공받은 추출물을 본 실험에 사용하 였다. 서리태 (Glycine max (L.) Merr) 는 증류수와 에탄올 (94%) 40mL에 각각 동결건조 분말 2g을 혼합하여 200 rpm 으로 25°C, 24시간동안 교반 추출을 실시하였다. 교반 추출 후 Whatman No. 3로 여과하고, 40°C에서 회전진공농축기 를 이용하여 각 용매를 제거하였다. 각 추출된 최종 추출물 들은 동결건조 후 보관하며, PBS로 희석 (w/v) 하여 0.1%, 0.01%, 0.001%를 제조하여 실험에 사용하였다.
RAW 264.7 macrophages (Korean Cell Line Bank, Korea) 와 RAW BLUE cells (InvivoGen, USA)은 10% fetal bovine serum (FBS; Gibco Laboratories, USA), 100 unit/ mL의 streptomycin과 penicillin (Gibco Laboratories)이 첨가된 Dulbecco’s modified Eagles’s medium (DMEM: HyClone, USA) 배지를 사용하여 37°C, 5% CO2 조건에서 배양하였다. RAW BLUE cells은 4~5번 계대배양 후, 100 mg/mL의 Zeocin (InvivoGen, USA)을 처리하였다 [8].
RAW 264.7 macrophages와 RAW BLUE cells은 12 well plate의 각 well당 5×105 cells/mL가 되도록 분주하여 2시간 안정화 시킨 후, 새로운 배지로 교체하여 주었다. 그 후 1.0 × 108 CFU/mL농도로 맞춘 heat-killed한 JW15 유산 균 시료 100 μL, 서리태 에탄올, 열수추출물을 각각 100 μL 를 첨가하여 48시간 배양하였다. 염증 반응 모델은 100, 500, 1,000 ng/mL LPS (Sigma, USA)를 처리하였으며, 48시간 후 배양 상층액만을 모아 NO, NF-κB와 cytokine (IL-1β, TNF-α)의 농도를 측정하였다 [8].
NO의 농도는 Griess reagent (Promega, USA) 를 이용하 여 측정하였다. 50 μL의 macrophage 배양액과 nitrite standard (0~100 μM sodium nitrite) 에 1% sulfanilamide가 함유된 5% phosphoric acid 50 μL 와 0.1% N-1-naphthyl ethylenediamine dihydrochloride 50 μL를 섞고 실온의 암 실에서 10분간 방치한 후, 540 nm에서 microplate reader (Tecan, Austria) 를 사용하여 흡광도를 측정하였다. 측정한 흡광도 값을 standard 표준곡선을 이용하여 NO의 생성농도 로 계산하였다 [21].
Secreted alkaline phosphatase reporter gene이 안정적 으로 transfection된 RAW BLUE cells을 이용하여 NF-κB pathway를 활성화시키는지 확인하였다. 12 well plate에 5.0 × 105 cell/mL RAW BLUE cells을 분주하고 2시간 안정화 시킨 후, JW15균주와 에탄올 및 열수 추출물을 각각 접종하 여 48시간 배양하였다. 양성대조물질로는 100 ng/mL LPS (Sigma, USA) 를 사용하였다. 배양 후 배양 상층액 20 μL 와 QUANTI-Blue (InvivoGen, USA) 200 μL를 96 well plate에 혼합한 후 37°C에서 15분간 반응시켰으며, 반응이 끝난 후 620 nm에서 ELISA reader (Tecan, Austria) 를 사 용하여 흡광도를 측정하였다 [8].
IL-1β와 TNF-α의 농도는 ELISA kits (eBioscience, USA) 를 이용하여 측정하였다. 96 well plate에 coating buffer로 희석한 IL-1β와 TNF-α의 capture antibodies 100 μL 를 4°C에서 하루 동안 코팅하였다. 0.05 % (v/v) 의 Tween 20 (Bioshop, Canada) 을 포함하는 PBS(PBST) 로 5번 세 척 후, PBS로 희석한 10 % (v/v) FBS 200 μL를 1시간동안 비특이적인 단백질 결합을 막기 위해 반응시켰다. PBST로 5 번 세척 후, IL-1β와 TNF-α의 standard와 macrophage 배 양액 100 μL를 넣고 2시간동안 실온에서 배양하였다. 모든 standard와 sample은 3번씩 실시하였다. PBST로 다시 5번 세척 한 후, IL-1β와 TNF-α의 detection antibodies 100 μL 를 1시간동안 실온에서 방치하였다. Plate를 PBST로 5번 세 척 후, Avidin-HRP를 30분간 실온에서 반응시키고 PBST로 7번 세척하였다. 세척 후 100 μL의 Tetramethylbenzidine (TMB) 를 암실에서 15분 반응시키고 50 μL의 2N H2SO4 로 반응을 멈추게 하였다. 반응이 끝난 plate를 450 nm에 서 측정하고 흡광도값을 standard (0~1,000 pg/mL; IL-1β, TNF-α) 표준곡선을 이용하여 계산하였다 [8].
Results
서리태 에탄올 및 열수 추출물에 의한 NO, NF-κB 그리 고 cytokine인 IL-1β, TNF-α의 생성량을 추출물의 농도별 로 측정하였다. 그 결과 NO 생성량의 경우, 0.1% 서리태 열 수추출물을 제외한 다른 농도의 서리태 추출물은 NO생성량 을 증가시키지 못하였다. 그러나 0.1% 열수추출물 (4.59 ± 0.18 μM/mL) 은 다른 농도의 추출물보다 유의적인 NO 생 성량 증가를 나타내었다. NF-κB의 경우, 0.1% 에탄올추출 물과 열수추출물이 다른 농도 추출물보다 유의적으로 더 높 은 NF-κB를 활성을 보였다. IL-1β의 경우, 에탄올 추출물은 농도의존성의 경향을 보이지 않았으며, 0.01% 에탄올추출 물 (49.57 ± 1.43 pg/mL) 과 0.1% 에탄올추출물 (38.14 ± 4.71 pg/mL) 이 다른 군에 비해 유의적인 IL-1β 생성량 증 가를 나타내었다. 0.1% 서리태 열수추출물의 TNF-α 생성량 이 24.725.3 ± 146.88 pg/mL으로 가장 높은 수치를 나타내 었으며, 0.1% 에탄올추출물에 비해 유의적인 증가를 나타내 었다 (Fig. 1).
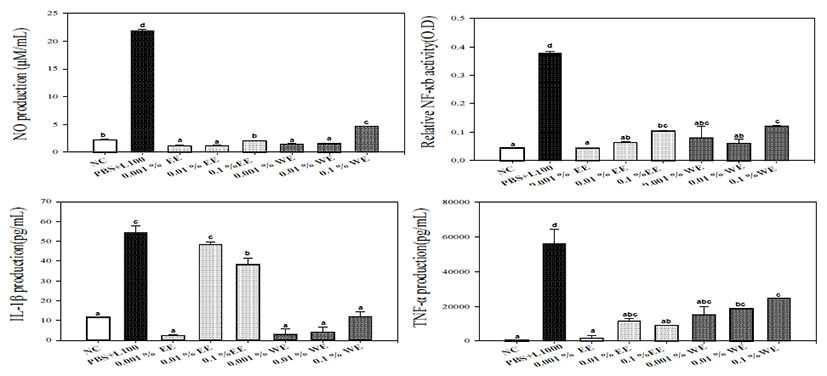
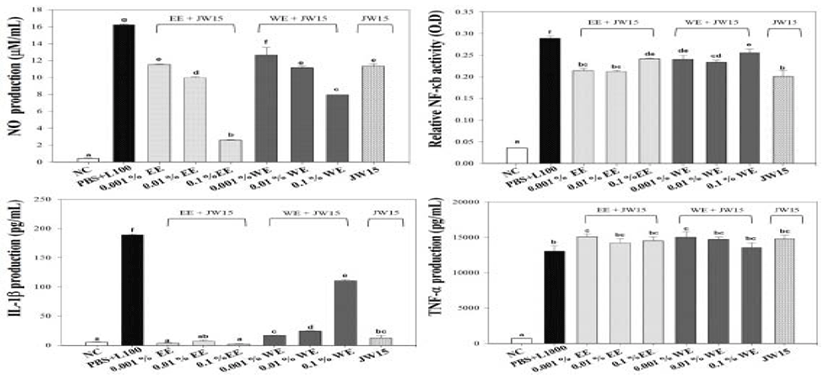
서리태 에탄올 및 열수추출물과 Weissella cibaria JW15 균주와의 혼합 시 나타나는 면역조절 시너지 효과를 확인하기 위하여, NO, NF-κB 및 cytokine (IL-1β, TNF-α) 의 생성량 을 측정하였다. 그 결과 NO 생성량의 경우 가장 낮은 농도인 0.001% 서리태 열수추출물과 JW15 혼합군에서 NO 생성량 (12.65 ± 1.56 μM/mL) 이 가장 높게 측정되었으며, JW15 단독의 NO 생성량 (11.34 ± 0.45 μM/mL) 에 비해 유의적 인 증가를 확인할 수 있었다. 그러나 서리태 에탄올 추출물과 JW15의 혼합군의 경우 JW15단독군과 비교하여 유의적인 시너지 효과를 관찰할 수 없었다. 에탄올 및 열수 추출물 모 두 농도가 증가함에 따라 NO생성량은 감소하는 농도 비의존 적인 패턴을 나타내었다. NF-κB의 경우, 모든 농도의 서리태 열수추출물 혼합군과 0.1% 에탄올추출물 혼합군에서 JW15 단독군에 비해 유의적으로 높은 NF-κB 생성을 유도하였다. IL-1β 측정 결과, 0.01%와 0.1% 열수추출물 혼합군에서 각 각 24.15 ± 2.19 pg/mL과 110.19 ± 4.38 pg/mL로서 JW15 단독군의 12.06 ± 7.58 pg/mL보다 유의적인 증가 결과를 나 타내었다. 그러나 TNF-α 생성량의 경우 서리태 에탄올 및 열 수추출물 혼합군 모두에서 JW15 단독군에 비해 유의적인 증 가 결과는 확인할 수 없었다 (Fig. 2).
Discussion
생균제 (Probiotics) 로써 사용되는 유산균들의 면역활성 증 진효과는 많은 연구를 통해 보고되고 있다 [21]. 본 연구에서 사용한 유산균주인 Weissella cibaria JW15 또한 in vitro 상 에서 NO, NF-κB와 cytokine 생산을 증가시켜 숙주의 면역 활성을 증진시켜 숙주의 면역활성을 증진시키는 것으로 보 고되어 있다 [8]. 본 실험에서 JW15균주와 혼합한 서리태 (Glycine max (L.) Merr.) 에 대해서 항산화 활성 및 항암 활 성 등 생리활성에 대한 연구는 많이 진행되어 있으나 [22], 면 역활성 증진에 대한 관련 연구는 부족한 상황이다. 따라서 본 연구에서는 JW15 유산균주와 서리태 에탄올, 열수추출물을 혼합하였을 때, 각 면역지표들 (NO, NF-κB, IL-1β 그리고 TNF-α) 의 생성능을 측정하여 유산균과 서리태 추출물의 면 역증강 시너지효과 여부를 확인하는 실험을 실시하였다.
서리태 에탄올 추출물과 열수추출물을 농도별로 RAW 264.7 대식세포에 반응시켜 NO, NF-κB 그리고 cytokine 생성능을 측정한 결과, 서리태 추출물이 각 면역지표들의 생 성을 증가시키는 것을 확인할 수 있었다 (Fig. 1). 이와 같은 면역지표들의 증가는 실험동물에게 검은콩을 투여하여 IL-2 와 INF-γ의 생성을 증가시켰다는 보고와 유사한 결과로 생각 된다 [23]. 검은콩 구성물질인 soy isoflavones가 LPS로 유 도된 대식세포에서 NO의 생성을 저하시키는 항염증효과를 가진다는 연구가 많이 보고되고 있는데 [24], 본 실험에서는 반대로 NO와 염증성 cytokine의 생산량을 증가시켰다. 이러 한 실험 결과는, 항염증효과를 지니는 soy isoflavones 이외 의 검은콩 구성물질 중 면역활성을 증진시키는 물질에 의한 가능성이 있을 것으로 생각된다.
JW15균주와 서리태 추출물을 혼합하였을 때 나타나는 각 면역지표들의 조절능력을 확인한 결과, 추출방법에 따라 에 탄올추출물보다 열수추출물의 면역활성능이 높은 것으로 확 인되었다. 이것은 에탄올과 열수로 추출하는 과정 중 추출물 의 성분 차이에 따라 나타나는 결과로 생각된다. 서리태 열 수추출물과 유산균을 혼합하였을 때, 서리태 열수추출물이 TNF-α를 제외한 면역지표들의 생성을 JW15 단독으로 처 리한 것보다 유의적으로 증가시키는 것으로 확인되었다. 특 히 0.1%의 서리태 열수추출물의 경우 현저한 IL-1β의 생성 을 유의적으로 증가시켰는데, 이러한 염증 cytokine의 증가 는 숙주의 면역체계내의 균형을 유지시키고 감염에 대한 저항 성을 증가시킨다는 보고와 유사성을 갖고 있다 [25]. Harata 등도 Lactobacillus gasseri TMC0356 경구투여가 IL-1β, TNF-α의 mRNA 발현을 증가시킨다는 연구보고를 발표하 였다 [26]. 따라서 본 실험의 결과를 통해 JW15균주와 서리 태추출물의 혼합물이 면역활성 능력을 나타내는 기전인 cytokine 활성변화를 유도하는 것으로 추측된다.
이상의 결과를 종합하여 보았을 때, 세포수준에서 서리태 의 에탄올 추출물과 열수추출물 모두 NO, NF-κB 그리고 TNF-α의 생성을 증가시키는 면역증강효과를 지니고 있었 으며, 또한 JW15와 서리태 열수추출물 혼합은 macrophage 를 활성화시켜 NO, NF-κB 그리고 IL-1β의 면역증강 시너 지효과를 나타내는 것으로 생각된다. JW15와 서리태추출 물 혼합의 NO측정 결과에서는 고농도 (0.1%) 보다 저농 도 (0.001%) 의 추출물과 유산균의 혼합에서 높은 NO 생 성량을 나타내었는데, 이와 같은 결과는 재실험을 통해 확인 이 필요한 것으로 보인다. 따라서 이번 결과를 바탕으로 향후 JW15와 서리태 열수추출물의 혼합물을 실험동물에게 경구 투여하여 in vivo 상에서도 면역증강 시너지효과가 발현된다 면, Weissella cibaria JW15균주와 서리태 열수추출물의 혼 합물은 면역력이 저하된 사람 및 동물의 건강기능성 식품소재 로 활용될 가치가 매우 높을 것으로 기대된다.







