ARTICLE
Anti-carcinogenic actions of glycoprotein conjugated with isoflavones from submerged-liquid culture of Agaricus blazei mycelia through reciprocal expression of Bcl-2 and Bax proteins
Young-Suk Kim6, Boh-Hyun Kim1, Gon-Sup Kim2, Joung-Soon Jang3, So-Young Kim4, Byeong-Dae Choi5, Jeong-Ok Kim6, Yeong-Lae Ha1,*
Author Information & Copyright ▼
1
Department of Applied Chemistry, College of Agriculture and Life Science, and Institute of Agriculture and Life Science, Gyeongsang National University, Jinju 660-701, Korea
2
Laboratory of Biochemistry, School of Veterinary Medicine, Gyeongsang National University, Jinju 660-701, Korea
3
Department of Internal Medicine, Chung-Ang University College of Medicine, Seoul 156-576, Korea
4
Department of Food and Nutrition, International University of Korea, Jinju 660-759, Korea
5
Department of Marine Food and Life Science Engineering, College of Marine Science, Gyeongsang National University, Tongyoung 650-160, Korea
6
HK Biotech, Co. Ltd., Jinju 660-844, Korea
*Corresponding author: Yeong-Lae Ha, Department of Applied Chemistry, Institute of Agriculture and Life Science, Gyeongsang National University, Jinju 660-701, Korea, Tel: +82-55-772-1964, Fax: +82-55-772-1969, E-mail:
ylha@gnu.ac.kr
© Research Institute of Veterinary Medicine. This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Nov 26, 2014; Revised: Dec 15, 2014; Accepted: Dec 16, 2014
Abstract
Glycoproteins isolated from fruit bodies and mycelial cultures of mushrooms exhibit anti-carcinogenic actions in human cancer cells and animal tumor cells by induction of apoptosis. Here, we report that isoflavone-conjugated glycoproteins (designate Gluvone), exhibit strong anti-carcinogenic effects on human breast cancer MCF-7 cells by induction of apoptosis. Gluvone with 9.4 kDa of molecular weight was isolated from submerged-liquid culture of Agaricus blazei mycelia (ABM) in soy flake-containing liquid medium. MCF-7 cells were incubated with various amounts of Gluvone (0~250 μM) for a period of 6 days. Gluvone exhibited anti-proliferative actions in a dose-dependent manner and 62% growth inhibition at 200 μM for 4 days relative to control. Hoechst 33258 staining analysis revealed that Gluvone induced formation of apoptotic bodies. Gluvone was associated with down-regulation of anti-apoptotic Bcl-2 protein expression as well as up-regulation of pro-apoptotic Bax protein expression. Gluvone treatment induced proteolytic activation of caspase-9 and caspase-3 through cytochrome c release from mitochondria to cytosol as well as concomitant degradation of poly (ADP-ribose) polymerase (PARP). In addition, Gluvone induced activation of caspase-8. Taken all together, these results indicate that the anti-proliferative effect of Gluvone is associated with induction of apoptotic cell death through the mitochondrial dysfunction pathway mediated by enhancement of Bax protein expression and suppression of Bcl-2 protein expression.
Keywords: Agaricus blazei mycelium (ABM); apoptosis; caspase 3; human breast cancer MCF-7 cells; isoflavone-conjugated glycoproteins (Gluvone)
Introduction
식용 버섯은 영양학적인 가치와 의약적인 가치가 높아 전 세계적으로 건강보조식품이나 전통의약품으로 사용되고 있다[1]. 버섯유래 수많은 화합물, 즉 다당체(polysaccharides), 단백다당체(glycoproteins), 테르펜류(terpenes) 및 페놀류(phenols) 등이 항암, 면역조절, 항바이러스 및 항균효과가 있음이 확증되었다[2-6].
버섯 다당체는 주로 β-(1,3)-D-glucan으로 소장에서 흡수가 되지 않아 대부분 면역계를 활성화시켜 항암성을 나타내기 때문에, 고분자(500-2,000 kDa)가 저분자 보다 더 강한 항암효과를 나타낸다[7-9]. 반면에, 단백다당체는 다당체-펩타이드 또는 다당체-단백질로 구성되어 있어 다당체가 단백질이나 폴리펩타이드 사슬에 공유결합을 하거나, 특정 다당체 곁사슬에 단백질이나 펩타이드가 결합되어 있다[10]. 그래서 단백다당체는 직접 암세포의 cell cycle을 arrest하거나 apoptosis를 유도하여 항암성을 나타낸다[11]. 또한 단백다당체의 항암성은 분자량이나 구성 성분에 따라 차이가 있다[12].
신령버섯(Agaricus blazei, AB), 상황버섯(Phellinus linteus), 차가버섯(Inonotus obliqua) 등은 항암성 단백다당체나 다당체를 함유하고 있어 암치료에 많이 이용되는 버섯이다. 특히 AB는 동물실험에서 고형암에 대한 억제율이 99.4%, 완치율이 90%인 것으로 보고되었다[1, 12, 13]. 주요 활성성분은 β-(1,3)-D-glucan의 주 체인에 β-(1,6)-glycosyl 가지를 가진 다당체[13-18]와 단백다당체(당질 약 50%와 단백질 약 43%로 구성)이다[10, 18, 19]. 이와 같은 항암효과를 갖는 단백다당체 및 다당체는 AB 자실체로부터 얻을 수도 있지만, AB mycelia (ABM) 액체배양으로부터 균일하고 많은 양을 쉽게 얻을 수 있다[3, 20]. 따라서 본연구진은 ABM을 대두박이 함유된 액체배지에서 배양하고 이를 자가분해(53°C, pH 5.5, 120 rpm, 3 시간)하여 분자량이 9,400 Da인 isoflavone-conjugated glycoprotein (Gluvone이라 명명)을 분리하였다[21, 22]. 이 Gluvone은 자가분해 하지 않은 것과 비교하여 MCF-7 인체 유선암과 S-180 cell로 유도한 mouse 복수암에 대한 항암효과가 크게 증가되었다[22]. 그러나 그 항암기전에 관한 연구는 아직 아무도 수행한 적이 없었다.
따라서 본 연구에서는 ABM 액체배양액을 자가분해하고 이로부터 분리한 Gluvone이 MCF-7 세포에 대해 강한 세포독성을 나타내었고, Gluvone이 mitochondrial dysfunction에 의한 apoptosis를 유도하였기에 그 결과를 보고하고자 한다.
Materials and Methods
실험재료
MCF-7 cell은 Korea Cell Line Bank (Seoul, Korea)에서 분양받아 사용하였다. Bovine serum albumin (BSA), sodium selenite, phenylmethylsulfonyl fluoride (PMSF), leupeptin과 RNase A는 Sigma-Aldrich (St. Louis, MO)에서 구입하였다. Dulbecco's Modified Eagle Medium/Ham's F-12 nutrient mixture (DMEM/F12), fetal bovine serum (FBS), 0.5% trypsin-5.3 mM EDTA, penicillin-streptomycin, phosphate buffered saline (PBS)과 transferrin은 Gibco BRL (Rockville, MD)에서 구입하였다. Bcl-2, Bax, caspase-3, caspase-8, caspase-9, cytochrome c와 poly (ADP-ribose) polymerase (PARP) rabbit polyclonal antibody는 Santa Cruz Biotechnology Inc. (Santa Cruz, CA)에서 구입하였다. Monoclonal anti-β-actin은 Sigma-Aldrich에서, anti-rabbit anti-mouse IgG-horseradish peroxidase는 Delta Biolabs (Muraoka Drive Gilroy, CA)에서 구입하였다. 그 외 사용된 일반적인 시약은 reagent grade 이상을 사용하였다.
Gluvone 분리
기본배지(1 L)에 황백당 20 g, 대두박 분해물 100 mL, MgSO4 0.5 g, KH2PO4 0.5 g를 첨가하였다. 이 액체배지를 500 mL 삼각플라스크에 300 mL 분주하고 살균(121°C, 30분)하여 액체배지로 사용하였다. 액체배지에 potato dextrose agar (PDA) 배지에서 활성화 한 ABM을 접종하고 7일간 진탕배양(120 rpm, 25°C)하였다.
이 ABM 액체배양물을 Kim 등[22]의 방법에 준하여 자가분해(53°C, pH 5.5, 120 rpm, 3시간)하고 Gluvone (9,400 Da)을 분리하였다. Gluvone은 탄수화물 66.6%, 단백질 31.0%, isoflavone (genestein 및 diadzein) 2.0%로 구성되어 있었다[22].
MCF-7 세포배양 및 시료처리
MCF-7 세포는 10% FBS와 penicillin/streptomycin (각각 100 U/mL, 100 g/mL)이 첨가된 DMEM/F12 배지(37°C, 5% CO2)에서 배양하였다[23]. 세포가 80% 자랐을 때 0.1% trypsin-1.06 mM EDTA를 처리하고 원심분리(4°C, 10분, 1,000 rpm)하여 세포를 회수하였다.
시료의 세포증식에 미치는 영향을 측정하기 위해 회수된 세포를 배양 배지로 희석하여 12-well culture plate의 각 well에 1 × 104 세포를 분주하고 24시간 배양하였고, serum free medium (SFM, 5 g/mL transferrin, 5 ng/mL selenium, 0.1 mg/mL BSA)으로 배지를 교환하고 24시간 더 배양하였다. 그 후 Gluvone 시료를 다양한 농도(0, 10, 100, 150, 200, 250 μM)로 처리하여 6일 동안 배양하였다. 다른 실험을 위해서는 culture dish (90 × 15 mm)에 1 mL 세포액(1 × 106 세포/mL)을 분주하여 상기 세포증식 실험과 동일한 방법으로 배양 및 Gluvone 시료 처리를 하고 4일간 배양하였다. 배지는 이틀마다 신선한 배지로 바꾸어 주었고 80% 자란 세포를 모든 실험에 사용하였다. 배양 마지막 일에 0.1% trypsin-1.06 mM EDTA를 처리하고 원심분리(4°C, 10분, 1,000 rpm)하여 세포를 회수하였다.
세포생장율 측정
살아있는 세포생존율 측정은 MTT assay를 이용하였다[23]. 흡광도 측정은 microplate reader (Anthos Labtech Instruments, Wals., Austria)로 570 nm에서 측정하였다. 시료의 세포생장율은 0일의 세포에 대한 백분률(%)로 나타내었다.
Hoechst 33258 염색
세포핵 형태를 Hoechst 33258로 염색하여 형광현미경으로 관찰하였다[24]. 먼저 세포를 4% paraformaldehyde 용액으로 10분간 고정한 다음, 0.1% Triton X-100 용액을 10분간 처리하였다. 그 후 Hoechst dye (10 g/mL)용액으로 10분간 핵을 염색시킨 후, fluorescence microscope (Carl Zeiss, Germany)으로 관찰하였으며, 역상광학현미경(Nicon Eclipse TE 300, Japan)을 이용하여 촬영하였다.
Western blot 분석
세포를 protease inhibitor leupeptin (10 g/mL)과 PMSF (2 mM)이 포함된 lysis buffer [50 mM Tris-HCl (pH 7.4), 150 mM NaCl, 1 mM EGTA, 1 mM EDTA, 10% glycerol]에서 lysis하였다. 단백질 농도는 Bio-Rad Protein Assay manual에 준하여 분석하였다. Western blotting은 Rakib 등[23]의 방법에 준하여 수행하였다. Bcl-2, Bax, caspase-8, caspase-3, caspase-9, cytochrome c 와 PARP의 단백질발현은 Western blot으로 분석하였다[23]. 관련 단백질 발현은 대조 세포를 100으로 보았을 때 Kodak ID Scientific Imaging System software를 이용하여 각 단백질 밴드의 발현 정도를 비교∙분석하였다.
Mitochondrial cytochrome c 방출 분석
세포의 mitochondria 분획과 cytosol 분획은 Miura 등[25]의 방법에 준하여 분석하였다. 세포를 PBS로 세척하여 extraction buffer [20 mM HEPES (pH 7.5), 10 mM KCl, 1.5 mM MgCl2, 1 mM EDTA, 1 mM EGTA, 1 mM DTT, 0.1 PMSF, 250 mM sucrose]를 첨가하고 homogenizer (Seoul, Korea)로 균질화한 후 원심분리(4°C, 10분, 1,000 rpm)하였다. 상등액을 Beckman ultracentrifuge (S. A., Gagny, France)로 원심분리(4°C, 15분, 10,000 g)하여 mitochondria 분획인 pellet을 얻고, 상등액을 다시 원심분리(4°C, 1시간, 100,000 g)하여 cytosol 분획(상등액)을 얻었다. Mitochondria 분획과 cytosol 분획의 cytochrome c 함량은 Western blot으로 분석하였다[23].
통계처리
Data는 평균(M) ± 표준편차(S.D.)로 나타내었다. 결과는 SAS (Statistical Analysis System, Cary, NC) version 8.1 프로그램을 이용하여 통계 분석하였다. 평균치간의 유의성은 Duncan의 다중검증으로 검증하였다.
Results
Gluvone의 세포생장 억제
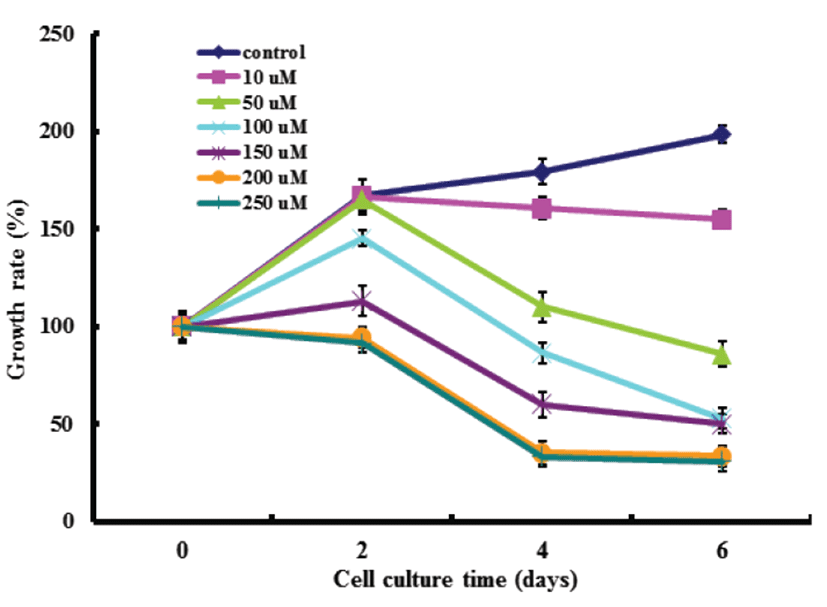
Gluvone은 isoflavone을 함유한 단백다당체이기 때문에 MCF-7 세포에 대한 강한 독성이 있을 것으로 기대되어 Gluvone을 MCF-7 세포에 농도별 (0~250 μM), 시간별(0, 2, 4, 6일)로 처리한 후 세포생장율을 MTT assay로 측정하였다(Fig. 1). Gluvone의 MCF-7 세포에 대한 세포생장율은 처리농도(10~250 μM)에 따라 비례하여 억제하였으나 200 μM과 250 μM 에서는 차이가 없었다. 또한 처리기간에 따라 모든 처리농도에서 배양 4일 이후에는 세포생장율이 억제되지 않았다. 이 결과는 200 μM Gluvone을 4일간 MCF-7 세포에 처리하였을 경우 세포생장이 최대로 억제되었음을 의미하였다.
Fig. 1.
Effects of Gluvone on the growth of human breast cancer MCF-7 cells. Results were expressed as percent of cell proliferation of control at 0 day. Data were means ± S.D. (n=6). Growth rate at 4 days was significantly different from each other at P<0.05 by Duncan’s multiple range test.
Download Original Figure
Gluvone의 apoptosis 유도 및 Bcl-2와 Bax의 발현
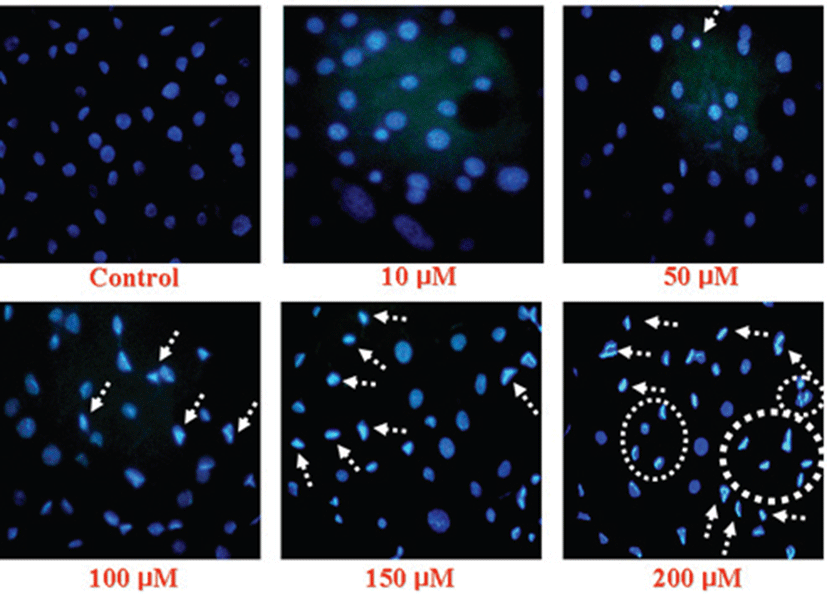
Apoptotic cell은 세포 수축, 핵 농축, chromatin의 응축, DNA 절단과 같은 형태학적인 특징을 나타낸다[26]. 따라서 Gluvone이 MCF-7의 apoptosis를 유도하는지를 조사하였다(Fig. 2). Gluvone은 MCF-7 세포의 핵을 응축시켰는데, 이 결과는 Gluvone을 처리하지 않은 대조군에 비해 Gluvone의 처리량이 증가할 수록 핵 응축은 증가되었다(Fig 2). 이 결과는 Gluone의 MCF-7 세포에 대한 세포독성(Fig. 1)은 apoptosis 유도에 기인함을 의미한다.
Fig. 2.
Nuclei morphological changes of Gluvone-treated MCF-7 cells. Cells were fixed and the nuclei were stained with Hoechst 33258.
Download Original Figure
세포내 신호에 의한 apoptosis의 기전은 17번 염색체에 존재하는 종양억제인자 p53에 의한 것이 비교적 잘 알려져 있다. DNA가 손상을 받게 되면 p53의 전사를 촉진시켜 세포주기의 진행 및 DNA 합성을 차단시키고, Bcl-2의 발현을 감소시키며, Bax의 발현을 증가시켜서 apoptosis를 유도한다. Bcl-2는 apoptosis를 방해하는 방향으로, Bax는 apoptosis를 유도하는 방향으로 각각 작동 한다고 알려져 있다[27]. 따라서 암세포 세포질에 p53 단백질이 발현되면 Bax 단백질의 활성이 유도된다.
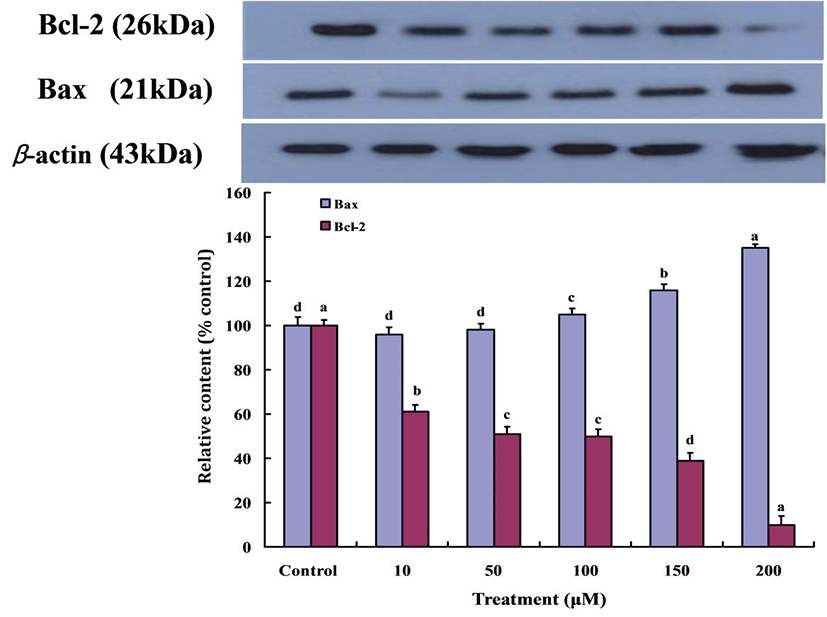
따라서 Gluvone이 Bcl-2와 Bax 단백질의 발현에 미치는 영향을 조사하였다(Fig. 3). Gluvone의 처리량이 증가할수록 Bcl-2 단백질의 발현은 감소하였고, Bax 단백질의 발현은 증가하였다. 이러한 결과들로 미루어 보아 Gluvone의 처리가 MCF-7 세포에서 Bax 단백질 발현을 증가시켜 apoptosis를 유도하는 것을 의미한다.
Fig. 3.
Expressions of Bax and Bcl-2 proteins in MCF-7 cells treated with Gluvone. Values are means ± S.D. (n=3). Means not sharing same small letters are different at P<0.05 by Duncan’s multiple range test.
Download Original Figure
Mitochondrial dysfunction에 의한 apoptosis 유도
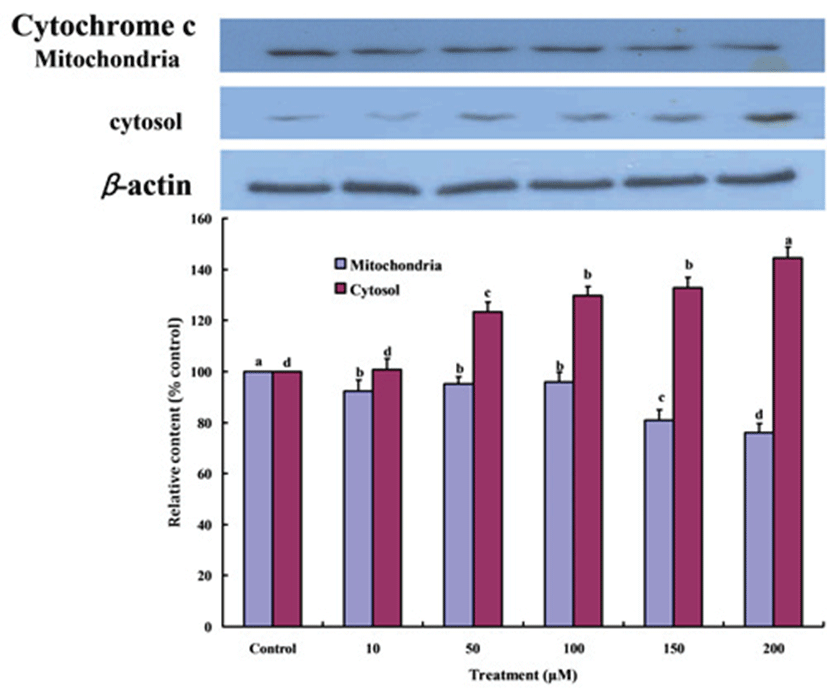
p53 발현 단백질에 의해 활성화 된 Bax 단백질은 mitochondrial cell membrane에 결합하여 mitochondria에 존재하는 cytochrome c를 세포질로 유출하고 세포가 생존하기 어렵게 되어 apoptosis를 유도하는 것으로 알려져 있다[28]. 따라서 Fig. 4는 Gluvone의 처리가 MCF-7 세포의 mitochondria에 존재하는 cytochrome c가 세포질 내로 유출되었음을 나타낸다. Gluvone의 처리농도가 증가할수록 mitochondria에 존재하는 cytochrome c의 량은 감소하였고, 세포질의 cytochrome c의 량은 증가하였다.
Fig. 4.
Cytochrome c distribution to mitochondria and cytosol in MCF-7 cells treated with Gluvone. Values are means ± S.D. (n=3). Means not sharing same smal letterst are different at P<0.05 by Duncan’s multiple range test.
Download Original Figure
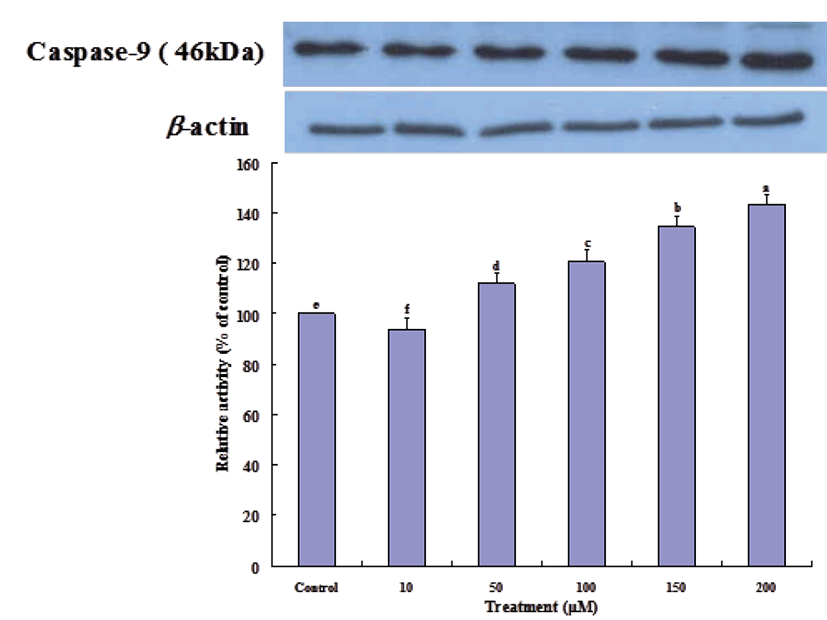
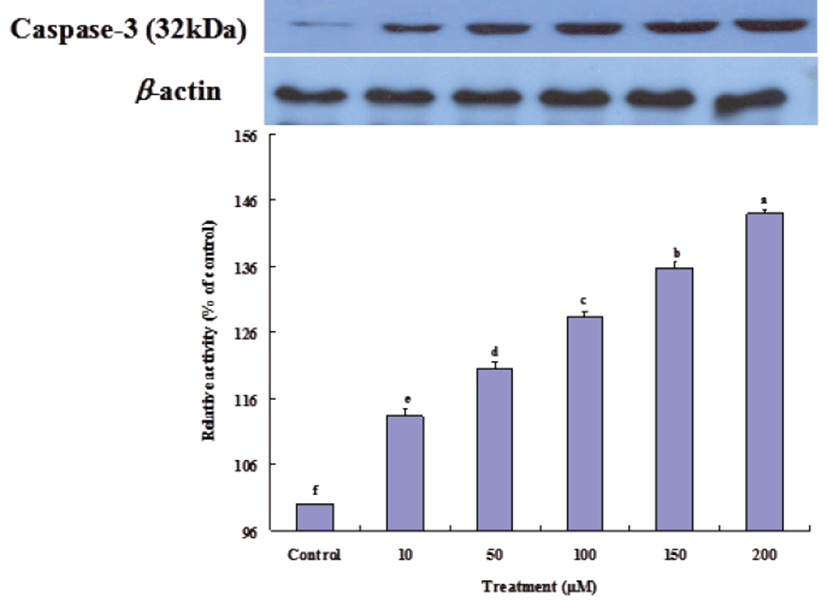
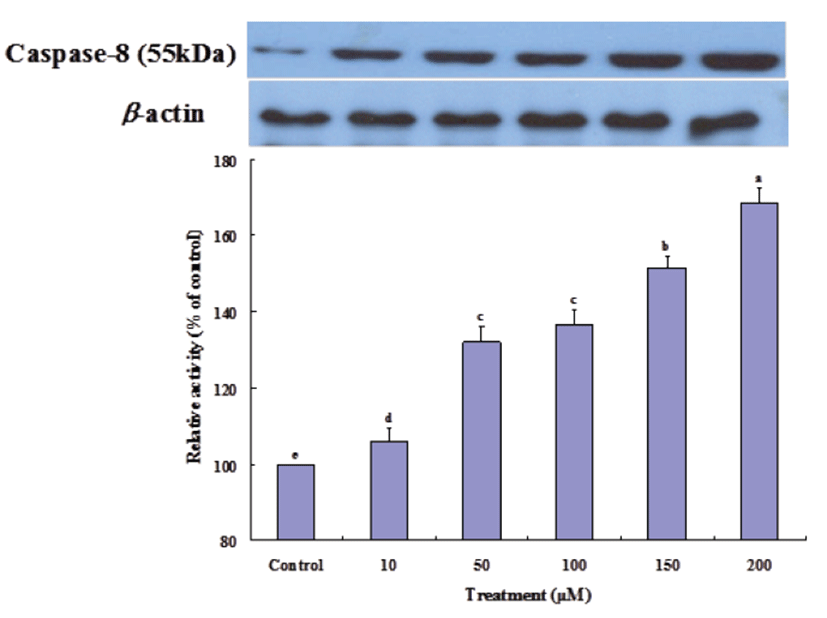
방출된 cytochrome c는 Apaf-1 (apoptotic protease activating factor 1)과 결합하여 pro-caspase-9을 활성화 시키고 이것은 다시 caspase-3를 활성화시켜 apoptosis를 유도한다[28]. Gluvone 처리 농도에 따라 caspase-9 (Fig. 5) 과 caspase-3 (Fig. 6) 단백질의 발현 정도는 증가하였다. 또한 cytochrome c와는 관련이 없지만 caspase-8이 활성화되면 caspase-9 활성화를 증폭시키고, 이는 하부에서 작용하는 caspase-3 활성화를 증폭시킨다[29]. Fig. 7에서 보는 바와 같이 caspase-8 단백질 발현은 Gluvone의 처리 농도에 따라 증가하여, 이 효소의 활성도 caspase-3의 발현에 기여한다고 볼 수 있다. 이들 caspase의 활성화는 apoptosis를 유도하게 된다. 따라서 Gluvone의 MCF-7 세포독성은 Bax 단백질을 발현을 증가시켜, mitochondria의 cytochrome c를 방출시키고 이 cytochrome c에 의한 caspase-3 활성화에 따라 apoptosis가 유발되는 mitochondrial dysfunction에 기인한다고 할 수 있다.
Fig. 5.
Expressions of caspase-9 proteins in MCF-7 cells treated with Gluvone. Values are means ± S.D. (n=3). Means not sharing same small letters are different at P<0.05 by Duncan’s multiple range test.
Download Original Figure
Fig. 6.
Expressions of caspase-3 proteins in MCF-7 cells treated with Gluvone. Values are means ± S.D. (n=3). Means not sharing same small letters superscript are different at P<0.05 by Duncan’s multiple range test.
Download Original Figure
Fig. 7.
Expressions of caspase-8 proteins in MCF-7 cells treated with Gluvone. Values are means ± S.D. (n=3). Means not sharing same small letters are different at P<0.05 by Duncan’s multiple range test.
Download Original Figure
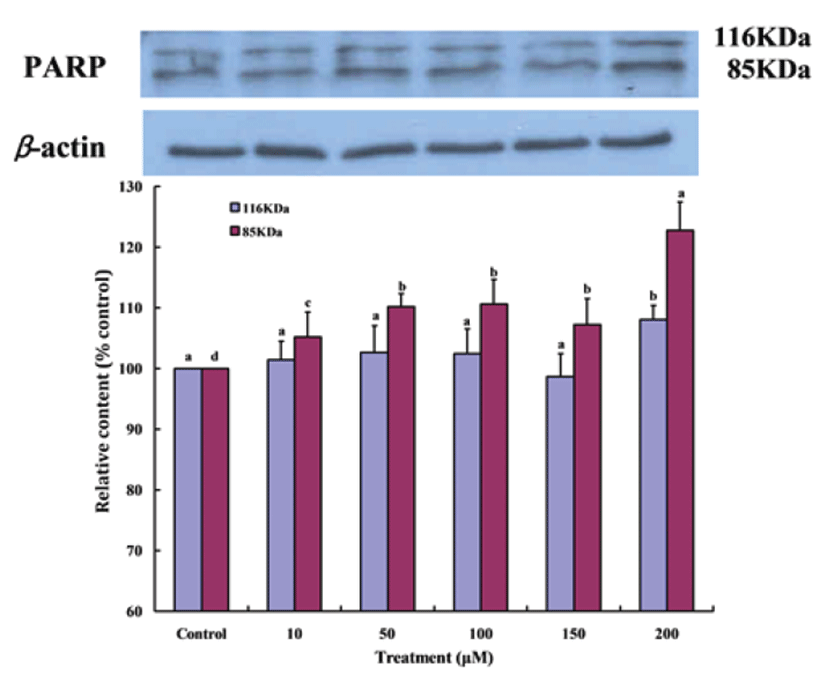
PARP 단백질은 세포의 DNA repair나 genomic stability의 유지에 중요한 역할을 하며, apoptosis 과정 중 caspase-3의 활성에 의해 PARP 단백질(116 Kda)이 85 KDa으로 분해되어 그 기능을 상실하게 된다[30]. Fig. 8은 Gluvone 처 리가 MCF-7 세포의 PARP 발현 정도를 나타낸 결과로 Gluvone의 처리량이 증가할수록 PARP 단백질의 단편화가 일어나 116 KDa의 양은 감소하고 86 KDa의 단편은 증가되었다. 이 결과로 Gluvone이 MCF-7 세포의 apoptosis를 유도한다는 것을 다시 확인할 수 있었다.
Fig. 8.
Expressions of PARP proteins in MCF-7 cells treated with Gluvone. Values are means ± S.D. (n=3). Means not sharing same small letters are different at P<0.05 by Duncan’s multiple range test.
Download Original Figure
Discussion
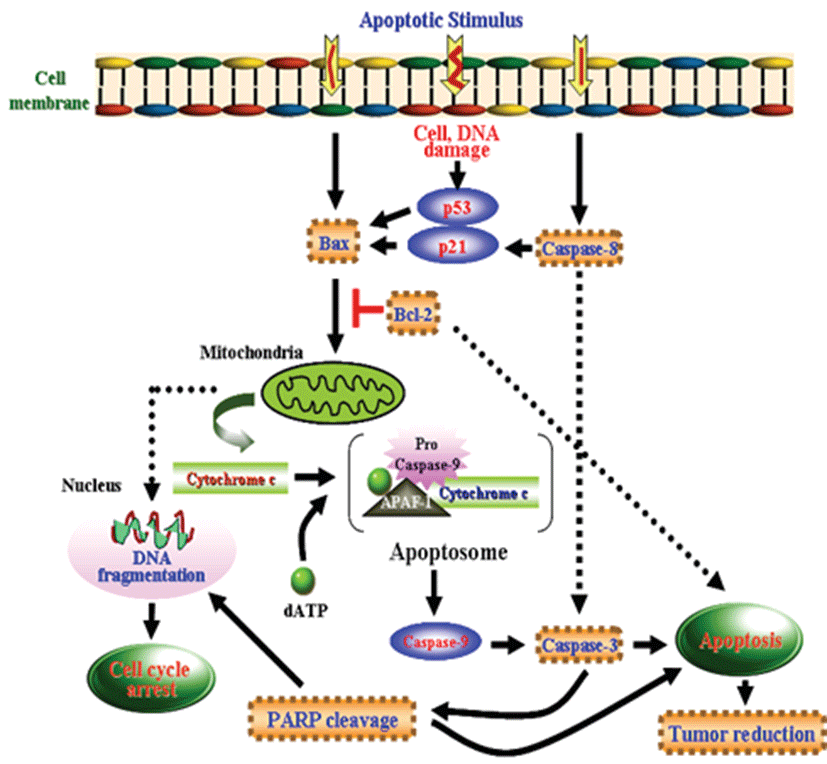
본 연구에서 ABM 액체배양물로부터 분리한 isoflavone이 conjugation된 단백다당체인 Gluvone이 mitochondrial dysfunction에 의한 기전으로 MCF-7 세포의 apoptosis를 유도함을 확인하였다. Gluvone은 MCF-7 cell의 생장을 농도 의존적으로 억제 하였고, anti-apoptotic 단백질인 Bcl-2의 발현을 down-regulation하고 pro-apoptotic 단백질인 Bax의 발현을 up-regulation하여 mitochondria의 cytochrome c 방출, caspase-8, caspase-9, caspase-3을 활성화시키고, PARP를 분해시켜 apoptosis를 유도하였다(Fig. 9).
버섯으로부터 다양한 항암 다당체와 단백다당체가 분리되었다. 수많은 버섯으로부터 β-D-glucan, 표고버섯으로부터 lentinan, 구름버섯으로부터 크레스틴(PS-K), 치마버섯으로부터 소니필란(SPG) 그리고 많은 버섯으로부터 단백다당체가 분리되었다[31-34]. 본 연구에서는 ABM 액체배양물로부터 분리한 분자량 9,400 Da인 Gluvone은 이들 항암제와는 달리 isoflavone이 단백다당체에 결합되어 있다는 점에서 큰 차이가 있다. 대부분의 버섯 유래 다당체는 면역체계를 활성화시켜 간접적으로 항암성을 나타내지만, 단백다당체는 cell cycle arrest를 유도하거나 apoptosis을 유도하여 항암성을 나타낸다. 차가버섯 물 추출은 대장암 HT-29 세포의 DNA 합성 억제에 의한 apoptosis 유도와 caspase-8 경로 활성증가에 의한 apoptosis를 유도하였다[35]. AB 수용액 추출물은 인체 폐암 A-549 세포의 G2/M phase arrest를 통한 apoptosis 유도는 cyclin A의 발현 감소, ckd inhibitor p21 발현증가 등이 관여한다고 보고하였다[36]. 구름버섯(Trametes versicolor)으로부터 분리된 다당체-펩타이드 복합체(PSP)의 인체 유방암 MAD-MB-231 세포 증식 감소와 상황버섯으로부터 분리된 protein bound polysaccharide (PBP)의 인체 직장암 SW480 세포 증식억제는 apoptosis에 기인하였다[37, 38]. 이들 보고와 마찬가지로 Gluvone의 MCF-7 세포에 대한 항암기전은 apoptosis 조절에 중요한 유전자들의 선택적 발현 조절을 통한 apoptosis 유발과 밀접한 관련이 있었으며, 이는 Gluvone이 강력한 항암 및 암 예방 효능의 잠재력을 가지고 있음을 의미하는 것이지만 항암제로 사용하기 위해서는 많은 연구가 수행되어야 할 것이다.
Isoflavone 중 genistein은 여러 종류의 암세포의 apoptosis를 유발하였다 [39-41]. Akiyama 등[42]은 genestein이 tumorigenesis 과정에 중요한 역할을 하고 성장조절 수용체와 밀접하게 연관되어 있는 protein tyrosine kinase (PTK)의 작용을 특이적으로 억제하였다. 또한 genistein은 DNA와 topoisomerase II 사이의 공유 결합을 촉진함으로써 topoisomerase II의 작용을 억제였다[43]. 따라서 Gluvone의 구성분인 isoflavone의 암화 억제나 apoptosis 유도 촉진은 유리상태로 존재하는 것보다 Gluvone에 결합된 상태의 isoflavone이 단백다당체의 활성에 시너지 효과를 부여할 것으로 기대되지만, 이를 위한 더 많은 연구가 수행되어야 할 것이다.
결론적으로, ABM 액체배양물로부터 분리한 Gluvone의 MCF-7 세포에 대한 항암기전은 Bax 단백질의 발현 증가에 따른 mitochondrial dysfunction에 의한 apoptosis에 기인함을 밝혔다. Gluvone에 결합된 isoflavone의 역할에 대한 연구는 더욱 구체적으로 수행되어야 하겠지만, 다양한 형태의 항암제들은 암세포의 apoptosis를 유도하여 항암제로서 작용하기에 apoptosis를 유도하는 Gluvone을 항암제로 개발할 수 있음을 암시한다.
Acknowledgements
본 연구는 한국연구재단 연구과제(2013R1A1A2011587) 와 중소기업청의 연구과제(C0135881)에 의해 수행되었음을 감사 드립니다.
REFERENCES
Dilani D, Silva D, Rapior S, Fons F, Bahkali AH, Hyde KD. Medicinal mushrooms in supportive cancer thera-pies an approach to anti-cancer effects and putative mechanisms of action. Fungal Divers. 2012; 55 p. 1-35.

Li NS, Yan CY, Hua DH, Zhang DJ. Isolation, purifica¬tion, and structural characterization of a novel polysac-charide from Ganoderma capense. Int J Biol Macromol. 2013; 57 p. 285-290.

Cui F, Zan X, Li Y, Yang Y, Sun W, Zhou Q, Yu S, Dong Y. Purification and partial characterization of a novel an¬ti-tumor glycoprotein from cultured mycelia of Grifola frondosa. Int J Bioll Macromol. 2013; 62 p. 684-690.

Krügener S, Schaper C, Krings U, Berger RG. Pleu¬rotus species convert monoterpenes to furanoterpe¬noids through 1,4-endoperoxides. Bioresour Technol. 2009; 100 p. 2855-2860.

Pigatto G, Lodi A, Aliakbarian B, Converti A, da Silva MR, Palma MS. Phenol oxidation by mushroom waste extracts A kinetic and thermodynamic study. Bioresour Technol. 2013; 143 p. 678-681.

Zhou LB, Chen B. Bioactivities of water-soluble poly¬saccharides from Jisongrong mushroom anti-breast car-cinoma cell and antioxidant potential. Int J Biol Macro mol. 2011; 48 p. 1-4.

Samanta S, Maity K, Nandi AK, Sen IK, Devi KS, Mukherjee S, Maiti TK, Acharya Islam SS. A glucan from an ectomycorrhizal edible mushroom Tricholoma crassum (Berk.) Sacc.: isolation, characterization, and biological studies. Carbohydr Res. 2013; 367 p. 33-40.

Zhang M, Cui SW, Cheung PCK, Wang Q. Antitumor polysaccharides from mushrooms a review on their iso-lation process, structural characteristics and antitumor activity. Trends Food Sci Technol. 2007; 18 p. 4-19.

Mizuno T, Hagiwara T, Nakamura T, Ito H, Shimura K, Sumiya T, Asakura A. Antitumor activity and some prop¬erties of water soluble polysaccharides from the fruit¬ing body of Agaricus blazei Murill. Agric Biol Chem. 1990; 54 p. 2889-2896.

Labat-Robert J, Robert L. Fifty years of structural glyco¬proteins. Pathol Biol (Paris). 2012; 60 p. 66-75.

Cui FJ, Li Y, Xu YY, Liu ZQ, Huang DM, Zhang ZC, Tao WY. Induction of apoptosis in SGC-7901 cells by polysaccharide-peptide GFPS1b from the cultured mycelia of Grifola frondosa GF9801. Toxicol In Vitro. 2007; 21 p. 417-427.

Hong JH, Kim SJ, Pogaku R, Youn KS. Antitumor activities of spray-dried powders with different molecu lar masses fractionated from the crude protein-bound polysaccharide extract of Agaricus blazei Murill. Food Sci Biotechnol. 2007; 16 p. 600-664.

Yoshiaki FK, Hidekazu O, Koichi S, Ryo E. Tumoricidal activity of high molecular weight polysaccharides de-rived from Agaricus blazei via oral administration in the mouse tumor model. Nippon Shokuhin Kagaku Kogaku Kaishi. 1998; 45 p. 246-252.

Dong Q, Yao J, Yang XT, Fang JN. Structural character¬ization of water-soluble ß-D-glucan from fruiting bodies of Agaricus blazei Murr. Carbohydr Res. 2002; 337 p. 417-421.

Ito H, Ito H, Amano H, Noda H. Inhibitory action of a (1?6)-ß-D-glucan-protein complex (FIII-2-b) isolated from Agaricus blazei Murill ("himemastutake") on Meth A fibrosarcoma-bearing mice and its antitumor mecha-nism. Jpn J Pharmacol. 1994; 66 p. 265-271.

Kawagish H, Inagaki R, Kanao T, Mizuno T, Shimura K, Ito H, Hagiwara T, Nakamura T. Fraction and antitumor activity of the water-insoluble residue of Agaricus blazei fruiting bodies. Carbohydr Res. 1989; 186 p. 267-273.

Menoli RC, Mantovani MS, Ribeiro LR, Speit G, Jordão BQ. Antimutagenic effects of the mushroom Agaricus blazei Murill extracts on V79 cells. Mutat Res. 2001; 496 p. 5-13.

Smith JE, Rowan NJ, Sullivan R. Medicinal mush¬rooms a rapidly developing area of biotechnology for cancer therapy and other bioactivities. Biotech Letter. 2002; 24 p. 1839-1845.

Kawagish H, Kanao T, Inagaki R, Mizuno T, Shimura K, Ito H, Hagiwara T, Nkamura T. Formolysis of a potent antitumor (l-6)-ß-D-glucan-protein complex from Agar¬icus blazei fruiting bodies and antitumor activity of the resulting products. Carbohydr Polym. 1990; 12 p. 393-403.

Kim YS, Jang WJ, Rakib MA, Kwon JM, Ahn CR, Kim SY, Cho YU, Ha YK, Kim JO, Ha YL. Enhancement of anticarcinogenic potentials of submerged-liquid culture of Agaricus blazei Murill on mouse ascites cancer by rice hull. J Life Sci. 2010; 20 p. 1402-1408.

Kim JO, Ha YL, Kim YS, Park CW. Isoflavone-ß-D- glucan produced by Agaricus blazei in the submerged liquid culture and method of producing same. 2006; US 07060470B2.

Kim SY, Kim YS, Jang JS, Kim BH, Rakib AM, Kim GS, Kim JO, Ha YL. Isolation of anticarcinogenic isofla-vone-conjugated glycoproteins from submerged-liquid culture of Agaricus blazei mycelia by autolysis process. J Life Sci. 2014; 24 p. 1316-1324.

Rakib AR, Kim YS, Jang WJ, Jang JS, Kang SJ, Ha YL. Preventive effect of t,t-conjugated linoleic acid on 12-O-tetradecanoylphorbol-13-acetate-induced inhibition of gap junctional intercellular communication in human mammary epithelial MCF-10A cells. J Agic Food Chem. 2011; 59 p. 4164-4170.

Allen RT, Hunter WJ, Agrawal DK. Morphological and biochemical characterization and analysis of apoptosis. J Pharmacol Toxicol Methods. 1997; 37 p. 215-228.

Miura K, Aminova L, Murayama Y. Fusarenon-X in¬duced apoptosis in HL-60 cells depends on caspase acti-vation and cytochrome c release. Toxicol. 2002; 172 p. 103-112.

Reed JC. Dysregulation of apoptosis in cancer. Cancer J Sci Am. 1998; 4 p. S8-S14.

Kuwana T, Newmeyer DD. Bcl-2 family proteins and the role of mitochondria in apoptosis. Curr Opin Cell Biol. 2003; 15 p. 691-699.

Green DR. Apoptotic pathways the roads to ruin. Cell. 1998; 94 p. 695-698.

Matapurkar A, Lazebnik Y. Requirement of cyto¬chrome c for apoptosis in human cell. Cell Death Differ. 2006; 13 p. 2062-2067.

Boulares AH, Yakovlev AG, Ivanova V, Stoica BA, Wang G, Iyer S, Smulson M. Role of poly(ADP-ribose) polymerase (PARP) cleavage in apoptosis. J Biol Chem. 1999; 274 p. 22932-22940.

Maity P, Samanta S, Nandi AK, Sen IK, Paloi S, Acharya K, Islam SS. Structure elucidation and antioxidant prop¬erties of soluble b-D-glucan from mushroom Entoloma lividoalbum. Int J Biol Macromol. 2014; 63 p. 140-149.

Ng ML, Yap AT. Inhibition of human colon carcinoma development by lentinan from shiitake mushrooms (Len-tinus edodes). J Altern Complement Med. 2002; 8 p. 581-589.

Manzi P, Pizzoferrato L. Beta-glucans in edible mush¬rooms. Food Chem. 2000; 68 p. 315-318.

Zhang M, Zhu L, Cui SW, Wang Q, Zhou T, Shen H. Fractionation, partial characterization and bioactivity of water-soluble polysaccharides and polysaccharide-protein complexes form Pleurotus geesteranus. Int J Biol Macromol. 2011; 48 p. 5-12.

Kim EJ, Lee YJ, Shin HK, Park JHY. A Study on the mechanisms by which the aqueous extract of Inonotus obliquus induces apoptosis and inhibits proliferation in HT-29 human colon cancer cells. J Korean Soc Food Sci Nutr. 2006; 35 p. 516-523.

Choi WY, Park C, Lee JY, Kim GY, Park YM, Jeong YK, Lee WH, Choi YH. Anti-proliferative effects of water ex¬tract of Agaricus blazei Murill in human lung cancer cell line A549. J Korean Soc Food Sci Nutr. 2004; 33 p. 1237-1245.

Chow LW, Lo CS, Loo WT, Hu XC, Sham JS. Polysac¬charide peptide mediates apoptosis by up-regulating p21 gene and down-regulating cyclin D1 gene. Am J Chin Med. 2003; 31 p. 1-9.

Kim JY, Jung EJ, Won YS, Lee JH, Shin DY, Seo KI. Cultivated Orostachys japonicus induces apoptosis in human colon cancer cells. Korean J Food Sci Technol. 2012; 44 p. 317-323.

Yanagihara K, Ito A, Toge T, Numoto M. Antiprolifera¬tive effects of isoflavones on human cancer cell lines established from the gastrointestinal tract. Cancer Res. 1993; 53 p. 5815-5821.

Spinozzi F, Pagliacci MC, Migliorati G, Moraca R, Grignani F, Riccardi C, Nicoletti I. The natural tyro¬sine kinase inhibitor genistein produces cell cycle ar¬rest and apoptosis in Jurkat T-leukemia cells. Leuk Res. 1994; 18 p. 431-439.

Pagliacci MC, Smacchia M, Migliorati G, Grignani F, Riccardi C, Nicoletti I. Growth-inhibitory effects of the natural phytooestrogen genistein in MCF-7 human breast cancer cells. Eur J Cancer. 1994; 30 p. 1675-1682.

Akiyama T, Ishida J, Nakagawa S, Ogawara H, Wata¬nabe S, Itoh N, Shibuya M, Fukami Y. Genistein, a spe-cific inhibitor of tyrosine-specific protein kinases. J Biol Chem. 1987; 262 p. 5592-5595.

McCabe MJ, Orrenius S. Genistein induces apoptosis in immature human thymocytes by inhibiting topoisomer-ase-II. Biochem Biophys Res Commun. 1993; 194 p. 944-950.