ARTICLE
Evaluation of biocompatibility of α-1,3 galactosyltransferase knockout pig bone graft in a rat calvarial defect model
Se Eun Kim1, Ga Hoi Choi1, Kyung Mi Shim1, Seok Hwa Choi1, Sang-Myeong Lee3, Seong Soo Kang1,*
Author Information & Copyright ▼
1College of Veterinary Medicine, Chonnam National University, Gwangju 500-757, Korea
2College of Veterinary Medicine, Chungbuk National University, Cheongju 361-763, Korea
3College of Environmental and Bioresource Sciences, Chonnbuk National University, Iksan 570-752, Korea
*Corresponding Author :Seong Soo Kang, Department of Surgery, College of Veterinary Medicine, Chonnam National University, Gwangju 500-757, Korea, Tel: +82-62-530-2877, Fax: +82-62-530-2881; E-mail:
vetkang@chonnam.ac.kr
© Research Institute of Veterinary Medicine, Chungbuk National University. All rights reserved. This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Jun 5, 2014; Revised: Jun 24, 2014; Accepted: Jun 25, 2014
Abstract
The current study was conducted to evaluate the biocompatibility of α-1,3 galactosyltransferase knockout pig bone graft in a rat calvarial defect model. Porcine cancellous bones were harvested from general and alpha-gal KO pigs and washed with 70% ethanol solution and normal saline. Bone pieces of the alpha-gal KO pig underwent a chemical treatment process to delipidize and deproteinize the bone. Bone graft particles were freeze-dried and stored at −70°C until use. Each bone graft was implanted into the rat calvarial defect in a fresh general pig, fresh transgenic pig, and chemical-treated pig bone group. There was no systemic adverse effect on hematology or necropsy findings in all groups at 1 week and 4 weeks. In the microcomputed tomography analysis, bone volume increased significantly in the chemical-treated transgenic pig bone group, whereas bone mineral density decreased significantly in the fresh general pig bone group compared with other groups. Histological evaluation showed cellular infiltration located at the margin of the bone graft particles, especially in the fresh general pig bone group. These results indicate that fresh general pig bone can elicit a greater local inflammatory response than fresh transgenic pig bone. Further, chemical-treated transgenic pig bone graft was less immunogenic than fresh bone graft. In conclusion, transgenic pig bone is a more biocompatible graft material. In addition, chemical treatment can reduce bone graft immunogenicity by delipidizing and deproteinizing bone.
Keywords: xenotransplantation; bone graft; α-1; 3 gal knockout pig; calvarial defect; rat
Introduction
장기 이식은 사고나 질병에 의한 손상된 장기를 대체할 수 있는 유일한 치료 방법으로 최근 들어 수요가 증가하고 있으나, 공여 장기의 절대적인 부족으로 인해 사회적인 문제가 발생되고 있다. 이러한 부족한 이식 장기를 대체하는 방법으로서 사람과 유사한 포유 동물의 장기를 사람에게 이식하는 이종장기이식(xenotransplantation)에 대한 관심이 증가하고 있다[1-3]. 특히 여러 동물들 중 돼지는 사람의 장기와 생리학적 기능이나 크기가 유사하다는 점에서 가장 적합한 이종 장기 공급 동물로 생각되고 있다[4, 5].
그러나 돼지의 장기를 사람에게 이식했을 때 가장 큰 문제점은 이식한 지 수 분 내에 일어나는 초급성 거부 반응이다. 사람, 구세계 원숭이, 유인원을 제외한 대부분의 포유류에는 알파갈 항원결정인자(α-Gal epitope; Galα1-3Galβ1-4G1cNAc-R)라는 일종의 탄수화물 구조가 존재하는데 이러한 장기를 사람에게 이식하게 되면 이식 장기 세포의 표면에 존재하는 알파갈 항원결정인자와 사람의 혈액 내에 존재하는 알파갈 특이 자연항체가 반응을 함으로써 이식 장기에 대한 거부 반응이 일어나게 된다[4-8].
따라서 이러한 돼지 장기에 대한 사람의 초급성 거부 반응을 없애기 위해 알파갈 항원결정인자와 관련된 α-1,3 galactosyltransferase 유전자가 제거된 알파갈 넉아웃 돼지를 생산하고 있으며[8, 9] 이렇게 생산된 알파갈 넉아웃 돼지의 장기를 영장류에 이종 이식하는 연구들이 진행되고 있다[1, 10, 11].
특히 신장이나 심장, 간과 같은 다른 연부조직 장기에 비해 골은 면역 반응을 일으키는 단백질이 적으며 동결건조나 탈회 동결건조, 방사선 조사 등에 의해 골의 특성을 유지하면서도 간단하게 항원성을 줄일 수 있다고 알려져 왔다[12-15]. Feng 등[16]의 연구에 따르면 돼지뼈에는 알파갈 항원결정인자가 뼈의 세포외기질에는 발현되지 않으나 골세포 표면에 존재한다는 보고가 있으며 따라서 알파갈 넉아웃 형질전환 돼지의 골을 이식할 경우 알파갈 항원결정인자에 의한 거부반응을 예방할 수 있을 것이라 생각된다.
알파갈 넉아웃 형질전환 돼지의 심장, 신장 및 흉선 등의 이종이식에 관한 연구는 진행되고 있으나[1, 10, 11] 골이식에 대한 연구는 아직까지 잘 알려진 바 없다. 따라서 본 연구에서는 일반 돼지 및 알파갈 넉아웃 형질전환 돼지의 생 뼈와 항원성을 줄이기 위해 화학처리를 한 뼈를 랫드의 두개골 결손부에 이식하여 알파갈 넉아웃 형질전환 돼지뼈의 이종골 이식재로서의 가능성을 평가하고자 하였다.
Materials and Methods
생 뼈 채취
본 연구에 사용된 돼지 뼈는 국립축산과학원에서 보유하고 있는 건강한 12 주령, 체중 10 kg의 알파갈 넉아웃 형질전환 돼지와 도축장에서 채취한 약 170 일령, 체중 110 kg의 일반 돼지의 대퇴골 중 해면질골을 사용하였다.
화학처리한 유기물 함유 돼지 해면질골 이식재 제작
일반 돼지와 알파갈 넉아웃 형질전환 돼지의 사지골격을 수술적으로 채취한 후 뼈 표면의 연부조직을 물리적으로 제거하고 70% 에탄올과 생리식염수로 소독과정을 거친 뒤 해면질골을 분리한 후 분쇄하여 –70°C에 보관하였다. 형질전환 돼지의 사지골격 중 일부는 10% 과산화수소에 3시간 동안 침지하여 뼈 표면에 존재할 수 있는 각종 이물질을 제거하였다. 이어서 인산완충액(phosphate buffered saline, PBS)에 넣은 다음 톱을 이용하여 취급하기 용이하게 2 cm3 크기로 각각 절단하고 절단된 뼈를 PBS로 여러 번 세척하여 골수부위를 제거하였다. 절단된 뼈를 액체질소에 1시간 동안 침지하여 완전히 동결시킨 다음 분쇄기(Retsch, MM400, Germany)에 넣어 입자로 제조하였으며 제조된 입자를 회수한 다음 에탄올을 이용하여 분쇄과정에서 생성된 기름을 제거하였다. 그리고 –80°C에서 완전히 동결시킨 후 동결건조기(Ilshin, FD8508, Korea)를 이용하여 건조시켰고, 제조된 뼈 입자는 –70°C에서 보관하였다.
랫드에서 두개골 결손부의 형성
체중 250~280 g의 건강한 7주령 수컷 Sprague-Dawley 랫 드(Samtaco, Osan, Korea) 40마리를 온도 23 ± 2°C, 상대습도 60 ± 10%로 유지하고 12시간의 명암주기가 유지되는 실내에서 전용 사료와 식수를 자유로이 공급하며 사육하였다. 실험에 사용하기 전 랫드를 10마리씩 대조군(Critical defect, CD), 일반 돼지 해면질 생 뼈 이식군(Fresh bone General, Fresh G), 형질전환 돼지 해면질 생 뼈 이식군(Fresh bone transgenic, Fresh T) 및 형질전환 돼지 화학처리 해면질골 이식군(Chemical treated transgenic, Chem T)으로 나누었다. 본 연구의 동물 사육 및 실험 계획서는 전남대학교 동물실험윤리위원회의 승인을 받았다(CNU IACUC-YB-R-2013-31).
랫드를 Ketamine (Ketamine50®, Yuhan Co., Korea) 40 mg/kg와 Xylazine (Rompun®, Bayer Korea, Korea) 10 mg/kg을 합제한 것을 복강 주사하여 전신 마취하였다. 두개부의 털을 삭모하고 소독한 후 피부를 절개하고 골막을 들어올린 후 두개골에 8 mm trephine bur를 이용하여 원형 결손부를 형성하였다. 결손 부위에 일반 돼지와 형질전환 돼지의 해면질 생 뼈와 탈지 및 탈단백과정을 거친 형질전환 돼지 해면질골을 각 군별로 0.03 g씩 이식한 후 골막은 4-0 흡수성 봉합사(Surgisorb®, Samyang Co., Seoul, Korea), 피부는 3-0 비흡수성 봉합사(Black Silk, Ailee Co., Seoul, Korea)로 봉합하였다.
혈액검사
1주 및 4주차에 랫드를 전신마취 하였고 후대정맥에서 채혈하여 EDTA 튜브에 혈액을 수집하였다. 수집한 혈액은 Hemavet blood analyzer (Drew Scientific Co. USA)를 이용하여 백혈구(white blood cells), 적혈구(red blood cells), 혈색소(hemoglobin) 및 적혈구용적(hematocrit)을 측정하였다.
안락사 후 부검 및 병리 소견 관찰
1주 및 4주차에 랫드를 채혈한 후 방혈 치사하여 안락사 후, 이식부위와 비장, 흉선, 익하림프절 등 면역 관련 주요 장기를 부검하였다. 면역 관련 주요 장기는 적출하여 장기 무게를 측정하였고 랫드의 체중에 따른 상대적 장기 무게를 계산하였다.
Micro CT 분석
두개부의 골결손 부위를 포함한 골조직을 다이아몬드 디스크로 절단하여 채취하였다. 채취한 골조직은 Skyscan 1172 Desktop X-ray microtomograph (Skyscan, Aartselaar, Belgium)로 48 kVp, 201 μA 조건 하에 micro CT 촬영을 시행하였다. NRecon software (Skyscan, Aartselaar, Belgium)를 이용하여 Reconstructions을 수행하고 두개골 결손 경계부를 포함하여 관심영역(region of interest, ROI)을 설정한 후, CTAn software (Skyscan, Aartselaar, Belgium)을 이용하여 bone volume (BV)과 bone mineral density (BMD)를 분석하였다.
조직학적 평가
골조직은 10% 중성 포르말린에 고정시킨 후 Calci-Clear™ (National diagnostics, Atlanta)로 탈회한 후 paraplast (Sherwood Medical Industries, St. Louis)로 포매하였다. 포매한 조직을 microtome (Reichet-Jung 820)으로 5 μm 두께의 절편을 제작한 다음 hematoxylin and eosin (H&E) 염색하여 현미경으로 골결손 부위의 염증발현 여부 및 신생골 형성을 관찰하였다.
통계분석
Micro CT 상에서 측정된 1주 및 4주차의 골부피와 골밀도의 군 간 분석을 위해 one-way ANOVA (SPSS version 21.0)를 사용하였으며, Bonferroni 검정법을 이용하여 5% 유의수준(P<0.05)에서 유의성을 검증하였다.
Results
혈액검사
혈액검사 결과 WBC, RBC, HB 및 HCT 수치는 모두 정상 범위 안에 있었으며 군간의 유의적인 차이는 나타나지 않았다(Table 1).
Table 1.
CBC (complete blood count) of rats at 1 week and 4 weeks after bone implantation
| Group |
WBC (K/µL) |
RBC (M/µL) |
HB (g/dL) |
HCT (%) |
| CD |
1 week |
6.97 ± 1.08 |
6.11 ± 0.73 |
14.30 ± 1.08 |
35.56 ± 4.40 |
| 4 weeks |
8.11 ± 1.56 |
7.81 ± 0.61 |
17.36 ± 0.72 |
44.88 ± 3.43 |
| Fresh G |
1 week |
6.46 ± 1.47 |
8.22 ± 2.47 |
15.73 ± 1.28 |
48.70 ± 15.25 |
| 4 weeks |
7.93 ± 1.95 |
7.66 ± 0.44 |
17.06 ± 1.10 |
41.37 ± 3.33 |
| Fresh T |
1 week |
7.69 ± 3.54 |
7.10 ± 1.54 |
15.46 ± 3.04 |
41.21 ± 9.85 |
| 4 weeks |
6.96 ± 1.36 |
7.12 ± 0.87 |
16.18 ± 1.88 |
39.16 ± 4.47 |
| Chem T |
1 week |
8.41 ± 1.48 |
7.06 ± 0.32 |
17.84 ± 0.36 |
40.00 ± 1.25 |
| 4 weeks |
9.63 ± 1.39 |
7.95 ± 0.87 |
16.40 ± 0.70 |
39.83 ± 5.53 |
Download Excel Table
부검 소견 및 상대적 장기 무게의 측정
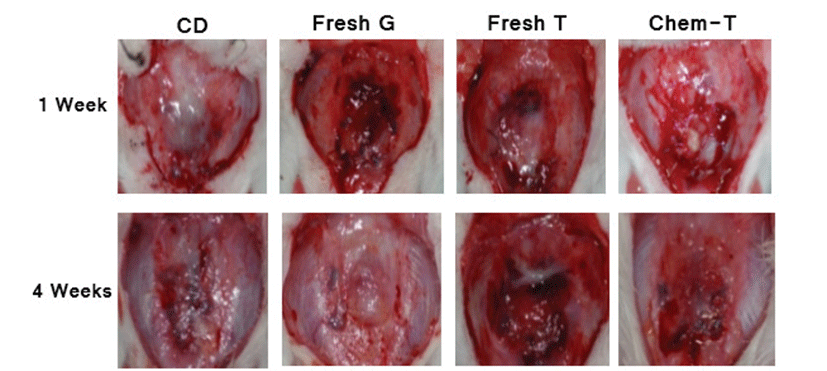
희생 후 부검 시 면역관련 주요 장기의 이상소견은 나타나지 않았으며 측정한 장기 무게에서도 유의적인 변화는 나타나지 않았다(Table 2). 또한 해면질골을 이식한 두개골 결손부 부검 시 육안적 검사에서도 염증과 관련된 특이적인 소견은 관찰되지 않았다(Fig. 1).
Table 2.
Relative organ weights of rats at 1 week and 4 weeks after bone implantation
| Group |
Body weight (g) |
Relative organ weight (g) (Organ weight/body weight × 100)
|
| Spleen |
Thymus |
Lymph node |
| CD |
1 week |
255.6 ± 10.83 |
0.3561 ± 0.0404 |
0.2047 ± 0.0388 |
0.5608 ± 0.0630 |
| 4 weeks |
381.20 ± 25.47 |
0.2393 ± 0.0258 |
0.1508 ± 0.0181 |
0.3901 ± 0.0357 |
| Fresh G |
1 week |
253.4 ± 7.99 |
0.3148 ± 0.0533 |
0.2165 ± 0.0609 |
0.4924 ± 0.0505 |
| 4 weeks |
348.78 ± 24.23 |
0.2342 ± 0.0324 |
0.1349 ± 0.0271 |
0.3690 ± 0.0340 |
| Fresh T |
1 week |
255.2 ± 7.04 |
0.3117 ± 0.0454 |
0.1847 ± 0.0318 |
0.4812 ± 0.0817 |
| 4 weeks |
346.83 ± 15.53 |
0.2191 ± 0.0268 |
0.1328 ± 0.0192 |
0.3519 ± 0.0242 |
| Chem T |
1 week |
253.0 ± 10.04 |
0.3898 ± 0.0450 |
0.2373 ± 0.0417 |
0.6271 ± 0.0845 |
| 4 weeks |
368.25 ± 11.93 |
0.2221 ± 0.0241 |
0.1494 ± 0.0375 |
0.3715 ± 0.0369 |
Download Excel Table
Fig. 1.
Photographs of rat calvaria at 1 week and 4 weeks after bone implantation. CD group: critical defect group, Fresh G group: fresh general pig bone, Fresh T group: fresh transgenic pig bone, Chem T group: chemical treated transgenic pig bone.
Download Original Figure
Micro CT 분석
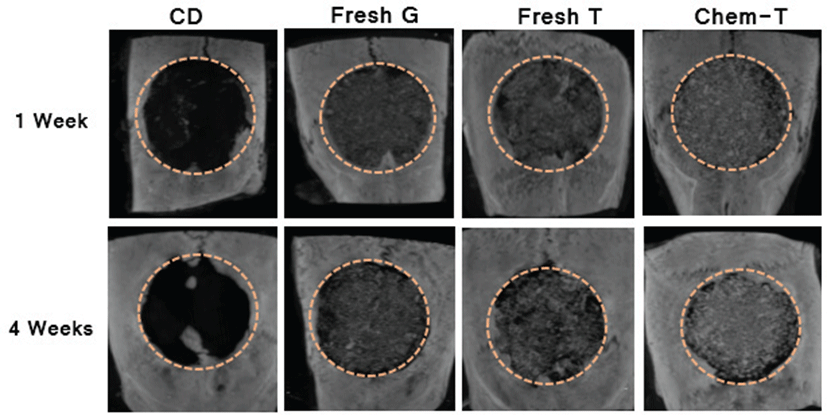
Micro CT 3D 영상에서 1주차에는 이식군에서 이식재가 골결손 부위 내에 형태를 유지하고 있는 것을 확인할 수 있었으며, 4주차에서는 대조군에서 골재생이 거의 일어나지 않아 골결손부위가 채워지지 않은 것에 비해 이식군에서는 이식재가 골결손 부위 내에서 형태를 유지하고 있었으며 골결손 가장자리부터 신생골 형성이 시작되고 있는 것이 관찰되었다(Fig. 2). 특히 일반 돼지 해면질 생 뼈 이식군에 비해 형질전환 돼지 해면질 생 뼈 이식군이나 화학처리 해면질골 이식군이 골결손 가장자리로부터 신생골 형성이 더욱 많이 이루어진 것을 관찰할 수 있었다. 골부피의 경우 1주차에서 대조군에 비해 이식군의 골부피가 유의적으로 높은 것을 확인할 수 있었으며, 형질전환 돼지 화학처리 해면질골 이식군, 형질전환 돼지 해면질 생 뼈 이식군, 일반 돼지 해면질 생 뼈 이식군 순으로 골부피가 높은 것을 볼 수 있었다(Table 3). 뿐만 아니라 4주차에서는 다른 생 뼈 이식군은 대조군과 유사한 골부피를 보였으나 형질전환 돼지 화학처리 해면질골 이식군은 더 높은 골 부피를 보였다. 골밀도의 경우 모든 이식군에서 1주차에 비해 4주차에 감소하는 경향을 보였으며, 유의적인 차이 는 나타나지 않았으나 화학처리 해면질골 이식군의 골밀도가 가장 높은 것을 확인할 수 있었다.
Fig. 2.
Micro CT 3D images of rat calvaria at 1 week and 4 weeks after bone implantation. CD group: critical defect group, Fresh G group: fresh general pig bone, Fresh T group: fresh transgenic pig bone, Chem T group: chemical treated transgenic pig bone. Dotted line: defect margin.
Download Original Figure
Table 3.
Bone volume and bone mineral density of the regenerated rat calvaria at 1 week and 4 weeks after bone implantation
| Group |
BV (mm3)
|
BMD (g/mm3)
|
| 1 week |
4 weeks |
1 week |
4 weeks |
| CD |
0.145 ± 0.170 |
2.944 ± 2.699 |
0 |
0.018 ± 0.040 |
| Fresh G |
1.289 ± 0.299** |
2.739 ± 1.307 |
0.010 ± 0.009 |
0 |
| Fresh T |
2.251 ± 0.497**,† |
3.607 ± 1.345 |
0.010 ± 0.011 |
0.010 ± 0.111 |
| Chem T |
5.016 ± 0.594**,††,‡‡ |
9.792 ± 5.508*,†,‡ |
0.058 ± 0.012 |
0.051 ± 0.051 |
Download Excel Table
조직학적 평가
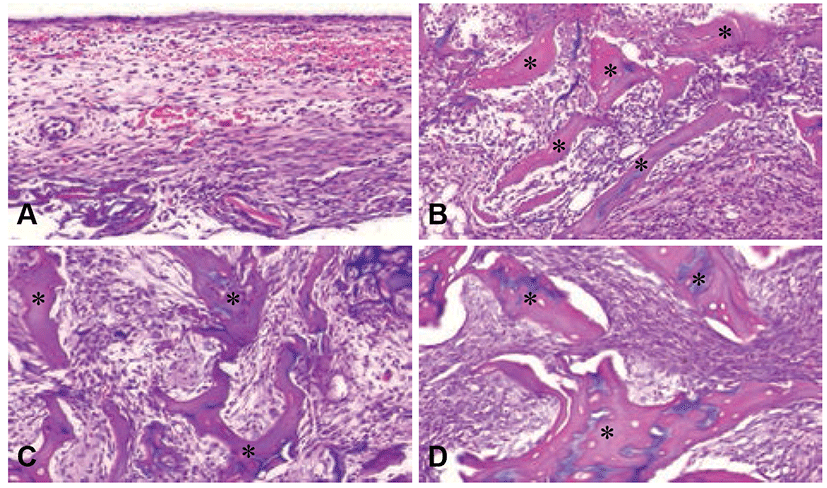
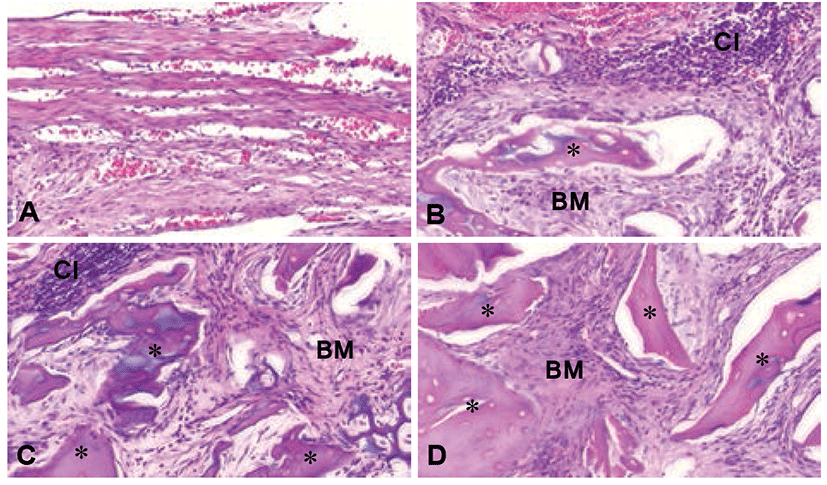
두개골 결손부 중앙 부분의 조직 사진에서 1주차에 대조군의 경우 섬유모세포양 세포(fibroblast-like cell)들과 염증세포(inflammatory cell)가 관찰되었다. 이식군에서는 이식한 골 입자가 흡수되지 않고 잘 유지되고 있는 것이 관찰되었으며 이식재 입자 주위로 염증세포 침윤이 관찰되었다(Fig. 3). 4주차 조직 사진에서 대조군의 결손 부위에는 신생골 형성이 없었고 약간의 적혈구와 섬유성 결합조직으로만 채워져 있었다(Fig. 4). 그러나 모든 이식군에서는 이식재 입자 주위에 골유사기질(bone like material)이 형성된 것이 관찰되었다(Fig. 4). 특히 형질전환 돼지 화학처리 해면질골 이식군, 형질전환 돼지 해면질 생 뼈 이식군, 일반 돼지 해면질 생 뼈 이식군 순으로 골유사기질이 더 많이 형성된 것을 볼 수 있었다. 그러나 형질전환 돼지 화학처리 해면질골 이식군을 제외한 생 뼈를 이식한 모든 군에서는 이식재 입자 주위에 림프계 세포 (Lymphoid cell) 침윤이 관찰되었다.
Fig. 3.
Histological findings of center region of rat calvarial defects at 1 week after bone implantation. Hematoxylin & eosin stain, ×200. (A) CD group: critical defect group, (B) Fresh G group: fresh general pig bone, (C) Fresh T group: fresh transgenic pig bone, (D) Chem T group: chemical treated transgenic pig bone. *: bone graft particle.
Download Original Figure
Fig. 4.
Histological findings of center region of rat calvarial defects at 4 week after bone implantation. Hematoxylin & eosin stain, ×200. (A) CD group: critical defect group, (B) Fresh G group: fresh general pig bone, (C) Fresh T group: fresh transgenic pig bone, (D) Chem T group: chemical treated transgenic pig bone. *: bone graft particle, BM: bone like material, CI: cellular infiltration.
Download Original Figure
Discussion
장기 이식에 대한 수요가 증가하면서 돼지의 장기를 사람에게 이식하는 이종 이식에 대한 관심 또한 증가하고 있다[1-3]. 그러나 돼지의 세포 표면에 발현되는 알파갈 항원결정인자와 사람 혈액의 알파갈 특이 자연항체 사이의 초급성 면역반응이 돼지에서 사람으로의 이종장기 이식을 어렵게 하고 있다[4-8].
따라서 이러한 면역반응을 없애기 위해 항원결정인자가 제거된 알파갈 넉아웃 형질전환 돼지가 새로운 대안으로 떠오르고 있다[8, 9]. 실제 알파갈 넉아웃 형질전환 돼지의 다른 연부조직 장기와 관련된 연구[1, 10, 11]는 많이 시행되고 있으나 골이식과 관련된 연구는 거의 없는 실정이다. 실제로 골은 혈액 다음으로 많이 이식되는 장기로 외상이나 골관절염, 골다공증 등 골이 제대로 기능을 하지 못하는 경우에 골이식이 시행되며 최근 들어 점점 필요성이 증가하고 있고[17], 면역학적 단백질이 적은 편이므로 실제로 이식 실현 가능성이 높은 장기라고 할 수 있다[17-20].
따라서 본 연구는 일반 돼지 및 알파갈 넉아웃 형질전환 돼지의 생 뼈 및 탈지∙탈단백 등 화학적 처리를 한 해면질골의 골이식재로서의 가능성을 알아보기 위해 면역학적인 반응 및 초기 골 재생능력을 평가하였다.
일반 돼지 및 형질전환 돼지의 해면질골을 이식하였을 때 전신 면역반응이 나타나는지 살펴보기 위해 혈액검사 및 부검을 실시하였다. 혈액검사 결과 모든 수치가 정상 범위 안에 존재하였고 군간의 유의적인 차이는 나타나지 않았으며, 부검 시 육안적 검사에서도 면역관련 주요 장기의 이상 소견은 관찰되지 않았다. 그 밖에 장기 무게에서도 특별한 차이가 존재하지 않았다. 이러한 결과들을 통해 일반 돼지와 알파갈 넉아웃 형질전환 돼지의 해면질골로 인한 전신적인 면역반응이 나타나지 않았다고 생각할 수 있었다.
골이식 1주와 4주 후에 실시한 골이식부의 육안적인 검사에서 국소적인 염증 반응은 관찰되지 않았다. 조직학적 분석 결과 1주차에 대조군에서는 결손 부위에 염증세포들이, 이식군에서는 이식재 입자 주위에 염증세포 침윤을 볼 수 있으며, 이것은 골재생에서 정상적인 생리적인 반응인 초기 염증기로 볼 수 있다. 그러나 대조군에 비하여 모든 이식군에서 이식재 주위에 많은 염증세포들이 관찰되었고, 화학처리 해면질골 이식군을 제외한 모든 이식군에서 조직 부종도 관찰되어 국소적인 염증반응이 관찰되었다. 또한 4주차에서는 화학처리 해면질골 이식군과 달리 생 뼈 이식군에서 림프계 세포 침윤이 더 많이 관찰되었다. 그러나 생 뼈를 이식한 모든 군에서 1주차의 염증기는 4주차에 세포증식기 및 조직증식기 단계로 진행되어서 거의 정상적인 골재생 과정을 거친다는 사실을 관찰하였다. 실제로 다른 처리를 하지 않은 생 뼈를 이식하는 것은 숙주에게서 뚜렷한 면역 반응을 일으킬 수 있다고 알려져 있으나[21-23], 다른 실질 장기와는 다르게 면역 거부반응이 약하다는 것을 확인할 수 있었다. 또한 이러한 면역 반응은 간단한 화학처리를 통하여 억제할 수 있었다. 이러한 결과는 뼈에 탈지 및 탈단백 처리를 간단하게 해줌으로써 면역원성 물질들을 제거하여 이식재에 대한 면역 거부 반응을 줄일 수 있다는 다른 문헌들의 내용과 일치한다[22, 23]. 또한 일반 돼지와 형질전환 돼지 생 뼈를 비교하였을 때 일반 돼지에서 세포 침윤이 더 많이 관찰되는 것으로 보아 일반 돼지와 달리 형질전환 돼지의 생 뼈는 면역 반응을 덜 일으킨다고 할 수 있다.
Micro CT 결과를 3D 영상으로 구성한 결과 대조군의 경우 1주차와 4주차에 차이가 없을 정도로 골 결손부에 신생골이 형성되지 않고 그대로 유지되는 것을 볼 수 있었다. 그 밖에 골부피와 골밀도를 분석한 결과 1주차와 4주차 간의 유의적인 증가는 나타나지 않았다. 또한 조직학적 분석 결과에서도 결손부 중앙에 섬유성 결합조직만이 관찰되었다. 본 연구에서 랫드의 두개골에 형성한 결손부의 크기는 8 mm로 이는 랫드 두개골의 임계 크기 골결손으로 자연적으로 치유가 되지 않는 최소 크기의 골결손을 의미한다. 실제 임계 골결손부는 결손부에 섬유성 결합조직만 얇게 형성될 뿐 골 재생은 관찰되지 않는다고 알려져 있으며 본 연구의 대조군의 결과에서도 확인할 수 있었다[24].
다른 이식군의 결과에서는 먼저 Micro CT 3D 영상에서 골이식재가 골결손부 내에 잘 유지되고 있었으며 특히 4주차에서는 골결손부 가장자리부터 신생골이 형성되는 양상이 관찰되었다. 1주와 4주차의 비교 시 골부피는 증가하였으며 골밀도는 감소되는 경향을 보였다. 조직학적 평가에서는 1주에 비해 4주차에서 골이식재 입자의 크기가 작아지면서 이식재 입자 주위로 새로운 골유사기질이 관찰되었다. 이러한 결과는 골이식 시 이식재가 흡수되고 새로운 골 기질이 형성되는 골 재형성(bone remodeling) 과정이라고 볼 수 있고[25] 이렇게 이식재가 흡수되는 과정에서 골밀도는 감소하고 새롭게 형성된 골유사기질로 인해 골부피는 증가하는 경향이 나타났다고 할 수 있다. 이러한 골부피의 증가는 화학처리 해면질골 이식군에서 더 뚜렷이 나타났다. 생 뼈 이식군들의 골밀도를 비교해보면 형질전환 돼지 생 뼈에 비해 일반돼지 생 뼈의 골밀도가 뚜렷이 감소하는 경향이 나타났는데 이는 형질전환돼지 생 뼈보다 일반돼지 생 뼈에 대한 국소적인 염증 반응이 더 심하게 일어남으로써 골이 흡수되는 과정에서 나타나는 결과라 할 수 있다.
4주차에 형성된 골유사기질을 비교하였을 때 형질전환 돼지 화학처리 해면질골 이식군, 형질전환 돼지 생 뼈 이식군, 일반 돼지 생 뼈 이식군 순으로 더 많이 형성된 것을 볼 수 있었다. 또한 골유사기질의 양상에서 형질전환 돼지 생 뼈와 형질전환 돼지 화학처리 해면질골 이식군의 골유사기질이 일반 돼지 생 뼈 이식군보다 더 많이 존재하였으며, 이는 차후 골로 형성될 가능성이 더 높을 것으로 생각된다.
따라서 본 연구 결과 생 뼈 자체는 전신 면역을 일으키지 않으나 화학처리를 한 뼈에 비해 국소적인 염증을 일으킬 수 있으며, 일반 돼지 뼈에 비해 알파갈 넉아웃 형질전환 돼지 생 뼈의 경우 면역 반응이 더 적다는 것이 확인되었다. 뿐만 아니라 형질전환 돼지 뼈는 일반 돼지 뼈에 비해 흡수가 덜 되면서도 차후에 골로 변화되는 골유사기질이 많이 만들어진 것이 확인되었다. 또한 간단히 화학처리를 한 형질전환 해면질골 이식군의 경우 생 뼈 이식군과 비교하였을 때 면역반응이 훨씬 적으면서도 더 많은 골유사기질이 형성되었다. 이러한 골유사기질은 나중에 미성숙골(woven bone)에서 성숙골(lamellar bone)로 변화하여 신생골로 형성될 가능성이 높다.
결론적으로 형질전환 돼지 생 뼈는 일반 돼지 생 뼈에 비해 이식 시 면역 반응을 덜 일으키는 생체적합성이 뛰어난 골이식 소재이며, 생 뼈에 탈지∙탈단백 등의 화학 처리를 해줌으로 써 골 이식재의 면역원성을 훨씬 감소시킬 수 있다.
Acknowledgements
본 연구는 농촌진흥청 차세대 바이오그린 21 사업의 연구비(No.: PJ009617) 지원을 받아 수행되었으며 이에 감사드립니다.
REFERENCES
Dorling A, Riesbeck K, Warrens A, Lechler R. Clinical xenotransplantation of solid organs. Lancet. 1997; 349 p. 867-871.

Gridelli B, Remuzzi G. Strategies for making more organs available for transplantation. New Engl J Med. 2000; 343 p. 404-410.

Lechler RI, Sykes M, Thomson AW, Turka LA. Organ transplantation—how much of the promise has been realized?. Nat Med. 2005; 11 p. 605-613.

Galili U. The α-gal epitope (Galα1-3Galβ1-4GlcNAc-R) in xenotransplantation. Biochimie. 2001; 83 p. 557-563.

Yang YG, Sykes M. Xenotransplantation: current status and a perspective on the future. Nat Rev Immunol. 2007; 7 p. 519-531.

d’Apice AJ, Cowan PJ. Xenotransplantation: the next generation of engineered animals. Transpl Immunol. 2009; 21 p. 111.

Li S, Waer M, Billiau AD. Xenotransplantation: role of natural immunity. Transpl Immunol. 2009; 21 p. 70-74.

Ramsoondar JJ, Macháty Z, Costa C, Williams BL, Fodor WL, Bondioli KR. Production of a1, 3-galactosyl-transferase-knockout cloned pigs expressing human α1, 2-fucosylosyltransferase. Biol Reprod. 2003; 69 p. 437-445.

Klymiuk N, Aigner B, Brem G, Wolf E. Genetic modification of pigs as organ donors for xenotransplantation. Mol Reprod Dev. 2010; 77 p. 209-221.

Kuwaki K, Tseng YL, Dor FJ, Shimizu A, Houser SL, Sanderson TM, Lancos CJ, Prabharasuth DD, Cheng J, Moran K. Heart transplantation in baboons using α1, 3-galactosyltransferase gene-knockout pigs as donors: initial experience. Nat Med. 2005; 11 p. 29-31.

Yamada K, Yazawa K, Shimizu A, Iwanaga T, Hisashi Y, Nuhn M, O'Malley P, Nobori S, Vagefi PA, Patience C. Marked prolongation of porcine renal xenograft survival in baboons through the use of a1, 3-galactosyltransferase gene-knockout donors and the cotransplantation of vascularized thymic tissue. Nat Med. 2005; 11 p. 32-34.

Supronowicz P, Zhukauskas R, York-Ely A, Wicomb W, Thula T, Fleming L, Cobb RR. Immunologic analyses of bovine bone treated with a novel tissue sterilization process. Xenotransplantation. 2008; 15 p. 398-406.

Zunino J, Bengochea M, Johnston J, Deneo H, Hernandez S, Servetto C, Taranto L, Ordoqui G. Immunologic and osteogeneic properties of xenogeneic and allogeneic demineralized bone transplants. Cell Tissue Bank. 2004; 5 p. 141-148.

Galia CR, Macedo CA, Rosito R, Mello TMd, Camargo LMAQ, Moreira LF. In vitro and in vivo evaluation of lyophilized bovine bone biocompatibility. Clinics. 2008; 63 p. 801-806.

Katz J, Mukherjee N, Cobb RR, Bursac P, York-Ely A. Incorporation and immunogenicity of cleaned bovine bone in a sheep model. J Biomater appl. 2009; 24 p. 159-174.

Feng W, Lian Y, Zhou Z, Lu Y, Li S, Pei F, Cheng J. Distribution of the alpha-gal epitope on adult porcine bone tissue. Transplantation proceedings. 2006; 38 p. 2247-2251.

VandeVord PJ, Nasser S, Wooley PH. Immunological responses to bone soluble proteins in recipients of bone allografts. J Orthop Res. 2005; 23 p. 1059-1064.

Bolano L, Kopta J. The immunology of bone and cartilage transplantation. Orthopedics. 1991; 14 p. 987-996.

Friedlaender GE, Strong D, Sell K. Studies on the antigenicity of bone. I. Freeze-dried and deep-frozen bone allografts in rabbits. J Bone Joint Surg Am. 1976; 58 p. 854-858.

Lee J, Song H, Kim N, Choi I. Comparison of osteoinductive efficacy of freezing, freeze-drying and defat-freezing implant preparation for allograft in rabbit. Kor J Vet Res. 2007; 47 p. 219-228.

Burchardt H. The biology of bone graft repair. Clin Orthop Relat R. 1983; 174 p. 28-34.

Horowitz M, Friedlaender G. Immunologic aspects of bone transplantation. A rationale for future studies. Orthop Clin N Am. 1987; 18 p. 227-233.

In: Tobias KM, Johnston SA, editors.Kraus KH. bone grafts and substitutes. Veterinary Surgery: Small Animal. 2012; St. louisElsevier saunders p. 676-684.

Spicer PP, Kretlow JD, Young S, Jansen JA, Kasper FK, Mikos AG. Evaluation of bone regeneration using the rat critical size calvarial defect. Nat Protoc. 2012; 7 p. 1918-1929.

Develioglu H, Unver Saraydin S, Kartal U. The bone-healing effect of a xenograft in a rat calvarial defect model. Dent Mater J. 2009; 28 p. 396-0.