Introduction
모발은 상피조직에 야기될 찰과상을 완충하며, 직접적인 자외선으로부터 보호하는 동시에 체온을 조절하고, 외부로부터의 자극을 전달하는 등 생리적으로 중요한 역할을 담당한다. 특히 두피 모발은 인체 모발의 약 20%를 차지하며, 두부의 보호뿐만 아니라 대인관계에 있어서 성별과 연령 및 개성에 맞는 외향적인 면모를 부각시키는데 중요한 요소 중 하나로 인지되고 있다[1]. 일반적으로 모발의 수명은 남성의 경우 약 3~5년, 여성의 경우 약 4~6년으로 알려져 있으며, 모유두(dermal papilla)의 활동 주기에 의해 결정된다[2]. 정상모발의 90%는 모유두의 활동이 활발하여 모발을 성장시키는 성장기(anagen, growing phase)에 있으며, 모근부가 수축되고 모유두가 분리되면서 성장이 늦어지는 퇴행기(catagen, transitional phase)는 1% 미만의 비율을 보인다. 이 후 모유두의 활동이 완전히 멈추고 모구가 건조되어 곤봉모가 되는 휴지기(telogen, resting phase)와 모발이 탈락하면서 새로운 모발이 발생되는 발생기(exogen and early anagen)로 이어지는 4단계의 모주기(hair cycle)를 반복하게 된다. 이러한 모주기가 정상적으로 순환하지 못하고 모유두의 활동이 멈추어 휴지기의 모발 비율이 증가하거나 모발이 비정상적으로 탈락한 뒤 재생되지 않는 증상을 탈모(alopecia)라고 한다[1, 3].
탈모를 노화 현상의 일환으로 인식하던 기존의 개념과 달리 최근에는 20~30대 여성과 청소년기의 학생들에서도 나타나며, 유전적인 요인과 더불어 환경적 스트레스, 편중된 식습관에의 인한 영양적 불균형 등의 원인이 대두되고 있다[3, 4]. 현재 사용되고 있는 모발성장 촉진제제로는 경피 도포제인 미녹시딜(Minoxidil), 경구 복용제인 피나스테리드(Finasteride)와 두타스테리드(Dutasteride)가 FDA의 승인을 얻어 임상적으로 유통되고 있다[1, 3]. 하지만 임상사례에 따르면 미녹시딜의 경우 체중증가, 부종, 협심증, 피부염, 가려움증이 유발되기도 하며, 피나스테리드 복용 시 남성 성기능 장애 및 기형아 출산이 보고되기도 하였다[5, 6]. 두타스테리드의 부작용으로는 발기부전과 성욕저하가 대표적이며 전립선암에 대한 우려가 제기된 바 있다[7-9]. 이러한 기존 의약품의 단점을 보완하고 장기적인 사용에도 안전한 천연물 유래 물질의 개발에 관심이 집중되고 있으며, 두피의 산화적 스트레스 감소를 통한 발모 유도, 식물 유래 천연물 발효 물질의 도포를 통한 발모효과 및 특정 식물 추출물의 모발성장 촉진 등 다양한 측면의 연구가 수행된 바 있다[3, 10, 11].
최근 육상식물 이외에도 생물량이 풍부한 해양식물을 대상 으로 화장품이나 건강식품 등에 적용하는 많은 시도가 이루어지고 있으며, 향후 높은 활용 가능성이 부각되고 있다[12-15]. 해양 식물을 이용한 발모 효과에 대한 연구는 대부분 상업화를 위한 특허를 중심으로 이루어지고 있으며, 국내에는 약 40여 개의 특허가 출원 및 등록되어 있다. 그러나 모든 특허는 여러 해조류를 혼합합 조성물이거나 육상식물과 해조류의 추출물을 혼합한 조성물로 단일 해조류 유래 물질에 의한 발모 촉진 효과 연구는 일부 해조류를 제외하고는 전무한 실정이다. 본 연구의 재료인 톳(Sargassum fusiforme (Harvey) Setchell)은 모자반목(Fucales), 모자반과(Sargassaceae)에 속하는 갈조류로 우리나라와 일본 등 동아시아에 분포하고 있으며, 국내에서는 식용으로 알려져 있고, 특히 일본에서는 많은 수요를 보이고 있는 대표적인 해조류 중 하나이다. 또한, 선행 연구를 통해 톳에 대한 높은 항산화 효능이 확인되었을 뿐만 아니라 항염증 반응을 통한 아토피 증상 완화 효과를 보이는 것으로 입증되어 피부 개선에 대한 잠재력이 인정되었다[16]. 본 연구에서는 human keratinocyte인 HaCaT 및 C57BL/6 마우스모델 연구를 통해 톳 추출물 및 분획물의 발모 촉진 효과를 확인하고자 하였다.
Materials and Methods
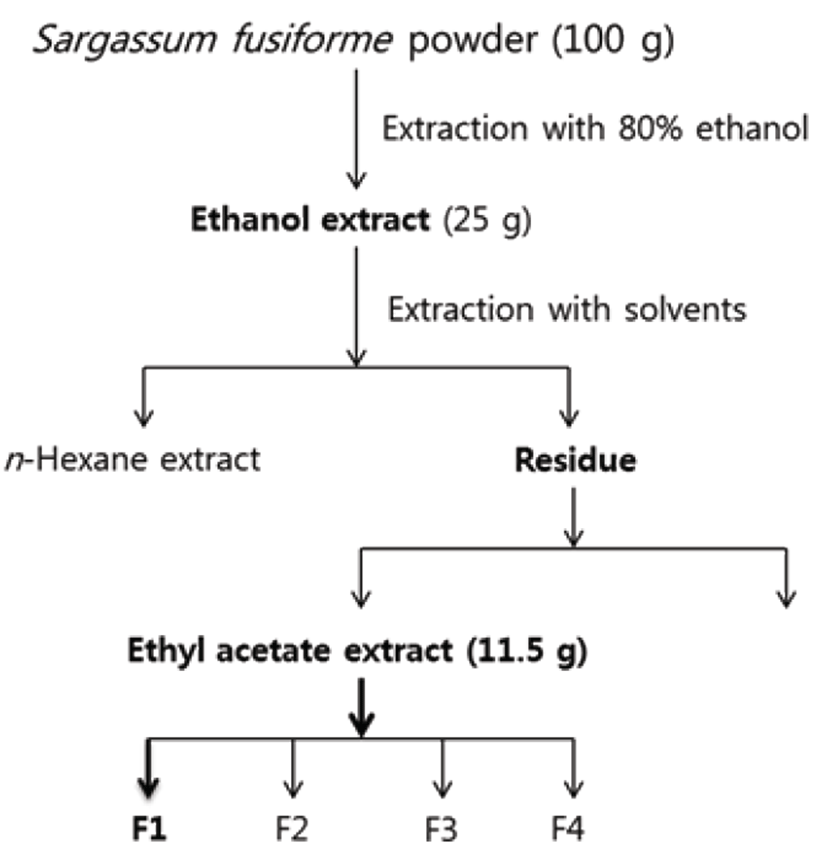
톳은 2012년 10~11월에 동해에서 채집하였으며, 표본 제작 후 국립생물자원관에 보관하였다(Voucher No.: NIBRAL0000137941). 채집한 톳은 염분과 모래를 수돗물로 제거한 후 70% 에탄올과 증류수를 이용하여 2차 세척한 뒤 음지에서 자연건조 하였다. 건조된 톳을 곱게 파쇄한 후 톳 100 g을 1 L의 80% 에탄올에 침지하여 실온에서 24시간 주기로 3일 동안 추출하였으며, filter paper (Whatmann International Ltd., Maidstone, UK)로 여과한 뒤 증발기(Rotary evaporator, N-1110, Eyela, Tokyo, Japan)를 이용하여 용매를 증발시킨 시료를 실험에 사용하였다. 에탄올 추출물로 얻은 시료는 n-hexane, ethyl acetate (EA), chloroform, n-butanol 및 water를 통해 연속적으로 분획하였으며, 이 분획물 중 생물학적 활성이 확인된 EA 추출물을 4가지로 재 분획하였다. EA의 재 분획을 위해 Silica gel (230~400 mesh)을 glass column (300 mm × 30 mm)에 넣고 chloroform으로 활성화한 뒤 EA 추출물을 silica gel의 상층부에 주입하였으며, column에 1 L의 chloroform: methanol (75:25, v/v), 1 L의 chloroform:EA (75:25 to 0:100, v/v), 1 L의 EA:acetone (75:25 to 0:100, v/v), 1 L의 acetone:methanol (75:25 to 0:100, v/v)을 순차적으로 흘려 보낸 후 얻어지는 용액을 차례대로 30 mL씩 테스트 튜브에 모아 동일한 성분이 함유되어있는지 여부를 thin-layer chromatography (TLC)를 이용하여 확인하였다. 총 87개의 시료를 확보한 뒤 Silica gel TLC plates (20 cm × 20 cm) 상에서 나타나는 Rf 값을 토대로 비교하였으며, 용매는 chloroform:methanol:water (75:25:10)를 사용하였고, 스팟은 플레이트를 iodine fumes에 노출시킴으로서 확인하였다. 같은 Rf 값을 가지는 시료들을 선별한 결과 4개의 그룹으로 (fraction number:F1~F4) 구분되었으며, 동일한 성분이 함유된 시료들을 모아 증발기를 이용하여 용매를 증발시킨 후 실험에 사용하였다. 4개의 1차 분획물 (F1~F4) 중 생물학적 활성이 높게 나타난 F1 (FR)을 시험물질로 선정하였다(Fig. 1).
생후 5주된 수컷 C57BL/6 마우스를 (주)샘타코 바이오 코리아로부터 구입하여 1주간 순화시키면서 일반증상을 관찰한 후 건강한 개체만을 선별하여 실험에 사용하였으며, 사육 시 환경 조건은 실내온도 23 ± 3°C, 상대습도 50 ± 10%, 조명시간 12시간(오전 9시~오후 9시), 조도는 150~200 lux로 조절하였다. 실험군은 무처리군(Control, Ctrl), 5% 미녹시딜 처리군(MIN, 양성대조군; (주)현대약품), 에탄올 추출물(ET) 처리군, fraction1 (FR) 처리군으로 설정하였고, 약물처리군의 경우 저농도(20 mg/kg)와 고농도(40 mg/kg)로 구분하였으며, 각 실험군은 3마리씩 분류하여 변화를 관찰하였다. 시료 도포 하루 전 마우스의 등을 전기제모기 및 제모제 를 이용하여 완전 제모를 하였으며, 각 군별로 요구 농도가 되도록 조정한 뒤 0.2 mL 용량을 붓을 이용하여 고르게 도포하였다. 각 시험물질의 도포는 21일간 매일 1회씩 같은 시각(오후 2시)에 실시하여, 1일, 6일, 9일, 12일, 15일 및 21일째에 체중 측정 및 사진 촬영을 통해서 변화 양상을 관찰하였다.
동물실험은 Gangneung-Wonju National University Animal Care and Use Committee (Approval no.: GWNU-2013-18)에 의해 승인되었으며, 실험의 절차는 IACUC 표준운영가이드라인(식품의약안정처∙농림수산검역검사본부, 2011)에 의거하여 수행하였다.
실험물질 도포일로부터 1일, 6일, 9일, 12일, 15일 및 21일째에 실험동물을 pentobarbital (Sigma-Aldrich, St. Louis, MO, USA)로 마취시킨 후 발모의 정도를 육안 및 사진 촬영을 통해 관찰하였다. 모발 성장 효과를 상대적으로 비교하기 위해 전체 면적 대비 발모 면적을 0~10%(–), 11~30%(+), 31~50%(++), 51~70%(+++), 71~90%(++++), 91~100% (+++++)로 구분하여 육안으로 판정하였다.
시험개시 후 최종일에 실험물질 도포부위 중 발모가 왕성한 부위와 지연된 부위의 피부가 포함되도록 적출한 후 10% Neutral buffered formalin으로 7일간 고정하였으며, 조직절편 및 hematoxylin-eosin 염색을 비롯한 영구 슬라이드 제작은 연세대학교 의과대학 임상의학연구센터 실험동물부(Department of laboratory animal medicine, Medical research center, Yonsei university college of medicine)에 의뢰하였다(Application No.: 2013-0970).
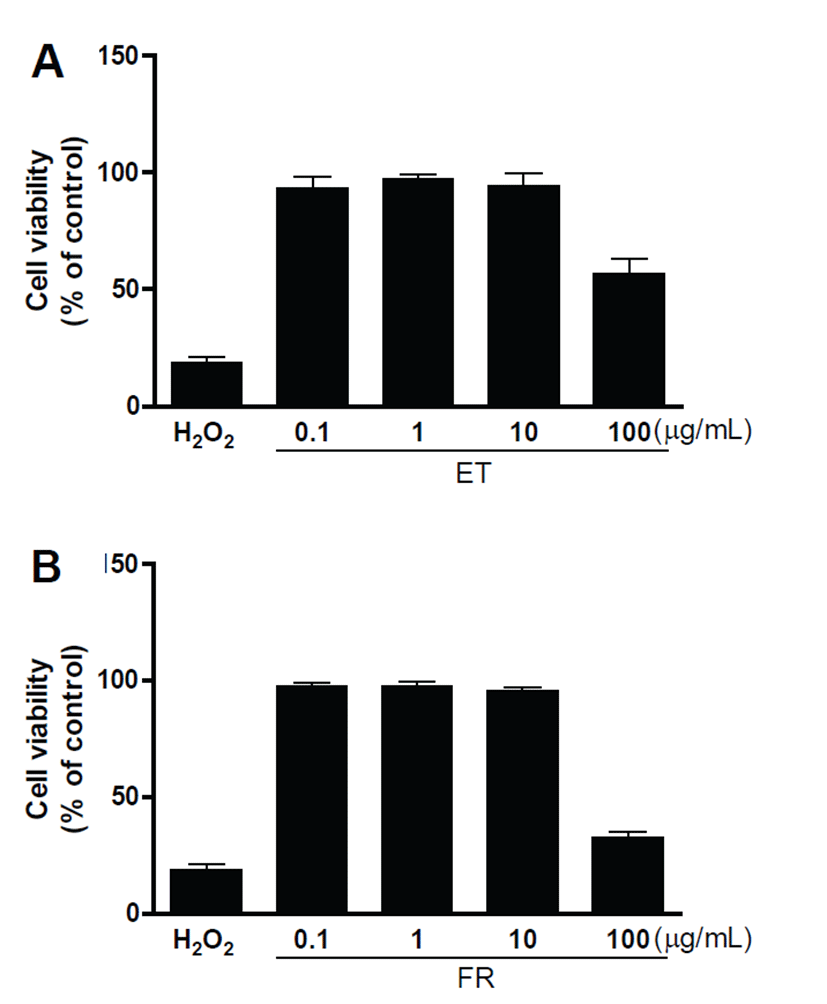
ET 및 FR의 농도에 따른 세포 활성 저해 여부를 파악하기 위해 Cell Counting Kit-8 (CCK-8, Dojindo, Kumamoto, Japan)를 사용하였다. 세포주는 피부조직에 미치는 잠재적 영향을 확인하기 위해 human keratinocyte, HaCaT 세포주를 96well plate에 1 × 105 cells/mL가 되도록 분주하여 0.1, 1, 10, 100 μg/mL 농도의 시험물질 및 대조군 1 mM H2O2를 처리하였으며, 5% CO2 incubator에서 24시간 배양 후 10 μL CCK 용액을 각 well에 넣고 2시간 동안 37°C 배양기에서 배양한 뒤 450 nm 파장 하에서 ELISA reader (Spectramax Plus 384 Spectrophotometer, Molecular Devices, Sunnydale, CA, USA)로 흡광도를 측정하여 비교하였다.
톳 추출물 및 분획물에 의한 발모 관련 유전자 발현 수준 변화를 확인하기 위해 human keratinocyte HaCaT 세포주를 대상으로 1 × 107 cell/mL의 세포에 농도별로 약물처리 후 Trizol reagent (Invitrogen, Carlsbad, CA, USA)를 이용하여 total RNA를 추출하였다. 추출한 RNA 1 μg를 대상으로 oligo dT primer 및 TOPscript™ Reverse Transcriptase (Enzynomics, Seoul, Korea)를 사용하여 cDNA를 합성하였다. 실시간 중합효소연쇄반응(Quantitative real-time PCR)은 SYBR Green PCR Master Mix (Qiagen, Valencia, CA, USA)를 사용하여 총 20 μL reaction mixture가 되도록 섞은 뒤 Rotor-Gene 6000 (Corbett Research, Sydney, Australia)를 이용하여 수행되었다. PCR 조건은 pre-denaturation 95°C 10분 후 denaturation 95°C 15초, annealing 57°C 15초, extension 72°C 10초를 1 cycle로 45회 반복한 뒤 final extension 72°C 10분을 설정하였다. Primer는 KGF (forward: ggcaaagtaaaagggaccca, reverse: aaggcaacaaacatttcccc), TGF-β1 (forward: catcaacgggttcactaccg, reverse: aagttggcatggtagccctt), VEGF (forward: caaggccagcacataggaga, reverse: gcaacgcgagtctgtgtttt), GAPDH (forward: ggagccaaaagggtcatcat, reverse: gtgatggcatggactgtggt)를 Bioneer (Deajeon, Korea)에 제작 의뢰하여 사용하였다.
Results
본 연구에 사용된 시험약물의 직접적인 피부도포 시 특별한 이상 증상이나 과민한 피부의 변화는 관찰되지 않았으며 실험 중 모든 약물에 의한 치명적 독성이 관찰되지 않았고, 급격한 체중의 증가나 감소가 관찰되지 않아 약물에 의한 스트레스 등 특별한 이상반응은 없는 것으로 사료되었다(Fig. 2). 한편, ET 고농도 처리군(40 mg/kg)에서 미미한 수준의 각질이 발생하였으나 시간 경과 시 제모부위가 정상적으로 회복됨에 따라 정상으로 회복되었으며, FR 고농도 처리군(40 mg/kg)의 경우 개체에 따라 제모 후 약한 발적이 관찰되었으나 도포 7~10일 경과 후 모두 정상으로 회복되어 약물에 의한 자극은 아닌 것으로 판단되었다.
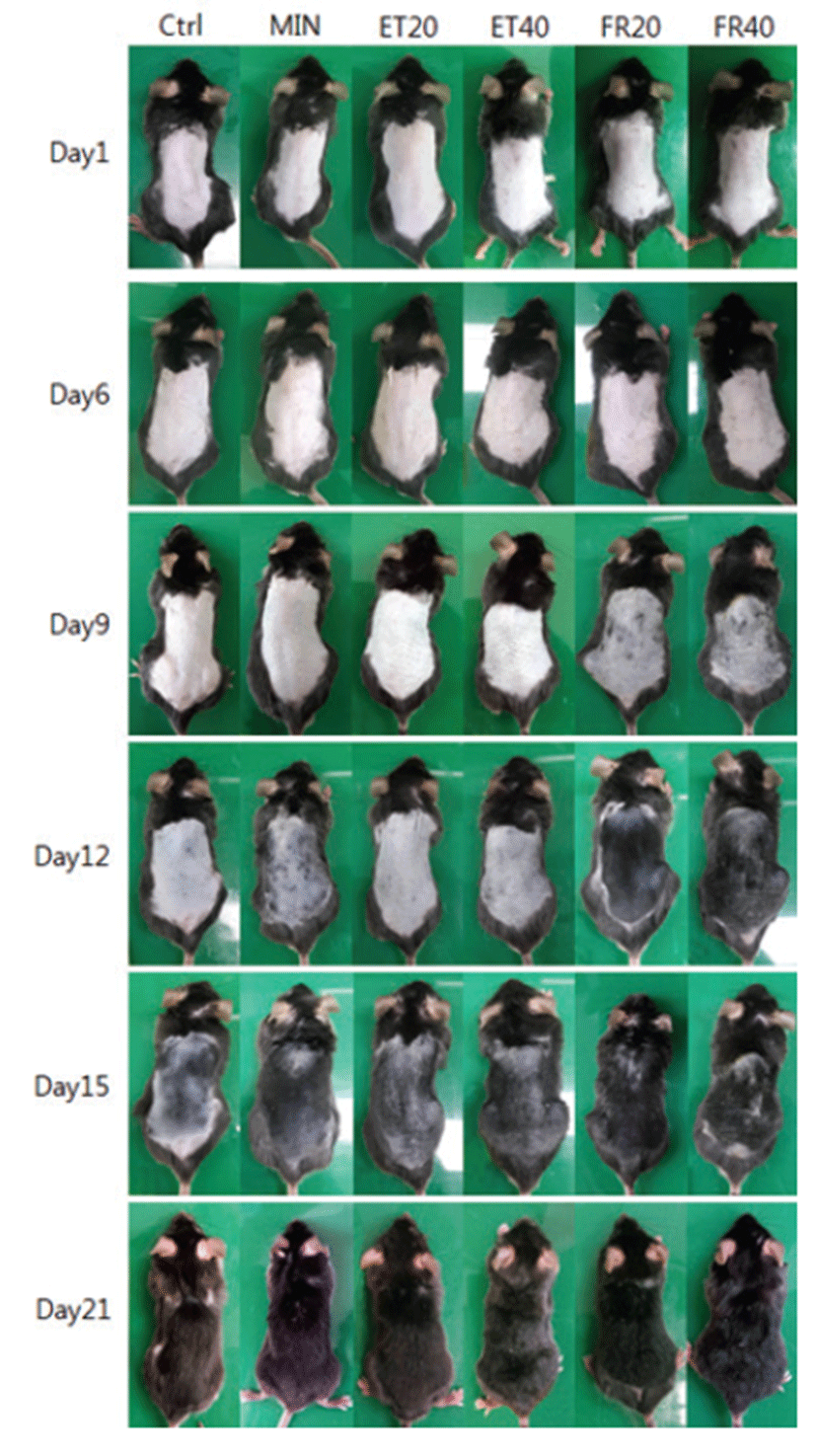
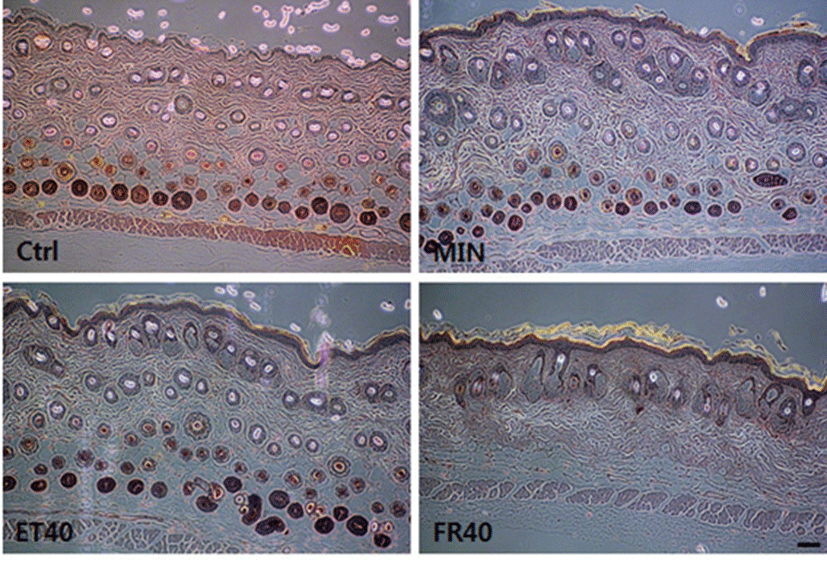
일반적으로 C57BL/6 마우스는 생후부터 모든 모낭이 성장기로 들어가 털이 자라기 시작했다가 약 6주령이 되면서 휴지기로 접어들어 약 4주 동안 유지되며, melanin 합성이 모발성장 주기와 잘 일치하여 피부색으로 성장주기를 판정할 수 있어 모발생리 연구에 널리 이용되는 모델이다[17]. 각 시험군별 발모 효과를 육안으로 관찰한 결과 6일 경과 시 FR 도포군의 피부가 회색으로 변하기 시작하면서 짧은 털의 성장이 관찰되었으며, 9일부터 MIN 도포군 및 ET 도포군에서도 털의 성장을 확인하였다(Fig. 3). 한편, FR 도포군에서는 9일째부터 밀도가 높은 다발 형상의 발모가 진행되기 시작하였고, 12일 경과 시 다른 시험군들에 비해 현저한 발모 수준을 보였다. 이와 같은 경향성은 시험 종료시점인 21일 도포 시점까지 유지되었으며, 양성대조군인 MIN 및 ET 도포군이 19~20일 전후로 제모전과 동일한 수준의 회복을 보인 반면 FR 도포군은 약 3~5일정도 빠른 발모성장을 보였다(Fig. 3, Table 1). 시험물질 도포 후 나타나는 조직학적 변화를 확인한 결과 ET 도포군에서 MIN과 유사한 수준의 모낭(hair follicle) 유도가 관찰되었으며, FR 도포군에서는 다른 시험군들에 비해 상대적으로 모낭의 발달 정도가 증가한 것으로 나타났다(Fig. 4). 더욱이 대조군과 비교했을 때 고농도 도포군에서도 안정된 피부조직 형태를 보이고 있어 톳 유래 ET 및 FR은 양성대조군 인 MIN에 비해 동등하거나 그 이상의 발모효과를 가지는 안전성이 높은 저자극성 물질로 사료된다. (Fig. 5).
| Days | Ctrl | MIN | ET20 | ET40 | FR20 | FR40 |
|---|---|---|---|---|---|---|
| 6 | − | − | − | − | + | + |
| 9 | − | − | − | − | ++ | ++ |
| 12 | + | ++ | + | + | +++ | +++ |
| 15 | ++ | +++ | +++ | +++ | ++++ | ++++ |
| 21 | ++++ | +++++ | +++++ | +++++ | +++++ | +++++ |
Study compounds were applied to the shaved dorsal skin of mice for 21 days, and hair growth was evaluated by the scoring index: 0~10%(−), 11~30% (+), 31~50% (++), 51~70% (+++), 71~90% (+++), 90~100% (+++++). Ctrl, non-treated normal; MIN, minoxidil 5%; ET20/40, ethanol extract 20/40 mg/kg; FR20/40, fraction 20/40 mg/kg.
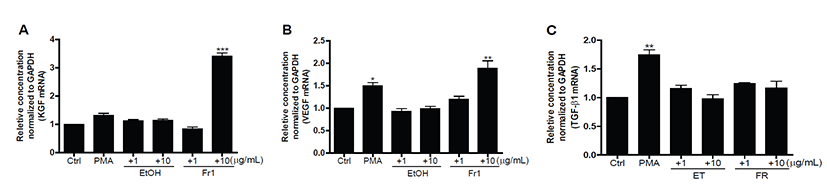
실험동물을 대상으로 수행한 in vivo 실험과 더불어 톳 ET와 FR에 의한 발모관련 유전자발현 확인은 ET 및FR 모두에서 독성이 나타나지 않는 최대농도인 10 μg/mL이하(1, 10 μg/mL)로 선정하였다. 본 실험에서는 모발 성장에 직간접적으로 영향을 미치는 것으로 알려진 KGF, VEGF, TGF-β1의 유전자 발현 수준을 대조군(PMA, Phorbol 12-myristate 13-acetate) 과 비교함으로써 ET와 FR의 기전적 발모 효능을 검증하고자 하였다. 대조군인 PMA는 protein kinase C (PKC) pathways를 활성화하여 KGF, VEGF 등 성장인자의 mRNA 발현을 증가시키는 물질로 알려져 있어 본 연구의 적합한 대조물질로 사용되었다[18, 19]. 섬유아세포 성장인자 family의 member로서 모발 성장을 촉진하는 인자인 KGF [20, 21]는 ET와 FR에서 대조군에 비해 발현수준이 증가하는 경향을 보였으며, 특히 FR 10 μg/mL 처리군에서 약 3.5배 이상의 높은 발현 증가율을 보였다(Fig. 6A). 또한, 휴지기에 신생혈관 생성을 촉진시키는 인자로서 새로운 모발을 성장기로 자극하는 VEGF [20] 역시 FR 처리군에서 상대적으로 높은 발현 수준을 보였으며, 고농도 처리군에서는 약2배이상의 증가율을 보여 KGF와 유사한 경향성을 보였다(Fig. 6B). 반면 모발 성장을 억제하는 것으로 알려진 TGF-β1 [19, 21]의 경우 ET 및 FR 처리군에서 유의한 수준의 mRNA 발현 증가가 관찰되지 않았다(Fig. 6C).
Discussion
발모제에 대한 과민반응은 부종, 피부염, 가려움증 등을 야기하기도 하며[5, 6], 지속적인 피부 손상은 2차 감염의 우려가 있어 부작용이 없는 저자극성 신소재개발이 중요한 연구대상으로 부각되고 있다. 본 연구에서는 시험물질인 해양 갈조류 톳 추출물 및 분획물의 발모 촉진 효과를 확인하고 발모관련 유전자분석을 수행하여 톳의 분자세포학적 배경을 함께 제시하고자 하였다. 연구기간 동안 시험물질 처치에 따른 피부민감반응은 발견되지 않아 안전한 물질로 사료되었으며 C57BL/6 마우스의 등을 제모하고 시험물질을 처리하였을 때 피부조직의 정상화와 함께 양성대조군인 MIN에 비해 동등이상의 모낭 유도가 관찰되어 우수한 수준의 발모효과가 있는 것으로 판단되었다. 특히 in-vivo 실험에서 MIN와 유사한 모발 성장을 보인 ET는 모발 관련 유전자가 다소 증가 하는 경향은 보였으나 통계적 유의성이 인정되지 않은 반면 in-vivo 실험에서도 가장 빠른 모발 성장을 보인 FR은 KGF 및 VEGF 모두 높은 수준의 발현을 야기하여 상대적으로 모발 성장 촉진에 긍정적인 효과를 가져올 수 있는 기전적 잠재성이 인정되었다. 한편, KGF 단백질은 각질세포 뿐 아니라 섬유아세포와 내피세포의 분열과 성장에도 영향을 미치는 것으로 알려져 있어 KGF의 유의한 수준의 발현은 성장기의 모발에 상대적으로 강한 신호자극을 전달했을 것으로 사료된다. 특히 FR은 피부 세포들의 성장과 휴지기 신생혈관생성을 동시에 촉진함으로써 ER 및 MIN에 비해 빠른 모발 성장을 보인 것으로 판단된다. 또한, KGF와 TGF-β1 두 유전자는 성장기 모발에서 모두 발현하며, 특히 TGF-β1은 주로 성장기의 후반과 퇴행기 초반에 작용하면서 모발 주기를 조절하는 것으로 알려져 있어[21, 24, 25] 두 유전자의 동시 활성화는 빠른 모발 주기의 진행과 함께 주변 세포와 모발 세포의 빠른 재생을 야기할 것으로 예상되어 이에 대한 추가적인 기전 연구가 필요할 것으로 사료된다.
결론적으로 톳 유래 ET 및 FR은 모발성장인자를 자극하고 혈관신생을 도와 모발 성장에 긍정적인 환경을 조성하는 것으로 생각되며, MIN과 비교했을 때 동등이상의 발모 효과가 확인되었을 뿐만 아니라 피부자극이 없는 안전한 물질임이 확인되어 모발성장 촉진 및 탈모예방제제로의 개발 가능성이 높은 후보소재로 기대된다.







