ARTICLE
Green tea ameliorates recognition memory defects in acute radiation syndrome caused by gamma irradiation
Jong-Sik Jang1, Changjong Moon2, Jong-Choon Kim2, Uhee Jung3, Sung-Kee Jo3, Sung-Ho Kim2,*
Author Information & Copyright ▼
1College of Animal Science, Kyungpook National University, Sangju 742-711, Korea
2College of Veterinary Medicine, Chonnam National University, Gwangju 500-757, Korea
3Advanced Radiation Technology Institute, Korea Atomic Energy Research Institute, Jeongeup 580-185, Korea
*Corresponding Author : Sung-Ho Kim, College of Veterinary Medicine, Chonnam National University, Gwangju 500-757, Korea, Tel: +82-62-530-2837, Fax: +82-62-530-2841; E-mail:
shokim@jnu.ac.kr
© Research Institute of Veterinary Medicine, Chungbuk National University. All rights reserved. This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: May 14, 2014; Revised: Jun 24, 2014; Accepted: Jun 25, 2014
Abstract
An evidence suggests that even low-dose irradiation can lead to progressive cognitive decline as well as memory deficits in both humans and experimental animals in part due to hippocampal dysfunction. To determine whether or not green tea (GT) and epigallocatechin gallate (EGCG) could attenuate memory impairment as well as suppress hippocampal neurogenesis, passive avoidance and object recognition memory test as well as TUNEL assay and immunohistochemical detection with markers of neurogenesis (Ki-67 and doublecortin (DCX)) were performed using adult mice treated with relatively low-dose gamma irradiation (2.0 Gy). GT was administered intraperitonially at a dosage of 50 mg/kg of body weight at 36 and 12 hr pre-irradiation and at 30 minutes post-irradiation, or orally at a dosage of 250 mg/kg of body weight/day for 7 days before autopsy. EGCG (25 mg/kg of body weight) was administered intraperitonially at 36 and 12 hr pre-irradiation and at 30 minutes post-irradiation. In the passive avoidance and object recognition memory test, mice trained for 1 day after acute irradiation (2 Gy) showed significant memory deficits compared with sham controls. The number of TUNEL-positive apoptotic nuclei in the dentate gyrus increased by 12 h after irradiation. In addition, the numbers of Ki-67- and DCX-positive cells significantly decreased. GT treatment prior to irradiation attenuated memory defects, blocked apoptotic death, as well as reduced the number of DCX-positive cells. Therefore, GT may attenuate memory defects in adult mice exposed to a relatively low dose of radiation possibly by inhibiting the detrimental effects of irradiation on hippocampal neurogenesis.
Keywords: green tea; radiation; memory impairment; neurogenesis; apoptosis
Introduction
방사선 조사 시 뇌의 반응은 실험동물 및 인체에서 과거 수십 년간 연구의 대상이 되어왔다. 1970년 이전에는 사람의 뇌조직은 단회 조사인 경우, 급성중추신경계 장해증상은 30 Gy 이상, 백색질 괴사는 60 Gy 이상의 용량에서 발생되는, 방사선 저항성이 있는 장기로 인식되었다. 1980~1990년대 동안 방사선 조사 후 6개월 이상 경과 시점에서 혈관의 비정상, 탈수초 등을 특징으로 하는 만성방사선 뇌손상이 알려졌다. 이와 같이 과거에는 방사선에 의한 만성 뇌손상이 glial 세포의 증식능 감소, 혈관내피세포의 손상 등과 관계되는 것으로 인식하였다[1, 2]. 최근 방사선 치료 환자에서 과거의 보고와 같은 해부학적 이상소견 없이 확연한 인지장해가 나타나는 것이 확인되었고, 이와 관계된 기능적 변화에 대한 연구가 관심의 대상이 되고 있다[3].
방사선에 의한 인지 장해는 6개월 이상 생존한 뇌방사선 치료환자 중 50~90%에서 보고되었다[4, 5]. 방사선치료 및 기타 암치료 의술의 발달과 함께 암환자의 생존율이 증가하고 있는 시점에서 이와 같은 기능적 장해에 대한 관심은 급격히 증가하고 있다[6]. 언어 및 공간 기억력, 집중력, 문제해결능력 등의 이상으로 나타나는, 방사선에 의한 인지 장해는 시간경과에 따라 빈도 및 증상의 심도가 상승한다. 뇌 부분조사 환자에서는 드물지만, 전체 뇌조사환자의 경우 일부에서 인지장해는 치매로 발전되고, 이러한 환자는 점진적인 기억력 감퇴, 운동실조 및 뇨실금의 증상을 나타낸다[7-10]. 뇌의 해부학적, 방사선 진단적 이상 없이 나타나는 이러한 장해 증상은 장기 생존 환자의 삶의 질을 악화 시키게 되며, 따라서 방사선에 의한 뇌 기능적 장해를 예방하거나 경감시키는 방법의 도출은 매우 중요하다.
약초추출물에는 많은 양의 flavonoid가 함유되어있고 이는 polyphenolic compound 성분으로서 각종 생리활성을 나타낸다. Phenolic compound를 다량 함유한 식물 추출물은 방 사선 장해경감효과를 나타낸다[11, 12]. Polyphenol 류를 가진 식물 중 하나가 녹차이다. 녹차추출물은 항산화효과를 나타내는 catechin류로 알려진 많은 polyphenol을 가지고 있다[13]. 이중 (-)-epigallocatechin-3-gallate (EGCG)는 가장 대표적인 성분이며, 녹차 섭취 시 관찰되는 생리활성 효과 반응의 대부분을 나타내는 것으로 알려져 있다[14].
본 연구에서는 비교적 저선량의 방사선을 조사한 마우스에서 녹차 열수추출물 및 EGCG의 인지, 기억장애 개선효과 및 해마 신경발생 장해에 대한 억제 효과를 평가 하였다.
Materials and Methods
실험동물
7주령의 수컷 ICR 마우스(오리엔트바이오, 성남, 한국)를 사용하였다. 동물의 사육은 온도 22 ± 2°C, 상대습도 50 ± 10%, 조명시간은 12시간(오전 8시 점등~오후 8시 소등) 및 조도 200~300 lux로 설정된 시설에서 수행하였다. 순화기간을 거쳐 polycarbonate 사육상자에 4마리씩 수용하고 실험동물용 고형사료(삼양사료, 원주, 한국)와 정수장치를 통과한 수도수를 자유롭게 섭취하도록 하였다. 동물실험은 전남대학교 동물실험윤리위원회의 승인(CNU IACUC-YB-2012-38)하에 수행되었다.
시료제조 및 투여
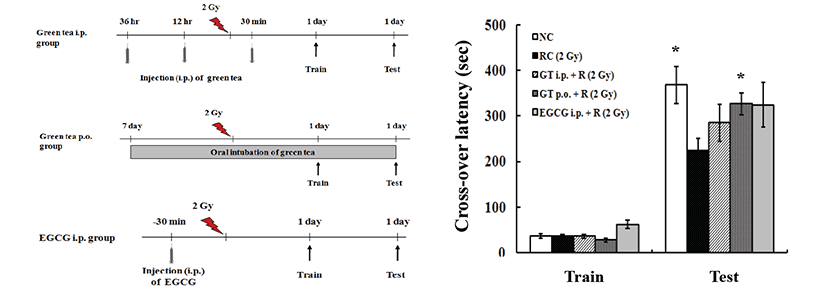
시중에서 구입하고 순천대학교 한약자원학과에서 동정 받은 녹차잎(보성녹차영농조합, 보성, 한국)을 세절하여, 100 g당 증류수 1,000 mL의 비율로 혼합하고 80°C수조에서 8시간 중탕 추출한 뒤 고형분을 제거한 현탁액을 1,000 g에서 10분간 원심분리시키고 상층액을 여과하여 감압농축하고 동결 건조시켰다. 녹차 추출물의 최종 추출수율은 약 12%였다. 녹차추출물의 투여는 복강내 주사군의 경우, 체중 kg당 50 mg의 양으로 방사선 조사 전 36 및 12시간에 2회, 방사선 조사 후 30분에 1회, 총 3회 주사하였으며, 경구투여군의 경우 방방사선 조사 일주일 전부터 실험종료 시까지 매일 체중 kg당 250 mg의 양으로 경구투여하였고, EGCG (Sigma-Aldrich, Deisenhofen, Germany)는 체중 kg당 25 mg의 양으로 방사선 조사 전 36 및 12시간에 2회, 방사선 조사 후 30분에 1회, 총 3회 복강내 주사하였다(Figs. 1 and 2).
Fig. 1.
Effect of green tea (GT) or epigallocatechin gallate (EGCG) on avoidance learning-related memory. Sham controls (1 day after sham irradiation, NC) and mice 1 day after 2 Gy of gamma-irradiation with (GT + R, EGCG + R) or without test materials treatment (RC) were trained by passive avoidance, respectively (n=8 for each group). The trained mice were tested 1 day after training. The cross-over latency was recorded. Values are expressed as mean ± S.E. *Indicates a significant difference at P<0.05 compared with the radiation control group.
Download Original Figure
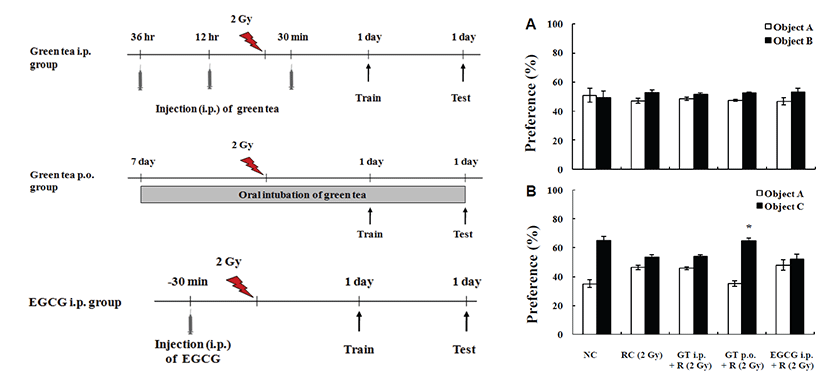
Fig. 2.
Effect of green tea (GT) or epigallocatechin gallate (EGCG) on object recognition learning-related memory. Sham controls (1 day after sham irradiation, NC) and mice 1 day after 2 Gy of gamma-irradiation with (GT + R, EGCG + R) or without test materials treatment (RC) were examined (n=8 for each group). During training, two objects were presented to each mouse for 15 min. After 24 hr, one of the old objects was replaced with a novel object (testing). If the mouse remembered the old object, it would spend more time with the novel object during testing, as indicated by higher percentage of object preference. (A) The mice of each group showed equal preference to the two objects during training. (B) During testing, sham control and irradiated mice treated with GT (p.o.) showed significant preference to the novel object, but there is no significant preference for the novel object in the mice trained 1 day after irradiation without GT treatment. Values are expressed as mean ± S.E. *Indicates a significant difference at P<0.01 compared with the preference of object B in corresponding group and significant difference at P<0.01 compared with the preference of object C in the radiation control group.
Download Original Figure
방사선 조사
방사선조사는 실험용 방사선 조사기(Gamma-cell Elan 3000, Nordion International, Ottawa, Canada)를 사용하여 137Cs 감마선(선량율: 2 Gy/min)을 2 Gy 용량으로 1회 전신조사 하였다.
기능행동학적 평가
방사선 비조사대조군, 방사선 단독조사군, 방사선 조사와 녹차추출물병행투여군(경구 또는 복강내 주사) 및 방사선 조사와 EGCG병행투여군(복강내 주사)으로 나누고, 각 군당 8마리를 공시하여 passive avoidance test와 object recognition memory test를 실시하였다. 간단히 설명하면, passive avoidance test는 마우스의 밝은 곳을 싫어하는 습성을 이용한 행동학 실험이다. 어두운 방과 밝은 방으로 나누어진 구조물에 방 사이의 문이 설치되어 있는데, 마우스를 밝은 방에 두어 일정한 시간(1분) 후 방사이의 문을 개방하면, 어두운 곳으로 들어가는 시간(cross-over latency)(초)을 측정하고, 어두운 방의 바닥의 grid에 0.7 mA의 전류를 2초간 흐르게 하여, 들어간 마우스에 전기충격을 주게 하였다(training). 이 후 마우스를 꺼내고 24시간이 지난 후 다시 밝은 방에 두고(1분), 다시 방 사이 문을 개방하였을 때, 어두운 방으로 들어가는 시간(cross-over latency)을 측정하여(testing), 학습·기억의 능력을 평가하였다. Object recognition memory test는 마우스의 새로운 물체에 대한 호기심을 표시하는 습성을 이용한 행동학 실험이다. 마우스케이지에 서로 다른 모양을 가진 물체를 넣고 마우스를 넣게 되면, 마우스는 새로운 두 물체에 같은 비율의 호기심(sniffing, approaching)을 나타낸다. 15 분 동안의 training 과정을 거친 후, 다시 마우스를 꺼내고 24시간 후에 두 물체 중 하나를 바꾸고 마우스를 동일 케이지에 넣게 되면, 일반적인 학습·기억의 능력을 지닌 마우스는 새로운 물체에 더 많은 호기심을 표시한다. 이러한 호기심의 표시(%)의 차이를 측정하여 학습과 기억의 능력을 평가하였다.
신경줄기세포 변화의 조직형태학적 평가
방사선 비조사대조군, 방사선 단독조사군, 방사선 조사와 녹차추출물병행투여군(경구 또는 복강내 주사) 및 방사선 조사와 EGCG병행투여군(복강내 주사)으로 나누고, 각 군당 4마리로 하였다. 방사선 조사 후 12시간에 마우스를 희생시키고, terminal deoxynucleotidyl transferase (TdT)-mediated dUTP nick end-labeling (TUNEL) 방법과 면역염색법으로 각각 해마신경세포의 apoptosis 발생, doublecortin (DCX) 및 Ki-67 양성세포의 변화를 확인하였다. 각 마우스의 뇌는 정확히 정수리점 뒤 2.12 mm에서 시료를 채취하여 통상적 방법에 따라 조직을 고정하고 파라핀 포매 후 절편을 제작하였다. 세포사멸은 apoptosis 발생, 내인성 증식인자는 Ki-67, 미성숙 신경줄기세포 변화는 DCX를 관찰하였다. 마우스 뇌의 정수리점 뒤 2.12 mm에서 5 μm두께의 절편을 시작으로 연속된 절편의 10개 중 각각 3개의 절편에서 apoptosis 발생, Ki-67과 DCX 양성 세포수를 측정하였다. 양성세포수 측정은 치아이랑(dentate gyrus) 칼모양면의 위쪽과 아래쪽 subgranular zone에 존재하는 모든 양성반응세포를 정량 하였다. 각각의 마우스 3개의 절편에서 얻어진 양성세포의 수에 대한 평균값을 n=1로 결정하였다. Apoptosis 검사는 TUNEL 기법과 hematoxylin-eosin 염색으로 확인한다. Intergen (Purchase, NY, USA)사의 TUNEL kit를 이용하고, 그들이 제안한 방법으로 실시하였다. 면역조직화학염색은 avidin-biotin-complex-horseradish conjugation (ABC-HRP) 방법(Vector Laboratories, Burlingame, CA, USA)에 따라 실시하였다. 내재성 peroxidase를 제거하기 위해 0.3% 과산화수소수가 포함된 3차 증류수에 20분간 반응시켰다. 단클론 토끼 anti-Ki-67항체(DRM004; Acris Antibodies GmbH, Hiddenhausen, Germany)를 1:500으로 희석한 것과 다클론 토끼 anti-DCX 항체(Cell signaling Technology, Beverly, MA, USA)를 1:400으로 희석하여 반응시켰다. 면역반응은 avidin-biotin peroxidase complex (Elite kit; Vector, Burlingame, CA, USA)를 사용하였으며, diaminobenzidine substrate kit (Vector, Burlingame, CA, USA)를 사용하여 발색하였다.
통계처리
모든 실험에서 얻어진 자료는 one-way ANOVA (the post-hoc Student-Newman-Keuls)의 방법으로 유의성 검사하였고, 그들의 수치는 평균 및 표준오차의 값으로 나타냈다. 또한 유의성은 P값이 0.05보다 작을 때 그 값을 유의성이 있는 값으로 하였다.
Results
기능행동학적 평가
Passive avoidance test에서 training 동안 모든 마우스가 비슷한 정도의 짧은 시간 내에 어두운 방으로 들어가 전기쇼크 받았다. 기억력 test를 위해 24시간 후 다시 밝은 방에 노출되었을 때 비조사대조군은 어두운 방으로 들어가는 시간(cross-over latency, 368.1 ± 41.3)이 오래 걸린 반면, 방사선 단독조사군은 유의성 있는 감소를 나타냈다(223.8 ± 27.1). 그러나 녹차추출물 경구투여군은 유의성 있는 기억 결손 경감효과가 관찰되었다(326.6 ± 28.1, P<0.05, Fig. 1). Object recognition memory test에서 모든 실험군 마우스는 training 중 두개의 물체에 거의 동일한 선호도를 보였다. 비교 가능한 주의력(attention), 동기부여(motivation), 시각적 인식(visual perception) 정도는 모든 실험군에서 차이가 없었다. Test에서(training 24시간 후), 새로운 물건에 대한 선호도는 비조사대조군에서 65.0 ± 2.7%였으며, 방사선 단독조사군에서는 53.6 ± 1.5%로 기억 결손을 보였다. 녹차추출물병행투여군의 경우 경구투여군에서 64.8 ± 1.9%의 선호도를 보여 유의성 있는 기억 결손 경감효과가 관찰되었다(P<0.01, Fig. 2).
신경줄기세포 변화의 조직형태학적 평가
Apoptosis 발생 세포는 H&E 염색상에서 핵염색질과 세포질의 농축 및 산호성 세포질의 특성을 나타내었으며, TUNEL 염색에서 양성의 세포 및 apoptotic body가 관찰되었다. 비조사대조군에서는 양성세포가 관찰되지 않았으며 방사선 단독조사군에서는 18.5개로 그 수가 증가하였다. 방사선과 녹차추출물병행투여군에서는 평균치를 기준으로 복강내 주사군에서 34%, 경구투여군에서 51%의 유의성 있는 감소를 나타냈다(P<0.05). Ki-67과 DCX 양성 세포는 비조사대조군에서 각각 평균 9.57개 및 46.86개가 관찰되었으며, 방사선 단독조사군에서 현저히 감소하였다. 녹차추출물병행(복강내 주사)투여에 따라 DCX 양성세포가 평균치 기준으로 45.6%의 유의성 있는 증가를 보였다(P<0.05, Table 1).
Table 1.
Effect of green tea (GT) or epigallocatechin gallate (EGCG) on gamma-radiation-induced histological changes of dentate gyrus
| Groups |
TUNEL |
Ki-67 |
Dcx |
| NC |
0 |
9.57 ± 0.64 |
46.86 ± 3.04 |
| RC (2.0 Gy) |
18.50 ± 1.60 |
2.86 ± 0.61 |
19.57 ± 2.10 |
| GTa + R |
12.25 ± 1.45* |
3.50 ± 0.65 |
28.50 ± 2.39* |
| GTb + R |
9.00 ± 2.42* |
3.67 ± 1.04 |
20.33 ± 2.35 |
| EGCGc + R |
12.50 ± 1.50* |
2.75 ± 0.25 |
25.75 ± 2.13 |
Download Excel Table
Discussion
중추신경계에 대한 고선량 방사선의 부작용은 잘 알려져 있다. 이에 비해 저선량 방사선에 의한 뇌손상은 비교적 연구가 미흡하며, 최근 저선량 방사선에 민감부위인 해마의 구조구조적 변화 및 이와 관련된 인지장해가 관심의 대상이 되고 있다[4]. 치아이랑의 신경줄기세포는 자기재생 및 신경세포, 성상세포 또는 oligodendrocyte를 형성한다. 동물에서 10 Gy의 방사선 조사 시에도 탈수초 및 백색질 괴사는 일어나지 않으나 새로운 해마신경세포의 생성은 심각한 손상을 나타낸다. 이러한 신경재생의 장해는 2 Gy 이하의 용량에서도 일어나는 것으로 알려져 있다[15, 16]. 본 연구에서도 2 Gy의 감마선 조사에 따라 해마 신경세포의 손상 및 인지 장해가 재확인 되었다.
방사선에 노출되는 환경에 처한 경우 방사선 장해경감제는 방사선에 대한 저항성 및 생존율 개선에 중요한 역할을 하게 된다. 그러나 대부분의 방사선 장해경감제는 고용량 및 반복적 사용시 독성이 수반되고 가격이 비싼 것으로 알려져 있다[17]. 과거 수십 년간 방사선장해경감제로서 천연물에 대한 평가는 독성이 적고 쉽게 구할 수 있다는 점에서 많은 관심의 대상이 되었다. 많은 식물유래물질은 약성을 가지며 각종 질병의 치료에 적용되어왔다. 이와 같은 관점에서 방사선장해 경감을 위해서도 많은 식물유래물질들이 연구되어왔다[18].
전리방사선에 의한 장해효과는 유리기(free radical)와 DNA 또는 기타 세포내 거대분자와의 상호작용에 의한 산화적 손상이 원인으로 알려져 있다[19]. 녹차와 추출물은 많은 polyphenol을 가지고 있다. 과일이나 야채에 포함된 polyphenol은 강한 항산화작용을 나타낸다. 녹차에 포함된 polyphenol도 항염증 및 항산화작용으로 인해 건강에 도움을 준다. 세포주기정지, apoptosis 및 세포사를 유도하여 각종 암세포주의 증식을 억제하는 것이 알려져 있다[20]. 또한 녹차에 포함된 polyphenol은 여러 동물실험모델에서 화학적 발암에 대해 억제효과를 나타낸다. 이중 EGCG는 녹차의 polyphenol중 55~70%로 가장 많은 부분을 차지하며, 비타민 C 또는 E보다 강한 항산화활성이 있는 것으로 알려져 있다. EGCG는 superoxide anion, hydroxyl radical 및 hydrogen peroxide에 대한 소거 활성을 가지며, OH radical에 의한 DNA의 산화적 손상을 억제한다[21]. 이와 같이 녹차 및 EGCG의 항산화활성에도 불구하고 방사선장해 경감에 대한 보고는 비교적 적다. Yoshioka 등은 pUC18 plasmid DNA에서 베타 및 감마선에 의한 손상을 OH radical의 소거로 인해 억제한다고 하였다[22]. EGCG의 피부적용 및 녹차의 음용이 피부암을 유발하는 자외선에 의한 광화학적 장해 를 억제하며 이는 DNA 회복과 관계 있다고 하였다[23]. 감마선에 대한 효과연구에서 EGCG는 사람표피세포주의 apoptosis를 억제하였으며, 생존율을 증가시켰고 소장움세포의 손상도 억제하였다. 이외 감마선 및 항암제투여에 따른 침샘의 손상도 경감시키는 것으로 알려져 있다[24-26]. 본 연구에서 해마신경세포에서도 녹차 및 EGCG가 apoptosis의 발생을 억제하였으며 DCX양성세포의 수는 증가시켰다. 본 연구를 통하여 해마 신경세포 손상에도 녹차 및 EGCG의 효과가 확인 되었으며 이는 기타 방사선 장해 경감효과에서 연관성이 보고된 녹차의 항산화작용에 의한 것으로 추정된다. 해마 신경세포의 손상 및 손상 경감 효과는 인지 장해를 관찰한 행동 시험에서 확인 되었다.
결론적으로 본 연구에서 적용된 실험방법에서 확인된 녹차의 학습기억 장해 개선효과는 방사선 조사에 의해 생성되는 자유라디칼에 대하여 녹차의 항산화작용에 의한 직접적 소거 효과와 2차적인 항염증 효과가 관여된 것으로 사료되나 이에 대한 기전적 추가 연구가 요구된다. 이상의 결과에서 녹차는 방사선 사고 노출자 또는 치료 환자의 삶의 질 개선이라는 관점에서 효과적인 적용 후보제가 될 수 있을 것이다.
Acknowledgements
이 논문은 2013학년도 경북대학교 학술연구비지원사업 및 교육과학기술부의 재원으로 시행하는 한국과학재단의 원자력기술개발사업에 의하여 연구되었으며 동물실험은 전남대학교 동물의학연구소의 지원협조를 받았고 이에 감사 드린다.
REFERENCES
Schultheiss TE, Stephens LC. Permanent radiation myelopathy. Br J Radiol. 1992; 65 p. 737-753.

van der Maazen RW, Kleiboer BJ, Verhagen I, van der Kogel AJ. Repair capacity of adult rat glial progenitor cells determined by an in vitro clonogenic assay after in vitro or in vivo fractionated irradiation. Int J Radiat Biol. 1993; 63 p. 661-666.

Greene-Schloesser D, Robbins ME. Radiation-induced cognitive impairment--from bench to bedside. Neuro Oncol. 2012; 14 p. iv37-iv44.

Johannesen TB, Lien HH, Hole KH, Lote K. Radiological and clinical assessment of long-term brain tumour survivors after radiotherapy. Radiother Oncol. 2003; 69 p. 169-176.

Meyers CA, Brown PD. Role and relevance of neurocognitive assessment in clinical trials of patients with CNS tumors. J Clin Oncol. 2006; 24 p. 1305-1309.

Cochran DC, Chan MD, Aklilu M, Lovato JF, Alphonse NK, Bourland JD, Urbanic JJ, McMullen KP, Shaw EG, Tatter SB, Ellis TL. The effect of targeted agents on outcomes in patients with brain metastases from renal cell carcinoma treated with Gamma Knife surgery. J Neurosurg. 2012; 116 p. 978-983.

Laukkanen E, Klonoff H, Allan B, Graeb D, Murray N. The role of prophylactic brain irradiation in limited stage small cell lung cancer: clinical, neuropsychologic, and CT sequelae. Int J Radiat Oncol Biol Phys. 1988; 14 p. 1109-1117.

Roman DD, Sperduto PW. Neuropsychological effects of cranial radiation: current knowledge and future directions. Int J Radiat Oncol Biol Phys. 1995; 31 p. 983-998.

Vigliani MC, Duyckaerts C, Hauw JJ, Poisson M, Magdelenat H, Delattre JY. Dementia following treatment of brain tumors with radiotherapy administered alone or in combination with nitrosourea-based chemotherapy: a clinical and pathological study. J Neurooncol. 1999; 41 p. 137-149.

Dropcho EJ. Central nervous system injury by therapeutic irradiation. Neurol Clin. 1991; 9 p. 969-988.

Shimoi K, Masuda S, Shen B, Furugori M, Kinae N. Radioprotective effects of antioxidative plant flavonoids in mice. Mutat Res. 1996; 350 p. 153-161.

Hosseinimehr SJ. Trends in the development of radioprotective agents. Drug Discov Today. 2007; 12 p. 794-805.

Cabrera C, Artacho R, Gimenez R. Beneficial effects of green tea-a review. J Am Coll Nutr. 2006; 25 p. 79-99.

Bettuzzi S, Brausi M, Rizzi F, Castagnetti G, Peracchia G, Corti A. Chemoprevention of human prostate cancer by oral administration of green tea catechins in volunteers with high-grade prostate intraepithelial neoplasia: a preliminary report from a one-year proof-of-principle study. Cancer Res. 2006; 66 p. 1234-1240.

Gage FH, Kempermann G, Palmer TD, Peterson DA, Ray J. Multipotent progenitor cells in the adult dentate gyrus. J Neurobiol. 1998; 36 p. 249-266.

Monje ML, Vogel H, Masek M, Ligon KL, Fisher PG, Palmer TD. Impaired human hippocampal neurogenesis after treatment for central nervous system malignancies. Ann Neurol. 2007; 62 p. 515-520.

Kouvaris JR, Kouloulias VE, Vlahos LJ. Amifostine: the first selective-target and broad-spectrum radioprotector. Oncologist. 2007; 12 p. 738-747.

Richi B, Kale RK, Tiku AB. Radio-modulatory effects of green tea catechin EGCG on pBR322 plasmid DNA and murine splenocytes against gamma-radiation induced damage. Mutat Res. 2012; 747 p. 62-70.

Iyer R, Lehnert BE. Effects of ionizing radiation in targeted and nontargeted cells. Arch Biochem Biophys. 2000; 376 p. 14-25.

de Mejia EG, Ramirez-Mares MV, Puangpraphant S. Bioactive components of tea: cancer, inflammation and behavior. Brain Behav Immun. 2009; 23 p. 721-731.

Qi X. Reactive oxygen species scavenging activities and inhibition on DNA oxidative damage of dimeric compounds from the oxidation of (-)-epigallocatechin-3-O-gallate. Fitoterapia. 2010; 81 p. 205-209.

Yoshioka H, Akai G, Yoshinaga K, Hasegawa K, Yosh Ioka H. Protecting effect of a green tea percolate and its main constituents against gamma ray-induced scission of DNA. Biosci Biotechnol Biochem. 1996; 60 p. 117-119.

Katiyar SK. Green tea prevents non-melanoma skin cancer by enhancing DNA repair. Arch Biochem Biophys. 2011; 508 p. 152-158.

Kondo H, Park SH, Watanabe K, Yamamoto Y, Akashi M. Polyphenol (-)-epigallocatechin gallate inhibits apop¬tosis induced by irradiation in human HaCaT keratinocytes. Biochem Biophys Res Commun. 2004; 316 p. 59-64.

Lee HJ, Kim JS, Moon C, Kim JC, Lee YS, Jang JS, Jo SK, Kim SH. Modification of gamma-radiation response in mice by green tea polyphenols. Phytother Res. 2008; 22 p. 1380-1383.

Yamamoto T, Staples J, Wataha J, Lewis J, Lockwood P, Schoenlein P, Rao S, Osaki T, Dickinson D, Kamatani T, Schuster G, Hsu S. Protective effects of EGCG on salivary gland cells treated with gamma-radiation or cis-platinum(II)diammine dichloride. Anticancer Res. 2004; 24 p. 3065-3073.