Introduction
위염(gastritis) 및 위궤양(gastric ulcer)은 하나의 원인에 의해 발병되는 것이 아니라 여러 인자들이 복합적으로 작용하여 발생한다[2, 13]. 위 점막을 손상시키는 공격인자의 하나인 알코올 과다 섭취는 위장의 출혈과 염증발생을 유발시켜 급성위염을 일으킬 수 있다[18, 21]. 이러한 알코올의 급성위염 발병은 알코올 농도 의존적으로 병변을 일으키며 위장에 직접적인 손상을 일으키게 된다[3, 11]. 따라서 높은 농도의 알코올 처리는 동물을 이용한 위염 및 위 점막 손상 유발 모델에서 널리 사용되고 있다[11, 22]. 현재 시판 혹은 개발 중인 위염 및 위궤양 치료제들은 90% 이상이 합성 의약품 및 무기 염류로 단일 기전을 표적으로 하는 약물들이 대다수이고 그에 따른 부작용도 상당하다[20]. 대표적인 H2 antagonist라 할 수 있는 cimetidine을 장기 복용할 경우 성호르몬인 안드로겐 수용체를 blocking하여 테스토스테론의 합성을 저해함으로써 에스트라디올의 활성도를 높여 남성에 있어 성기능 장애 및 여성형 유방을 일으킨다는 보고가 있었으며 제산제의 경우에도 위장수축을 저해하거나, 소화를 더디게 하고 변비를 유발할 뿐 아니라 위장 내 산도를 감소시켜 해로운 세균의 증식을 초래하는 등의 여러 부작용들이 꾸준히 보고되고 있다[4]. 위산 분비를 감소시키는 효과가 큰 약물 중 하나인 ranitidine은 thiourea기가 없는 약한 imidazole 염기의 물질로서 위점막 벽세포의 histamine 수용체에 직접 길항적으로 작용하여 위산분비를 억제시킨다고 알려져 있다[16]. 그러나 ranitidine의 복용에 의한 아나필락 쇼크가 최근 부작용으로 보고되고 있는 등, 기존 항위궤양 제재에 의한 부작용 문제가 크게 대두되고 있다[1].
알코올성 위염은 위 점막 보호물질 감소, 산화적 스트레스, 히스타민 분비의 증가 등에 의한 위 손상이 염증을 악화시킨다고 알려져 있다[9, 21]. 하지만 아직 알코올에 의한 위염 발생의 분자학적인 기전에 대해서는 정확하게 규명이 되지 않았으며, 이에 따라 특이적 치료방법도 없는 실정이다[15].
현재 염생식물은 기능성식품으로 인정받고 있으며, 의약 및 미용소재로 활용되고 있다. 또한 현재 간척지에서 자라 기존의 식량과 토지경합을 하지 않으면서도 유용한 자원을 만드는 바이오 연료와 사료작물 후보로 주목을 받고 있어 미래의 해수농업, 내염성 작물 육종 등 지속 가능한 농업을 위한 소재로 기대되고 있다[8].
염생식물 중 하나인 수송나물(Salsola komarovi Iljin)은 명아주과로 1년생 초본 식물이고, 가시솔나물, 돼지털나물, 땅녹미채라고도 불리고 우리나라 전국의 해변과 일본, 중국, 시베리아 그리고 호주 등지에 넓게 분포하며, 중국에서 자사봉, 저모채, 일본에서는 미루나 등으로 불리면서 식용으로 사용되고 있다. 수송나물은 해안 모래땅에서 자라며 해가 잘 들고, 배수가 잘 되면서도 보수력이 있는 비옥한 사질양토에서 자생하며, 잎은 솔잎처럼 가늘고 길이가 1~3 cm로서 끝이 뾰족하며 처음에는 연하고 부드럽지만 나중에 줄기와 함께 딱딱해져서 가시로 된다[8]. 줄기는 밑부분에서 많은 가지가 갈라지고 비스듬히 서거나 옆으로 기며 높이는 10~40 cm 로서 전체에 털이 없다. 어린 순과 잎을 따서 삶거나 데쳐서 식용으로 먹을 수 있으며 수송나물의 약효는 5월 단오 무렵에 채취한 것이 제일 좋고 그 이후의 것은 약성이 지나쳐 약간 독이 있다. 효능으로는 혈압을 내리며 해열, 해독, 염증과 비만증, 고혈압, 황달, 위장보호 등의 증에 상용한다고 알려져 있다[8]. 또한, 중국의 ‘중약대사전’에서는 간의 기를 고르게 하고 혈압을 낮춘다고 기록되어 있다[8]. 이러한 수송나물의 위장보호에 대한 기록을 통하여 알코올성 위염으로부터 위장 보호 효과를 나타낼 수 있을 것으로 기대 할 수 있다.
본 연구에서는 비교적 안전성이 높은 약물인 천연물 중에서 바닷가의 잡초로 여겨지는 염생식물(halophyte)을 가지고 항위염 및 항위궤양 효과에 대한 실험을 실시하였다. 국내에서 재배된 수송나물 추출물의 투여가 알코올 처리로 유발된 위염 동물모델에서 위점막 손상에 미치는 영향을 관찰하여 위장 보호 효과의 기능성을 평가하고자 하였다.
Materials and Methods
본 실험에 사용한 재료는 수송나물(용문농장, 경기도)분말, 함초(부안함초농장, 전북)분말을 사용하였다. 수송나물 분말 시료 100 g을 50% 에탄올 수용액 600 mL에 80°C에서 3시간 동안 가온 환류 냉각 추출한 추출물을 qualitative filter paper로 감압 여과하였다. 이 여과액을 rotary evaporator (HANSHIN, Bucheon, Korea)를 사용하여 농축하고, 농축액을 ultra-low temperature freezer (SANYO, Japan)에서 24시간 동결시킨 후 동결건조(FDU-8606, Operon, Korea)하여 수송나물 에탄올 추출물 5.9 g을 얻었다. 위와 같은 방식으로 수송나물 열수 추출물 13.4 g을 얻었다. 함초 분말 시료 100 g을 50% 에탄올 수용액 400 mL에 80°C에서 수송나물 추출물을 얻는 방법과 동일한 방법으로 농축 및 동결건조 하여 함초 추출물 5.4 g을 얻었다. 모든 추출물은 실험 직전까지 −20°C에 보관하여 사용하였다.
실험동물은 체중 350~400 g의 7주령 Sprague-Dawley (SD) rats를 (주)샘타코(경기, 한국)에서 구입하여 수컷 60 를 사용하였다. 사육기간 중 온도는 23 ± 2°C, 상대습도 50 ± 5% 환기횟수는 10회/시간, 조명시간은 12시간(7:00~19:00) 조도는 150~300 lux를 유지하였다. 동물 입수 시 모든 동물의 일반 건강상태에 대한 수의학적 검역을 실시하였으며 시험을 실시하는데 적합하도록 설치류용 고형사료(샘타코, 경기, 한국)와 여과 살균된 정제수를 자유롭게 섭취하도록 하며 약 1주일간의 순화기간을 거쳤다. 본 연구에 사용된 동물실험에 관련된 모든 실험과정과 절차는 원광대학교 동물실험윤리위원회의 사전심의와 윤리 규정을 준수하여 수행되었다.
60% HCl-ethanol 투여 급성 위염 질환모델 효능평가(SD rats, n=10)를 위하여 주간 체중에 근거하여 다음과 같이 군 분리를 하였다. 정상대조군(I), 알콜성 위염 유발 시험 대조군(II), 양성대조군(Ranitidine (III) 300 mg/kg), 함초 50% 알코올 추출물(50% alcohol extract of Salicornia herbacea L. 500 mg/kg 투여군, IV), 수송나물 50% 알코올 추출물(50% alcohol extract of Salsola komarovi Iljin 500 mg/kg 투여군, V), 수송나물 열수 추출물(water extract of Salsola komarovi Iljin 500 mg/kg 투여군, VI)과 같이 총 6군으로 군당 SD rats 10마리씩 구성하여 군별로 시험물질을 투여하여 실험을 진행하였다. 시료조제에서 함초 에탄올 추출물과 수송나물 에탄올 추출물은 생리식염수에 용해시킨 후 사용하였다. 투여방법은 경구투여를 실시하였고 사료 및 음수는 자유로이 섭취토록 하였으며 실험 24시간 전에 절수 시키고 실험이 진행되었다.
7주령 체중 350~400 g의 수컷 SD rat 10마리를 한 군으로 하여 24시간 절식시킨 후 함초 에탄올 추출물(500 mg/kg)과 수송나물 에탄올추출물(500 mg/kg)을 투여한 후, 위염 유발 물질인 150 mM HCl + 60% ethanol을 1 mL씩 단회 경구투여 하여 위염을 유발하였다. 24시간 이상 절식한 후 Mizui와 Doteuchi [14]의 방법으로 실험하였다. 즉, 실험물질을 경구투여 하고 30분 후에 60% HCl-ethanol용액(60% ethanol에 150 mM HCl을 함유) 1 mL을 경구투여 하여 절식, 절수 하에서 1시간 방치 후 ether로 치사 시켰다. 이후 위를 적출하여 유문부를 결찰하고 위내에 10% formalin 용액 10 mL 을 주입한 상태로 formalin 용액에 10분간 반응시켜 위 내외를 고정하였다. 염증의 면적을 측정하기 위하여 대만부를 절개하여 촬영한 후 영상분석 프로그램(Image-ProR Plus 7.0, Media CyberneticsR, Bethesda, MD, USA)으로 분석하여 염증 및 궤양 부위의 면적을 측정하였다.
위염유발 물질(150 mM HCl + 60% ethanol)을 투여하고 30분 후에 움직임과 증상을 관찰하여 활동량, 호흡 등 임상적 증상을 평가기준에 따라 3명의 관찰자가 같은 조건에서 배점하여 기록하였다(Table 1). 정상적인 보행에 비슷하며, 털 고르기 행동이 관찰 시 1점, 자극에 의하여 움직이거나 정상적인 움직임에 비해 느리거나 감소 시 5점, 움직임이 거의 없으며, 자극에 의하여 약간의 움직임이 관찰 시 10점, 움직임이 없거나 호흡수 저하 및 심호흡 관찰 시 15점으로 배점하였다.
위염을 유발시켰을 때 실험약물에 의한 위염의 억제작용은 다음과 같이 에탄올 투여 위궤양 유발 대조군(II군)의 손상면적에서 시료처치군(III, IV, V, VI군)의 손상면적을 뺀 값을, 에탄올 투여 위궤양 유발 대조군(II군)으로 나눈 값의 백분율로 {lesion area (control) − lesion area (sample)}/lesion area (control) × 100 = inhibition ratio (%)를 나타내었다.
위염을 유발시켰을 때 실험 약물에 의한 위 병리조직 병변 점수를 확인하기 위하여 각 군의 동물들로부터 육안병변 관찰과 병변 점수를 구한 후, 위 조직을 10% formalin 액에서 고정시킨 검체를 위체부에서 육안손상이 관찰된 부위가 포함되도록 절취하여(trimming) 다시 10% formalin 액으로 후 고정시킨 후 일반적인 방법에 따라 조직학적 관찰을 실시하였다. 위 조직 검사를 위하여 선위(glandular stomach) 부위를 가로 방향으로 5 mm 간격으로 잘라, 3개 부위를 검사하고 병변의 등급을 결정하였다. 위의 선별된 부위들은 다른 개체들 간에 서로 동일한 부위가 되도록 주의하여 선정하였다. 선정된 부위들의 조직들은 병리조직학적 검사를 위한 통상적인 방법을 사용하여 파라핀 포매한 후, 4 μm 두께로 절편하여 H & E 염색 후 병리조직학적인 검사를 수행하였다. 각 조직 소견의 병변에 대한 평가를 수행하여 이들의 정도를 4단계{0(no lesion), 1(mild), 2(moderate), 3(severe)}의 점수로 나누어 기록하고, 3개 부위의 점수의 합을 구한 후, 위의 병리조직학적 소견에 대한 각 군의 평균 점수를 구하였다. 또한 위염을 유발시켰을 때 실험약물에 의한 위 점막 조직을 관찰하고, Image Measurement System (Focus Technology, Germany)을 이용하여 위 점막 기저막 부위에서 위점막 융모 상피 끝까지의 길이를 현미경 Nikon Eclipse E200 (Nikon, Japan)을 이용하여 융모 상피세포 길이(villi length)를 측정하였다. 병리조직 제작 시 적출된 위의 선위(glandular stomach) 부위 중 3부위가 포함되도록 제작된 각각의 슬라이드 조직의 3부위의 융모 상피세포 길이를 각각 측정하여, 총 9개 측정값의 평균값과 표준편차를 해당 개체의 융모 상피세포 길이로 하였다.
Results
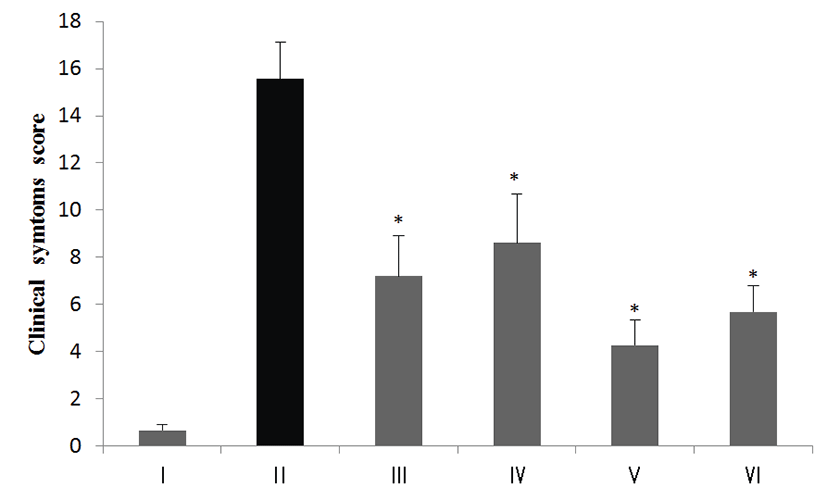
SD rat에 HCl-ethanol을 경구 투여하면 위 점막층의 지질과산화 증가 및 점막손상을 유발한다는 보고에 따라 위염 및 위궤양을 유발하였다. 위염 유발물질인 HCl-ethanol을 투여 30분 후 SD rat의 움직임과 증상을 살펴보고 1시간 동안의 활동량에 따른 평가를 실시하여 기록하였다. 실험 결과는 Table 1과 같은 기준으로 평가를 실시하였다(Fig. 1). 정상군 에서는 0.67 ± 0.24로 고개를 가누고 정상적 보행 및 털 고르기, 먹이 섭취 등의 행동을 보였으나 HCl-ethanol과 생리식염수를 투여한 대조군의 임상증상 소견 점수는 15.56 ± 1.57로 대부분 움직임이 없었으며 자극에 의해서 약간의 움직임을 보였다. 그에 비하여 HCl-ethanol과 함께 ranitidine 약물을 투여한 군에서는 7.20 ± 1.70, 함초 50% 에탄올 추출물 500 mg/kg 투여군(IV)에서는 8.62 ± 2.05, 수송나물 50% 에탄올 추출물 500 mg/kg 투여군(V)에서 4.27 ± 1.07, 수송나물 열수 추출물 500 mg/kg 투여군(VI)에서 5.69 ± 1.11으로 대조군에 비하여 움직임이 증가하였음을 확인하였다(P<0.05).
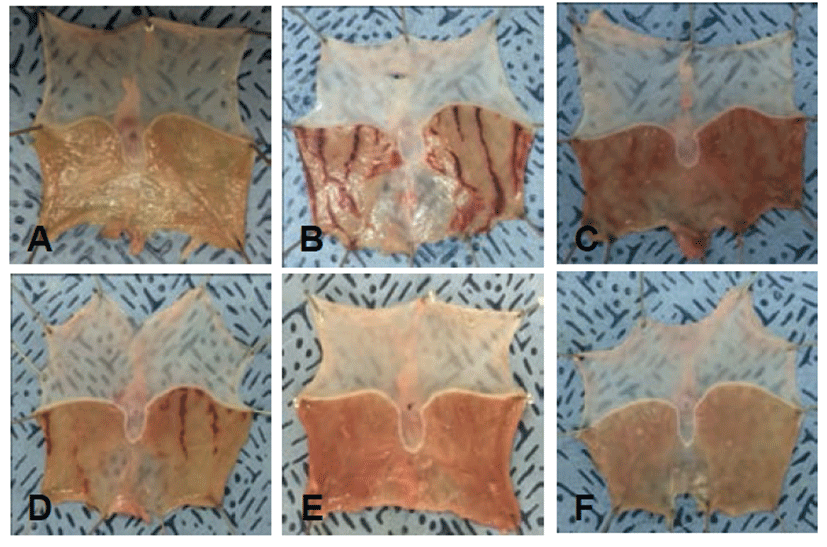
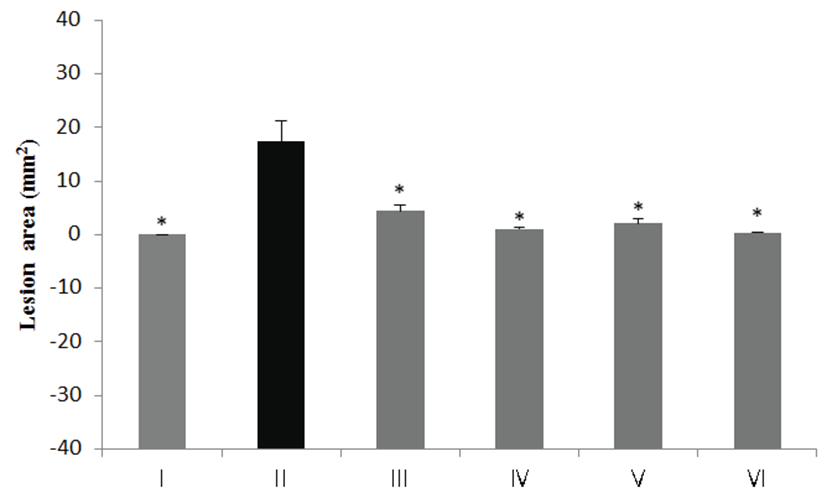
HCl-ethanol에 의한 위염 및 위궤양은 에탄올이 위 점막을 직접적으로 자극하여 점막하근층에 부종을 유발하고 국소적으로 일시적인 허혈 상태를 발생시켜 미세혈액순환이 정체되어 급성위염이 유발되고, 또한 HCl이 위 운동을 항진시켜 급성위염을 더욱 악화시키는 것으로 보고되었다. 위 점막 손상에 대한 형태학적인 변화를 살펴본 결과 함초 50% 에탄올 추출물 500 mg/kg 투여군(IV)에서 알콜성 위염 유발 시험 대조군(II)에 비해 약 86.9 ± 0.16% 정도의 위궤양 보호효과를 보였고, 수송나물 50% 에탄올 추출물 500 mg/kg 투여군(V)에서 알콜성 위염 유발 시험 대조군(II)에 비해 약 97.5 ± 0.22% 정도의 위궤양 보호효과를 보였으며, 수송나물 열수 추출물 500 mg/kg 투여군(VI)에서 알콜성 위염 유발 시험 대조군(II)에 비해 약 93.6 ± 0.21% 정도의 위궤양 보호효과가 있음을 알 수 있었다(Fig. 2). 알콜성 위염 유발 시험 대조군(II)의 경우 위점막층의 출혈 정도가 심했으며 점막하층까지 손상이 발생하였으나, 함초, 수송나물 에탄올 추출물 투여군과 수송나물 열수 추출물 투여군에서는 일반적으로 위점막 보호작용이 있는 것으로 알려진 ranitidine만큼 보호효과가 높았다는 것을 확인하였다. 또한 수송나물 에탄올 추출물을 투여하였을 경우에는 함초 에탄올 추출물과 수송나물 열수 추출물보다 위손상 억제율이 높았다(Fig. 3).
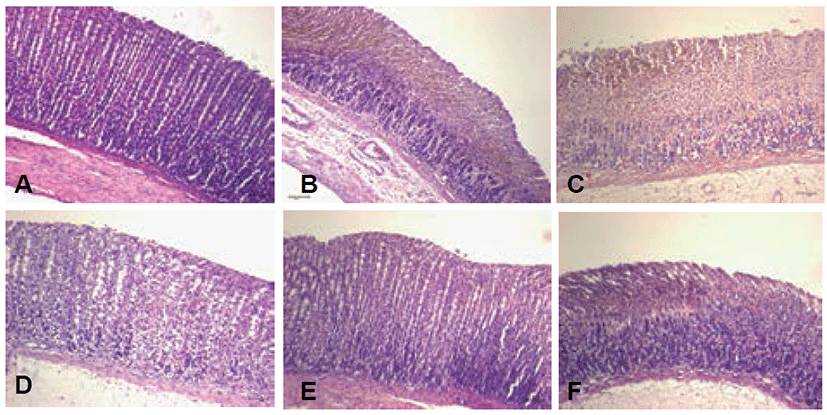
H&E 염색을 통하여 위조직의 병리학적인 관찰을 실시한 결과, 정상군의 경우에 병리조직학적 병변이 관찰되지 않아 육안점수 0의 값을 얻었다. HCl-ethanol과 함께 ranitidine 약물을 투여한 군(III)의 경우 4.33 ± 0.58, HCl-ethanol와 생리식염수를 투여한 군에서는 7.00 ± 1.00의 육안점수를 보였고, 함초 50% 에탄올 추출물 500 mg/kg 투여군(IV)에서는 3.67 ± 0.58, 수송나물 50% 에탄올 추출물 500 mg/kg 투여군(V)에서 2.67 ± 0.58, 수송나물 열수 추출물 500 mg/kg 투여군(VI)에서 3.33 ± 0.58로, 수송나물 50% 에탄올 추출물 500 mg/kg 투여군(V)이 HCl-ethanol과 생리식염수를 투여한 대조군과 비교하였을 때, ranitidine 약물을 투여한 군만큼 유의한 변화를 보였다(P<0.05).
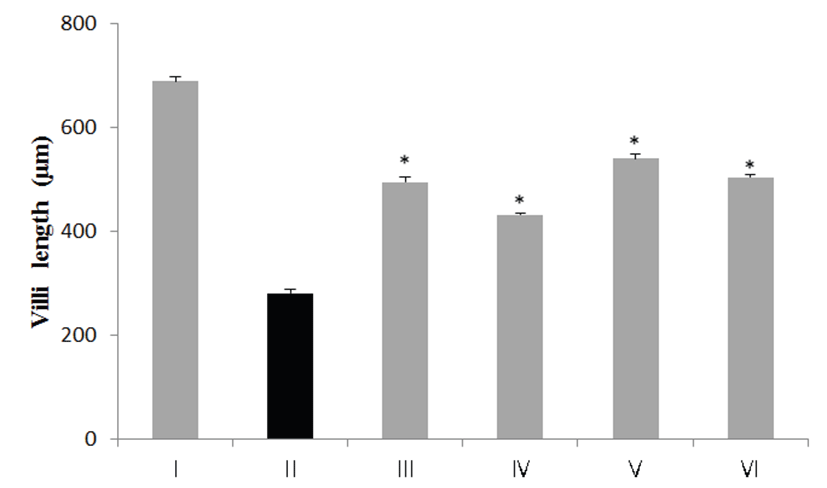
또한 실험결과 Fig. 4에 나타난 바와 같이 정상군의 경우에는 689.3 ± 8.5로 융모 세포의 손상과 융모 세포의 병변은 관찰되지 않았다. HCl-ethanol과 생리식염수를 투여한 군에서는 280.5 ± 7.31로, 개체에 따라 병변의 정도 차이는 있지만 HCl-ethanol과 함께 ranitidine 약물을 투여한 군(IV)의 경우 494.33 ± 10.58로 개체에 따라 가벼운 위 점막 상피세포 위축 소견이 보이는 개체가 일부 관찰되었지만 다른 유의한 병변은 관찰되지 않았다. 함초 50% 에탄올 추출물 500 mg/kg 투여군(IV)에서는 432.33 ± 1.89, 수송나물 50% 에탄올 추출물 500 mg/kg 투여군(V)에서 540.67 ± 8.96, 수송나물 열수 추출물 500 mg/kg 투여군(VI)에서 503.56 ± 6.55로, 알콜성 위염 유발 시험 대조군(II)과 비교하여 유의한 차이를 보였다(P<0.05).
병리조직학적 검사 결과 HCl-ethanol을 투여한 위궤양 모델에서, ranitidine 약물 치료 효과만큼의 유의성을 보인 것은 수송나물 50% 에탄올 추출물인 것을 확인하였고, 각각의 치료효과는 수송나물 에탄올 추출물, 수송나물 열수 추출물, 함초 에탄올 추출물 순으로 우수한 것으로 판단 되었다(Fig. 5).
Discussion
소화성 궤양은 상복부에 동통, 흉통, 위산과다, 위장관 출혈, 경련, 압박감 등을 호소하며 가끔 오심, 구토, 식욕부진, 체중감소 등을 초래하는 질환으로[19], 주요 발병원인으로는Helicobacter pylori 감염, 소염제 등 약물의 과다복용, 불규칙한 식습관, 음주, 정신적·육체적 스트레스[7] 및 위 연동운동의 증가, 위액의 과다분비 및 위점막의 혈류장해 등이 있다[6]. 현재 시중에서 사용되고 있는 위궤양 치료제는 공격인자 억제작용으로 위액의 소화력을 저하시키는 항펩신제, 위액을 중화시키는 NaHCO3, MgO, CaCO3, Al(OH)3 등 제산제 및 위액의 분비를 억제시키는 항콜린제, 항가스트린제, 점막마취제, muscarine receptor antagonist, H2-receptorantagonist, H+, K+ −APTase inhibitor 등이 있으며, 방어인자 강화작용으로 위 점막의 수복을 촉진시키는 prostaglandin제제 등이 있다[12, 18].
최근 여러 연구에서 산화적 손상이 알코올에 의한 위 병변을 일으키는 중요한 인자로 작용한다고 보고되고 있다[17]. 알코올성 위염은 임상에서 흔하게 접하는 질환이지만 이전 보고들에 따르면 알코올의 과다한 섭취는 급성 및 만성 위염의 원인이 되며 위장의 출혈과 미란을 유발하고 위점막 상피세포의 손실을 일으켜 위 손상을 이야기 한다고 한다[5]. 또한 위액의 분비를 증가시켜 위장의 공격인자로 작용하여 위 점막을 보호하는 방어체계가 깨져 병변을 일으켜 위손상을 약화시킨다고 알려져 있다[10].
본 연구에서는 급성 위손상 모델을 통해 염생식물인 함초 추출물과 수송나물 에탄올 추출물, 수송나물 열수추출물의 위염 발생 억제 효과를 조사하였다. 이번 연구를 통한 결과 알콜성 위염을 유발시킨 그룹이 정상 대조군과 비교하였을 때 확연한 위 점막 손상을 일으켰음을 확인할 수 있었다. 알코올성 위염을 유발시킨 그룹의 동물의 위벽에 출혈과 위점막 손상 면적이 증가된 것을 관찰할 수 있었고, 조직 병리학적인 관찰을 통해 위 점막 상피세포의 손실이 크게 증가된 것을 확인할 수 있었다. 또한 이번 연구에서 염생식물인 수송나물이 알코올로 증가된 위점막 손상을 감소시켰음을 확인하였다.
본 연구를 통하여 수송나물의 항 위염 및 항 위궤양의 효과를 알 수 있었으며 이에 따라 염생식물인 수송나물을 더 연구할 가치가 있음을 알 수 있었다. 또한 실험결과 수송나물의 위염 치료제 개발의 가능성을 확인하였으며 질병 예방 차원에서 기능성 식품의 개발에도 응용할 수 있을 것으로 사료된다.