Original Article
Pharmacological properties of Technekitty injection (Tc-99m) in diagnosing feline hyperthyroidism
Jae Cheong Lim
1,*
, So-Young Lee
1
, Eun Ha Cho
1
, Yu Mi Jung
1
, Ki Hwan Park
1
, Young Uk Park
1
, Sung Soo Nam
1
, Tae Hoon Lee
1
, Jae Won Lee
1
, Jisu Sun
2
, Hye Kyung Chung
2
, Yong Jin Lee
2
, Yeon Chae
3
, Byeong-Teck Kang
3
1Radioisotope Research Division, Korea Atomic Energy Research Institute, Daejeon 34057, Korea
2Korea Radioisotope Center for Pharmaceuticals, Korea Institute of Radiological and Medical Sciences, Seoul 01812, Korea
3Laboratory of Veterinary Internal Medicine, College of Veterinary Medicine, Chungbuk National University, Cheongju 28644, Korea
*Corresponding author: Jae Cheong Lim, Radioisotope Research Division, Korea Atomic Energy Research Institute, Daejeon 34057, Korea, Tel: +82-42-868-8344, E-mail:
limjc@kaeri.re.kr
We have conducted a study on the pharmacological and toxicological characteristics of Technekitty injection (Tc-99m) under development. Because of the large volume, we will report it in two papers. We will first report the results on the pharmacological characteristics, and then report the toxicological characteristics.
© Research Institute of Veterinary Medicine, Chungbuk National University.
Received: Nov 06, 2024; Revised: Dec 06, 2024; Accepted: Dec 09, 2024
Abstract
Thyroid scanning using technetium-99m (99mTc) is the gold standard for diagnosing feline hyperthyroidism. In cats with an overactive thyroid, a thyroid scan is the most appropriate imaging technique to detect and localize any hyperfunctional adenomatous thyroid tissue. In this study, the pharmacological properties of the Technekitty injection (Tc-99m), developed as a diagnostic agent for feline hyperthyroidism using 99mTc as an active ingredient, were tested in FRTL-5 thyroid follicular cell line and ICR mice. The percentage of cell uptake of the Tc-99m in FRTL-5 thyroid cells was 0.182 ± 0.018%, which was about 6 times higher compared to Clone 9 hepatocytes. This uptake decreased by 38.2% due to competitive inhibition by iodine (sodium iodide). In tissue distribution tests by using ICR mice, the highest distribution was observed in the liver, kidneys, spleen, lungs, and femur at 0.083 hours after administration, and this distribution decreased as the compound was excreted through the kidneys, the primary excretory organ. Maximum distribution was confirmed at 1 hour in the small intestine, 6 hours in the large intestine, and 2 hours in the thyroid gland. Additionally, the total amount excreted through urine and feces over 48 hours (2 days) was 78.80% of the injected dose, with 37.70% (47.84% of the total excretion) excreted through urine and 41.10% (52.16% of the total excretion) through feces. In conclusion, the Tc-99m has the same mechanism of action, potency, absorption, distribution, metabolism, and excretion characteristics as 99mTc used for feline hyperthyroidism in the United States, Europe, and other countries, because the Technekitty injection (Tc-99m) contains 99mTc as its sole active ingredient. Based on these results, the Technekitty injection (Tc-99m) is expected to be safely used in the clinical diagnosis of feline hyperthyroidism.
Keywords: feline hyperthyroidism; technetium-99m (99mTc); sodium pertechnetate Tc 99m; Technekitty injection (Tc-99m); pharmacological properties
INTRODUCTION
고양이 갑상선기능항진증은 고양이의 갑상선에서 갑상선 호르몬인 티록신(T4)과 삼요오드티로닌(T3)을 비정상적으로 과다하게 분비하는 질환이며, 대부분의 경우 양성 갑상선 샘종에 의해 유발된다. 노령 고양이에서 진단되는 가장 흔한 질병 중 하나로써 유병률은 10세 이상 고양이의 약 10%로 보고되어 있으며, 체중 감소, 식욕 증가, 다음, 다뇨, 활동성 증가, 털 상태의 악화 등의 임상 증상을 나타낸다[1]. 고양이 갑상선기능항진증의 명확한 원인은 밝혀져 있지 않으며, 수명 연장, 유전적인 감수성, 식이 및 사육 환경 등이 고양이 갑상선기능항진증의 발생에 영향을 준다고 보고된다[1]. 이 질환이 조기에 진단되지 않으면 체중 감소, 빈맥, 신경과민 등의 전신 증상이 나타날 수 있으며, 치료하지 않으면 심각한 합병증으로 이어질 수 있다[1, 2].
고양이 갑상선기능항진증의 진단법으로는 주로 임상 증상 관찰, 혈액 검사, 초음파 검사, 갑상선 스캔(thyroid scintigraphy) 등이 사용된다. 혈액 검사로는 총 T4(total thyroxine concentration) 검사 및 자유 T4(free thyroxine concentration) 검사가 주로 사용된다. 총 T4 검사는 혈청 내 총 T4 수치를 측정하여 진단하며, 갑상선호르몬 분비량을 직접 반영하는 가장 일반적인 검사이다. 증가된 총 T4 수치로 고양이 갑상선기능항진증의 진단이 가능하며 90% 이상에서 정확한 결과를 얻을 수 있으나, 초기 또는 경미한 갑상선기능항진증에서는 총 T4 수치가 정상 범위에 있을 수 있다. 또한, 총 T4수치는 euthyroid sick syndrome에서 위양성 또는 위음성을 보일 수도 있다. 자유 T4 검사는 총 T4 검사로 진단이 어렵거나 경미한 증상을 보이는 고양이 갑상선기능항진증의 진단에 유용하다. 그러나 10%–20%의 정상 고양이에서도 자유 T4 수치가 상승할 수 있어, 다른 검사와 함께 사용하는 것이 권장된다. 초음파 검사는 비침습적으로 갑상선의 크기와 결절을 시각적으로 확인할 수 있는 장점이 있으나, 갑상선의 기능적 정보를 얻을 수가 없으므로 갑상선기능항진증을 확진하기 어려운 단점이 있다[3–5].
이에 반해 테크네튬-99m(technetium-99m, 99mTc)을 이용한 갑상선 스캔은 갑상선의 해부학적 구조와 생리적 기능에 관한 정보를 제공하며, 고양이 갑상선 질환의 진단, 병기 설정 및 관리에 중요한 역할을 한다[5–9]. 갑상선기능항진증과 같은 과활성 갑상선을 가진 고양이에게 갑상선 스캔은 모든 과기능성, 선종성 갑상선 조직을 탐지하고 범위를 파악하는 데 가장 적합한 영상 진단기술이다. 또한, 갑상선 스캔은 일측성 갑상선 질환과 양측성 갑상선 질환을 구분하고, 갑상선 크기와 활성도를 평가하며, 이소성 또는 전이성 갑상선 조직을 진단할 수 있는 장점이 있다[10].
테크네튬-99m은 과테크네튬산나트륨(sodium pertechnetate) 구조로 되어 있으며, 진단용 방사성의약품으로 사용된다. 일반적으로 테크네튬-99m 용액은 과테크네튬산나트륨 주사액 제너레이터(sodium pertechnetate injection generator)에 생리식염수를 주입하여 용출되며, 테크네튬-99m의 물리적 반감기는 6.02시간으로 0.141 MeV의 감마선을 방출하는 물리적 특성이 있어 감마 카메라를 이용한 갑상선 스캔에 적합하다[2, 11–13].
체내로 투여된 테크네튬-99m은 요오드 펌프(sodium iodide symporter)를 통하여 갑상선에 특이적으로 섭취되는 특성이 있으며, 갑상선기능항진증에서는 갑상선 대사가 증가함에 따라 테크네튬-99m의 섭취량이 증가한다[11, 14]. 이에 따라 테크네튬-99m을 이용한 갑상선 스캔은 1960년대부터 인체용 갑상선기능항진증의 진단에 사용되고 있으며, 수의학 분야에서는 고양이의 갑상선기능항진증을 진단하고 병기를 설정하기 위한 표준 진단법으로 사용된다[8]. 그러나 방사성의약품은 국가별 법령에 따라 허가 받은 방사성물질 취급 시설과 취급자가 필수적이다. 최근 한국에 방사성의약품을 동물의 진단에 사용할 수 있는 시설이 구축됨에 따라 테크네튬-99m 등 효율적인 동물용 방사성의약품을 한국에 도입하기 위한 연구가 요구되고 있다.
테크네키티 주사액(Tc-99m)은 기존 테크네튬-99m 용액에 생리식염수만을 추가하고 분배하여, 고양이에 대한 투여용량에 따라 낮은 방사능량으로 개발 중인 정맥 주사용 방사성의약품이다. 따라서 테크네키티 주사액(Tc-99m)은 과테크네튬산나트륨(sodium pertechnetate) 구조의 테크네튬-99m을 단일 유효성분으로 하며, 기존 사용 중인 테크네튬-99m과 화학적 구조 및 특성이 동일하다. 본 연구에서는 향후 한국에 동물용 테크네튬-99m을 도입하기 위하여, 테크네키티 주사액(Tc-99m)의 약리학적 특성을 확인하였다.
MATERIALS AND METHODS
시험물질의 품질 확인 시험
시험물질인 테크네키티 주사액(Tc-99m)은 한국원자력연구원의 방사성의약품 제조시설에서 제조되었으며, 시험 및 기준법에 따라 시험물질의 성상, 확인, pH, 순도(방사화학적 이물, 몰리브덴-99, 알루미늄), 무균, 엔도톡신, 불용성이물, 방사능량 등의 품질이 확인되었다.
세포 배양
FRTL-5 랫드 정상 갑상선 세포(rat thyroid follicular cell line)는 서울대학교병원 박영주 교수로부터 제공받아 시험에 사용하였다. 즉, F-12 nutrient mixture Ham Kaighn’s modification medium(LM 010-03, WELGENE, Gyeongsan, Korea) 배지에 5% bovine calf serum(S003-01, WELGENE), antibiotic-antimycotic solution(AA001, SolBio, Suwon, Korea), 1% 10 mM MEM-Non essential amino acid(LS005-01, WELGENE)를 넣었으며, 추가적으로 6가지 호르몬(10 mU/mL bovine thyroid stimulating hormone; T1614, Scripps Research, La Jolla, CA, USA), bovine insulin(I5500, Sigma-Aldrich, St. Louis, MO, USA) 10 ug/mL, human transferrin(T2252, Sigma-Aldrich) 5 ug/mL, hydrocortisone(3867, Calbiochem, San Diego, CA, USA) 0.36 ng/mL, somatostatin(S9129, Sigma-Aldrich) 10 ng/mL, Glycyl-L-histidyl-L-Lysine acetate(G1887, Sigma-Aldrich) 2 ng/mL을 넣어 만든 배양액으로 배양하였다. 또한, clone-9 세포(CRL-1439, ATCC, Manassas, VA, USA)는 ATCC로부터 구매하였으며, ATCC에서 제공된 방법대로 배양하였다. 즉, F-12 nutrient mixture Ham’s modification medium(LM 010-03, WELGENE) 배지에 5% fetal bovine serum(S001-01, WELGENE)과 antibiotic-antimycotic solution(AA001, SolBio)을 넣어 만든 배양액으로 배양하였다. 위 두가지 세포는 항온, 항습 배양기(37℃, 95% air, 5% CO2)에서 배양하였으며, 세포 confluence 80% 상태가 되면 계대배양하여 세포유지 및 실험 목적에 맞게 사용하였다[15].
세포 섭취율 시험
Clone 9 세포와 FRTL-5 세포를 12 well plate에 well 당 5 × 105 수로 seeding하였다. 준비한 각 세포에 5 uCi의 테크네키티 주사액(Tc-99m)과 1 uM의 요오드(sodium iodide, Sigma-Aldrich)를 동시에 처리하거나, 5 uCi의 테크네키티 주사액(Tc-99m)만을 처리하여 2시간동안 37도에서 배양하였다. 각 처리 방법에 따른 그룹별 표본수는 3개(n = 3)로 하였다. 배양이 종료된 후에 세포배양액을 회수하고, 차가운 PBS로 세척하여 세척액을 회수하였다. 감마카운터(Wallac Wizard1470, Perkinelmer, Waltham, MA, USA)를 이용하여 세포배양액과 세척액의 방사능량을 측정하고 이를 합산하여, 세포에 섭취되지 않은 테크네키티 주사액(Tc-99m)의 양을 확인하였다. 그리고 1N NaOH로 각 세포액을 회수하고, 감마카운터로 회수된 세포액의 방사능량을 측정하여 세포에 섭취된 테크네키티 주사액(Tc-99m)의 양을 확인하였다[15].
실험동물 사육 관리
특정 병원체 부재(SPF) 조건의 생후 6주령의 수컷 ICR 마우스(DBL, Eumseong, Korea)를 구매하여 일주일의 순화기간을 거친 후 실험을 수행하였다. 역상삼투압수와 방사선 멸균 사료를 공급하고, 사육 및 실험은 동물실험윤리위원회(#kirams2024-0059)와 국가RI신약센터 실험동물시설(제611호) 설치류 계류지의 표준작업지침서(IMG-SOP-ANI-001~008)에 따라 수행하였다. 온도는 19℃–25℃, 습도는 30%–70%, 조명은 12시간 명주기/12시간 암주기, 조도는 150–300 Lux, 환기 횟수는 시간당 10–20회, 청소 등은 시험시설의 표준작업지침서에 따라 실시하였다.
조직 분포 및 배설 시험을 위한 시험물질의 제조 및 투여
필요에 따라 생리식염주사액을 이용하여 투여용량을 맞추었으며, 테크네키티 주사액(Tc-99m)은 마리 당 0.67 mCi/kg 용량으로 0.2 mL를 투여하였다. 투여용량은 투여 당일 실험동물의 체중을 측정한 후, 반올림하여 10 μL 단위로 산출하였다. 시험물질은 꼬리 정맥에 주사한 후, 투여 전 후 주사기의 방사능량을 측정하여 실제 투여된 방사능량을 계산하였다.
생체 내 조직 분포 시험
생체 내 조직분포 확인을 위하여 각 시간대 별로 4마리씩 군 분리하여 총 20마리를 시험에 사용하였다. 마리 당 시험물질 0.67 mCi/kg/0.2 mL(± 20%)씩 꼬리 정맥에 투여한 후, 0.083시간(5분), 1시간, 2시간, 6시간, 24시간 이후에 체중(소수점 둘째 자리까지 측정)을 측정하고 혈액, 심장, 간, 폐, 비장, 신장, 위, 소장, 대장, 갑상선, 침샘, 근육, 대퇴골, 뇌, 생식기를 채취하였다. 투여 당일, 희생되는 실험동물 군은 희생 전 체중을 측정하지 않았다. 혈액은 각 개체의 심장 채혈을 통하여 채취한 후, 1.7 mL microtube에 담아 무게를 측정하였으며, 빈 tube의 무게를 제외하여 실제 혈액 무게를 계산하였다. 채취한 생체 조직의 무게를 측정(소수점 셋째 자리까지)한 뒤, 시험물질의 투여 방사능량의 1/10 및 1/100로 희석해 준비한 표준물질(standard, STD)과 함께 감마카운터를 이용해 샘플 당 1분씩 방사능량을 측정하였다. 결과값은 표준물질의 방사능량을 기준으로 마우스당 주입된 양의 %ID(injected dose)로 환산하였으며, 각 조직별 결과값을 이용하여 주요장기(혈액, 침샘 및 신장 등)에서의 PK parameter(AUC; area under the curve, Tmax, Cmax, CL 등)를 Phoenix WinNonlin 8.2를 이용하여 산출하였다.
생체 내 배설 시험
생체 내 배설 확인을 위하여 총 4마리를 시험에 사용하였다. 마리 당 0.67 mCi/kg/0.2 mL (± 20%)씩 꼬리 정맥으로 투여한 후, 마우스용 대사케이지로 이동하여 1 케이지당 1마리씩 수용하였다. 시험물질 투여 후, 6시간, 24시간, 48시간에 뇨 및 변을 수집하였으며, 케이지 내부 및 철망을 알코올 솜으로 닦아내어 별도 시료로 수집하였다. 각각의 시료는 시험물질에 처리한 방사능량의 1/10 과 1/100의 STD로 준비하여 gamma counter로 측정하였으며, 시료당 1분간 측정하였다. STD를 기준으로 넣어준 방사능량을 계산하여 % ID로 계산하였으며, 시간에 따른 배설량을 누적하여 계산하였다. Swab 샘플은 뇨 샘플에 더하여 최종 뇨 및 변으로의 배출량을 산출하였다.
통계 분석
세포섭취율 및 생체 내 분포량 등에 대한 통계적 분석값 산출은 Microsoft excel, GraphPad Prism(Prism 5 version 5.01, GraphPad Software, San Diego, CA, USA)을 사용하였으며, Phoenix WinNonlin 8.2(Certara, Radnor, PA, USA)를 이용하여 PK parameter에 대한 통계적 분석값을 산출하였다.
RESULTS
시험물질의 품질 확인
테크네키티 주사액(Tc-99m)은 테크네튬-99m이 활성성분이기 때문에, 시험물질이 약리적 효과를 발휘하기 위해서는 핵종에 대한 확인과 방사화학적 순도의 확인이 필수적이다. 품질 확인 결과, 시험물질은 테크네튬-99m의 주피크인 0.141 MeV가 확인되고 방사화학적 순도 또한 95% 이상으로써 일반적으로 방사성의약품에 요구되는 기준을 충족하였다. 본 연구에 사용된 테크네키티 주사액(Tc-99m)의 품질(Supplementary Fig. S1)은 별도로 첨부하였다.
세포 섭취율 평가
갑상선 세포에서 테크네키티 주사액(Tc-99m)과 요오드(sodium iodide)의 경쟁반응에 따른 세포 내 섭취율을 비교 평가함으로써, 테크네키티 주사액(Tc-99m)이 갑상선 세포에 선택적으로 섭취되는 작용기전을 평가하였다.
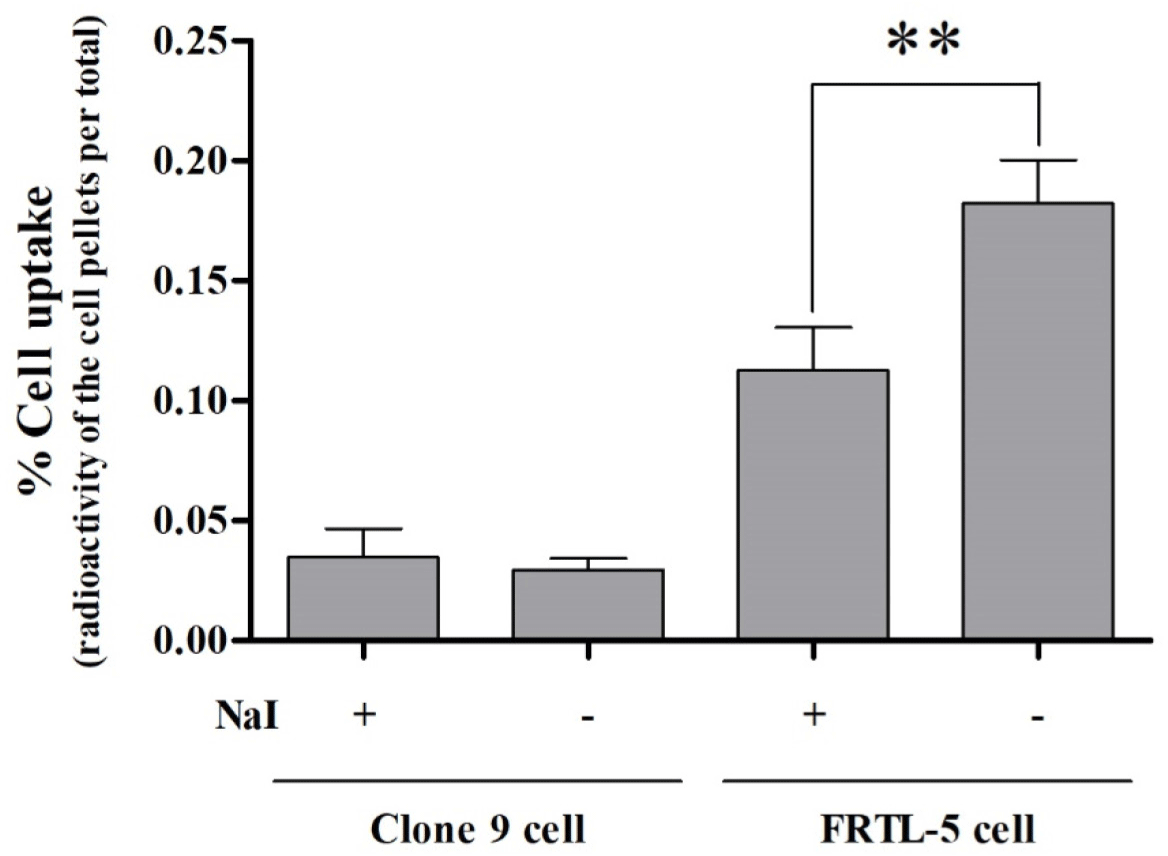
Fig. 1과 같이 clone 9 세포에서 테크네키티 주사액(Tc-99m)의 세포 섭취율(%cell uptake)은 0.029 ± 0.005%이었고, 이에 반해 FRTL-5 세포에서 테크네키티 주사액(Tc-99m)의 세포 섭취율은 0.182 ± 0.018%로써 유의적으로 높은 수치를 보였다. 이를 통하여 테크네키티 주사액(Tc-99m)은 갑상선 세포에서 특이적으로 섭취됨을 확인하였다.
Fig. 1.
Cell uptake assay of the Technekitty injection (Tc-99m) in Clone 9 and FRTL-5 cells.
The % cell uptake means the percentage of the value obtained by dividing the amount of radioactivity uptaked by the cells by the amount of radioactivity administered. ** In FRTL-5 cells, %Cell uptake of the Technekitty injection (Tc-99m) was significantly reduced due to a competitive binding reaction with iodine.
Download Original Figure
요오드와의 경쟁 반응 시, clone 9 세포에서 테크네키티 주사액(Tc-99m)의 세포 섭취율은 0.035 ± 0.012%이었으며, FRTL-5 세포에서 테크네키티 주사액(Tc-99m)의 세포 섭취율은 0.113 ± 0.018%이었다. 타 장기의 세포에서는 요오드와의 경쟁 반응이 테크네키티 주사액(Tc-99m)의 세포 섭취율에 큰 영향을 주지 않았으나, 갑상선 세포에서는 세포 섭취율을 유의적(p=0.009)으로 감소시키는 결과가 확인되었다. 이를 통하여 테크네키티 주사액(Tc-99m)은 요오드(sodium iodide)와 동일한 기전으로 갑상선 세포에 섭취됨을 확인하였다(Fig. 1).
조직 분포 및 배설 시험을 위한 시험물질의 제조 및 투여
먼저, 시험을 위한 그룹을 구분하고, 그룹별 실험동물의 몸무게를 측정하였다. 순화기간동안 일반증상 이상 및 사망개체는 발견되지 않았다. 시험당일 개체별 몸무게를 측정하였으며, 평균 34.26 ± 1.68 g이었다.
조직분포 실험용으로 오름차순으로 총 5개 그룹으로 그룹당 4마리씩, 배설 실험용으로 4마리를 나누고, 각 그룹별 몸무게를 측정하였다. 각 개체별 투여된 시험물질은 평균 23.21 ± 0.93 μCi(0.86 ± 0.03 MBq) / 200 μL 로 모든 개체에 투여 허용 범위(± 20%) 내로 주입되었으며, 투여 이후, 실험기간 내 일반증상 이상 및 사망개체는 발견되지 않았다(Table 1, Supplementary Table S1).
Table 1.
Grouping, average weight and dosage for in vivo tissue distribution and excretion testing
|
Group |
Test substance |
Administration method |
Harvest time (hr) |
The number of animal |
Planned dosage (mCi/kg) |
Average weight (g) |
Actual dosage (µCi) |
Actual dosage (MBq) |
|
G1 |
Technekitty injection (Tc-99m) |
I.V. |
0.083 (5 min) |
4 |
0.67 |
33.27 ± 2.61 |
23.07 ± 1.06 |
0.85 ± 0.03 |
|
G2 |
Technekitty injection (Tc-99m) |
I.V. |
1 |
4 |
0.67 |
34.46 ± 2.14 |
23.29 ± 1.24 |
0.86 ± 0.05 |
|
G3 |
Technekitty injection (Tc-99m) |
I.V. |
2 |
4 |
0.67 |
33.89 ± 1.29 |
22.88 ± 0.72 |
0.85 ± 0.03 |
|
G4 |
Technekitty injection (Tc-99m) |
I.V. |
6 |
4 |
0.67 |
35.43 ± 1.72 |
23.38 ± 1.61 |
0.87 ± 0.06 |
|
G5 |
Technekitty injection (Tc-99m) |
I.V. |
24 |
4 |
0.67 |
33.77 ± 0.79 |
23.33 ± 0.62 |
0.86 ± 0.02 |
|
Excretion |
Technekitty injection (Tc-99m) |
I.V. |
6, 24, 48 |
4 |
0.67 |
34.77 ± 0.96 |
23.34 ± 0.57 |
0.86 ± 0.02 |
Download Excel Table
Table 2와 같이 테크네키티 주사액(Tc-99m)을 투여한 후, 조직 적출 전 개체별 몸무게를 측정하여 그룹별로 투여 당일과 적출일에 몸무게를 비교하였다. 당일에 희생하는 그룹 G1, G2, G3, G4 및 배설의 실험동물 몸무게는 별도로 측정하지 않았다. 시험기간동안 시험물질 투여 후 몸무게의 감소는 관찰되지 않았으며, 시험물질은 실험동물에게 주요한 영향을 미치지 않음을 확인하였다(Tables 1 and 2).
Table 2.
Weight by group after administration of the Technekitty injection (Tc-99m)
|
Group |
Harvest time (hr) |
Average body weight on the day of administration (g) |
Average weight on harvest day (g) |
|
G1 |
0.083 (5 min) |
33.27 ± 2.61 |
NA |
|
G2 |
1 |
34.46 ± 2.14 |
NA |
|
G3 |
2 |
33.89 ± 1.29 |
NA |
|
G4 |
6 |
35.43 ± 1.72 |
NA |
|
GS |
24 |
33.77 ± 0.79 |
32.62 ± 0.40 |
|
Excretion |
- |
34.77 ± 0.96 |
NA |
Download Excel Table
생체 내 조직 분포 시험; 각 시간대별 조직 내 분포(%injected dose/organ)
각 시간대별 테크네키티 주사액(Tc-99m)의 조직 내 분포 양상을 적출한 전체 조직(organ) 및 조직 무게(g)로 보정하여 분석하였다. 각 조직의 무게는 혈액, 근육 및 대퇴골을 제외하고는 전체 장기를 적출하여 무게를 측정하여 적용하였다. 혈액은 몸무게를 기준으로 58.5 mL/kg을 총량으로 설정하여 적출한 조직의 무게를 곱하여 산출하였다.
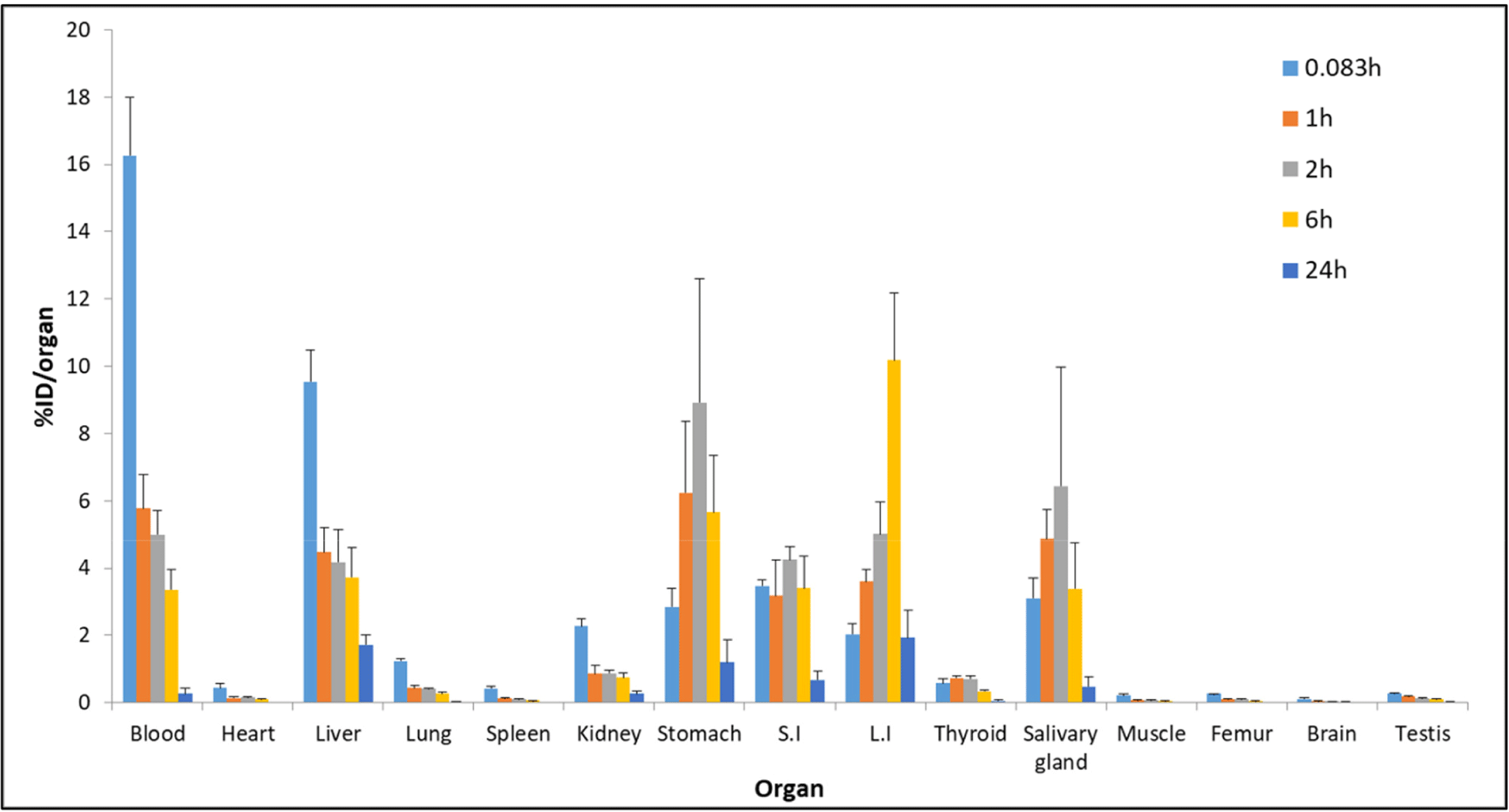
Table 3과 같이 시험물질 테크네키티 주사액(Tc-99m)은 꼬리 정맥에 주사 후, 각 조직으로 흡수, 분포되었다가 신장 및 소화기관(위, 소장, 대장)을 통하여 배설됨을 확인하였다. 시험물질은 소화기관을 제외한 대부분의 조직에서 0.083시간에 최대 분포를 확인하였으며, 꼬리 정맥으로 투여 직후(5분 이내)에 빠르게 전신으로 퍼지는 것을 확인하였다. 시험물질은 시간이 지남에 따라 대부분 장기에서 분포량이 낮아지는 것을 확인하였으며, 배출장기인 신장을 포함하여 간, 비장, 폐, 근육, 대퇴골에서는 0.083시간에, 소화기관인 위, 소장에서는 2시간에, 대장은 6시간에 최고 분포를 보임을 확인하였다. 내분비기관인 갑상선에서는 1시간에, 침샘에서는 2시간에 최고 분포를 보임을 확인하였다. 시험물질의 대부분은 신장 및 소화기관(위, 소장, 대장)을 통하여 배출되는 것으로 확인하였으며, 투여 후 24시간에 간, 위, 소장, 대장을 제외한 장기에서 0.5 %ID 이하로 확인되어 거의 대부분이 배출된 것으로 확인되었다(Table 3, Fig. 2).
Table 3.
After administration of the Technekitty injection (Tc-99m), the value of in vivo tissue distribution (%ID/organ)
|
Organs |
Mean (%ID/organ) |
|
0.083 hr |
1 hr |
2 hr |
6 hr |
24 hr |
|
AVG |
S.D. |
AVG |
S.D. |
AVG |
S.D. |
AVG |
S.D. |
AVG |
S.D. |
|
Blood |
16.268 |
1.732 |
5.768 |
1.023 |
5.003 |
0.716 |
3.363 |
0.601 |
0.271 |
0.167 |
|
Heart |
0.441 |
0.123 |
0.144 |
0.032 |
0.164 |
0.022 |
0.093 |
0.026 |
0.013 |
0.006 |
|
Liver |
9.541 |
0.939 |
4.476 |
0.713 |
4.183 |
0.974 |
3.723 |
0.900 |
1.719 |
0.305 |
|
Lung |
1.245 |
0.047 |
0.439 |
0.072 |
0.406 |
0.033 |
0.264 |
0.058 |
0.033 |
0.013 |
|
Spleen |
0.419 |
0.078 |
0.130 |
0.014 |
0.114 |
0.009 |
0.070 |
0.007 |
0.009 |
0.004 |
|
Kidney |
2.268 |
0.220 |
0.858 |
0.248 |
0.881 |
0.076 |
0.750 |
0.129 |
0.270 |
0.063 |
|
Stomach |
2.848 |
0.560 |
6.247 |
2.106 |
8.916 |
3.677 |
5.666 |
1.672 |
1.202 |
0.680 |
|
Small intestine |
3.475 |
0.182 |
3.183 |
1.054 |
4.247 |
0.405 |
3.401 |
0.960 |
0.681 |
0.245 |
|
Large intestine |
2.033 |
0.312 |
3.597 |
0.370 |
5.011 |
0.962 |
10.174 |
2.012 |
1.935 |
0.813 |
|
Thyroid |
0.575 |
0.150 |
0.730 |
0.071 |
0.711 |
0.100 |
0.341 |
0.038 |
0.055 |
0.024 |
|
Salivary gland |
3.113 |
0.584 |
4.872 |
0.862 |
6.442 |
3.531 |
3.394 |
1.368 |
0.474 |
0.309 |
|
Muscle |
0.206 |
0.049 |
0.079 |
0.021 |
0.065 |
0.021 |
0.050 |
0.015 |
0.005 |
0.003 |
|
Femur |
0.268 |
0.007 |
0.101 |
0.021 |
0.100 |
0.022 |
0.053 |
0.013 |
0.006 |
0.004 |
|
Brain |
0.114 |
0.040 |
0.053 |
0.013 |
0.046 |
0.003 |
0.033 |
0.008 |
0.005 |
0.001 |
|
Testis |
0.281 |
0.023 |
0.187 |
0.023 |
0.143 |
0.008 |
0.103 |
0.025 |
0.018 |
0.006 |
|
Tail |
3.249 |
0.660 |
1.390 |
0.239 |
0.901 |
0.123 |
0.659 |
0.146 |
0.153 |
0.069 |
Download Excel Table
Fig. 2.
Distribution graph for each organ (%ID/organ).
After intravenous administration of the Technekitty injection (Tc-99m), the radioactivity of each organ was measured over time, and through this, the distribution characteristics of the Technekitty injection (Tc-99m)’s radioactivity in the body were evaluated. ID, injected dose.
Download Original Figure
생체 내 조직 분포 시험; 각 시간대별 조직 내 분포(%injected dose/g)
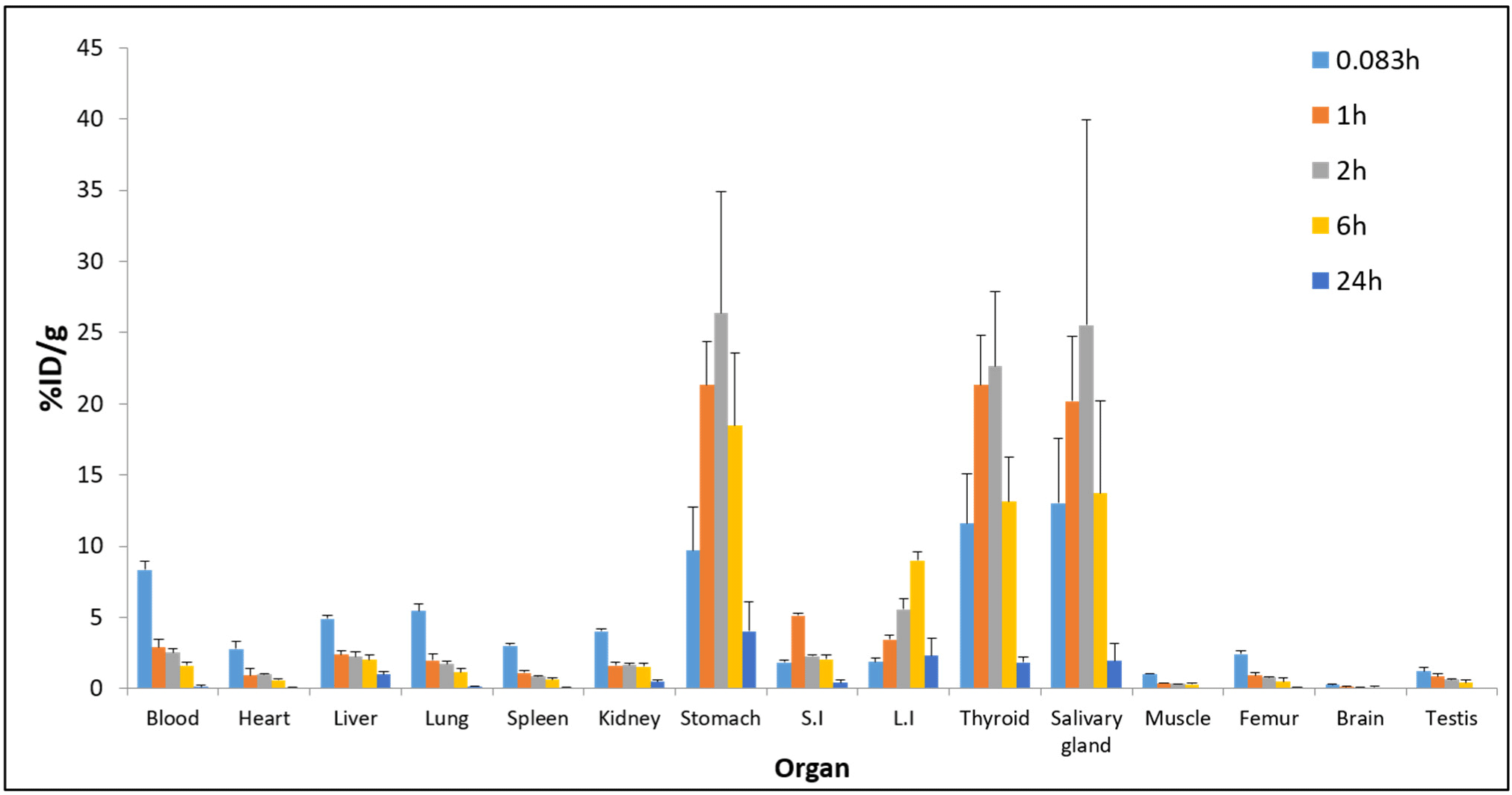
각 시간대별 테크네키티 주사액(Tc-99m)의 조직 내 분포 양상을 각 적출된 조직 무게(g)로 보정하여 마우스당 주입된 양의 %ID/g으로 환산하였다. 투여 후 0.083시간에 간, 신장, 비장, 폐, 대퇴골에서 최고 분포를 보임을 확인하였으며, 0.083시간 이후로 배출장기인 신장을 통하여 배설되어 낮아지는 분포 양상을 보였다. 소화기관인 소장에서는 1시간에, 대장에서는 6시간에 최대 분포를 보임을 확인하였다. 내분비기관인 갑상선에서는 2시간에 최고 분포를 보임을 확인하였다. 시험물질이 정맥 투여 직후, 혈액에서 최대 분포를 보이다 침샘, 갑상선, 위에서 투여 후 2시간에 최고 분포를 보이는 양상은 혈액에서 세포외액 및 위점막으로 빠르게 분포되는 테크네튬-99m의 전형적인 분포 양상이다. 투여 후 24시간에 간, 대장, 위, 갑상선 및 침샘을 제외한 모든 조직에서 0.5 %ID/g 이하로 확인되었다(Table 4, Fig. 3).
Table 4.
After administration of the Technekitty injection (Tc-99m), the value of in vivo tissue distribution (%ID/g)
|
Organs |
Mean (%ID/Organ) |
|
0.083 hr |
1 hr |
2 hr |
6 hr |
24 hr |
|
AVG |
S.D. |
AVG |
S.D. |
AVG |
S.D. |
AVG |
S.D. |
AVG |
S.D. |
|
Blood |
8.358 |
0.573 |
2.890 |
0.573 |
2.518 |
0.288 |
1.621 |
0.260 |
0.136 |
0.080 |
|
Heart |
2.780 |
0.507 |
0.912 |
0.507 |
0.977 |
0.090 |
0.594 |
0.123 |
0.079 |
0.036 |
|
Liver |
4.903 |
0.262 |
2.392 |
0.262 |
2.222 |
0.329 |
2.016 |
0.384 |
1.008 |
0.176 |
|
Lung |
5.447 |
0.473 |
1.971 |
0.473 |
1.723 |
0.184 |
1.136 |
0.252 |
0.149 |
0.058 |
|
Spleen |
3.015 |
0.152 |
1.122 |
0.152 |
0.844 |
0.088 |
0.634 |
0.112 |
0.080 |
0.035 |
|
Kidney |
4.027 |
0.194 |
1.629 |
0.194 |
1.642 |
0.168 |
1.555 |
0.211 |
0.498 |
0.134 |
|
Stomach |
9.683 |
3.041 |
21.329 |
3.041 |
26.376 |
8.489 |
18.481 |
5.081 |
4.031 |
2.032 |
|
Small intestine |
1.826 |
0.161 |
5.118 |
0.161 |
2.268 |
0.114 |
2.063 |
0.277 |
0.409 |
0.177 |
|
Large intestine |
1.869 |
0.284 |
3.448 |
0.284 |
5.554 |
0.765 |
8.986 |
0.648 |
2.314 |
1.206 |
|
Thyroid |
11.590 |
3.506 |
21.327 |
3.506 |
22.641 |
5.247 |
13.144 |
3.136 |
1.842 |
0.402 |
|
Salivary gland |
13.030 |
4.547 |
20.178 |
4.547 |
25.517 |
14.442 |
13.705 |
6.500 |
1.931 |
1.222 |
|
Muscle |
1.049 |
0.024 |
0.359 |
0.024 |
0.320 |
0.026 |
0.299 |
0.113 |
0.026 |
0.013 |
|
Femur |
2.411 |
0.221 |
0.914 |
0.221 |
0.776 |
0.054 |
0.494 |
0.280 |
0.064 |
0.027 |
|
Brain |
0.256 |
0.045 |
0.107 |
0.045 |
0.094 |
0.006 |
0.095 |
0.057 |
0.010 |
0.002 |
|
Testis |
1.224 |
0.231 |
0.850 |
0.231 |
0.639 |
0.048 |
0.418 |
0.227 |
0.080 |
0.026 |
|
Tail |
3.937 |
0.831 |
1.567 |
0.831 |
1.068 |
0.140 |
0.798 |
0.156 |
0.197 |
0.098 |
Download Excel Table
Fig. 3.
Distribution graph for each organ (%ID/g).
After intravenous administration of the Technekitty injection (Tc-99m), the radioactivity density of each organ was measured over time. The radioactivity of each organ was measured and divided by its weight, and the efficiency of the Technekitty injection (Tc-99m) uptake by each organ in the body was evaluated. ID, injected dose.
Download Original Figure
생체 내 조직 분포 시험; 조직 내 분포(%injected dose/g)의 PK 파라미터(parameter) 산출
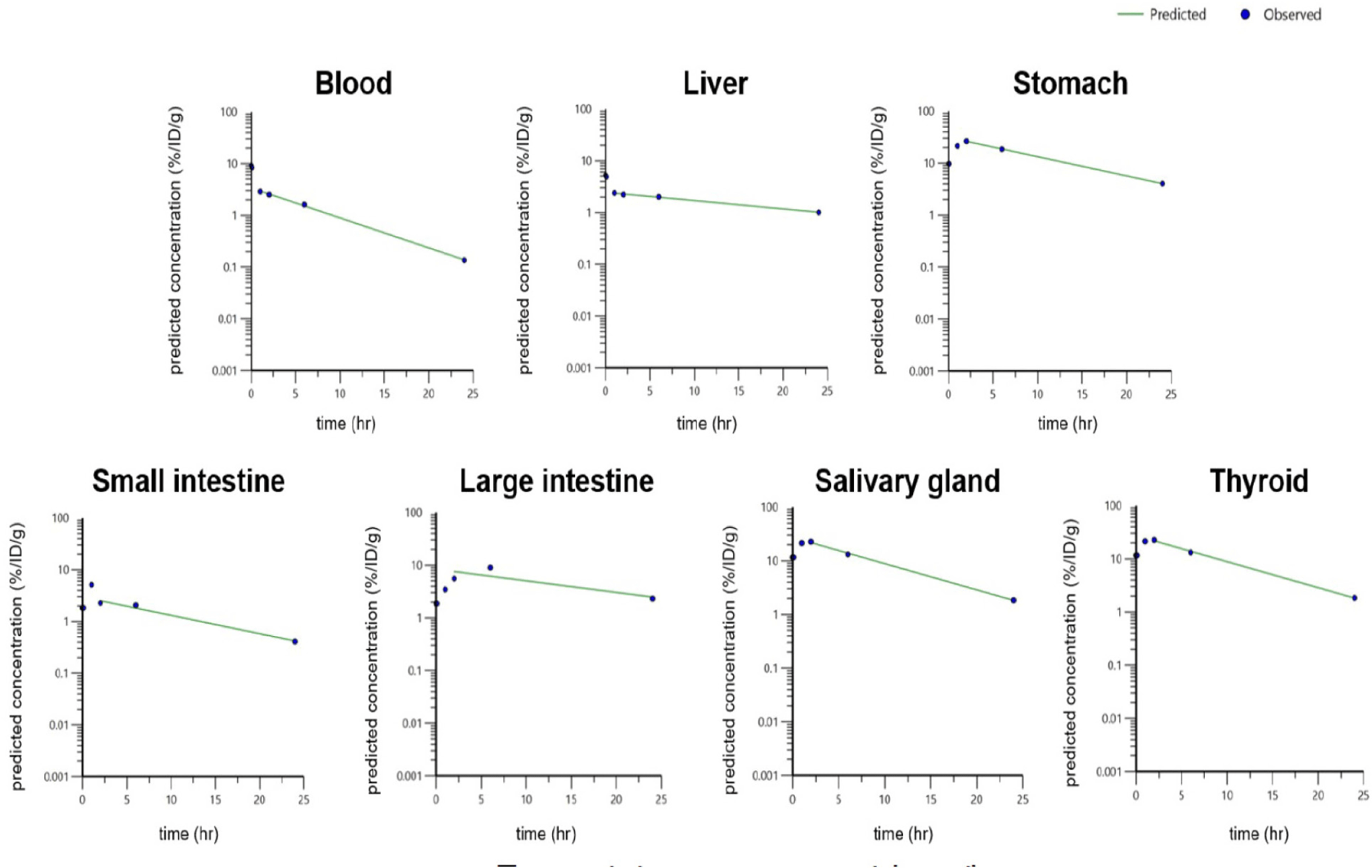
시험물질을 정맥 투여 후, 각 시간에 따른 조직 내 분포의 약동학적 파라미터를 산출하여 비교하였다. 각 조직별로 AUC를 비교하였을 때, 혈액에 비하여 간은 약 1.50배, 위는 11.01배, 소장은 1.25배, 대장은 4.68배 더 높은 값을 나타내었으며, 갑상선은 7.81배, 침샘은 8.24배 더 높은 값을 보였다. 그 외의 조직에서는 혈액에 비하여 AUC값이 낮아 시험물질이 거의 영향을 미치지 않음을 확인하였다(Table 5, Fig. 4).
Table 5.
PK parameters for in vivo tissue distribution (%ID/g) of the Technekitty injection (Tc-99m)
|
Organs |
Tmax (hr) |
Cmax (%ID/g) |
AUClast (hr × [%ID/g]) |
AUCINF_obs (hr × [%ID/g]) |
CI_obs ({mCi}/{hr × [%ID/g]}/kg) |
MRTlast (hr) |
MRTINF_obs (hr) |
HL_Lambda_z1) (hr) |
|
Blood |
0.083 |
8.358 |
27.084 |
28.104 |
0.024 |
6.015 |
6.940 |
5.198 |
|
Heart |
0.083 |
2.780 |
10.404 |
11.102 |
0.060 |
6.719 |
8.360 |
6.108 |
|
Liver |
0.083 |
4.903 |
40.590 |
67.839 |
0.010 |
9.963 |
26.455 |
18.730 |
|
Lung |
0.083 |
5.447 |
19.832 |
21.161 |
0.032 |
6.663 |
8.312 |
6.189 |
|
Spleen |
0.083 |
3.015 |
10.743 |
11.456 |
0.058 |
6.697 |
8.330 |
6.195 |
|
Kidney |
0.083 |
4.027 |
27.515 |
36.251 |
0.018 |
9.150 |
16.957 |
12.161 |
|
Stomach |
2 |
26.376 |
298.465 |
345.810 |
0.002 |
8.638 |
12.349 |
8.141 |
|
Small intestine |
1 |
5.118 |
33.882 |
38.890 |
0.017 |
8.111 |
11.735 |
8.496 |
|
Large intestine |
6 |
8.986 |
124.702 |
170.379 |
0.004 |
10.361 |
19.308 |
13.680 |
|
Thyroid |
2 |
22.641 |
211.414 |
227.777 |
0.003 |
7.455 |
9.282 |
6.158 |
|
Salivary gland |
2 |
25.517 |
223.304 |
240.129 |
0.003 |
7.419 |
9.191 |
6.040 |
|
Muscle |
0.083 |
1.049 |
4.263 |
4.485 |
0.149 |
6.820 |
8.090 |
5.931 |
|
Femur |
0.083 |
2.411 |
8.754 |
9.318 |
0.072 |
6.567 |
8.154 |
6.108 |
|
Brain |
0.083 |
0.256 |
1.332 |
1.427 |
0.469 |
7.336 |
9.074 |
6.589 |
|
Testis |
0.083 |
1.224 |
7.554 |
8.415 |
0.080 |
7.438 |
10.225 |
7.418 |
Download Excel Table
생체 내 배설 시험
시험물질 투여 후, 시간에 따른 생체 내 배설 정도를 확인하기 위하여 정상 마우스 4마리에 꼬리 정맥 투여 후, 대사케이지당 1마리씩 넣어 6시간, 24시간 및 48시간까지 뇨와 변 시료를 회수하였다. 시료 회수 시간에 시간 경과에 따른 뇨 시료의 정확한 회수를 위하여 대사케이지 내부를 알코올 솜으로 swab하여 뇨 시료와 합하여 배설 정도를 평가하였다. 배설 시험 기간 동안 실험동물의 이상사태(탈출, 급이상황 등) 및 사망개체는 발견되지 않았다.
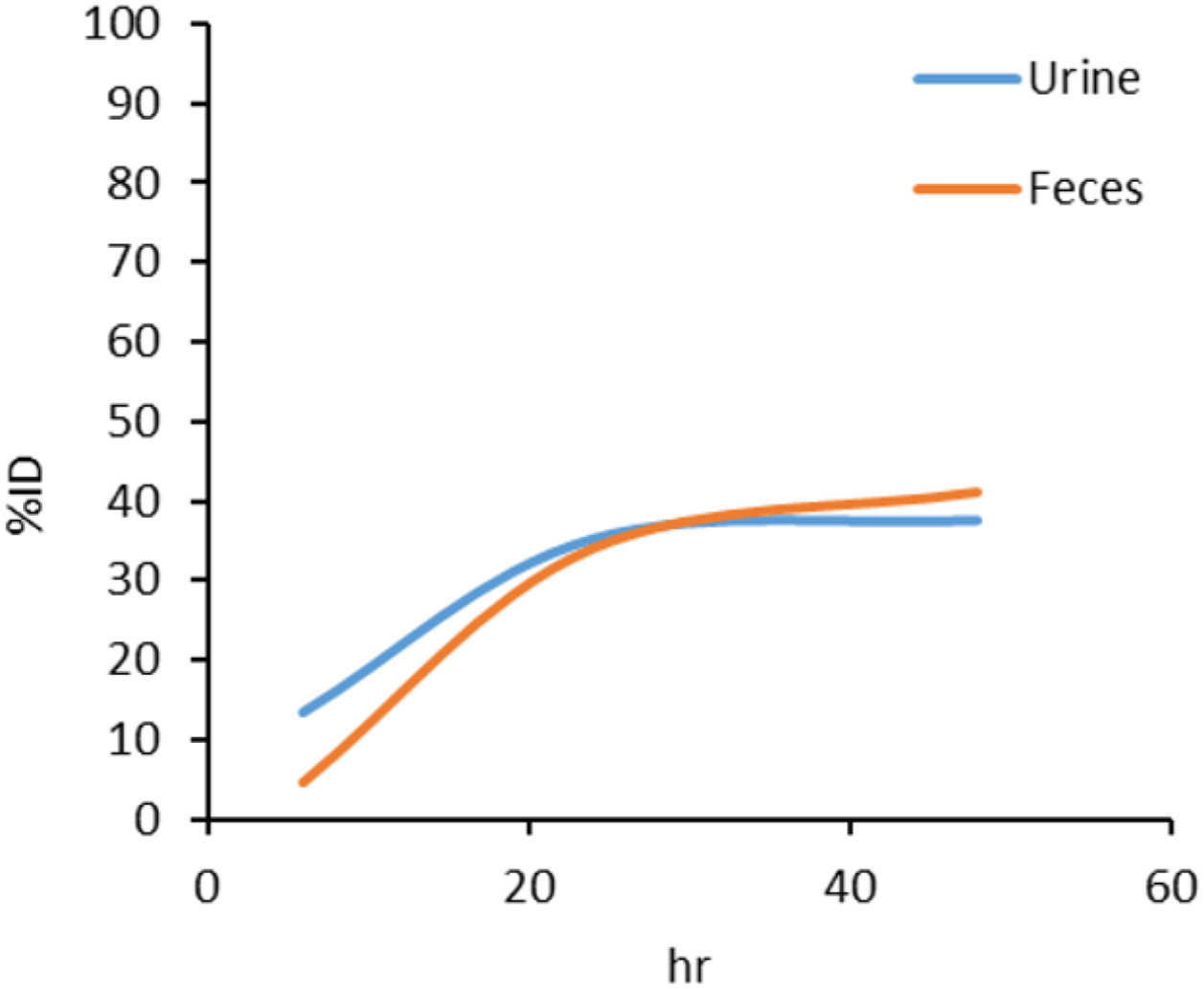
Table 6과 같이 테크네키티 주사액(Tc-99m) 약물이 48시간(2일)까지 뇨와 변을 통하여 배설된 총량은 주입된 양의 78.80%로 뇨로 37.70%(총 배설량의 47.84%), 변으로 41.10%(총 배설량의 52.16%)가 배설되었음을 확인하였다. 48시간 관찰기간 동안 주입된 양의 약 78.80%가 생체 내에서 배설되었으며, 총 배설량의 87.92%(주입된 양의 69.28%)가 주사 후 24시간 이내에 배설됨을 확인하였다(Table 6, Fig. 5).
Table 6.
Average value of urine and fecal excretion (%ID) over time
|
Excretion |
Mean (%) |
|
8 hr |
24 hr |
48 hr |
SUM |
|
Urine |
13.340 |
21.949 |
2.412 |
35.289 |
|
Feces |
4.607 |
29.384 |
7.108 |
33.990 |
|
SUM |
17.947 |
51.333 |
9.521 |
78.801 |
Download Excel Table
DISCUSSION
테크네튬-99m의 갑상선 스캔은 고양이의 갑상선기능항진증을 진단하고 병기를 설정하기 위한 표준 진단법으로 사용된다[10]. 본 연구에서는 이러한 테크네튬-99m을 단일 활성성분으로 하여 고양이 갑상선기능항진증 진단제로 개발되고 있는 테크네키티 주사액(Tc-99m)의 약리학적 특성을 FRTL-5 갑상선 세포와 랫드를 이용하여 시험하였다.
테크네튬-99m은 요오드(iodide)와 이온 크기와 전하가 유사하여 체내에서 유사한 생물학적 분포 양상을 보인다[7, 16]. 체내에서 요오드는 갑상선 소포 세포의 요오드 펌프에 의하여 선택적으로 섭취된다. 요오드 펌프는 갑상선 소포 세포의 세포막에 발현되는 세포막단백질이며, 이 단백질은 ATP를 사용하여 2개의 나트륨 이온과 1개의 요오드 이온을 갑상선 소포 세포 안으로 능동 수송한다. 이러한 기전으로 갑상선 소포 세포에 선택적으로 섭취된 요오드는 갑상선 소포로 운반되어 저장되며, 테크네튬-99m은 요오드와 마찬가지로 요오드 펌프에 의하여 갑상선 소포 세포 내로 포획되어 농축된다[17–20]. 갑상선기능항진증에 이환된 고양이에서는 갑상선 대사가 증가함에 따라 테크네튬-99m의 섭취량이 증가한다. 이에 따라 갑상선 스캔으로 확인하였을 때 갑상선의 테크네튬-99m 섭취율이 증가하는 경우에는 고양이 갑상선기능항진증의 진단이 가능하다[11, 12, 14]. 수많은 임상시험 보고를 통하여 테크네튬-99m이 갑상선에 농축되는 비율은 혈청 T4 농도와 유의미한 상관관계가 있음이 확인되며, 특히 갑상선과 침샘의 테크네튬-99m 섭취율 비를 이용한 갑상선기능항진증 진단 효과가 검증되어 일반적으로 사용된다[6–8, 10, 14, 21–26].
테크네키티 주사액(Tc-99m)은 과테크네튬산나트륨 구조의 테크네튬-99m 용액을 단일 유효성분으로 가지며, 대한약전의 과테크네튬산나트륨(99mTc) 주사액 및 미국약전(USP)의 Sodium Pertechnetate Tc 99m Injection 기준으로 제조된다. 따라서 해외에서 고양이 갑상선기능항진증 진단에 사용되고 있는 테크네튬-99m과 동일하며, 테크네키티 주사액(Tc-99m)의 작용기전 및 효력은 기존 보고된 테크네튬-99m의 고양이 갑상선기능항진증에 대한 작용기전 및 효력과 같다.
타 장기인 간세포에 비하여 갑상선 세포에서 테크네키티 주사액(Tc-99m)의 세포 섭취율은 6배 이상으로 유의적으로 높은 수치를 보였다. 또한, 요오드와 경쟁 반응하였을 때 갑상선 세포에서 테크네키티 주사액(Tc-99m)의 세포 섭취율은 61.8% 수준으로 유의적인 감소를 보였다. 테크네튬-99m을 이용한 고양이 갑상선기능항진증 진단에 대하여 보고된 문헌과 같이, 테크네키티 주사액(Tc-99m)은 요오드와 동일하게 갑상선 소포 세포의 세포막에 발현되는 요오드 펌프에 의한 선택적인 능동수송을 통하여 갑상선에 섭취되고 저장되는 작용 기전을 가진다는 것이 확인되었다. 또한, 시험에 사용된 테크네키티 주사액(Tc-99m)은 주피크 0.141 MeV를 방출하는 테크네튬-99m을 주성분으로 하며, 방사화학적 순도 또한 95% 이상으로써 일반적으로 방사성의약품에 요구되는 품질 기준을 만족하는 것이 확인되었다. 갑상선에 섭취된 테크네키티 주사액(Tc-99m)의 단일 유효성분인 테크네튬-99m은 0.141 MeV의 감마 방사선을 물리적으로 방출하므로, 감마 카메라를 이용한 갑상선 스캔이 가능하다.
테크네튬-99m은 갑상선기능항진증의 진단에 수십 년 간 사용되고 있어, 기존의 많은 문헌 보고를 통하여 체내에서 테크네튬-99m의 흡수, 분포, 대사, 배설 특성이 검증되어 있다.
테크네키티 주사액(Tc-99m)은 정맥으로 투여된 직후(5분 이내) 빠르게 전신으로 퍼져나가며, 주로 갑상선 소포 세포 내로 포획되어 농축된다. 그 밖에 요오드 펌프가 발현되어 있는 침샘, 위점막 등에도 일시적으로 농축되며, 변화 없이 방출된다[7, 16, 19, 20]. 투여 직후 혈액에서 최대 분포를 보이다, 투여 후 2시간에 갑상선, 침샘, 위에서 최고 분포를 보이는 테크네튬-99m의 전형적인 분포 양상을 보였다.
테크네키티 주사액(Tc-99m)의 대사 특성은 다음과 같다. 테크네튬-99m, 즉 과테크테튬산(pertechnetate)은 요오드와 비슷한 생물학적 행동을 모방하는 특성을 가지는 “가짜 할로겐(pseudohalogen)”으로써, 이온의 크기와 전하가 유사하여 요오드 이온과 마찬가지로 갑상선 여포 세포막의 요오드 펌프를 통하여 갑상선 조직에 포획되어 농축된다. 이렇게 갑상선에 섭취된 과테크네튬산은 요오드와는 다르게 티로글로불린(thyroglobulin)의 티로실(tyrosyl) 그룹에 통합되는 티로글로불린 유기화(thyroglobulin organification) 및 갑상선호르몬 생산 과정에 사용되지 않고 농축되며, 변화 없이 혈액으로 배출되어 신장과 소화기관을 통하여 체외로 제거된다[7, 11, 12, 16, 19, 20, 27–29].
또한, 테크네키티 주사액(Tc-99m)은 정맥 투여 후, 48시간까지 주입된 양의 78.80%가 배설되며, 총 배설량의 약 87.92%가 24시간 이내 배설되며, 그중 48%는 뇨로, 52%는 변으로 배설된다. 일반적인 작은 분자량의 배설양상이 주로 뇨이나, 뇨와 변으로의 배설량이 비슷한 것은 시험물질(Tc-99m)이 사구체 여과를 통해 배설되지만 세뇨관에서 부분적으로 재흡수되기 때문으로 판단되며, 이온화된 테크네튬-99m이 위와 대장으로 직접 분비되는 특성으로 인해 변을 통하여 배설된 총량이 높은 것으로 판단된다.
고양이 갑상선기능항진증의 진단에서 테크네튬-99m은 기존의 요오드(I-123, I-131) 대비 여러 장점을 제공한다. 테크네튬-99m은 반감기가 6시간으로 짧아 고양이와 진료자가 받을 수 있는 방사선 피폭이 신속하게 감소되며, 촬영 시간이 1–2시간 이내로 빠르기 때문에 고양이에게 가해지는 스트레스를 최소화할 수 있다. 이와 같이 테크네튬-99m은 진단에 특화된 방사성의약품으로써 고양이 갑상산기능항진증을 진단하는 데 유리하며 임상적 활용성이 높다.
결론적으로 테크네키티 주사액(Tc-99m)은 고양이 갑상선기능항진증 진단과 관련하여 기존 보고된 테크네튬-99m과 동일한 작용기전, 효력, 흡수, 분포, 대사 및 배설 특성을 가진다. 한국에서 동물용의약품의 허가는 농림축산검역본부에서 관리한다. 테크네키티 주사액(Tc-99m)을 동물용 진단제로 허가받기 위해서는 본 연구에서 기술한 약리학적 특성에 추가하여 독성학적 특성의 검증이 필요하며, 이후 임상시험을 통한 안전성과 진단효과에 대한 검증이 필요하다. 향후 본 연구 결과를 기반으로 테크네키티 주사액(Tc-99m)이 동물용 방사성의약품으로 허가되어 한국에서도 임상 진단에 사용될 수 있기를 기대한다.
Acknowledgements
This work was supported by Korea Institute of Planning and Evaluation for Technology in Food, Agriculture, Forestry (IPET) through Companion Animal Life Cycle Industry Technology Development Program, funded by Ministry of Agriculture, Food and Rural Affairs (MAFRA) (322095-04). This study was supported by a grant of the Korea Institute of Radiological and Medical Sciences (KIRAMS), funded by Ministry of Science and ICT (MSIT), Korea (No. 50539-2024).
REFERENCES
Mooney CT, Thoday KL, Nicoll JJ, Doxey DL. Qualitative and quantitative thyroid imaging in feline hyperthyroidism using technetium-99m as pertechnetate. Vet Radiol Ultrasound. 1992; 33:313-320


Peterson ME, Becker DV. Radionuclide thyroid imaging in 135 cats with hyperthyroidism. Vet Radiol. 1984; 25:23-27


Volckaert V, Vandermeulen E, Daminet S, Saunders JH, Peremans K. Hyperthyroidism in cats: part II: scintigraphic diagnosis and radioiodine treatment. Vlaams Diergeneeskd Tijdschr. 2016; 85:265-273


Lim JC, Kim DM, Nam SS, Cho EH, Lee SY, Chung HK, Lee I. Pharmacological properties of the thyrokitty injection (I-131) for the treatment of the feline hyperthyroidism. J Biomed Transl Res. 2022; 23:163-177

Sucupira MS, Camargo EE, Nickoloff EL, Alderson PO, Wagner HN. The role of
99mTc pertechnetate uptake in the evaluation of thyroid function. Int J Nucl Med Biol. 1983; 10:29-33



Ahad F, Ganie SA. Iodine, iodine metabolism and iodine deficiency disorders revisited. Indian J Endocrinol Metab. 2010; 14:13-17

Chung JK. Sodium iodide symporter: its role in nuclear medicine. J Nucl Med. 2002; 43:1188-1200

Feldman EC, Nelson RW. Feline hyperthyroidism (thyrotoxicosis).In In: Feldman EC, Nelson RW, editors.(eds.) Canine and feline endocrinology and reproduction. 3rd ed Philadelphia: W.B. Saunders Company. 2004; p p. 152-218

Beck KA, Hornof WJ, Feldman EC. The normal feline thyroid. Vet Radiol. 1985; 26:35-38


Fischetti AJ, Drost WT, DiBartola SP, Chew DJ, Schenck PA, Meadows C. Effects of methimazole on thyroid gland uptake of
99mTC-pertechnetate in 19 hyperthyroid cats. Vet Radiol Ultrasound. 2005; 46:267-272



Lee Y. Thyroid imaging in 53 cats with hyperthyroidism using technetium-99m as pertechnetate. Korean J Vet Res. 1999; 39:394-397

Henrikson TD, Armbrust LJ, Hoskinson JJ, Milliken GA, Wedekind KJ, Kirk CA, Nachreiner RF. Thyroid to salivary ratios determined by technetium-99
M pertechnetate imaging in thirty-two euthyroid cats. Vet Radiol Ultrasound. 2005; 46:521-523



Lambrechts N, Jordaan MM, Pilloy WJG, Van Heerden J, Clauss RP. Thyroidal radioisotope uptake in euthyroid cats: a comparison between 131I and
99MTcO
4. J S Afr Vet Assoc. 1997; 68:35-39



Socolow EL, Ingbar SH. Metabolism of
99mPertechnetate by the thyroid gland of the rat. Endocrinology. 1967; 80:337-344



Thrall J, Ziessman H. Endocrine system.In In: Thrall J, Ziessman H, editors.(eds.) Nuclear medicine: the requisites. St. Louis: Mosby. 1995; p p. 321-343

Daniel GB, Brawner WR. Thyroid scintigraphy.In In: Daniel GB, Berry CR, editors.(eds.) Textbook of veterinary nuclear medicine. 2nd ed Chapel Hill: American College of Veterinary Radiology. 2006; p p. 181-198