서론
영장류란 생물 분류학적으로 영장목에 속하는 포유류로 원시원숭이, 신세계원숭이, 구세계원숭이, 유인원을 포함하고 있으며 인간도 영장류에 속한다. 학계에서 통칭하는 영장류는 보통 비인간 영장류(non-human primate)를 지칭하는데 그 중에서도 마카크속(Macaca) 원숭이가 대표적이다. 마카크속 원숭이는 구세계원숭이의 일종으로 필리핀원숭이(cynomolgus monkey, Macacafascicularis)와 붉은털원숭이(rhesus monkey, Macacamulatta)가 생명공학 연구분야에서 가장 광범위하게 사용되고 있으며 전 세계적으로 수입 및 수출량이 가장 많은 종이다[1].
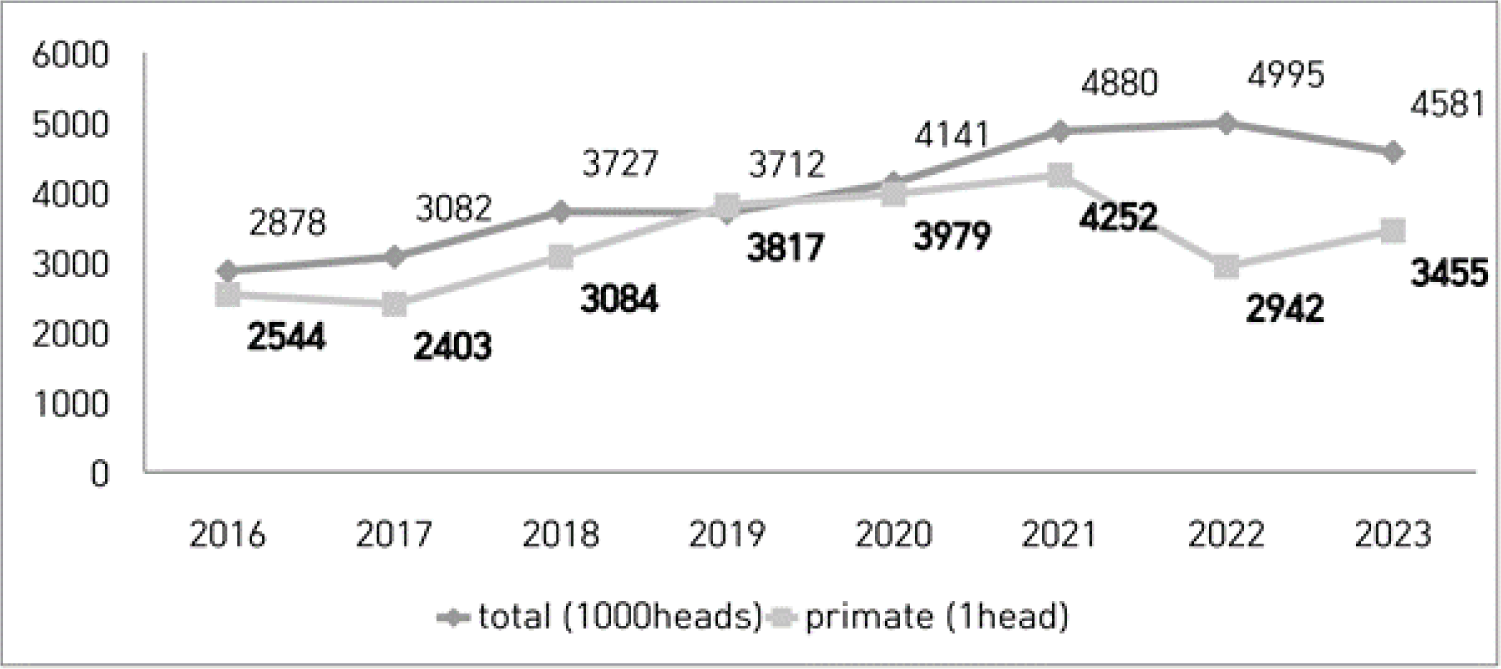
그 다음으로 많이 사용되는 영장류는 신세계원숭이에 속하는 다람쥐원숭이(common squirrel monkey)와 마모셋(marmoset)이다. 마카크원숭이보다 인간과 진화적 관계가 다소 멀다는 것이 단점이지만 크기가 작기 때문에 사육 시설 등 취급이 용이하고, 번식 주기가 짧고 산자수가 많아 개체수 확보에 유리하다는 장점이 있다. 코로나 팬데믹 기간 동안 신속한 코로나 백신 및 치료제 개발을 위해 영장류 연구에 대한 필요성이 크게 증가하여 영장류 수요가 급증하였으며 이로 인하여 영장류 부족 현상이 일어났다. 국내에서의 영장류 사용 두수는 코로나 시기에 그 필요성에 의하여 2021년 4,252두로 최고점을 찍고 2023년에는 3,455두로 감소하였다(Fig. 1). 전 세계 영장류의 80%–90%를 공급하고 있는 중국이 2020년 야생동물 수출 금지 조치를 발표하며 수급에 큰 타격이 발생했고, 이로 인해 영장류 자원 관리에 대한 중요성이 더 커지고 있다. 영장류 자원의 공급난과 코로나 팬데믹의 영향으로 실험용 영장류 중 필리핀원숭이의 한 마리당 가격은 2019년 대비 2022년에 4배가 되었다[2]. 실험용 영장류의 수요와 공급의 불균형이 지속됨에 따라 선진국들에서 실험용 영장류 자원을 무기화하려는 움직임이 나타나고 있다. 이에 대응하기 위해 체계적인 영장류 자원 관리 및 질병 예방 시스템이 필요한 상황이다.
영장류 시설 내에서의 검역 과정은 동물 감염 방지뿐만 아니라 작업자 인간 건강을 보호하는 중요한 과정이다. 영장류의 타액이나 비말에 의해 주요 병원체의 전파 및 질병 감염 우려가 있기 때문에, 출입자들은 이중 삼중의 소독 절차를 거쳐 수술 장갑과 보안경, 마스크 등 개인보호장비를 착용해야만 한다. 또한, 실험실에서 사용한 물건 등에 대한 소독 및 폐기물 관리를 철저히 해야 한다. 영장류 수입위생조건에 따른 농림축산식품부 고시에 기재된 B형 간염, 결핵, 내부 및 외부 기생충, 기타 세균성 병원체가 법적으로 관리되고 있는 감염병이다[3].
세계동물보건기구(World Organization for Animal Health, WOAH)에 따르면, 현재 인간 감염병의 60%가 인수공통감염병이며, 에볼라, HIV(human immunodeficiency virus), 인플루엔자와 같이 최근 전 세계적으로 팬데믹한 이슈로 떠오르고 있는 인간 감염병의 최소 75%는 동물유래 감염병이고, 잠재적 생물테러물질의 80%가 동물 매개 병원체에 의한 것이다[4]. 이러한 인수공통전염병에 대한 선제적이고 신속한 대응을 위한 효과적인 과학적 연구를 위해서는 충분한 영장류 자원의 선제적 확보가 필수적이며, 이를 위해 국내 및 해외의 영장류 활용 연구기관들의 효과적인 영장류 자원 관리를 위한 다양한 검역 현황 및 주요 감염병에 대한 조사가 필요하다. 이는 향후 국내 영장류 활용 연구의 국가적인 영장류 자원 확보 계획의 기초자료로 활용될 수 있다.
본 연구는 학술 논문, 영장류 관련 전공 서적, 정부 기관 공식 자료(농림축산식품부, 식품의약품안전처), 언론 기사 등 여러 경로의 문헌 자료를 분석하여 작성하였다. 국내뿐만 아니라 미국 Centers for Disease Control and Prevention, 호주 DAFF(Department of Agriculture, Fisheries and Forestry), 영국 Department for Environment, Food & Rural Affairs 등 해외 검역 관련 기관 및 세계동물보건기구의 홈페이지에서 자료를 수집하였다.
영장류 국내 도입 절차
영장류 국내 검역 절차를 Fig. 2와 같이 정리하였으며 이는 국가영장류센터의 SOP(standard operating procedure)를 참조하였다.
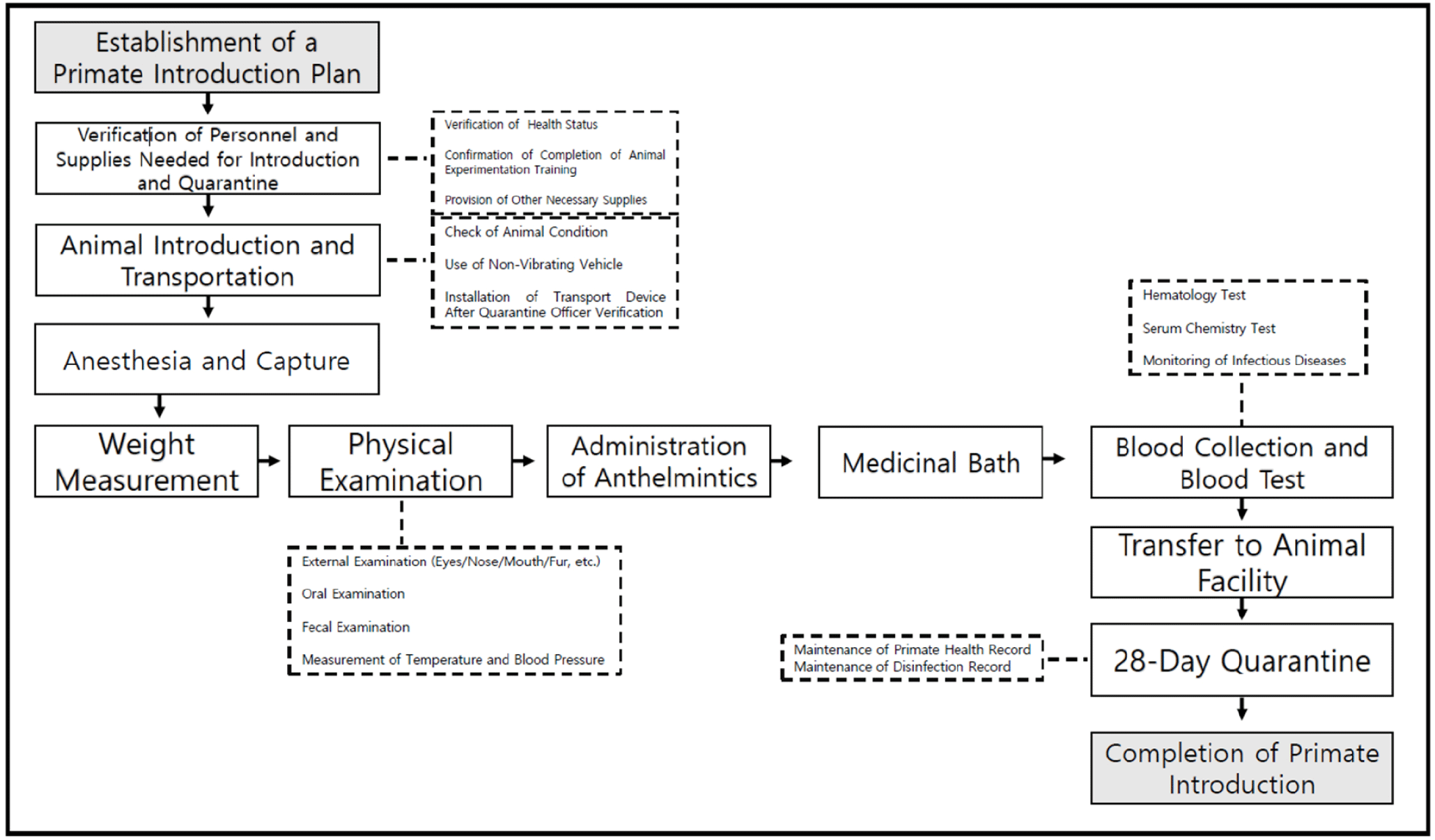
영장류의 도입 및 검역을 성공적으로 수행하기 위해서는 사전에 동물을 직접 접촉하는 수의사, 사육사 등 주요 인원에 대한 건강 검진사항이 필요하다. 사람에 의한 영장류 감염을 방지하고자 연 1회 종합 건강검진을 통한 결핵 등 주요 인수공통감염병, 검사를 수행하여 음성 여부를 반드시 확인해야 한다. 「동물보호법」, 「실험동물에 관한 법률」 및 「실험동물의 관리와 사용에 관한 규정」에 의거한 동물실험 참여자에 대한 법정의무교육의 일환의 동물실험 연구자 교육을 필수적으로 이수해야 한다. 최종적으로 주요 감염병 음성이 확인된 인원만 멸균복 및 보호장구 착용 여부를 점검한 후 도입 및 검역 작업을 진행한다.
동물의 도입 및 수송에 관해서는, 공항이나 항구에 도착한 후 「가축전염병 예방법」 제 36조에 따라 동물검역기관의 장에게 검역을 신청하고 검역관의 검역을 받아야 한다. 영장류의 수송 스트레스를 완화하기 위해 온도, 환기 등 환경조건이 적절하게 유지되는 수송수단을 이용하여 운송한다. 검역관의 확인 후 타소장치를 설치하고, 검역 시행 장소로 동물을 수송한다. 도착 시 검역관이 추가 확인을 한 후 타소장치를 제거하고 일련의 검역 과정을 수행한다.
마취제, 주사기, 손상성 폐기물통, 일반의료 폐기물 통, 포획망, 전등, 공구, 포획용 장갑, 라텍스 장갑, 포획틀, 멸균복, 고글을 준비한다. 포획틀을 사용하여 움직이지 못하게 보정한 뒤 마취제를 근육주사 한다. 영장류의 진정에 사용되는 마취제의 종류로는 ketamine, medetomidine, diazepam, xylazine 등이 알려져 있다. 그 중 ketamine이 영장류의 보정을 목적으로 가장 널리 사용되는데 안전 마진이 넓고 부작용이 적은 약물이기 때문이다. Ketamine를 kg 당 10–15 mg 용량으로 근육 주사한다. 근육 주사 시 효과는 5–10분 이내에 나타나며 효과는 15–30분 정도 지속된다. 근육 주사는 소량의 약물을 주사할 때 가장 선호되는 방법으로 주로 대퇴근 상부에 주사를 하여 신경 손상을 막도록 한다. 체격이 큰 비인간 영장류에서는 삼두근이나 둔부를 주사 부위로 사용할 수 있다[5].
선반, 체중계, 기록지를 준비한다. 마취 포획되어 진정 상태에 있는 비인간 영장류를 영점이 맞춰진 체중계에 올려 체중을 측정한다. 비인간 영장류 중 붉은털원숭이의 평균 체중은 수컷 5.6–10.9 kg, 암컷 4.4–10.7 kg로 알려져 있다[6]. 필리핀원숭이의 평균 체중은 수컷 3.5–8.3 kg, 암컷 2.5–5.7 kg이며 신세계 원숭이에 속하는 마모셋의 평균 체중은 300–360 g이다.
주사기, 구충용 주사제, 알코올 솜, 폐기물 박스를 준비한다. 알코올 솜으로 소독한 대퇴부에 주사기를 삽입 후 구충용 주사제를 근육 주사한다. 주로 사용하는 주사용 구충제로는 ivermectin, praziquantel이 있으며 ivermectin은 체중당 200–300 mcg, praziquantel은 5 mg를 근육 주사한다[7]. Ivermectin의 경우 효과적인 구충 효과를 위해 같은 용량의 주사제를 14일 후에 한 번 더 투여하며 praziquantel은 단회투여가 원칙이다.
준비물로 손전등, 체온계, 핸드 타올, 면봉, 코니컬 튜브, 연고, 폐기물 박스가 필요하다.
신체 검사는 비인간 영장류의 상태를 확인할 수 있는 가장 기본적인 검사이다. 육안상으로 비만, 마름의 여부를 간접적으로 확인할 수 있다. 피모 검사를 통해 피부 질환 여부 및 기생충의 감염 여부를 확인하며 개체의 컨디션을 예측할 수 있다. 눈의 충혈이나 부종, 귀의 염증 및 분비물 상태, 코의 출혈 상태를 확인한다. 손가락 및 발가락의 기형 유무를 검사한다. 이동 중 생긴 상처가 있는지 전신을 꼼꼼하게 확인하며, 문제가 있는 부위는 기록지에 정확한 부위를 기록하여 관리한다. 추가로 항문에서 멸균 면봉으로 채취한 시료를 코니컬 튜브에 담아 수송 및 배양 검사를 진행한다.
준비물로 주사기, EDTA tube, heparin tube, SST(serum separating tube), 탈지면, 손상성 폐기물 통, 진정 약물, 아이스박스, 혈액 롤러, 알코올 스프레이, 폐기물 박스가 필요하다[8]. 비인간 영장류 중 붉은털원숭이의 대략적인 순환 혈액은 1 kg 당 44–67 mL이며 정상 성인 수컷의 총 혈액량은 420–770 mL, 암컷의 경우 280–630 mL이다[9].
최소한으로 부작용으로 순환 혈액량의 최대 10%를 한번에 채혈할 수 있는데 회복에 3–4주의 시간 간격이 필요하다. 간격이 짧을수록 단 회 채혈할 수 있는 혈액량이 줄어든다. 성인 비인간 영장류의 최대 허용 채혈량은 한 번에 10 mL/kg이며, 4개월 미만의 경우는 6 mL/kg이다. 최대 채혈량은 헤마토크릿 및 헤모글로빈, 건강 상태, 나이, 생리 주기 등에 따라 다르다. 나이 든 동물, 스트레스를 받은 동물, 자연적 또는 실험적으로 질병이 있는 동물 또는 생리 주기에 있는 암컷의 경우엔 최대 허용 채혈량을 견디기 어렵다[10].
혈구 검사 항목으로는 WBC, neutrophils, lymphocytes, monocytes, eosinophils, basophils, RBC, hemoglobin, hematocrit, mean corpuscular volume, mean corpuscular hemoglobin, mean corpuscular hemoglobin concentration, platelet count, mean platelet volume이 있다.
혈청화학 검사 항목으로는 AST(aspartate aminotransferase), ALT(alanine aminotransferase), ALP(alkaline phosphatase), BUN(blood urea nitrogen), creatinine, total cholesterol, albumin, total protein, triglycerides, total bilirubin, IP(inorganic phosphorus), calcium, GGT(gamma-glutamyl transferase), LDH(lactate dehydrogenase), DBIL(direct bilirubin)이 있다[11, 12].
국내 연구기관에서의 영장류 검역 절차
대한민국으로 수입되는 영장류의 수출국 내에는 에볼라 출혈열, 마버그 출혈열 발생이 없어야 한다. 생산 사육한 시설에서는 수출 전 최소 24개월간 홍역, A형 간염, B형 간염, 원숭이 두창 및 결핵이 임상적, 혈청학적, 병리학적으로 발생한 적이 없고, 동 질병에 대한 예방 접종을 실시하지 않아야 한다. 영장류는 수출국의 검역 시설에서 수출 전 최소 30일간 검역을 받아야 하며, 그 기간동안 수출국 정부수의관이 개체별로 검사시료를 채취하여 질병별 검사 방법 및 기준에 의한 검사를 받고 그 결과가 음성이어야 한다. 2016년 농림축산식품부 고시인 영장류 수입위생조건에 따른 검사 대상 질병명은 B형 간염, 결핵, 내부 및 외부기생충, 기타 세균성 병원체이다[3].
B형 간염은 gibbons, great apes에서 검역 시작 1주 이내 최소 1회 검사를 실시한다. 검사 방법은 anti-hepatitis B core 항원 및 hepatitis B 표면항원을 사용한 혈청학적 검사이다.
결핵은 모든 종에서 실시하며 검역 시작 1주 이내 최소 1회 피부검사를 통해 진행한다.
내부 및 외부기생충 또한 모든 종에서 실시한다. 검역초기와 검역 종료에 가까울 때 최소 2회 동물종 및 기생충체에 대한 적절한 방법에 의한 검사 및 항기생충제를 투여한다.
기타 세균성 병원체는 검역초기와 첫 번째 검사가 끝나고 최소 1주일 후 실시하며, 분변배양검사, 신선분변 또는 직장 swap을 즉시 배양 또는 운송배지에 즉시 존치하는 방식으로 검사를 수행한다.
국외 영장류 연구기관에서의 영장류 검역 절차
영장류 검역은 동물의 이동과 수입을 관리하고, 전염성 질병의 전파를 예방하기 위해 중요한 역할을 한다. 검역 과정에서 동물의 건강 상태를 확인하고, 질병의 확산을 통제하는 것에 초점을 맞추고 있다. 이를 위해 영장류 동물의 수입 전 검사, 격리 기간 설정, 백신 접종, 건강 증명서 발급 등의 절차를 수행하며, 수입 절차는 국가별·기관별로 약간의 차이가 있다.
미국은 Centers for Disease Control and Prevention의 Global Migration and Quarantine 부서에서 영장류 수입에 관한 규정을 제정하고 시행 및 관리하고 있다[13]. 미국의 규정상 비인간 영장류(non-human primate)는 어떠한 경우에도 애완동물로 수입될 수 없는데 이는 원숭이에서 인간으로 전파될 수 있는 심각한 감염으로부터 미국 영내 거주인을 보호하기 위한 조치이다. 영장류의 수입은 과학적, 교육적, 전시 목적으로만 가능하며 에볼라 출혈열, B바이러스 감염증, 원숭이 두창, 위장질환(살모넬라증, 이질, 캠필로박터증), 황열, 원숭이 면역결핍 바이러스 감염, 결핵 등이 주요 검역 대상 질병이다.
유럽은 영국, 프랑스, 독일, 네덜란드, 이탈리아 등 EU 전역에서 8개의 영장류 시설을 보유 중이다. 대표적으로 영국에서의 영장류 수입은 DEFRA(Department for Environment, Food and Rural Affairs) 부서의 Balai rule로 관리되고 있다[14]. Balai rule은 영장류와 관련된 연구 및 보존 활동에 적용되는 규정으로 영국 과학자들이 영장류를 이용한 연구를 수행할 때 윤리적 기준을 준수하도록 하는 원칙을 포함하고 있다. 인도네시아 발리에서 열린 국제회의에서 이 규정이 채택되었기에 붙여진 이름이다. 또한, 영국에서의 영장류 수입시 건강 증명서가 첨부되어 있어야 한다. 추가로 광견병법 개정에 따라 모든 영장류는 영국 도착 후 DEFRA 승인 검역 시설에서 4개월 동안 격리되어야 한다.
호주에서의 영장류 수출입 절차는 DAFF에서 관리하고 있다. 호주로의 영장류 수입 시 수출 국가 수의 당국으로부터 권한을 부여받은 수의사의 적절한 인증 절차가 필요하다. 수의사는 검사를 위한 시료를 직접 채취했음과 검사가 수출 국가의 수의당국이 인정하는 모니터링 시설에서 수행되었음을 보증해야 한다. 또한, 영장류에서 감염성 또는 전염성 질병의 증거가 없음을 확인해야 한다[15].
비인간 영장류 도입 절차의 시작인 계획 수립부터 검역 과정 및 동물실 도입까지의 전단계를 정리하여 분석하였을 때, 우리나라 외 다른 국가들의 비인간 영장류 수출입 절차의 기본적인 구조는 큰 차이를 보이지 않았다. 검역 기간 모두 30일 전후로 유사하였으나 법적 요구사항, 서류 양식, 검역 주관 기관 등 세부적인 부분에서 일부의 차이가 있음을 확인하였다. 위 결과를 토대로 감염성 질병의 전파 방지 및 검역 관리 방법을 개선시킬 수 있는 방안을 마련할 수 있을 것으로 기대된다.
영장류 주요 감염성 질병
결핵을 일으키는 원인이 되는 세균은 Mycobacteriumtuberculosis이다. 호기성의 간균이며, 산에 대한 저항성이 강하기 때문에 항산균으로 분류된다. 크기는 0.2–0.6 × 1.0 μm 정도이다. 배양을 위해서 산소가 필요하며, 세포벽의 지방질의 함유량이 높아 항산성 염색이 사용된다. 주로 기침이나 재채기를 통한 호흡기 감염으로 전파될 수 있으며 자외선, 열, 살균제 등에 의해 파괴된다[16]. M. tuberculosis는 생물안전 3등급(biosafety level 3) 병원체로 음압을 통한 공기 흐름이 조절되어 있는 시설에서 다룰 수 있다[17].
주로 호흡기에서 나오는 비말을 통해 감염된다. M. tuberculosis가 폐에 침입해서 폐포대식세포(alveolar macrophage)의 작용을 무력화한다. 결핵균은 폐포대식세포에서 포식작용을 하기 위해 형성하는 포식소체(phagosome)와 리소좀의 결합을 막는 방식으로 대식세포 작용을 무력화한 후, 무력화된 폐포대식세포 안에서 증식한다[16].
결핵은 구세계원숭이 및 신세계원숭이 그리고 유인원에서 모두 발생한다. 일부 종은 질병에 다소 취약한 점이 있는 등 종간 차이가 있지만 모든 영장류는 결핵에 걸릴 수 있다. 일반적으로 구세계원숭이는 신세계원숭이와 유인원보다 결핵에 더 민감한 것으로 알려져 있다. 일반적으로 임상 증상은 질병이 일정 수준 이상 진행될 때까지 미미하거나 나타나지 않는다. 임상 증상이 있는 경우의 주요 증상은 비특이적이며 쇠약, 마비, 식욕 부진, 체중감소, 기침 등이 있다. 폐 외 결핵 중 척추 결핵은 하반신 마비, 뇌 결핵은 간질성 발작을 일으키며, 장 결핵은 심한 설사로 이어진다. 결핵에 걸린 동물은 정상적 혈구성, 정상 색소성 빈혈이 나타날 수 있다.
붉은털원숭이에서 결핵은 일반적으로 폐병변으로 나타난다. 붉은털원숭이는 급성 및 진행성 형태의 결핵에 걸릴 수 있다[18]. 반면, 필리핀원숭이는 결핵에 더 저항력이 있는 것으로 보이며, 인간의 잠복감염 형태와 유사한 무증상 형태의 감염으로 존재한다. 간헐적인 기침과 만성 체중 감소는 질병 감염 가능성의 지표가 된다.
흉부 방사선 사진을 사용하여 흉부의 이상을 감지할 수 있다. 결핵의 병변은 폐의 모든 부위에서 나타날 수 있으며 크기, 모양, 밀도가 다를 수 있다. 흉부 방사선 사진은 폐 질환을 확인할 수 있지만 결핵과 노카르디아증, 아스페리길루스증과 같은 폐의 육아종성 질환을 감별 진단할 수 없기 때문에 결핵 스크리닝을 위한 검사 절차로 사용할 수 있다.
피내 투베르쿨린 피부 검사는 MOT(mammalian old tuberculin) 또는 PPD(purified protein derivates)를 사용한다. 투베르쿨린은 눈꺼풀 가장자리 근처에 주로 주사된다. 검사 방법은 Mycobacterium 항원에 대한 지연된 과민반응을 주사 후 24시간, 48시간, 72시간 뒤에 확인하는 것이다. 주사 후 홍반 및 국소 진피 괴사를 동반한 눈꺼풀의 부종 및 처짐을 관찰할 수 있다[19]. 피내 투베르쿨린 피부 검사는 2–3주 간격으로 반복된다. 이 기간 동안 혈액 검사 및 흉부 엑스레이, PCR, 배양, 결핵균의 항산염색 등 다른 검사를 통해 질병을 확인한다. 양성 반응을 보이는 동물은 일반적으로 안락사를 시행한다[5].
인터페론 감마 검사는 피부 검사에 대한 대안 또는 보충 검사법으로 사용된다. 전혈 샘플에 포함되어 있는 림프구에 의한 인터페론-감마 생성 측정을 통해 항원에 대한 세포 반응성을 감지하는 검사 방법이다. 피부 검사와 비교하여 인터페론 감마 검사는 민감도(sensitivity)가 낮고 특이도(specificity)가 높기 때문에 두 검사의 조합을 통해 전반적인 민감도와 특이도를 증가시킬 수 있다.
결핵 검사의 gold standard는 배양이다. 간접 검사의 양성 결과는 검체의 세균 배양으로 확진한다. 배양 기간은 최소 8주 이상 진행되어야 하는데 이유는 M. tuberculosis complex 감염이 동시에 발생할 수 있으므로 교차 반응에 의한 위양성이 나올 수 있기 때문이다. 배양 외에 PCR을 통한 진단이 있는데 마이코박테리아 DNA 검출에 사용할 수 있으며 기존의 배양 방법보다 진단이 훨씬 빠르다는 장점이 있다[20].
의심 개체의 신속한 격리 및 분리가 이루어져야 한다. 이환 개체의 사육을 위해서는 생물안전 3등급 조건이 필요하다. 비인간영장류의 치료에는 최소 9–12개월, 최대 30개월의 rifampicin, ethanmbutol, streptomycin 및 isoniazid의 복합 약물 요법이 사용된다. 두 가지 이상의 약물을 사용하는 다제요법은 항생제 내성을 발생할 수 있어서 주의해야 한다[21].
원숭이두창 바이러스(monkypox virus)는 Poxiviridae과에 속하는 Orthopoxvirus속의 이중가닥의 DNA 바이러스이다. 벽돌 모양의 형태를 가진 외피를 지니고 있으며, 바이러스 입자의 크기는 약 200 nm의 너비와 250 nm의 길이를 가지고 있다.
원숭이 두창 바이러스는 인수공통감염병으로 감염된 사람, 감염된 동물(쥐, 다람쥐, 설치류 및 원숭이 등) 또는 오염된 물질에 접촉할 경우 감염될 수 있다. 비말 전파도 가능하지만 그 가능성은 낮다. 태반을 통해 감염된 모체에서 태아로 수직 감염도 가능하다[22].
영장류에서의 임상 증상은 종에 따라 다르다. 일반적으로 수포성 발진은 실험적 접종 후 6–7일에 나타난다. 병변은 손, 발, 얼굴에서 주로 관찰할 수 있다[23]. 오한, 림프절 부종, 피로, 근육통, 두통 등이 나타나는 증상 초기는 감기와 유사한 면을 보일 수 있다. 일반적으로 유인원, 비인간 영장류, 아프리카 녹색원숭이에서는 치명적이지 않은 감염병이다. 다람쥐원숭이(common squirrel monkey, Saimirisciureus), 비단마모셋(common marmoset, Callithrixjacchus), 솜털머리타마린(cotton-top tamarin, Saguinusoedipus) 종에서 두창 바이러스의 자연 발생 감염이 보고되어 있다[24].
사람의 경우 대부분 2–4주 후 자연 치유되며, 치명률은 1% 미만이나 면역저하자, 8세 미만 소아, 습진 병력, 임신 및 모유 수유자에서는 중증도가 더 높다[23].
특유의 피부 병변이 원숭이 두창 감염을 시사한다. 피부병변액, 피부병변조직, 가피 및 혈액 검체 등에서 원숭이두창 바이러스 특이 유전자를 확인하는 유전자 검출 검사를 통해 진단한다. 조직 슬라이드에서 각질형성세포의 부종과 큰 호산성 세포질 내 포함체를 관찰할 수 있으며 이는 보조적인 진단 방법으로 사용된다[24–25].
사람의 경우 진단 검사 결과가 양성인 경우, 격리 입원하여 증상에 따른 대증치료를 받게 되며 필요시 tecovirimat와 같은 항바이러스제를 투여하게 된다. 감염된 사람 또는 동물과의 직접적, 간접적 접촉을 피하고 소독을 철저히 함으로써 예방하며 일반인 대상 예방접종은 일반적으로 필요하지 않다. 노출 전 예방 접종은 원숭이두창 바이러스 노출 가능성이 높은 실험실 요원, 치료병상 의료진, 역학조사관 등이다. 노출 후 접종은 확진자와 접촉 강도가 중위험 이상인 노출자가 접종 대상이다[23]. 영장류의 경우도 마찬가지로 대증 요법을 통해 개체의 사망을 막을 수 있다. 대부분의 경우 몇 주 후에 자연적으로 회복되며 동일하거나 관련된 바이러스에 대한 자연 면역이 형성된다[26].
홍역 바이러스(measles virus)는 Paramyxovirus과의 Morbillivirus 속에 속하는 외피를 가진 단일 가닥 RNA 바이러스이며 인간이 숙주이다. 홍역은 유인원, 비인간 영장류, 아프리카 녹색원숭이(african green monkey, Chlorocebussabaeus), 마모셋, 올빼미원숭이(owl monkey, Aotus), 다람쥐원숭이에게 감염을 일으킬 수 있다[24].
홍역은 공기 중 에어로졸로 전파된다. 바이러스는 편도선이나 호흡기를 통해 체내에 들어와 림프절에서 복제된 후, 바이러스혈증이 발생하고 림프조직과 상피 표면으로 퍼진다. 일시적인 면역 억제와 구강 점막의 국소 괴사, 수포성 발진, 간질성 폐렴, 위장관염을 유발하며, 때때로 뇌염이 발생할 수 있다. 세포융합체와 핵내 및 세포질 내 포함체가 현미경적으로 관찰된다[24].
홍역에 이환된 영장류는 무증상일 수도 있으며, 발열, 결막염, 얼굴 홍반, 호흡 곤란, 설사를 동반할 수 있다[27]. 마모셋에서의 홍역은 주로 호흡기 및 점막 감염보다는 위장염이 발생한다.
홍역은 주로 미열, 피부 발진, 호흡 곤란과 같은 특징적인 임상 증상으로 진단한다. 경우에 따라 혈청학적 검사, 바이러스 분리, 면역조직화학, 전자현미경을 통한 진단법이 동원될 수 있다. 원숭이 두창 바이러스, 야바 원숭이 종양 바이러스(Yaba monkey tumor virus), 유인원 수두 바이러스(simian varicella virus)는 유사한 피부 병변을 일으킬 수 있기 때문에 감별진단을 해야 한다. 시겔라, 살모넬라, 캠필로박터 감염증은 마모셋에서 홍역과 유사한 위장염을 일으킬 수 있기 때문에 감별진단이 필요하다[27].
개 홍역(canine distemper) 바이러스의 백신은 붉은털원숭이에서 항체 반응을 유도할 수 있다. 면역 시스템이 반응하여 항체를 생성하므로 개 홍역 바이러스의 백신은 붉은털원숭이 면역 체계를 자극하여 홍역에 대한 방어력을 갖추게 한다[24]. 치료는 대증치료를 시행한다.
원숭이 면역결핍 바이러스(simian immuno-deficiency virus disease, SIV)는 분류상 Retroviridae과에 Lentivirus속에 속하며 다양한 종의 구세계 비인간류 영장류에 감염된다. 영장류에서 원숭이 면역결핍 바이러스(SIV) 유래 질환은 인간에서 인간 면역결핍 바이러스(HIV) 유래 질환과 큰 유사성이 있어서 감염 연구에 매우 중요한 모델이 된다.
원숭이 면역결핍 바이러스는 주로 네 가지 경로를 통해 전파된다. 첫째, 어미에서 태아로의 수직 감염이 있다. 둘째, 감염된 원숭이와의 성 접촉을 통해 바이러스가 퍼질 수 있다. 셋째, 싸움이나 상처 등을 통해 감염된 혈액이 접촉하면서 전파될 수 있다. 마지막으로 실험실 환경에서 주사기나 기구를 통한 감염이 일어날 수 있으며 이러한 전파 경로들을 통해 원숭이 면역결핍 바이러스가 집단 내에 확산될 수 있다.
원숭이 면역결핍 바이러스(SIV)에 이환된 영장류는 여러 형태로 증상이 발현될 수 있다. 우선, 사람에서의 후천성면역결핍증후군(AIDS) 환자의 뇌병증과 유사한 특징적인 뇌수막염이 나타날 수도 있으며 만성 설사는 가장 흔하게 나타나는 임상 증상이다. 원인으로 Cryptosporidiumparvum, Entamoeba spp., Enterocytozoonbienusi와 같은 균의 기회 감염이 원인일 수 있지만 가능성은 적고 주로 사람에서의 경우처럼 직접적으로 장병증을 유발하는 경우가 대부분이다.
그 외 많은 전신 바이러스 감염과 마찬가지로 파종성 피부 발진이 나타나기도 한다. 일반적으로 바이러스 접종 후 1–2주 이내에 몸통, 사타구니, 허벅지 안쪽, 얼굴에서 발생한다[28, 29].
아시아원숭이는 아프리카 종 원숭이 또는 그들의 조직과 직접 접촉하지 않는 것으로 감염을 예방한다. 숙주에 적응한 풍토병 원숭이 면역결핍 바이러스(SIV) 균주가 더 큰 문제가 된다. 자연 감염 후 일반적으로 혈청 변환이 되는 아시아 마카크와 달리 아프리카 종은 혈청 전환이 아닌 바이러스를 품고 있을 수 있으므로 유의해야 한다[17].
살모넬라(salmonella, Salmonella Enterica)는 그람음성, 통성 혐기성, 비포자 형성, 막대 모양의 세균으로 편모를 통한 운동성이 있다. 인간, 포유류, 파충류, 조류 등에 감염을 일으키는 병원균이며, 생화학적, 혈청학적 차이에 의해 다양하게 분류된다.
살모넬라 감염증은 주로 대변-구강 경로(oral-fecal route)를 통해 전파된다. 그 외 감염은 오염된 음식, 물 또는 매개물 섭취로 인해 발생할 수 있으며, 드물긴 하지만 공기 감염도 가능하다. 곤충은 기계적 벡터의 역할을 한다. 살모넬라는 환경에서 비교적 오랜 기간 동안 생존하고 증식할 수 있다.
붉은털원숭이에 살모넬라 타이피뮤리움을 실험적으로 구강 접종하였을 때 80%에서 설사가 발생했으며 그 강도는 접종 후 48–72시간에서 최고 농도를 나타냈다. 이환된 개체의 공장에서는 융모 단축, 융모 부종, 장샘의 경미한 신장(mild elongation of intestinal gland), 술잔 세포의 점액함량 감소, 상피의 단핵 세포 증가와 같은 경미한 변화가 관찰되었다. 회장과 결장의 변화는 더 심했고, 설사의 중증도와 양상이 일치했다. 심각한 설사를 보이는 영장류의 회장은 융모가 납작하게 변한 모습이 관찰된다[5]. 1964년–1967년에 수입된 5,076두의 영장류를 확인한 연구에 따르면 개체의 12%가 살모넬라균에 이환된 상태였다고 한다[30].
살모넬라증의 진단은 직장 스왑, 분변, 병변 부위의 시료를 활용한 원인균 분리로 진행된다. 최적의 방법으로는 신선한 1–2 g의 분변을 배지에 넣고 37도에서 배양시키는 것이다. 가능하면 질병의 급성기에 배양하는 것이 좋으며, 배양 전 이동이 필요할 시 샘플은 냉장 상태가 적절하다. 배양된 세균은 API 20E 또는 PCR 검사를 통해 특정 혈청형을 동정할 수 있다.
살모넬라 감염증의 치료는 설사로 인해 소실된 체액, 전해질 교정과 같은 보조적 처치와 항생제 처치가 요구된다. 심한 설사나 패혈증이 있는 개체는 질병 전파를 막기 위해 항생제 내성 검사를 거친 후 적절한 항생제 치료가 필수적이다. 살모넬라증은 사람으로의 전파 가능성이 있거나 보균 상태를 제거하는 것에 어려움이 있을 시 개체를 도태시킬 수도 있다.
시겔라(shigella)는 그람 음성, 비운동성, 비포자성, 호기성 및 통성 혐기성 세균이다. 살모넬라균과 다르게 환경 저항성이 없어서 자외선, 산성 PH, 높은 온도(55℃ 이상, 1시간)에서 비활성화된다.
시겔라는 비인간 영장류에서 발견되는 가장 흔한 장내 병원체 중 하나이다. 감염은 동일한 그룹 내 영장류 사이의 대변-구강 경로를 통해 이루어지며, 영장류의 그룹간 이동이나 새로운 그룹으로의 감염 개체 유입으로 발생한다.
세균성 이질 감염시 임상 증상으로 대변에서 점액 및 혈액이 관찰된다. 이환된 개체는 활력이 떨어지고 중증도에서 중증 탈수를 동반한 체중감소가 관찰된다. 복통으로 머리를 다리 사이에 두고 등을 구부린 자세로 앞으로 앉는 자세를 취할 수 있으며 얼굴과 목에 부종이 생길 수 있다. 붉은털원숭이에서는 세균성 이질로 인한 치은염, 유산, 공기낭감염증이 발생할 수 있다[31].
세균성 이질의 진단은 직장 스왑 또는 신선한 분변 시료 배양 후 API 20E 같은 생화학적 동정 키트나 PCR을 통해 진단할 수 있다. 환경 저항성이 없기 때문에 시료는 직사광선을 피해야 하며 37도의 호기성 환경 또는 미세호기성 환경에서 24–48시간 배양해야 한다. 주로 사용하는 배지는 맥콘키 한천 배지(MacConkey agar)와 살모넬라-시겔라 한천 배지(Salmonella shigella agar)이다.
치료는 항생제 감수성 검사를 통한 적절한 항생제 처치 및 공격적인 수분 교정 및 전해질 교정을 통해 이루어진다. 급성 사례에서는 집단 내 다른 개체의 병력에 근거하여 경험적으로 항생제를 처방할 수 있다. 시겔라균은 항생제 내성이 빠르게 생기고 많은 종들이 여러 약물에 대한 항생제 내성을 가지고 있는데 일반적으로 enrofloxacin 5 mg/kg의 하루 한 번 투여가 성공적인 치료법으로 알려져 있다[17].
고찰 및 제언
본 논문에서는 영장류와 인간의 건강과 안전을 보호하기 위한 비인간 영장류 검역 절차 및 주요 감염병을 정리하였다. 우리나라뿐만 아니라 미국, 유럽연합, 호주 등 여러 국가의 검역 및 도입 절차를 비교·분석하였으며, 비인간 영장류의 주요 감염성 질병의 원인체, 병인론, 임상증상, 진단, 치료 및 예방법을 나열하였다. 다른 나라의 비인간 영장류 수입 및 수출 절차에 대한 문헌 조사 결과, 기본 구조에서 큰 차이는 발견되지 않았으며 검역 기간은 또한 30일 내외로 유사했다. 다만, 법적 요구사항, 문서 양식, 검역 당국 등의 세부 사항에서 차이가 있음을 확인했다.
각국의 영장류 검역 절차를 종합적으로 분석한 결과를 통해 몇 가지 한계점을 고찰해 보았다. 현재 많은 국가에서 시행되고 있는 비인간 영장류 검역 절차는 주로 수입 시 감염병 예방을 위한 초기 단계에 중점을 두고 있다는 점에서 한계를 보인다. 검사 범위가 제한적이어서 대부분 특정 감염병에만 초점을 맞추고 있으며, 신종 감염성 질병이 발생할 경우 이를 신속히 탐지하고 대응하는 데 어려움이 있다. 더불어, 일부 진단 기법의 민감도와 특이도가 낮아 감염 초기나 잠복기 동안의 진단 정확도가 떨어질 수 있다는 문제가 제기된다. 아울러, 국가별로 영장류 검역 기준 및 절차가 상이하여 국제적으로 일관된 감염병 관리 체계를 구축하는 데 어려움이 발생할 수 있다.
이를 극복하기 위해 영장류 수입 시, 더 많은 감염병을 검사할 수 있는 종합적인 진단 체계가 필요하다. 본문에 소개된 감염성 질병의 진단 방법들은 사용된 검사 기법이나 진단을 제공하는 회사에 따라 민감도(sensitivity) 및 특이도(specificity)에서 상이한 결과를 보일 수 있다. 이러한 차이를 극복하고 진단의 신뢰성을 높이기 위해서는 단일 검사법에 의존하기보다는 상호 보완적인 성격을 가진 두 가지 이상의 검사 방법을 병행하여 적용하는 것이 바람직하다. 이를 통해 각각의 검사 결과를 교차 검증(cross-validation)함으로써, 진단의 정확도(validity, accuracy) 및 신뢰도(reliability)를 한층 더 향상시킬 수 있을 것으로 기대된다. 추가적으로 각국의 영장류 검역 절차를 국제적으로 표준화한 뒤 이를 준수할 수 있는 환경을 마련한다면 신종 질병의 전파를 효과적으로 방지함으로써 비인간 영장류뿐만 아니라 인류의 공중 보건에 긍정적인 영향을 미칠 수 있다. 이는 감염병의 확산을 조기에 차단함으로써 대규모 유행을 예방하고, 의료 시스템의 부담을 경감시키며, 궁극적으로 인구 집단의 전반적인 건강 수준을 향상시키는 데 기여할 것이다. 또한, 국제적인 협력과 대응 체계를 강화함으로써 새로운 병원체로 인한 잠재적 위험을 최소화하고, 공중 보건의 안정성을 더욱 공고히 할 수 있을 것이다.
미국의 경우 총 4단계로 SPF(specific pathogen-free) level을 정의한 기준을 바탕으로 영장류 자원을 유지·관리하여 연구에 사용하고 있다. 미국 NIH 및 국립 영장류센터의 SPF 영장류는 herpes B virus, STLV(simian T-lymphotropic virus), SRV-D(simian retrovirus D) 및 SIV를 SPF 최소 항목 바이러스로 분류하고 있다[32]. 개체가 보유하고 있는 병원체 항목에 따른 사육 시설 분리에 따른 체계를 구축한다면 감염성 질병의 전파 방지 및 검역 관리에 효율성이 높아질 것으로 판단된다.