Introduction
과거로부터 다양한 발효음식의 형태로 섭취되어온 프로바이오틱스는 인체 쪽에서는 그 유용성이 많이 연구가 진행되어 있다[1, 2]. 프로바이오틱스의 체내 유용성은 항균작용, 유해균 억제, 비타민 E, 유기산, 아미노산 등의 소화 및 흡수 개선, 장내 면역반응 증가, 혈중 IgG 수준 조절, 대식세포(macrophage)의 활성과 면역기능 향상 등 다양한 작용이 보고되고 있다[3–6]. 미생물을 프로바이오틱스로 이용하기 위해서는 다양한 기능과 안전성 및 안정성 문제를 고려해야 한다. 프로바이오틱스는 낮은 pH와 담즙산의 존재에서 생존하여 장에 도달할 수 있어야 하며, 체내에 무해하고 부작용이 없어야 한다[7, 8]. 프로바이오틱스의 활용이 동물로 확대되어 돼지, 닭, 소 등 산업동물을 위주로 연구 및 산업화가 활발하게 진행되어 왔으나, 반려동물에 대한 프로바이오틱스 사용에 관한 연구는 상당히 부족한 실정이다[9–11].
최근에 반려동물의 건강과 복지에 긍정적인 영향을 미치는 장내 세균총을 자연적으로 변형시키는 방법에 관심이 증가하고 있다. 반려동물에게 프로바이오틱스를 섭취하도록 하는 것도 가능한 방법 중 하나일 수 있다. L. acidophilus와 같은 Lactobacillus 종은 건강한 개의 소장관 내에서 확인할 수 있으며, 개의 영양과 대변 상태를 크게 개선한 보고가 있다[12]. 성공적인 효과를 나타내기 위해서는 프로바이오틱스의 숙주 특이성을 고려하여 숙주의 장에서 유래한 프로바이오틱스 사용이 중요하다[13]. 기존의 연구에서 개의 장에서 기원한 프로바이오틱스를 분리하고, 특성화하여 개를 위한 프로바이오틱스로 사용될 가능성을 제시하였다[14]. 그러나 반려동물을 위한 프로바이오틱스의 대부분은 개의 소장관 내에서 유래하지 않는다는 문제점을 가지고 있다.
항생제 치료는 감염을 예방하는 데 효과적이지만, 유익균과 병원균의 구별 없이 장내 세균총을 파괴한다. 이러한 항생제에 의한 장내 미생물 군집의 변화는 주요한 건강 문제를 일으킬 수 있다. 미생물 군집에 대한 교란은 “Dysbiosis”라고 알려진 장내 미생물이 균형이 깨져 질병이 초래되는 단계에 이를 수 있다[15]. 이를 치료하기 위해서는 프로바이오틱스의 섭취가 절대적으로 필요하다. 그러나 반려견을 대상으로 한 항생제 치료에 의해 파괴된 미생물 군집에 대한 영향은 잘 규명되지 않았다. 이 연구는 항생제 치료 후 회복 단계에서 개의 건강 상태에 대한 혼합 프로바이오틱스의 영향을 확인하고자 하였다.
따라서 본 연구에서는 개의 분변에서 분리된 Lactobacillus acidophilus HY7032 및 Lactobacillus reuteri HY7506의 유익한 기능을 나타내기 위한 기본적인 프로바이오틱스 특성과 체외 실험을 통해 균주가 말초혈액내 선천성 면역세포를 활성화 시키는지를 나타내는지 평가하였다. 또한, 동물실험을 통해 L. acidophilus HY7032 및 L. reuteri HY7506의 섭취가 항생제 투여된 비글 견의 건강에 미치는 효과 및 피모 상태에 미치는 효능을 평가하였다.
Materials and Methods
균주의 내산성을 측정하기 위해 spectrophotometer (BioTek, Winooski, VT, USA)로 600 nm에서 흡광도를 측정하여 탁도가 0.8로 맞춰질 때까지 de Man-Rogosa-Sharpe(MRS; Merck, Darmstadt, Germany) broth에 배양한 균을 pH가 2, 3, 4, 5로 조절된 MRS broth에 500:1의 비율로 접종하여 하루 동안 배양하였다. 균주의 내담즙성의 측정은 bile salt(Sigma-Aldrich, St. Louis, MO, USA)가 0.05%, 0.1%, 0.2%, 0.4% 첨가된 MRS broth에 균을 500:1의 비율로 접종하여 하룻 동안 배양하였다. 배양 후, 각 배양액을 phosphate-buffered saline(PBS; Sigma-Aldrich)로 단계 희석하고, 100 μL씩 MRS agar에 접종하여 혐기 조건에서 37℃에 36시간 배양하였다. 생균수 측정법에 따라 균수를 측정하여 생존율을 확인하였다. 실험에 사용된 균주인 Lactobacillus acidophilus HY7032 및 Lactobacillus reuteri HY7506은 한국야쿠르트(Yongin, Korea)로부터 제공 받아 MRS broth에서 35℃로 24시간 동안 배양하여 준비하였다.
Agar spot test 방법으로 항균 활성을 시험하였다[16]. MRS broth에 하룻 동안 키운 균 3 μL를 MRS agar(1.5% w/v agar)에 떨어뜨리고, 혐기 조건으로 37℃에서 24시간 동안 배양하였다. 그 후 indicator 균(1.5106 CFU/mL; Salmonella typhimurium, E. coli, Citrobacter freundii, Enterococcus faecium, Staphylococcus aureus, Staphylococcus intermedius, Listeria monocytogenes, Corynebacterium auriscarnis, Bacillus circulans)을 고르게 포함하고 있는 Trypticase soy agar(TSA, 0.8% w/v)를 유산균이 배양된 MRS agar 위에 도말 후, 37℃에 24시간 동안 배양한 후 콜로니를 중심으로 생성된 억제대의 직경을 측정하였다.
호중구의 활성도는 Oxidative burst 실험으로 확인하였다[17]. 개의 전혈과 RPMI1640(Gibco, Waltham, MA, USA) 배양배지를 1:1 비율로 섞은 100 μL 전혈과 MRS broth에서 24시간 배양한 25 μL 생균(live bacteria) 혹은 원심분리(12,000 × g, 10분)하여 생균을 제거한 25 μL 대사산물(metabolite)을 1.5 mL tube에서 잘 섞은 후 30분 동안 처리하였다. 배양배지를 1:1 비율로 섞은 100 μL 전혈에 50 μM phorbol-12-myristate-13-acetate(PMA; Sigma-Aldrich) 25 μL를 넣어주어 10 μM PMA 처리한 군을 양성대조군으로 설정하였다. 형광측정을 위해 30 μg/mL의 농도를 갖는 dihydrorhodamine123(DHR123; Sigma-Aldrich) solution 25 μL를 15분 동안 처리하였다. 원심분리(250 × g, 5분)하여 상층액을 제거하고, pellet을 풀어준 후 red blood cell(RBC) lysis buffer(Thermo Fisher Scientific, Waltham, MA, USA) 1 mL를 넣고 암실에서 7분 동안 반응시켰다. FACS(fluorescence activated cell sorting) buffer(PBS, 1% FBS, 0.1% sodium azide)에 세척한 후 다시 FACS buffer 0.3 mL를 넣고 Flow cytometry(BD Biociences, Franklin Lakes, NJ, USA)로 rhodamine 123의 녹색 형광의 평균 형광 강도(MFI, mean fluorescence intensity)를 측정하였다.
대식세포의 탐식 활성은 FACS를 통해 확인하였다. 1.5 mL tube에 100 μL의 전혈과 100 μL의 생균 혹은 대사산물을 넣고 잘 섞은 후 30분 동안 처리하였다. 그 후 원심분리(200 × g, 5분)하여 상층액을 제거하고 pellet을 풀어주었다. Fluorosphere beads solution(Fluoresbrite carboxy YG 1.0 micron microspheres; Polysciences, Warrington, USA) 100 μL를 넣고 30분 동안 처리하였다. 원심분리(250 × g, 5분) 후 상층액을 제거하고, RBC lysis buffer 1 mL를 넣어 암실에 7분 동안 반응시켰다. FACS buffer로 세척 후 다시 FACS buffer 0.3 mL를 넣고 Flow cytometry로 beads의 MFI를 측정하였다.
건강한 6개월령 암컷 비글 10마리를 실험군(L. acidophilus HY7032 + L. reuteri HY7506, n = 5) 및 대조군(Control, n = 5)으로 설정하였다. 각 군마다 항생제를 투여하기 전을 Baseline으로 설정하였다(Fig. 1). 7일 동안 항생제(Vancomycin 50 mg/마리 및 Polymyxin B 100 KU/마리)를 경구 투여한 후, 실험군에 3주간 L. acidophilus HY7032 및 L. reuteri HY7506을 각각 107 CFU/마리로 PBS에 현탁하여 경구 투여하였다[18]. 대조군에는 동일량의 1차 증류수를 경구 투여하였다. 실험 전 기간 동안 사료와 음수량은 실험군과 대조군 모두에서 동일하게 공급하였다. 매일 개체 상태 및 분변 양상을 기록하고, 매주 채혈 및 분변 채취와 피모 상태를 확인하였다. 본 실험은 건국대학교 동물실험윤리위원회(IACUC)의 심의 및 승인 후 진행되었다(승인 번호: KU17169).
체중측정을 위하여 항생제 투여 시작일부터 일주일 간격으로 유산균 투여 3주뒤까지 총 5회 개체별로 체중계로 체중을 측정하여 기록하였다. Body Condition Scoring (BCS) 측정은 WSAVA(World Small Animal Veterinary Association)에서 제공한 설명과 삽화에 따라 평가하였다. 항생제 투여 시작일부터 일주일 간격으로 유산균 투여 3주뒤까지 총 5회 매주 1인의 같은 관찰자가 BCS를 평가하여 기록하였다. Pain scale과 분변양상은 항생제 투여 시작일부터 매일 낮 1회 Colorado State University의 개 급성 통증 평가법(canine acute pain scale tool)과 Bristol Royal Infirmary에서 개발한 Bristol stool chart를 기준으로 평가 및 기록하였다[19, 20].
유산균 섭취 경과에 따른 실험군과 대조군 간의 피모의 육안상 비교를 위해 사진을 촬영하였다. 항생제 투여시작일부터 일주일 간격으로 확대 디지털 현미경을 이용하여 약 150배 배율로 배쪽 피부와 등쪽 털을 촬영하였다. 촬영한 사진에서 피부 상태와 털에서 비듬의 양을 평가하여 실험군과 대조군을 비교하였다.
유산균 섭취가 털 빠짐에 미치는 영향을 알기 위하여 인위적으로 털의 탈락을 유도하여 탈락되는 털의 개수를 기록 및 평가하였다. 항생제 투여시작일부터 일주일 간격으로 4 cm × 4 cm의 일정한 규격의 테이프로 개체별 등의 정중앙 지점에서 부착 후 떼어내기를 매회 새로운 테이프로 3회 반복하여 각 회차별 탈락한 털의 개수를 기록하였다.
유산균 섭취에 따른 피부 표면의 유수분 변화와 피지의 양을 관찰하기 위하여 유수분 측정기(Sebumeter[CK electronic GmbH, Köln, Germany], Corneometer[CK electronic GmbH])로 피부를 검사하였다. 항생제 투여시작일부터 일주일 간격으로 배쪽 피부의 3 cm × 3 cm 이상의 면적을 제모를 한 뒤 유수분 측정기로 기기 매뉴얼에 따라 개체당 3회 측정하여 기록하였다.
Result
프로바이오틱스를 섭취할 때, 유익한 효과를 나타내기 위해 필수적인 성질인 내산성, 내담즙성을 평가하기 위하여 pH, bile salt 저항성을 측정하였다. pH가 2, 3, 4, 5로 조절된 MRS broth와 bile salt가 0.05%, 0.1%, 0.2%, 0.4% 첨가된 MRS broth에 L. acidophilus HY7032와 L. reuteri HY7506을 각각 하룻 동안 배양하여 생존율을 조사하였다. 두 균주 모두 pH 4 이상에서 강한 내성을 보였고, pH가 감소할수록 생존율은 감소하였다(Table 1). 또한, 두 균주 모두 0.2% bile salt에 대한 내성뿐만 아니라, 0.4% bile salt에서도 내성이 존재하여 생존이 가능하였다. 따라서, 두 균주 모두 pH 4, 0.2% bile salt에 대한 저항성이 존재함을 확인하였다.
병원균의 성장을 억제하여 장내 공생 미생물을 유지하는데 도움을 줄 수 있는 항균활성을 조사하였다. Table 2에 나타난 바와 같이, 두 균주 모두 그람 음성균(Salmonella, E. coli, Citrobacter)과 그람 양성균(Staphylococcus, Listeria, Corynebacterium, Bacillus)에 대한 현저한 억제 영역이 관찰되었다. L. reuteri HY7506의 억제대의 직경이 L. acidophilus HY7032보다 대부분 크게 관찰되었기 때문에, L. reuteri HY7506의 항균능력이 L. acidophilus HY7032보다 더 우수했다.
동물의 면역 상태 기능을 입증하는 중요한 매개 변수인 reactive oxygen species(ROS) 생성 능력을 조사하기 위하여 oxidative burst를 수반하는 호중구의 활성을 조사하였다. 개의 전혈과 생균 또는 대사산물을 섞은 후, ROS와 반응할 때 녹색 형광을 방출하는 DHR 기질을 처리하였다. 호중구의 반응은 녹색 형광의 평균 형광 강도로 입증되었다. 양성대조군(PMA)의 MFI와 생균이나 대사산물을 처리한 MFI를 비교했을 때, PMA보다는 낮은 값을 나타냈지만 유의미하게 MFI를 증가시켰다(Table 3). 상대적으로 생균에서 L. acidophilus HY7032가 L. reuteri HY7506보다 MFI가 높은 것을 확인하였다. High(%)는 MFI가 높은 호중구의 비율로, 생균에서 L. acidophilus HY7032가 57.7%, L. reuteri HY7506이 55.9%를 나타냈다. 대사산물은 생균보다 상대적으로 활성을 덜 높이는 것을 확인하였다
생균 및 대사 산물이 phagocytosis를 수반하는 대식세포의 활성을 향상시키는지 여부를 조사하였다. 개의 전혈과 생균 또는 대사산물을 섞은 후, Fluorosphere beads solution를 처리하여 phagocytosis에 의해 방출된 녹색 형광의 평균 형광 강도를 측정하였다. Phagocytosis를 대조군(beads only)과 비교하였을 때 두 생균은 모두 MFI 및 High(%)을 높이는 것이 관찰되었다(Table 4). 또한, 두 균주의 대사산물도 마찬가지로 MFI를 증가시켰다.
| Strains | Live bacteria | Metabolite | ||
|---|---|---|---|---|
| MFI | High (%) | MFI | High (%) | |
| Beads only | 57.7 ± 12.7 | 8.07 | 57.7 ± 12.7 | 8.07 |
| HY7032 | 206 ± 41.8* | 27.1 | 234 ± 32.3** | 22.7 |
| HY7506 | 260 ± 32.7** | 29.6 | 150 ± 16.3* | 18.7 |
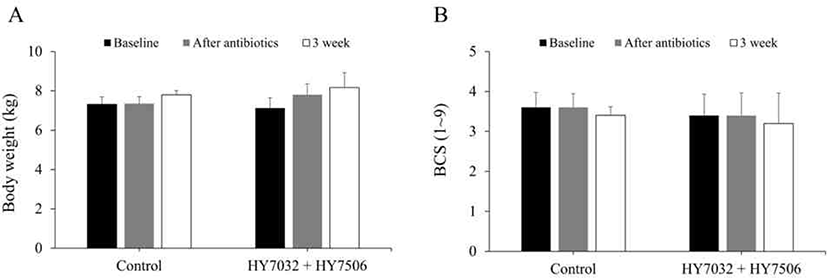
L. acidophilus HY7032 및 L. reuteri HY7506의 섭취가 체중 및 체형에 미치는 영향을 조사하기 위해 유산균 섭취 시작일부터 3주 후까지 평균 체중 및 BCS를 측정하였다. 체중 증가량은 실험군 4.5%, 대조군 6.0%로 대조군의 체중 증가율이 높았으나, 실험종료 시 평균체중은 실험군이 8.16 kg 대조군이 7.8 kg으로 증체율에 대한 유의한 차이가 없었다(Fig. 2A). BCS는 1–9단계로 구분하는 기준을 적용하였으며, 이상적인 체형은 BCS 4로 그보다 마르면 낮은 점수, 살찌면 높은 점수로 판정하였다. 실험군은 매주 평균 3.4–3.6, 대조군은 매주 평균 2.8–3.4로 실험군의 평균이 대조군보다 다소 높았으며, 대조군은 대체로 정상보다 마른 체형을 보였으나 유의한 차이는 나타나지 않았다(Fig. 2B).
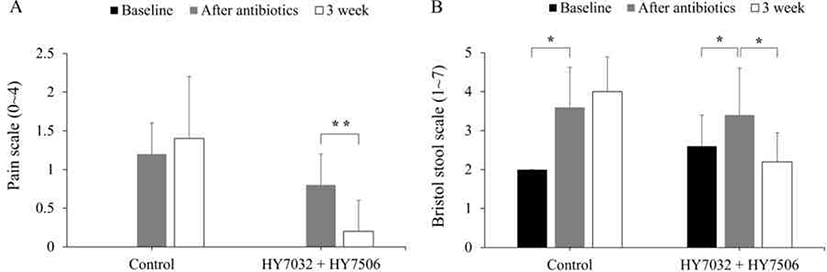
L. acidophilus HY7032 및 L. reuteri HY7506의 경구 투여가 비글 견의 개체 상태에 대해 미치는 영향을 조사하기 위해 pain scale과 분변양상을 측정하였다. 항생제 투여 전 비글 견의 pain scale은 모두 0으로 항생제 투여 후 일주일간 개체상태의 평균은 실험군 0.825, 대조군 1.25였으며, 유산균 투여 후 3주간의 개체상태 평균은 1.13, 대조군 1.53으로 대조군의 활력이 떨어지는 양상을 관찰하였다(Fig. 3A). 분변양상은 높을수록 묽은 변으로 2-3사이가 가장 건강한 변으로 판단하였다. 유산균 섭취 전 평균은 실험군 3.15, 대조군 3.05로 유사했으나, 유산균 투여 3주 동안의 분변양상은 실험군 2.82, 대조군 3.29로 대조군이 묽은 변을 누는 경향이 있었다(Fig. 3B). 설사 역시 대조군에 지속적으로 관찰되어 장염이 대조군에서는 지속되나, 실험군에서는 유산균투여 2주 안에 장염이 없어졌다.
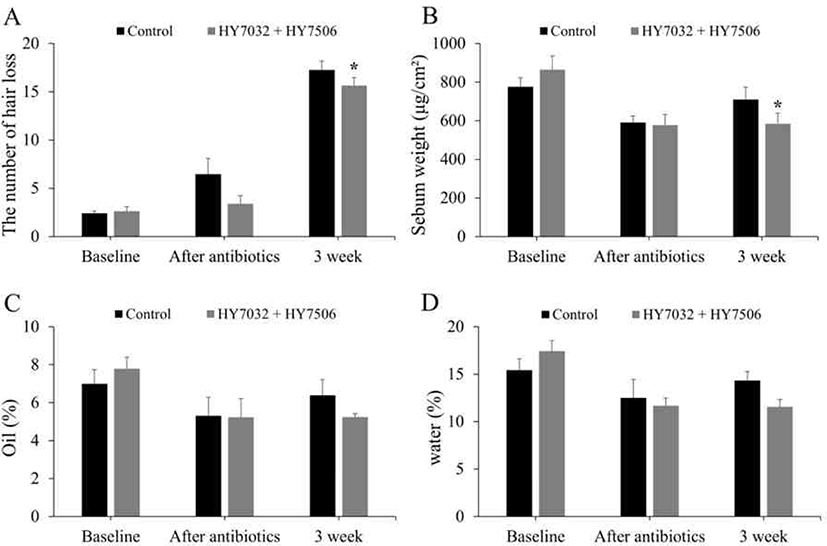
유산균이 피모에 미치는 영향을 확인하기 위해 확대 디지털 현미경을 이용하여 150배 배율로 등쪽 털을 촬영하여 육안평가를 진행하였다. 항생제 투여 이후, 1주차에서는 실험군과 대조군 모두에서 비듬의 양은 적게 관찰되었다. 3주차에서는 L. acidophilus HY7032 및 L. reuteri HY7506을 섭취한 실험군과 대조군을 비교하였을 때 평균적으로 비듬의 양이 대조군에서 다소 많이 관찰되었다(Fig. 4). 또한, 4 cm × 4 cm 규격의 테이프로 털 빠짐을 유도했을 때 평균적으로 대조군에서 유의미하게 높은 탈모유도 양상을 나타냈다(Fig. 5A). 배쪽 피부에서 유수분 측정기로 유수분과 피지를 측정하였을 때 유수분은 대조군과 실험군 간의 유의미한 차이가 나타나지 않았다. 다만 실험군에서 시간에 따른 피지량의 감소가 관찰되었다(Fig. 5B–D). 종합적으로 L. acidophilus HY7032 및 L. reuteri HY7506의 섭취는 피지의 양과 비듬의 양 감소와 털 빠짐을 억제함으로써 모질을 개선시켰다.

Discussion
최근 개를 포함한 반려동물의 건강을 유지하기 위한 방법이 상당한 관심을 받고 있다. 적절한 의학적 검진 외에도 양질의 식품을 공급해 주는 것 또한 반려동물의 건강 유지에 중요한 요소이다[2]. 반려견 식품의 중요성이 부각되는 만큼 반려동물 식품 시장이 급격한 성장을 거듭하고 있다. 프로바이오틱스의 조합은 항생제를 투여 받은 반려견의 장내 세균총 균형과 장 건강을 개선하여 개의 영양, 치료 및 관리에 유용할 수 있다[21]. 그러나 프로바이오틱스는 숙주 특이성을 나타내기 때문에 이를 고려하여 숙주의 장에서 유래한 프로바이오틱스의 사용이 중요하다[13]. 따라서, 본 연구에서는 개의 분변에서 분리된 L. acidophilus HY7032 및 L. reuteri HY7506의 기본적인 프로바이오틱스 특성과 장내 세균총이 파괴된 개에게 투여하였을 때 미치는 효과를 조사하였다.
일반적으로 프로바이오틱스의 유익한 효과는 위와 소장을 통과하는 동안 생존하여야만 발휘된다[22]. 생존하기 위해서는 체내의 위 환경과 비슷한 낮은 pH 2 수준과 소장에서 분비되는 담즙과 같은 가혹한 환경을 극복해야 한다. L. acidophilus HY7032 및 L. reuteri HY7506의 두 균주는 pH 4.0와 pH 5.0에서의 생존율이 감소하지 않았으며, pH 2, 3 수준에서도 생존율이 감소하는 경향이 있지만, 저 pH에 대한 저항성을 나타냈다. 그러나, 저 pH에 대한 저항력은 그다지 강하지 않기 때문에 다른 식품과 함께 섭취하는 것이 권장된다[23]. 프로바이오틱스를 함유하는 식품을 섭취하였을 때, 위장의 pH는 5.0 이상으로 상승하기 때문에 pH 4.0 이상에서 생존율이 감소하지 않은 두 균주 모두 높은 생존율로 위를 통과할 수 있을 것으로 판단된다[24]. 위를 통과한 후에는 장으로 들어가 담즙산에 노출되기 때문에 다양한 담즙산 농도에서 저항성을 확인하였다. 두 균주 모두 0.2%, 0.4% bile salt에서 살아남았다. 종합하면, 두 균주 모두 pH와 bile salt에 대해 저항성을 나타냈기 때문에 섭취하였을 때 충분히 장까지 도달할 수 있을 것으로 생각된다.
프로바이오틱스가 효과를 발휘하는 근본적인 메커니즘 중 하나는 항균제 분비를 통해 병원균을 제거하는 것으로 이는 균주 의존적이다[25]. 항균능력은 병원균의 성장을 억제하여 장내 공생 미생물을 유지하는 데 도움을 줄 수 있기 때문에 프로바이오틱스의 기본적인 특성으로 여겨지고 있다[26]. 따라서 여러 그람 양성균과 그람 음성균에 대한 L. acidophilus HY7032 및 L. reuteri HY7506의 항균 활성을 조사하였다. 그 결과, 두 균주 모두 그람 음성균(Salmonella, E. coli, Citrobacter)과 그람 양성균(Staphylococcus, Listeria, Corynebacterium, Bacillus)에 대한 현저한 억제 영역이 관찰되었다. 이는 개 사료와 같은 동물용 식품에 적용하였을 때 식품 유해 미생물에 대한 항균 활성을 통해 식품의 보존성이 올라갈 수 있으며, 반려동물이 섭취 시에는 항균제 분비로 병원균을 장에서 배제하여 성공적인 프로바이오틱스 효과를 발휘할 수 있음을 시사한다.
다양한 기능을 통해 프로바이오틱스는 다수의 유익한 효과를 지니는 것으로 알려져 있으며, 그 중 선천성 면역 증강 효과는 중요한 특성 중 하나로 인식되고 있다[27]. 따라서 본 연구에서는 개의 전혈을 사용하여 균주의 체외 면역 조절 효과를 평가하였다. 균주에 의한 면역 조절 활성은 살아있는 균 외에도 그 대사 산물을 통해 기인하기 때문에 균주와 대사 산물이 미치는 영향을 조사하였다[28]. 본 연구에서 L. acidophilus HY7032 및 L. reuteri HY7506에 의해 호중구가 자극되어 ROS 생성이 증가하여 MFI 값이 증가한 결과를 얻을 수 있었다. 생성된 ROS는 침입한 미생물을 죽이고, 숙주로부터 병원균을 제거하는 염증 반응을 유도한다고 알려져 있다[29]. 양성대조군으로 nicotinamide adenine dinucleotide phosphate (NADPH) 산화 효소 활성화제인 PMA를 사용하였는데, 균주나 대사산물이 PMA의 MFI 만큼 호중구의 활성을 높이지는 않는 것을 확인할 수 있었다[30]. 두 균주 모두 호중구 활성에 유의미한 효과를 보였지만, 균주의 대사 산물에 의해서는 현저히 떨어지는 호중구 활성을 나타냈다. 또한, 식균작용도 L. acidophilus HY7032 및 L. reuteri HY7506에 의해 상당히 활성화되었으며, 대사 산물에 의해서도 활성이 증가하였다. 병원성 미생물의 식균 작용(phagocytosis)은 선천성 면역 방어 메커니즘 중 하나이며, 동물의 면역 기능을 입증하는 데 또 다른 중요한 매개 변수이다[31]. 이전의 연구에 따르면 생쥐에 프로바이오틱스를 경구 투여할 시에 호흡 파열과 관련된 효소 활성이 증가하여 호중구를 강화할 수 있다고 보고되었다[32]. 또한, Lactobacillus 종에 의해 활성화된 대식세포에 의한 Aggregatibacter actinomycetemcomitans에 대한 식균 작용의 향상이 보고되었다[33]. 이러한 결과는 L. acidophilus HY7032 및 L. reuteri HY7506의 섭취는 선천성 면역 증강에 기여할 것으로 예상된다.
나아가, 동물실험을 통해 L. acidophilus HY7032 및 L. reuteri HY7506의 투여가 항생제가 투여된 개에게 미치는 영향을 조사하였다. 항생제에 의해 장내 공생생물이 사멸하여 결과적으로 장내 미생물 불균형이 초래된 개는 별다른 조치 없이는 지속적인 설사와 장염이 초래되어 활력이 떨어지는 경향을 나타냈다. 대조군과 비교하여, 실험군에서는 L. acidophilus HY7032 및 L. reuteri HY7506의 섭취를 통해 설사가 개선되었고, 활력 또한 회복되었다. 기존의 연구에서 건강한 반려동물에게 L. acidophilus의 투여가 대변의 상태를 개선하여 장 건강에 영향을 줄 수 있다고 보고가 되었다[34, 35]. 본 연구에서는 대변 상태 및 통증 척도 개선의 결과를 통해 Lactobacillus 종의 L. acidophilus HY7032 및 L. reuteri HY7506가 항생제를 투여 받은 개에게도 효과적일 수 있다는 것을 시사한다.
일반적으로 탈모증은 털이 자라는 부위에서 부분적으로 또는 완전히 털이 탈락하는 것으로, 반려동물의 경우에는 머리 또는 신체 어느 곳에서나 발생할 수 있다[36]. 탈모의 근본 원인은 곰팡이 감염, 면역 체계 불균형, 스트레스, 부적절한 식단, 아토피 피부염과 같은 다양한 요인과 관련될 수 있다[37]. 추정되는 탈모 원인에 따라 알맞은 치료 전략을 세워야 하며, 프로바이오틱스의 섭취는 그 중 하나의 방법일 수 있다[38]. 따라서, L. acidophilus HY7032 및 L. reuteri HY7506의 투여가 개의 피모에 미치는 영향을 조사하였다. 그 결과, L. acidophilus HY7032 및 L. reuteri HY7506에 의해 피지의 양과 비듬의 양이 감소하였으며, 털 빠짐을 억제하여 모질 개선 효과를 보였다. 본 연구에서는 L. acidophilus HY7032 및 L. reuteri HY7506의 섭취가 피지와 비듬의 양을 감소시켰지만, 유수분 균형은 대조군과 유의미한 차이를 보이지 않았다. 이러한 결과는 유수분의 영향이 아니라 프로바이오틱스의 섭취가 Malassezia yeast와 같이 비듬의 증가를 유발하는 두피 세균의 과다 증식을 억제하기 때문인 것으로 사료된다[39]. 실제로 L. paracasei의 경구 투여 시에, 비듬을 실질적이고 임상적으로 유의미하게 감소시켰다는 보고가 있다[40]. 이러한 보고는 프로바이오틱스의 섭취가 두피 홍반, 가려움증 및 기름기 감소를 포함한 이점을 가져올 수 있으며, 시간이 지남에 따라 두피에 존재하는 Malassezia yeast 수를 꾸준히 감소시켜 비듬을 감소시킬 수 있다고 주장한다. 종합해 보면, L. acidophilus HY7032 및 L. reuteri HY7506의 Malassezia yeast와 같은 병원균에 대한 항균능력과 항생제가 투여된 개에서 모질 개선 효과, 선천성 면역세포 활성, 그리고 장 건강 및 활력 개선을 확인할 수 있다.
본 실험 결과는 개의 분변에서 분리된 L. acidophilus HY7032 및 L. reuteri HY7506의 섭취가 항생제가 투여된 개의 장내 미생물 불균형 증상의 완화에 대한 결과를 확인한 연구로, 모질 개선에 대한 효과는 추가적인 연구가 필요하다. 결론적으로, L. acidophilus HY7032 및 L. reuteri HY7506은 항생제로 인해 장내 세균총이 불균형된 개의 건강개선에 도움이 되고, 면역 증강과 모질 개선에 효과를 나타내어 숙주 특이성을 고려한 반려견용 프로바이오틱스로 활용될 수 있음을 시사한다.
