Original Article
The effect of pentoxifylline on radiation-induced bone loss in C3H/HeN mice
Sung-Ho Kim
1,*
1College of Veterinary Medicine, Chonnam National University, Gwangju 61186, Korea
*Corresponding author: Sung-Ho Kim, College of Veterinary Medicine, Chonnam National University, Gwangju 61186, Korea, Tel: +82-62-530-2837, E-mail:
shokim@jnu.ac.kr
© Research Institute of Veterinary Medicine, Chungbuk National University. All rights reserved.
Received: Jan 22, 2021; Accepted: Feb 01, 2021
Abstract
Developments in cancer therapies and diagnostic techniques have improved the long-term survival of cancer patients. Certain cancer treatments, such as radiotherapy, often harm normal tissue as well as the specifically targeted cancer cells. High doses of radiation induce bone loss. This study investigated the effects of pentoxifylline (PTX) on radiation-induced bone loss in C3H/HeN mice. C3H/HeN mice were divided into sham and irradiation (3 Gy, gamma-ray, IR) groups. The irradiated mice were treated for 12 weeks with vehicle, PTX (p.o.) or PTX (s.c.). Grip strength, uterus weight, serum alkaline phosphatase (ALP) and tartrate-resistant acid phosphatase (TRAP) level were measured. Tibiae were analyzed using micro-computed tomography. There were no significant differences in the degree of grip strength, body weight and uterine weight between IR group and PTX-treated group. Treatment of PTX significantly preserved trabecular bone volume, trabecular number, trabecular separation and bone mineral density of proximal tibia metaphysic. The administration of PTX lowered serum TRAP in IR mice, suggesting that PTX can reduce the bone resorptive rate in mice. Our experimental data support the protective role of PTX against bone loss in irradiated mice. Based on the findings of this study, development of PTX-based treatments is anticipated to address bone loss after radiotherapy. Prospective dose escalation studies are required to determine the appropriate dosage of PTX.
Keywords: pentoxifylline; radiation; bone loss; microcomputed tomography; trabecular bone
Introduction
암 진단 및 치료 기술의 발달로 인해 환자의 장기생존율이 증가하고 있으며[1], 이에 따라 장기생존자들에서 특이적이고 만성적인 합병증이 발생할 수 있다. 암 치료의 중요한 방법으로 적용되는 방사선치료는 정상적인 조직을 손상시킬 수 있으며[2], 이러한 상황의 원인과 예후에 대한 보다 많은 관심과 연구가 필요하다.
고선량 방사선 노출은 뼈 소실을 일으킨다. 방사선 조사가 뼈에 미치는 주요 영향은, 뼈의 크기는 변화시키지 않으면서 조직의 기능성 구조의 감소를 수반하는 위축이다. 혈관의 변화, 뼈바탕질 및 세포성 변화 등이 방사선에 의한 뼈 변화의 병인으로써 고려되어 왔으며[3], 방사선 노출에 따른 자연발생 골절증가가 보고되었다[4]. 골다공증은 공중보건학적 관점의 문제이면서, 사회적 비용뿐만 아니라 골절 등 뼈기능이 약화된 환자에게 경제적 부담을 주고 있다[5]. 골다공증 경감제제는 뼈재형성 과정을 기반으로 하여 설계되는데, 몇몇 약물은 뼈재흡수를 막는 물질(에스트로겐, 칼시토닌, 비스포스포네이트, 칼슘, 비타민 D 및 랄록시펜) 및 기타 약물은 주로 뼈형성을 활성화하는 물질(불소 및 단백동화 스테로이드)이 관심의 대상이 되어 왔다[6].
Xanthine 유도체인 pentoxifylline(PTX)은 적혈구의 유연성 증강 및 혈관확장 작용으로 허혈성 심장질환, 간헐성 파행증과 같은 혈관성 장애를 개선하는 약물로 사용되었다[7]. 뼈와 관련하여, PTX가 건강한 동물 및 환자에서 골절치유 개선효과가 확인되었고, 뼈장애 치료 후보물질로서 적용 가능성이 가설되기도 하였다[8–10]. 랫트의 골절 모델에서 뼈 재형성기에서의 효과가 보고[10]되었고, 난소적출 동물에서 뼈구조 개선 작용의 결과도 알려졌다[11]. 방사선 장애에 대한 연구는 골수이식을 위한 방사선 조사 부작용 개선 유무 및 방사선에 의한 연부조직 괴사, 폐 및 피부 독성에 대한 연구가 수행되었다[12, 13].
이와 같이 PTX의 효과연구에도 불구하고, 방사선에 의해 유도된 뼈 소실에 대한 효과 유무를 확인하는 연구는 아직 매우 미비하다. 본 연구는 방사선 조사된 마우스에서 PTX의 효과를 평가하였다.
Materials and Methods
실험동물 및 방사선 조사
암컷 성숙(9주령) 마우스를 적용하였으며, 최적 마우스계통으로, 해면뼈의 부피가 효과 평가에 적정한 C3H/HeN 마우스(Orient Bio, Seongnam, Korea)를 사용하였다[14]. 동물의 사육은 온도 22 ± 2℃, 상대습도 50 ± 10%, 조명시간은 12시간(오전 8시 점등-오후 8시 소등) 및 조도 200–300 lux로 설정된 시설에서 수행하였다. 순화기간을 거쳐 polycarbonate 사육상자에 3마리씩 수용하고, 실험동물용 고형사료(Samyang Feed, Wonju, Korea)와 정수장치를 통과한 수도수를 자유롭게 섭취하도록 하였다. 모든 실험동물은 Institute of Laboratory Animal Resources의 ‘Guide for the Care and Use of Laboratory Animal’에 준하여 취급하였으며, 동물실험은 전남대학교 동물실험윤리위원회의 승인 하에 수행되었다(승인번호: CNU IACUC-YB-2015-16). 선행연구에서 확립된 방법[14]에 따라, 방사선 조사는 실험용 방사선 조사기(Gamma-cell Elan 3000, Nordion International, Ottawa, ON, Canada)를 사용하여 137Cs 감마선(선량율: 3.2 Gy/min)을 3 Gy, 1회 전신 조사하였으며, 방사선 조사 후 12주에 뼈변화를 평가하였다.
실험군의 분류 및 시험물질 투여
실험군은 정상대조군, 방사선 단독조사 대조군, PTX (Sigma chemicals, St. Louis, Mo, USA) 투여 및 방사선 조사 병행군으로 분류하였다. 기존 연구보고[11, 13, 15]에서 적용된 PTX의 투여량을 참고하여, 체중 kg당 250 mg을 방사선 조사 3일전부터 매일 경구투여하거나, 체중 kg당 50 mg을 방사선 조사 30분 전 및 매일 1회 피하주사하였다. PTX는 주사용 증류수에 용해하였으며, 적용 마우스는 실험군당 6마리로 하였다.
악력측정, 시료 채취 및 혈청생화학적 측정
투여기간 중 정기적으로 일반 임상증상을 관찰하였으며, 투여 전 및 부검 시 각각 체중을 측정하였다. 안락사 직전에 인장력측정기(Iwoo-G-500, Iwoo Scientific, Seoul, Korea)를 이용하여 악력을 측정하였다. 측정눈금을 영점으로 하고, 측정봉에 양쪽 앞발을 잡게 한 다음 꼬리를 서서히 안정되게 잡아당겨 앞발이 측정봉에서 떨어질 때의 최대 악력을 측정하였으며, 3회 실시하여 평균값을 산출하였다. 방사선 조사 후 12주에 부검을 시행하고, 자궁의 무게를 측정하였으며 좌측 정강뼈는 골밀도 및 전산화 단층촬영 시까지 70% 에탄올에 보관하였다. 부검 시 동물의 후대정맥에서 혈액을 채취하고, 채취한 혈액에서 혈청을 분리하고 뼈모세포 활성 지표효소인 alkaline phosphatase(ALP) 수치를 혈액생화학분석기(FDC 3500s, Fuji film, Tokyo, Japan)를 사용하여 분석하였으며, 뼈파괴세포 활성 평가 지표인 tartrate resistant acid phosphatase (TRAP)의 양은 측정키트(TRACP-5b ELISA Kit, Antibodies-online, Aachen, Germany)를 사용하여 enzyme linked immunosorbent assay(ELISA) 방법으로 분석하였다.
미세 전산화 단층 촬영(micro-computed tomography, μCT)
시료의 단층 영상은 μCT(Skyscan 1172; Skyscan, Kontich, Belgium)를 이용하여 다음과 같은 조건하에 채득하였다. 원추형 빔(cone beam) 방식의 x-ray source를 이용하여 50 kV, 200 μA 하에서 시료에 방사선을 조사 하였고, 이때 해상도(spatial resolution)는 17 μm로 조절하였다. 시료를 0.4도씩 회전시키면서 매회 1.2초간 방사선을 조사하였으며, 촬영은 포커스 스폿(focus spot)에서 방사된 빔이 시료를 투과하여 charge-coupled devices (CCD) 카메라에 영상이 맺히는 원리를 이용하였다. 채득된 영상은 NRecon 소프트웨어(Skyscan, Kontich, Belgium)를 이용하여 150개의 2차원 횡단면으로 재구성되었고, 각 단면간의 거리는 80 μm로 설정하였다. 정강뼈의 미세구조는 2차원적으로 채득된 영상의 뼈영역 만을 적용하여 CTan 소프트웨어(Skyscan, Kontich, Belgium)로 분석하였다. 해면뼈의 분석은 성장판 아래에서 1.5 mm를 측정 대상으로 하였다. 재구성된 2차원 이미지로부터 치밀뼈(cortical bone)와 해면뼈를 구분하여 관심영역(region of interest, ROI)을 설정한 후, 각 부분의 뼈용적(bone volume/tissue volume, BV/TV), 뼈두께(trabecular thickness, Tb.Th), 뼈분리간격(trabecular separation, Tb.Sp), 뼈수(trabecular number, Tb.N) 등의 양적 분석과 structure model index (SMI), trabecular bone pattern factor (Tb.Pf) 등의 구조적 파라미터(structural parameters) 값을 측정하였다. 해면뼈의 일부를 포함하는 원형 ROI를 설정하여 성적을 비교하였다. 골밀도(bone mineral density, BMD)는 0.25와 0.75 g/cm3의 hydroxyapatite standard phantom에 대한 Hounsfield unit(HU) 값을 얻은 후, 측정하고자 하는 시료편의 HU 값을 계산식에 대응시켜 구하였다. 치밀뼈는 해면뼈 소실 부위 아래부터 1.0 mm를 측정대상으로 하였으며, 뼈용적(bone volume, BV), polar moment of inertia(pMOI)의 값을 측정하였다.
자료통계 및 분석
모든 실험에서 얻어진 자료는 one-way ANOVA (the post-hoc Student-Newman-Keuls)의 방법으로 유의성을 검사하고, 그들의 수치는 평균 ± 표준편차(mean ± SD)의 값으로 나타냈다. p값이 0.05보다 작을 때 유의성이 있는 값으로 정하였다.
Results
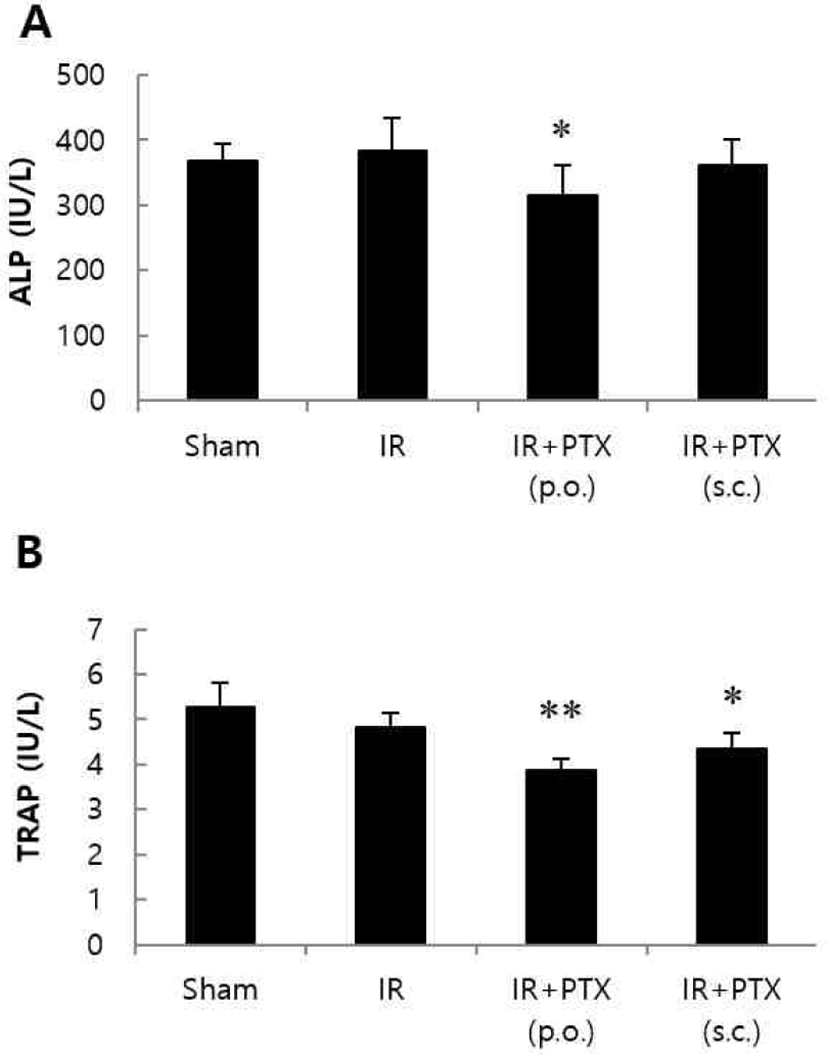
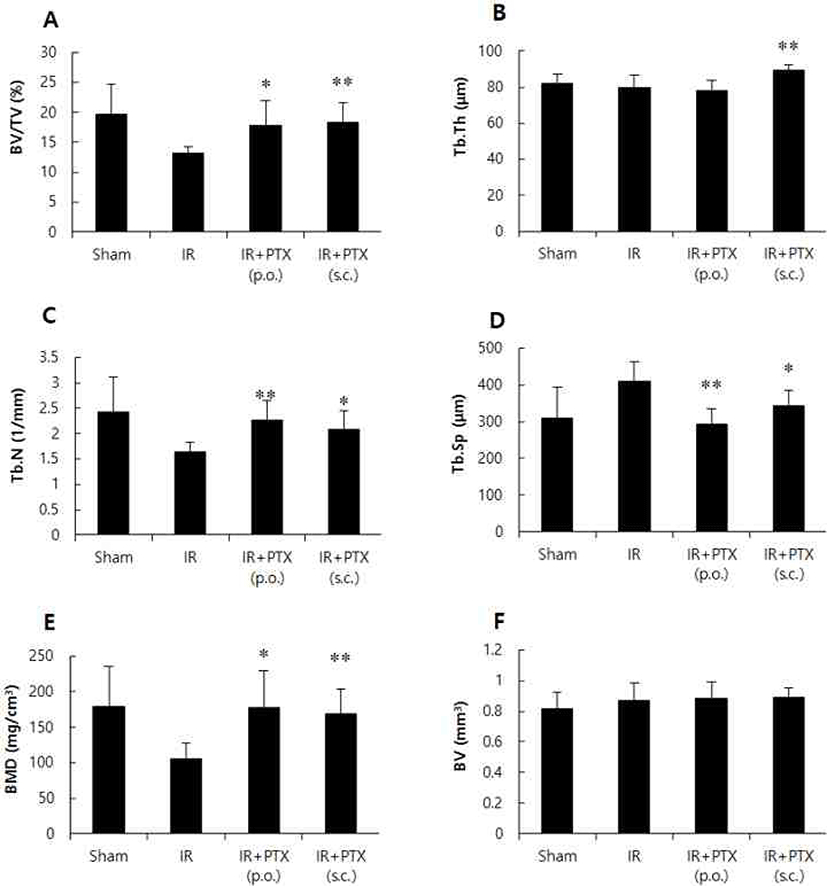
악력, 체중 및 자궁 무게는 군간 차이를 보이지 않았다(Fig. 1). 혈청 생화학적 지표의 변화는 Fig. 2와 같다. 방사선 조사군과 비교하여, 혈청 ALP 수치는 PTX 투여군에서 경미하게 감소하였으며, TRAP 수치는 PTX 경구투여 및 피하주사군에서 공히 유의성 있게 낮아졌다. 정상대조군, 방사선단독 조사군 및 PTX 투여군의 대표적 μCT 정강뼈 3차원 영상은 Fig. 3에 정리하였다. 방사선 조사군은 비조사대조군에 비해 해면뼈의 양은 30% 이상 감소하였다. 방사선 단독 조사군에 비해 PTX 경구투여군에서 BV/TV가 약 35% 증가하였으며, Tb.N과 BMD도 BV/TV와 유사한 증가 양상을 보였다. Tb.Sp는 방사선 조사군에 비해 PTX 경구투여군에서 약 29% 감소하였다. PTX 피하주사군에서는 BV/TV가 약 40% 증가하였으며, Tb.N, Tb.Th 및 BMD도 유사한 증가 양상을 보였다. Tb.Sp는 방사선 조사군에 비해 PTX 피하주사군에서 약 17% 감소하였다(Fig. 4). 치밀뼈 뼈용적(BV)은 모든 군에서 변화가 관찰되지 않았다.
Fig. 1.
Effect of pentoxifylline (PTX) on grip strength (A), body weight (B) and uterus weight (C) in irradiated mice (IR, 3 Gy). C3H/HeN mice were treated with vehicle or PTX (250 mg/kg/day, p.o. or 50 mg/kg/day, s.c.) for 12 weeks. Data are expressed as means ± S.D. (n = 6).
Download Original Figure
Fig. 2.
Effect of pentoxifylline (PTX) on serum alkaline phosphatase (ALP, A) and tartrate-resistant acid phosphatase (TRAP, B) in irradiated mice (IR, 3 Gy). C3H/HeN mice were treated with vehicle or PTX (250 mg/kg/day, p.o. or 50 mg/kg/day, s.c.) for 12 weeks. Data are expressed as means ± S.D. (n = 6). *p<0.05, **p<0.01 vs IR group at corresponding parameters.
Download Original Figure
Fig. 3.
Representative micro-CT three-dimensional images of trabecular architecture of tibia in (A) sham control, (B) irradiation control and a (C) irradiation + pentoxifylline (s.c.)-treated mouse.
Download Original Figure
Fig. 4.
Effect of pentoxifylline (PTX) on trabecular (A-E) and cortical (F) bone properties of tibia in irradiated mice (IR, 3 Gy). C3H/HeN mice were treated with vehicle or PTX (250 mg/kg/day, p.o. or 50 mg/kg/day, s.c.) for 12 weeks. BV/TV, bone volume density (A); Tb.Th, trabecular thickness (B); Tb.N, trabecular number (C); Tb.Sp, trabecular separation (D); BMD, bone mineral density (E); BV, cortical bone volume (F). Data are expressed as means ± S.D. (n = 6). *p<0.05, **p<0.01 vs IR group at corresponding parameters.
Download Original Figure
Discussion
골절은 방사선 치료의 만성현상으로 알려져 있으나, 방사선 노출에 의한 골절의 원인은 자세히 밝혀져 있지 않다. 전리방사선에 노출 후 골밀도 감소와 골절은 골수강내와 뼈단위의 뼈모세포와 혈관계통의 손상을 일으키는 만성적 반응때문에 일어난다고 알려져 있다[16, 17]. 몇몇 연구의 결과는 뼈모세포의 증식과 분화의 감소, 세포주기의 정지, 콜라겐 생산 감소, 세포자멸인자에 대한 감수성 증가 등, 방사선 노출 후 뼈모세포의 사멸과 손상에 의한 뼈형성의 부전을 보여준다[18, 19]. 뼈손상에 있어서 혈관계 손상의 장기적인 연관성은 아직 명확하게 밝혀져 있지 않다[17]. 그러나 방사선 조사에 의한 만성 뼈위축은 인의임상과 동물실험에서 보고되고 있다[20, 21].
방사선 노출에 의한 뼈파괴세포의 숫적 감소와 뼈흡수 활성저하를 나타내는 보고[22]가 있으나, 또 다른 연구에서는 방사선 조사에 따른 뼈흡수의 초기자극이 방사선 유도 뼈소실의 병인이라고 하였다[23]. 이와 같이 방사선이 뼈파괴세포 활성에 미치는 효과는 아직 불투명하다[22, 24]. 혈청내 뼈재형성 지표의 수치 변화는 뼈형성의 비율 변화를 반영하며[25], 골다공증 발생에서 빠른 뼈소실과의 연관성을 나타낸다. 뼈재형성 지표의 수치가 높게 나타나고, BMD의 수치가 낮게 나타나는 것은 특히 골절 위험도의 증가를 암시하는 것이며[26], 이러한 뼈재형성 지표는 골다공증 환자에서 치료제의 효능 검증을 위한 임상적 지표로 사용되고 있고, 뼈소실율과 골절 위험도의 간접적 판단기준으로 적용되고 있다[25]. 본 연구에서 뼈파괴세포의 활성도를 나타내는 혈청 TRAP 농도가 PTX 투여군에서 유의성 있게 감소하였다. 이러한 결과는 PTX가 난소절제 동물에서 뼈파괴세포의 수를 감소시키고, 이에 따른 뼈의 재흡수작용을 억제하여 뼈소실을 개선한다는 연구보고[11]와 일치하였다.
한편, 생체에 방사선이 노출되면 활성산소가 증가하여DNA 손상을 유발하게 되고, 이러한 활성산소를 제거하는 항산화물질은 방사선 장애 개선효과를 나타낸다[27]. PTX가 방사선 치료시 항산화물질과 같은 효과를 나타낸다는 보고[28, 29]를 참고하면, 본 연구에서 관찰된 PTX의 뼈소실 개선효과도 이러한 작용과 일부 연관되었을 것으로 예상되나, 이에 대한 추가 연구가 필요하다.
환자를 대상으로 한 역학적 연구에서 악력 및 BMD간에 상호 연관관계가 있다고 보고[30]되었으나, 본 연구에서는 이와 같은 결과는 관찰되지 않았다. 또한 방사선 전신조사에 의해 난소의 장해발생에 따른 호르몬의 변화가 뼈소실에 영향을 미칠 수 있다는 가정하에 자궁의 무게를 측정하였으며 실험군간 차이가 관찰되지 않아 호르몬 변화에 따른 뼈소실의 결과는 아닌 것으로 사료된다.
결론적으로 방사선 노출에 의한 뼈소실에서 PTX는 뼈소실 억제효과를 나타냈으며, 이는 뼈파괴세포 활성도 억제작용이 관여된 것으로 사료된다. PTX가 방사선에 의한 뼈소실 발생을 개선할 수 있는 가능성을 제시하였으나, 효과물질로 적용되기 위해서는 투여용량 및 효과에 대한 세포수준 및 분자생물학적 추가 연구가 요구된다.
Acknowledgements
이 논문은 전남대학교 학술연구비(과제번호: 2020-1809) 지원에 의하여 연구되었음.
References
Oeffinger KC, Mertens AC, Sklar CA, Kawashima T, Hudson MM, Meadows AT, Friedman DL, Marina N, Hobbie W, Kadan-Lottick NS, Schwartz CL, Leisenring W, Robison LL. Chronic health conditions in adult survivors of childhood cancer. N Engl J Med 2006;355:1572-1582.


Zhao W, Robbins MEC. Inflammation and chronic oxidative stress in radiation-induced late normal tissue injury: therapeutic implications. Curr Med Chem 2009;16:130-143.


Ergün H, Howland WJ. Postradiation atrophy of mature bone. CRC Crit Rev Diagn Imaging 1980;12:225-243.
Chen HHW, Lee BF, Guo HR, Su WR, Chiu NT. Changes in bone mineral density of lumbar spine after pelvic radiotherapy. Radiother Oncol 2002;62:239-242.

Liu Z, Piao J, Pang L, Qing X, Nan S, Pan Z, Guo Y, Wang X, Li F, Liu J, Cheng X. The diagnostic criteria for primary osteoporosis and the incidence of osteoporosis in China. J Bone Miner Metab 2002;20:181-189.


Harada SI, Rodan GA. Control of osteoblast function and regulation of bone mass. Nature 2003;423:349-355.


Delanian S, Depondt J, Lefaix JL. Major healing of refractory mandible osteoradionecrosis after treatment combining pentoxifylline and tocopherol: a phase II trial. Head Neck 2005;27:114-123.


Beşe NS, Ozgüroğlu M, Kamberoğlu K, Karahasanoglu T, Ober A. Pentoxifylline in the treatment of radiation-related pelvic insufficiency fractures of bone. Radiat Med 2003;21: 223-227.
Vashghani Farahani MM, Masteri Farahani R, Abdollahifar MA, Ghatresaman M, Ghoreishi SK, Hajihossainlou B, Chien S, Mostafavinia A, Rezaei F, Bayat M. Effects of pentoxifylline and alendronate on fracture healing in ovariectomy-induced osteoporosis in rats. Vet Res Forum 2019;10:93-100.
Attal M, Huguet F, Rubie H, Charlet JP, Schlaifer D, Huynh A, Laurent G, Pris J. Prevention of regimen-related toxicities after bone marrow transplantation by pentoxifylline: a prospective, randomized trial. Blood 1993 ;82:732-736.


Koh WJ, Stelzer KJ, Peterson LM, Staker BL, Ward WF, Russell KJ, Griffin TW. Effect of pentoxifylline on radiation-induced lung and skin toxicity in rats. Int J Radiat Oncol Biol Phys 1995;31:71-77.

Oksüz DC, Beşe NS, Altug T, Senocak M, Abidin BM, Belder M, Ober A. Does pentoxifylline increase radiation response of Ehrlich mammary carcinoma in mice? J BUON 2005;10:95-98.
Baxter NN, Habermann EB, Tepper JE, Durham SB, Virnig BA. Risk of pelvic fractures in older women following pelvic irradiation. J Am Med Assoc 2005;294:2587-2593.


Williams HJ, Davies AM. The effect of x-rays on bone: a pictorial review. Eur Radiol 2006;16:619-633.


Sakurai T, Sawada Y, Yoshimoto M, Kawai M, Miyakoshi J. Radiation-induced reduction of osteoblast differentiation in C2C12 cells. J Radiat Res 2007;48:515-521.


Szymczyk KH, Shapiro IM, Adams CS. Ionizing radiation sensitizes bone cells to apoptosis. Bone 2004;34:148-156.


Hamilton SA, Pecaut MJ, Gridley DS, Travis ND, Bandstra ER, Willey JS, Nelson GA, Bateman TA. A murine model for bone loss from therapeutic and space-relevant sources of radiation. J Appl Physiol 2006;101:789-793.


Sawajiri M, Mizoe J, Tanimoto K. Changes in osteoclasts after irradiation with carbon ion particles. Radiat Environ Biophys 2003;42:219-223.


Furstman LL. Effect of radiation on bone. J Dent Res 1972; 51:596-604.


Vit JP, Ohara PT, Tien DA, Fike JR, Eikmeier L, Beitz A, Wilcox GL, Jasmin L. The analgesic effect of low dose focal irradiation in a mouse model of bone cancer is associated with spinal changes in neuro-mediators of nociception. Pain 2006;120:188-201.


Hannon RA, Eastell R. Biochemical markers of bone turnover and fracture prediction. J Br Menopause Soc 2003;9: 10-15.


Garnero P, Hausherr E, Chapuy MC, Marcelli C, Grandjean H, Muller C, Cormier C, Bréart G, Meunier PJ, Delmas PD. Markers of bone resorption predict hip fracture in elderly women: the EPIDOS Prospective Study. J Bone Miner Res 1996;11:1531-1538.


Greenstock CL. Radiation and aging: free radical damage, biological response and possible antioxidant intervention. Med Hypotheses 1993;41:473-482.

Lyons AJ, Brennan PA. Pentoxifylline - a review of its use in osteoradionecrosis. Br J Oral Maxillofac Surg 2017;55: 230-234.


Amber KT, Shiman MI, Badiavas EV. The use of antioxidants in radiotherapy-induced skin toxicity. Integr Cancer Ther 2014;13:38-45.