Introduction
골관절염 또는 퇴행성 관절 질환은 관절 연골의 변성으로 시작되어 점차적으로 관절 연골 및 연골하골조직의 파괴로 인해 경미하게 염증을 일으키기 시작하고, 이로 인한 통증 및 강직증을 초래하는 난치성 질환으로 알려져 있다[1–3]. 골관절염의 근본적 치료방법은 아직 알려진 바 없으며, 약물요법, 관절에 대한 국소요법 및 물리치료, 수술적 요법 등이 적용된다[2]. 기존 골관절염 치료제로는 비스테로이드성 소염진통제, 스테로이드제 등이 주로 사용되어지며, 이 외에도 진통 및 항염작용 의약품 등이 사용되고 있으나, 위장관 관련 부작용에 의해 사용이 치료에 제한적이다[4, 5]. 골관절염이 진행되면 다양한 염증성 사이토카인이 발현된다. 골관절염이 진행되는 과정에서 종양괴사인자(tumor necrosis factor-alpha, TNF-α)가 발현되고, 이로 인해 인터류킨-6(interleukin-6, IL-6), 인터류킨-8(Interleukin-8, IL-8)과 같은 사이토카인의 합성에 영향을 주며[6–8], TNF-α 및 IL-6에 의해 자극되는 골아세포는 연골에 악영향을 미치게 됨으로써 기질금속단백질분해효소(matrix metalloprogeinase, MMP)를 생성한다[9]. 이 외에도, 골관절염으로 인해 연골이 파괴되면서 활액 내로 프로테오글리칸이 방출되며, 프로스타글란딘 E2(prostaglandin E2, PGE2)의 농도가 증가되어 통증이 증가된다[10].
로얄젤리는 여왕벌의 유충에게 독점적으로 공급되고, 로얄젤리를 섭취한 꿀벌은 다른 꿀벌들과 유전적으로는 동일하나, 섭취 여부에 따라 다르게 성장하게 된다[11–13]. 로얄젤리는 그람 양성균과 그람 음성균 모두에 대해 항균성을 지니고 있으며[14, 15], 이 외에도 면역력 증가[16, 17], 알레르기 감소[18], 콜레스테롤 수치 감소[19] 및 류마티스 관절염 개선 효과[20]가 있다고 알려져 있다.
Monosodium-iodoacetate(MIA) 유발 골관절염 모델은 골관절염 전임상 모델의 가장 대표적 모델로서, MIA는 Glyceraldehyde-3-phosphatase의 억제제로, 세포의 당 분해를 일으켜 세포 사멸을 일으키는 것으로 알려져 있다[21, 22]. 이러한 원리를 이용하여, MIA를 관절 내 주사할 경우, 연골 세포의 퇴행 및 사멸을 일으키고, 골 연골 세포의 출현과 같은 연골하골의 변화를 일으킨다[23, 24]. MIA 모델은 비교적 단기간에 병변이 유발되고, 사람의 골관절염과 유사한 양상으로 나타나, 특히 약리학적 약제 효능을 확인하기 위한 골관절염 전임상 시험에 널리 이용되고 있다[25, 26].
이에, 면역 개선 기능성이 있는 로얄젤리에 식품 첨가물 원료인 효소를 처리한, 효소처리 로얄젤리의 골관절염 개선 효과를 확인하고자 본 실험을 진행하였다.
Materials and Methods
효소처리 로얄젤리는 ㈜바이텍에서 공급받아 실험에 진행하였다. 공급받은 분말은 동결건조 로얄젤리의 지표성분 10-hydroxy-2-decenoic acid(10-HDA) 함량이 최소 4.5% 이상이 되도록 동결건조 로얄젤리 20 kg을 칭량하고, 정제수 100 kg을 혼합한 후, 엔도 및 엑소형 단백분해효소(Probeef 2000P), 엑소형 단백분해효소(Prozyme 2000) 및 엔도형 단백분해효소(Foodpro alkaline protease)를 각각 200 g씩 혼합 발효(55℃-58℃: 3시간, 45℃-50℃: 3시간, 50℃-55℃: 3시간, 55℃: 3시간, 85℃-95℃: 15분, 0.5 atm)하고, 발효된 혼합물을 비활성화 및 멸균(90 ± 5℃에 15분간 단백질분해효소 비활성화 및 멸균)시키고, 동결건조(선반온도; –40℃, 트랩온도; –65℃, 건조시 진공도; 250 mTorr 이하, 최종 온도; 23℃)한 다음, 건조된 원료를 분말로 분쇄(분쇄 시간: 30분)하였다. 최종 분말 분쇄된 것은 이취가 없으며, 연한 노란색 분말형태를 지니고 있다.
실험에 사용한 RAW 264.7 세포는 미국세포주은행(America type culture collection, ATCC, VA, USA)에서 구입하여 사용하였다. 10% Fetal bovine serum(FBS; Gibco Inc., NY, USA) 및 100 units/mL Penicillin streptomycine이 함유된 Dulbecco’s modified eagle medicum(DMEM: Gibco Inc., NY, USA) 배지를 이용하여 37℃, 5% CO2 인큐베이터 환경에서 배양하였고, 3일에 한번씩 계대배양을 진행하였다.
RAW 264.7 세포를 6-well plate에 3 × 105 cell/mL의 밀도로 분주하고, 12시간 동안 CO2 인큐베이터에서 안정화하였다. 이후, enzymatic royal jelly (ERJ) 및 Celecoxib (Sigma-Adrich, St. Louis, MO, USA)를 각각의 농도(ERJ; 50, 100, 200 μg/mL, Celecoxib : 5 mM)을 처리하여 24시간 동안 CO2 인큐베이터에서 배양하였다. 이후, 배지를 제거하고 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide(MTT; Sigma Aldrich) 시약을 배지에 희석하여 각 well에 1 mL씩 처리하여 3시간 동안 CO2 인큐베이터에서 배양한 후, MTT 시약을 제거하고, DMSO 시약을 동량 가하여 560 nm에서 흡광도를 측정하였다.
RAW 264.7 세포를 24-well plate에 1.5 × 105 cell/mL의 밀도로 분주하고, 10% FBS가 첨가된 DMEM 배지를 이용하여 18시간 안정화 시킨 후, ERJ 및 Celecoxib과 Lipopolyscharide(LPS, 1 μg/mL)를 동시 처리하고, 24시간 동안 CO2 인큐베이터에서 배양하였다. 이후, 염증성 사이토카인의 생성량을 확인하기 위하여 상층액을 분리한 후, ELISA kit(R&D systems Inc., MN, USA)를 이용하여 측정하였다.
RAW 264.7 세포를 24-well plate에 1.5 × 105 cell/mL의 밀도로 분주하고, 10% FBS가 첨가된 DMEM 배지를 이용하여 18시간 안정화 시킨 후, ERJ 및 Celecoxib과 LPS를 동시 처리하고, 24시간 동안 CO2 인큐베이터에서 배양하였다. 이후, PGE2 생성량을 확인하기 위하여 상층액을 분리한 후, PGE2 ELISA kit(R&D systems Inc., MN, USA)를 이용하여 측정하였다.
RAW 264.7 세포를 24-well plate에 1.5 × 105 cell/mL의 밀도로 분주하고, 10% FBS가 첨가된 DMEM 배지를 이용하여 18시간 안정화 시킨 후, ERJ 및 Celecoxib과 LPS를 동시 처리하고 24시간 동안 CO2 인큐베이터에서 배양하였다. 이후 산화질소(Nitric oxide, NO) 생성량을 확인하기 위하여 상층액을 분리한 후, Griess 시약(Sigma Aldrich)과 반응 후, 520 nm에서 흡광도를 측정하였다.
RAW 264.7 세포를 24-well plate에 1.5 × 105 cell/mL의 밀도로 분주하고, 10% FBS가 첨가된 DMEM 배지를 이용하여 18시간 안정화 시킨 후, ERJ 및 Celecoxib과 LPS를 동시 처리하고, 24시간 동안 CO2 인큐베이터에서 배양하였다. 이후, MMP-3 및 MMP-9 생성량을 확인하기 위하여 상층액을 분리한 후, ELISA kit(R&D systems Inc., MN, USA)를 이용하여 측정하였다.
골관절염 유발을 위하여 무게 약 180-200 g 사이의 6주령 SD랫드에, MIA를 이용하여 골관절염 유도 후, 실험을 진행하였다. 실험 동물을 사육환경에 적응시키기 위하여 1주일 동안 식이 및 물을 자유로이 섭취하도록 하였으며, 이후 본 시험을 진행하였다. 졸레틸(cat. No. 06516, Virbac, Carros, France)과 럼푼(cat. No. 41882, Bayer Korea, Seoul, Korea)을 2:1 비율로 희석한 후에 복강주사로 마취 후, 랫드의 무릎 주변을 제모하고 골관절염 유도물질인 MIA(3 mg/kg)를 왼쪽 무릎 관절강 내에 50 μL 주사하여 골관절염 유발을 진행하였고, 7일 후 체중 및 육안관찰을 통해 10마리씩 실험군을 배정하였다. 정상군(Normal) 및 골관절염유발군(Osteoarthritis, OA)는 1일 1회 생리식염수 경구투여를 진행하였고, 약물처리군(ERJ : 50, 100 또는 200 mg/kg) 및 양성대조군(초록입홍합추출분말, Perna canaliculus, PC : 200 mg/kg)은 1일 1회 각각의 용량으로 경구투여를 진행하였으며, 총 21일 동안 실험을 진행하였다. 실험 종료 후, 심장채혈을 통해 혈청을 분리하여 –70℃에 보관하였고, 슬관절 조직을 분리하여 각각 10% 중성 포르말린에 고정하여 실험에 사용하였다. 본 연구는 원광대학교 연구윤리위원회의 승인(WKU18-87)을 받아 시행하였다.
실험 종료 후, 심장채혈을 통하여 혈액을 채취하였고, 10,000×grpm에서 15분간 원심분리하여 혈청을 분리하였다. 분리한 혈청을 이용하여 혈청 내 인터류킨 1베타(interluekin-1beta, IL-1β) IL-6, TNF-α 생성량을 ELISA kit(R&D systems Inc., MN, USA)를 이용하여 확인하였다.
실험 종료 후, 족부를 취하여 10% 중성 포르말린에 고정하였고, 조직의 연골 조직 분석을 Micro-CT를 이용하여 분석 진행하였다. 조직 체적 대비 연골 체적을 확인하기 위하여 Skyscan-1076 Micro-CT scanner를 이용하여 분석 진행하였다. Pixel size는 35 μm, source voltage는 50 kVp, source current는 200 μA로 하였고, 1 mm 알루미늄 에너지 필터를 사용하였으며, 노출 시간은 0.46초로 하였다. 이후 bone volume 및 tissue volume은 Micro-CT 영상 뷰어인 CTAn 프로그램을 이용하여 분석하였다.
실험 종료 후, 족부를 취하여 10% 중성 포르말린에 고정하였고, 이후 Hematoxylin & Eosin(H&E) 염색을 진행하였다. 슬관절 조직을 파라핀 포메 후, 제조된 파라핀 블록을 5 μm의 두께로 절편하고, 절편을 수세 과정을 거친 후, 발색을 유발시키고, 유발된 조직을 헤마토실린(Fisher Scientific, ON, Canada) 및 에오신(Leica Microsystems Inc., ON, Canada)으로 3분간 염색한 후, 흐르는 물에서 수세하고 에탄올과 자일렌을 이용하여 탈수 및 투명화 과정을 거친 다음 봉입을 실시하였으며, 조직형태학적 관찰은 광학현미경(Carl Zeiss, Jena, Germany)을 이용하여 관찰하였다.
실험 종료 후, 족부를 취하여 10% 중성 포르말린에 고정하였고, 이후 MMP-3 및 MMP-9 염색을 진행하였다. 슬관절 조직을 파라핀 포메 후, 제조된 파라핀 블록을 5 μm의 두께로 슬라이스하고, 절편을 Peroxidase(Santa Cruz, TX, USA) 시약에 넣고, 실온에서 5분 동안 방치하였다. 이후, 절편을 PBS를 이용하여 세척 후, MMP-3 (Santa Cruz, TX, USA) 및 MMP-9(Abcam, CB, UK) (MMP-3: 1:200, MMP-9: 1:150, 0.1% Bovine serum albumin)으로 희석한 용액에 넣고 4℃에서 하룻 동안 반응하였다. 이후, PBS를 이용하여 2회 세척 진행하고, 2차 항체를 이용하여 60분 동안 상온에서 반응하였다. 이후 VX53 microscope(Olympus, Tokyo, Japan)을 이용하여 관찰 후, NFINITY3-3UR(Lumenera, Ottawa, Canada) 카메라를 사용하여 관찰하였다.
Results
ERJ 및 Celecoxib의 세포 생존율을 확인하기 위해 MTT assay를 진행하였다. Fig. 1에 나타낸 바와 같이 ERJ 및 Celcecoxib 처리시 세포 생존율에 영향을 주지 않음을 확인하였다.
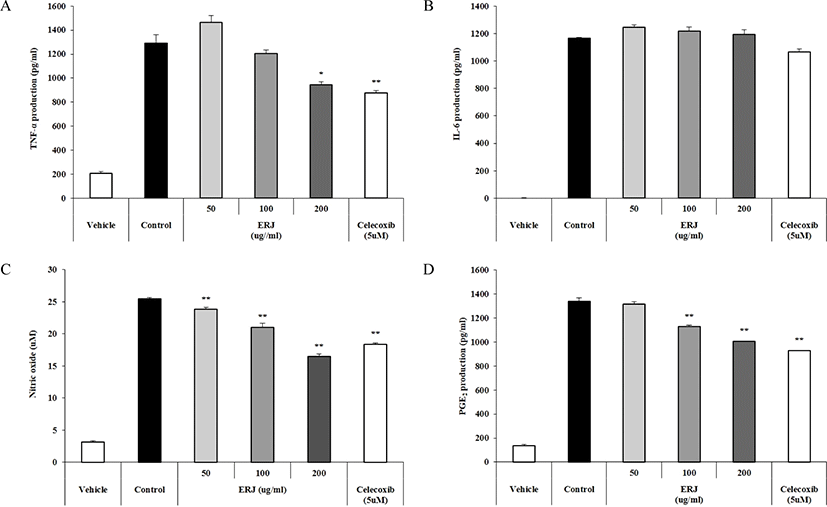
TNF-α는 대식세포에 의해 분비되어 발열 반응, 세포자살 또는 염증반응을 일으키는 사이토카인이다. 또한, TNF-α에 의해 IL-6를 발생시켜 패혈증을 유발하기도 한다[27]. Fig. 2에 나타낸 바와 같이 ERJ의 골관절염 개선 효과를 확인하기 위하여 염증성 사이토카인인 TNF-α 및 IL-6의 발현량을 확인하였고, 산화질소(Nitric oxide, NO) 및 PGE2 생성량을 확인하였다. 그 결과, 농도 의존적으로 TNF-α, NO 및 PGE2 생성량이 감소하는 것을 확인하였고, IL-6 생성량에는 큰 영향을 주지 않음을 확인하였다. 특히, NO 생성량은 대조군보다 ERJ 200 μg/mL에서 감소하는 것을 확인하였다.
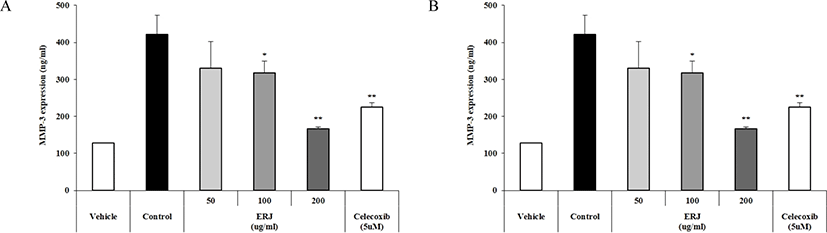
MMPs는 세포 외 매트릭스 구성 요소를 저하시키는 아연 의존성 효소를 나타낸다. MMPs는 활액 세포 및 연골 세포에 의해 관절 내에서 합성되며, MMPs가 과발현 되면, 연골 저하를 나타낸다[28]. Fig. 3에 나타낸 바와 같이 ERJ의 골관절염 개선 효과를 확인하기 위하여 MMP-3 및 MMP-9 발현량을 확인하였다. 그 결과, 농도의존적으로 MMP-3 및 MMP-9의 발현량이 감소됨을 확인하였으며, 대조군보다 ERJ 200 μg/mL에서 MMP-3 및 MMP-9의 발현량이 감소하는 것을 확인하였다.
본 실험기간 동안 1일 1회, 경구투여 전 체중 측정을 진행하였고, 그 결과를 Fig. 4에 나타내었다. Fig. 4에 나타낸 바와 같이 군간 차이 없이 체중이 증가함을 확인하였으며, 이러한 결과를 미루어 볼 때, 시료에 의한 독성은 나타나지 않는 것으로 확인된다.
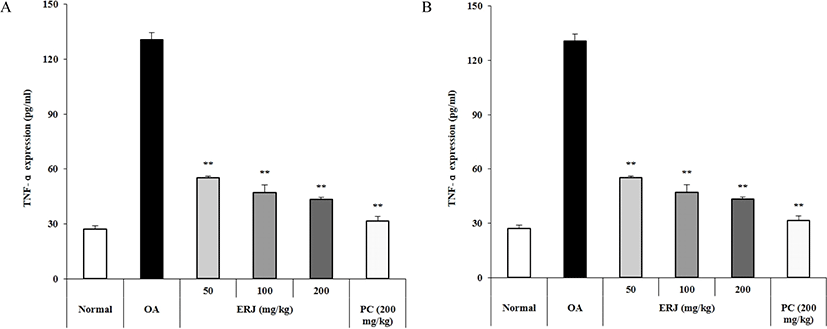
실험 종료 후, 혈청 내 염증성 사이토카인의 발현을 분석하기 위하여 TNF-α 및 IL-6 발현량을 확인하였다. Fig. 5에 나타낸 바와 같이, ERJ 경구투여시 용량 의존적으로 발현이 감소됨을 확인하였다. 이러한 결과로, MIA로 인해 증가된 과발현된 염증성 사이토카인이 ERJ 경구투여시 감소시킴으로써, 골관절염 개선 효과가 있는 것으로 사료된다.
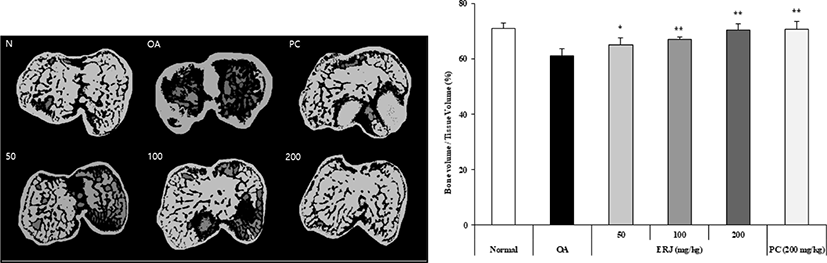
연골 조직의 손상 정도를 확인하기 위하여 Micro-CT 분석을 진행하여, 연골 체적 및 전체 조직 체적을 확인하였다. 골관절염이 진행됨에 따라 연골 조직의 체적이 감소하게 되고, 더 심해질 경우 골극이 진행되게 된다. Fig. 6에 나타낸 바와 같이, 골관절염이 유도된 마우스 모델에서 ERJ 및 PC 경구투여시 OA 대비 연골이 전체적으로 증가됨을 확인하였다. 특히, ERJ 200 mg/kg은 Normal 수준으로 연골이 회복됨을 확인하였다.
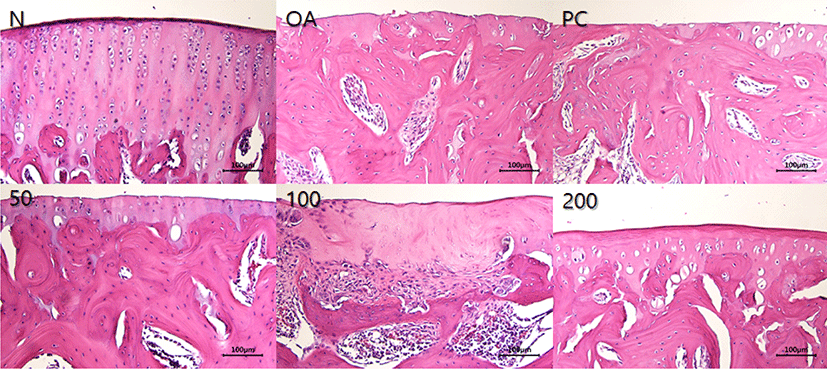
무릎 관절 내 활막세포의 변화, 염증세포 침윤 및 손상된 무릎 관절 표면 회복 여부를 확인하기 위하여 H&E 염색을 진행하였다. Fig. 7에 나타낸 바와 같이, MIA를 이용하여 골관절염 유도 시, 활막 및 섬유조직의 변형이 현저함을 확인하였으며, 궤양, 세동 및 연골 조직의 상실을 동반하는 불규칙한 표면을 나타냈다. 반면, ERJ 및 PC 경구투여시, 활막 및 섬유조직 변형이 회복되는 것을 확인하였으며, 특히 ERJ 200 mg/kg은 Normal과 비슷한 수준으로 회복함을 확인하였다.
MMP는 세포외 매트릭스의 모든 구성 요소를 분해할 수 있는 단백질 이화 효소군이다[29]. MMP-3는 연골 세포와 활액 세포에서 분비되며, 다양한 세포 외 기질을 분해할 수 있을 뿐만 아니라, 다른 단백질 분해 효소 세린을 활성화 시키는 것으로 알려져 있으며[30, 31], 골관절염 모델의 활막에서 발현되는 것으로 알려져 있다[32]. 반면, MMP-9은 대식세포, 호중구 및 호산구와 같은 염증 세포에 의해서 생성되며[33, 34], 보통 MMP는 전구체로 분비되어 제한된 단백질 분해에 의해 활성화 된다.
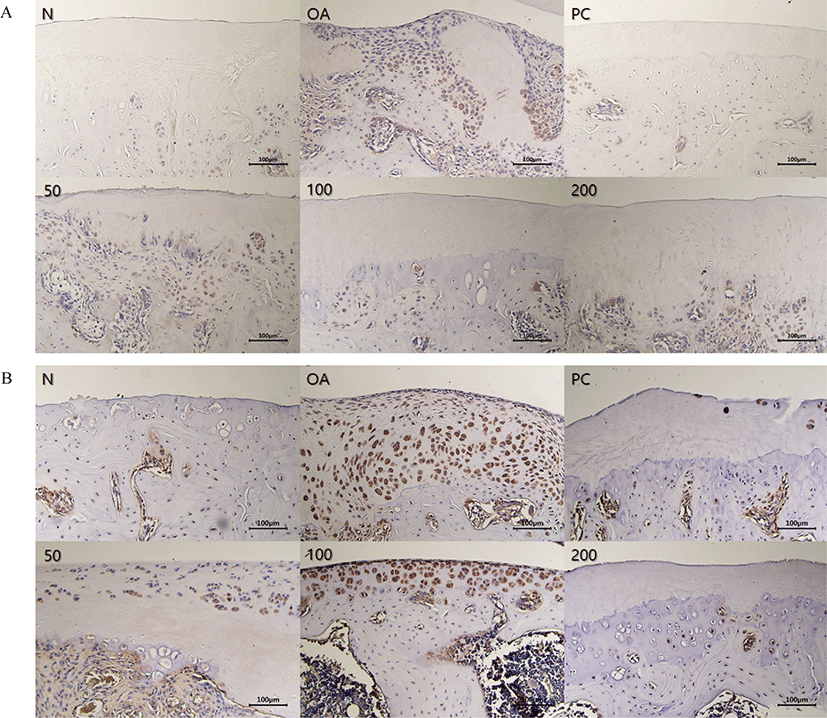
무릎 관절 내 활막세포에서 MMP-3 및 MMP-9의 발현정도를 확인하기 위하여 면역화학염색을 진행하였다. Fig. 8(A)에 나타낸 바와 같이, MIA를 이용하여 골관절염 유도시, 갈색 또는 노란색 입자가 세포질에서 볼 수 있었고, 내피세포 및 염증 세포에 염색이 되었으며, 활액 세포, 혈관 내피 세포가 발현됨을 확인하였다. 또한, Fig. 8(B)에 나타낸 바와 같이 골관절염이 심해지고, 표층뿐만 아니라 전층에 거쳐 MMP-9 발현이 증가되는 것을 확인하였다. 이러한 결과로 미루어 볼 때, ERJ 및 PC 경구투여시, MMP-3 및 MMP-9 발현이 감소되는 것을 확인하였으며, 특히 ERJ 200 mg/kg은 Normal과 비슷한 수준으로 개선됨을 확인하였다.
Discussion
골관절염은 강력한 통증과 기능 장애를 유발하는 퇴행성 무릎 관절 질환이다[35]. 퇴행성 관절염은 나이, 무릎 관절 병변, 비만, 전염병 및 다양한 관절 염증에 따라 증가되는 것으로 알려져 있다[36–39]. 기존 골관절염 치료제는 대부분 비스테로이드성 항염증제(Nonsterodial anti-inflammatory drugs, NSAID) 및 진통제로, 증상이나 징후를 제어하는데 매우 효과적인 것으로 알려져 있으나, 위장관 부작용을 수반하는 것으로 알려져 있다[40]. 이에, 천연물을 이용한 골관절염 개선 효과에 대한 연구가 진행되어지고 있으며, 임상적으로 부작용 위험을 줄일 것으로 보인다[41]. 대식세포(RAW 264.7)는 LPS 자극만으로도 NO를 생성하며[42], IL-1β 및 IL-6와 같은 전염증성사이토카인을 분비시킴으로써 TNF-α 분비를 유발하고, 이로 인해 PGE2의 생성을 증가시킨다[7, 43]. 또한, 골관절염 모델 유도 물질인 MIA는 GAPDH 효소 활성억제제로, 연골 세포 사멸을 유도하는 당분해 억제제이다[44]. SD rat의 관절 내에 MIA 주사시, 사람과 유사한 병변이 빠르게 생성되기 때문에 골관절염 시험의 대표 모델로 이용된다[45]. 10-HDA를 4.5% 이상 함유한 ERJ를 시료로 하여 RAW 264.7 세포에서 염증성 사이토카인 발현에 미치는 영향을 분석하였고, SD rat의 무릎 연골에 MIA를 주입하여 골관절염을 유발하고, ERJ를 경구투여 하여 혈중 염증성 사이토카인 및 연골 조직의 병리학적 분석을 진행하였다.
본 연구에서는 대식세포에 LPS를 처리하여 염증을 유도한 후, ERJ의 염증 개선 효과를 확인한 결과, 염증이 유발된 대식세포에서 ERJ를 처리하면, 세포 사멸의 중요한 매개 인자로 일려져 있는[46] 산화질소의 발현을 감소시키고, IL-1β와 같은 전 염증성 사이토카인의 발현을 감소시킴으로써, 면역 초기에 분비되는 것으로 알려져 있는 TNF-α의 발현을 감소시키고, 통증 유발 물질인 PGE2의 발현을 감소시킴을 확인하였다. 특히 골관절염에 있어 IL-1β와 TNF-α는 연골세포조직의 이화작용에 영향을 주는 중요한 사이토카인으로 알려져 있다[47]. 또한, GAPDH 효소 활성 억제제인 MIA를 이용하여 SD rat에서 골관절염을 유도한 결과, ERJ 경구투여시 혈중 염증성 사이토카인의 분비를 감소시키고, MMP-3 및 MMP-9의 발현을 감소시킴으로써 골관절염 개선 효과가 있음을 확인하였다.
최근까지 골관절염에 대한 다양한 연구가 진행되어 왔으나, 로얄젤리의 골관절염 개선 효능에 대한 연구는 미비한 실정이다. 특히, 본 연구에서 사용된 ERJ는 항염 및 면역개선 기능이 있다고 알려져 있으나[48], 골관절염에 대한 구체적 연구는 없음을 확인하였다. 이에 본 연구에서는 ERJ가 골관절염 개선 효능을 실험을 통하여 확인하였다. 종합적으로, ERJ는 골관절염 유발에 영향을 주는 염증성 사이토카인인 TNF-α 및 IL-6를 억제시키고, 골관절염 발병시 통증 유발에 영향을 주는 PGE2의 발현을 감소시켰으며, 연골 조직의 콜라겐을 분해하는 MMP-3 및 MMP-9의 발현을 억제시킴으로써 골관절염을 개선시키는 것을 확인하였다. 이러한 결과로 비추어 볼 때 ERJ는 향후 골관절염 치료제로 개발이 가능할 것으로 사료된다.
