Original Article
Anti-inflammatory activities of sinensetin on LPS-stimulated L6 skeletal muscle cells
Jin-A Kim1
,†, Sang Eun Ha2
,†, Seong Min Kim2, Preethi Vetrivel2, Gon Sup Kim2
,*

, Eun Hee Kim3
,*

1Department of Physical Therapy, International University of Korea, Jinju 52833, Korea
2Research Institute of Life Science, College of Veterinary Medicine, Gyeongsang National University, Jinju 52828, Korea
3Department of Nursing Science, International University of Korea, Jinju 52833, Korea
These authors equally contribute to this work.
*Corresponding author: Gon Sup Kim Research Institute of Life Science, College of Veterinary Medicine, Gyeongsang National University, Jinju 52828, Korea Tel: +82-55-772-2346, E-mail:
gonskim@gnu.ac.kr
Eun Hee Kim Department of Nursing Science, International University of Korea, Jinju 52833, Korea Tel: +82-55-751-7911, E-mail:
iuknurse@nate.com
© Research Institute of Veterinary Medicine, Chungbuk National University. All rights reserved.
Received: Dec 27, 2018; Accepted: Feb 27, 2019
Abstract
Inflammation is an important protective response mechanism that occurs against microbial invasion or injury. However, excessive inflammation may lead to cause of morbidity and mortality in diseases. The activated macrophages plays a vital role in inflammatory response by stimulation of lipopolysaccharide (LPS) and tumor necrosis factor-α (TNF-α). This activation further damages the host by inducing certain pro-inflammatory mediators such as nitric oxide (NO), interleukin-1β (IL-1β), interleukin-6 (IL-6), TNF-α, inducible nitrous oxide (iNOS) and cyclooxygenase (COX-2). Flavonoids are bioactive compounds with potential effects as anti-cancer, anti-inflammation, anti-viral and anti-bacterial activities. Polymethoxyflavones (PMFs) are unique to citrus plants which are of specific interest owing to their biological effects that includes lipoprotein metabolism and anti-inflammatory activity. Sinensetin is one of the PMFs having five methoxy groups on the basic benzo-γ-pyrone skeleton with a carbonyl group at the C4 position. Sinensetin have been known for exerting various pharmacological activities including anti-angiogenesis, anti-diabetic and anti-inflammatory activities. However, there are no studies focused on the anti-inflammatory effects of sinensetin on skeletal muscle cells. In the present study, we investigated the antiinflammatory effect of flavonoids isolated from Sinensetin on the production of pro-inflammatory mediators mediated by nuclear factor-kappa B (NF-κB) by inhibition of signal transduction in LPS - induced L6 skeletal muscle cells.
Keywords: flavonoids; sinensetin; L6 skeletal muscle cell; anti-inflammation; NF-κB signaling
Introduction
근육에서의 천연물질을 이용하여 염증반응을 조절하는 연구의 중요성이 높아지고 있다. 염증성 사이토카인(tumor necrosis factor-α [TNF-α], interleukin-6 [IL-6]) 및 염증 유 발 단백질(inducible nitrous oxide [iNOS], cyclooxygenase [COX-2])의 증가는 근육의 이화작용을 촉진시켜 근육량과 근력의 감소 및 체내에 지방을 축적시켜 면역노화 현상을 유발시킨다[1-3]. 근육질환에서 가장 중심이 되는 근육 기능 감소는 염증으로 유발되거나 대사성(metabolic) 근육 질환으 로 발생된다. 근육질환에 따라 근력약화가 진행하는 정도, 속도는 다르나 노화가 되어감에 따라 점차 심해진다[4]. 근 육감소와 염증발현 과정에서 나타나는 염증유발단백질은 근 육량과는 역상관관계를 나타내어 노화로 인한 근감소증에 중요한 영향을 미친다[5]. 따라서 천연물질을 통한 골격근의 염증발현 단백질을 확인하고, 신호전달기전에 대한 영향을 알아보고자 한다.
플라보노이드는 다양한 물질 속에 포함되어 있으며, 특히 식물의 물질대사 과정이나 식물의 조직에 존재한다. 폴리메 톡실레이티드 플라본스는 생물학적 효과로서 항염증, 항암, 항산화, 항바이러스, 임파구 증식억제, 궤양 감소 등에 관여 하는 것으로 보고되고 있다[6]. 폴리메톡실레이티드 플라본 스(polymethoxylated flavones, PMFs)는 노빌레틴(nobiletin), 시넨세틴(sinensetin), 탄게레틴(tangeretin), 헤스페리딘(hesperidin) 이 주요 활성 물질로서 그 중 시넨세틴은 면역조절 과 항염증반응에 관여한다[7]. 또한 시넨세틴과 노빌레틴은 적혈구의 응집 비율을 감소시키며, 시넨세틴과 헤스페리딘 은 질병 방어물질로서의 작용을 한다[8]. 배당체로 존재하는 대부분의 플라보노이드 화합물은 5개의 메톡시 그룹(15-카 본, C6-C3-C6)에 속하고, C4 위치의 카보닐 그룹과 함께 하 는 구조로 두 개의 원자고리가 접합된 기본골격으로 구성되 어 있다[9]. 시넨세틴의 주요 화학적 구조는 H, H, OCH3로 구성되어 있다[10].
염증 반응은 세균의 침입 또는 신체 손상으로 인한 보호 기전으로 작용한다. 지나친 염증 반응은 질병의 병리적 기 전을 활성화시키고, 이환율이나 사망률의 원인이 되기도 한 다[11, 12]. 그 중 염증 반응으로 인한 면역노화의 주요 병 리학적 과정으로서 골격근의 근육량 감소와 근력의 감소가 나타나며, 조직에 발생한 암, 근육에 발생한 암, 근육질환에 서의 근위축 그리고 패혈증의 병리적 변화에 의해서도 근육 의 감소가 나타난다[13, 14]. 근육량의 감소는 염증반응이 지 속될 때, 이상지질혈증, 당뇨, 림프구 증가, 관절염, 죽상동 맥경화증이 있을 때 근육단백질 분해가 가속화 된다[15].
근육세포막에 위치하고 있는 TLR4(toll like receptor)는 병원체를 통한 기존의 면역반응을 유도함으로써 항염증의 여러 단계들을 활성화 시키는 수용체이다[16]. 지방질다당류 Lipopolysaccharide(LPS)는 급성 염증 반응을 촉진시켜 면역 세포들을 활성화시킨다[17]. LPS는 그람음성균의 외막 복합 체에 위치하고 있으며, TLR4의 리간드(ligand)와 작용제(agonist) 로서 작용하여 TLR4가 조직 손상이나 감염에 대해 염 증반응을 인식한다[18].
TLR4의 하위신호기전으로 MyD88 유도를 통해 IκB를 활성화시켜, IκB의 인산화로 인해 p65와 p50으로 구성되는 NF-κB(nuclear factor κB)와 ERK, JNK, p38로 구성되는 MAPK(mitogen-activated protein kinase)의 활성화를 유도한 다[19].
LPS에 의해서 분비되는 염증유발물질로서 대표적으로 COX-2, inducible nitric oxide synthase(iNOS)가 있다[20].
3가지 화학적 성상으로 나타낼 수 있는 iNOS는 neuronal NOS, endothelial NOS, inducible NOS로 나눌 수 있으며, 그 중 LPS나 사이토카인, 세균에 의해 발현되는 iNOS가 있 다[21, 22]. 그리고 정상 생체 기능에 작용하는 COX-1과 염 증반응 부위에서 발현되는 COX-2가 있다[23].
플라보노이드의 유용 성분들을 이용한 연구는 활발히 진 행되고 있으나, 폴리메톡실레이티드 플라본스의 시넨세틴에 대한 연구는 아직 미미하며, 특히 골격근 세포에서의 연구 도 부족한 실정이다. 따라서 본 연구에서는 시넨세틴이 LPS 로 유도된 L6 골격근 세포에서 염증 관련 단백질 발현 양상 을 확인함으로써 항염증 작용에 미치는 영향을 조사하였다.
Material and Methods
재료 및 시약
Skeletal muscle cell line인 L6 세포는 한국세포주은행 (Korean Cell Line Bank, Seoul Korea)으로부터 구입하였으 며, 세포배양에 사용한 Dulbecco’s Modified Eagle Medium (DMEM)은 Gibco-BRL, Rockville, MD, USA에서 구입하였 고, fetal bovine serum(FBS), penicillin-streptomycin 등은 Gibco(BRL Life Technologies, Grand Island, NY, USA)에 서 구입하였다. 시넨세틴은 MedChem Express(MedChem Express, New Jersey, USA)에서 구입하였다. LPS와 MTT(3- (4,5-dimethylthiazol-2-yl)-2,5 diphenyltetrazoleum), β-actin antibody는 Sigma Chemical Co.(St. Louis, MO, USA)에서 구입하였고, iNOS, COX-2, IκB, phospho-IκB, p65, phospho- p65, β-actin은 Cell Signaling Technologies(Beverly, MA, USA)에서 구입하였다.
세포 배양법
Skeletal muscle cell line인 L6 세포는 한국세포주은행 (Korean Cell Line Bank, Seoul Korea)으로부터 구입하였으 며, 10% FBS와 100 uint/mL penicillin-stretomycin(GIBCO Inc, New York, NY, USA)이 포함된 DMEM(GIBCO Inc, NY, USA) 배지를 사용하여 37℃, 5% CO2 항온기에서 배 양하였다.
세포 생존율 측정
세포증식과 독성을 측정하기 위해 MTT assay를 실시하 였다. L6 세포를 10% FBS와 1% penicillin-streptomycin이 포함된 배지를 사용하여 48well plate에 5 × 104 cells/well로 분주하고, 37℃, 5% CO2 항온기에서 24시간 동안 배양하였 다. 배양한 L6 세포는 동일한 새 배지로 교체한 후 LPS(2 μg/ mL)로 1시간 전 처리 후, 시넨세틴을 0, 5, 15 μM의 다양한 농도로 처리하여 24시간 배양하였다. 24시간 후 5 mg/mL의 MTT 용액 50 μL를 각 well에 넣고 incubator에 3시간 동안 배양하였다. 배양이 끝난 후 상등액을 제거하고 각 well에 500 μL의 DMSO(dimethyl sulfoxide)를 첨가하여 10분 동안 Shaker에 돌린 후 550 nm에서 흡광도를 측정하였다.
Western blot analysis
L6 세포가 5 × 105 cells/well의 농도가 되게 60 mm plate 에 분주하고, 37℃, 5% CO2 항온기에서 24시간 동안 배양 하였다. 배양한 L6 세포는 동일한 새 배지로 교체한 후 LPS(2 μg/mL)로 1시간 전 처리 후, 시넨세틴을 0, 5, 15 μM 의 다양한 농도로 처리하여 24시간 배양하였다. 시료 처리가 완료된 세포를 2회 1 × PBS로 세척한 후 1 mL의 1 × PBS 를 첨가하여 스크래퍼로 세포를 모아준 후 1.5 mL Conical tube로 옮겨주었다. 4℃에서 2,000 × g으로 5분간 원심 분리 한 후 상등액을 완벽히 제거하고, 셀만 획득하였다. RIPA buffer(iNtRON Biotechnology, Korea)를 50 μL 첨가, 충분 한 피펫팅을 한 뒤 ice에서 30분–1시간 동안 용해시킨 후 4℃에서 9,500 × g으로 10분간 원심 분리하여 세포막 성분 등 을 제거하였다. 단백질 농도는 PierceTM BCA assay(Thermo Fisher Scientific, Rockford, IL 61101, USA)를 사용하여 정 량하였다. 4℃에서 9,500 × g으로 10분간 원심 분리한 상등 액을 이용하여 단백질을 정량하였다. Total cell lysate(단 백질 20 μg)를 8%, 10% running gel과 4.5% stacking gel을 이용하여 gradient sodium dodecyl sulfate polyacrylamide gel electrophoresis(SDS-PAGE)로 크기에 따라 단백질을 분 리한 후, polyvinylidene fluoride(PVDF) membrane에 이동시 켰다. 단백질이 이동된 membrane은 5% non-fat skim milk solution 또는 BSA solution으로 blocking하였다. 측정하고 자 하는 1차 항체를(iNOS 1:1,000, COX-2 1:1,000, I-κB 1:1,000, phospho-IκB 1:1,000, p65 1:1,000, phospho-p65 1:1,000, β-actin 1:10,000) 각각 첨가하여 skim milk 혹은 BSA solution에 희석하여 24시간 반응시킨 후, Tris-Buffered Saline and Tween 20(TBS-T) 용액으로 5회 세척하였다. 계 속하여 2차 항체(anti-rabbit, anti- mouse, anti-goat)를 3시간 반응시키고, 다시 TBS-T 용액으로 5회 세척하였다. Membrane에 ECL detection kit의 시약 Ⅰ과 Ⅱ를 1:1로 섞은 후 에 혼합액을 도포하고, ECL detection system(Bio-Rad Laboratory, Hercules, CA, USA)을 이용하여 iNOS, COX-2 및 I κB, NF-κB의 phosphorylation을 관찰하였다. 각 단백질 밴 드의 강도는 ImageJ(http://rsb.info.nih.gov)을 사용하여 수치 화 하였다.
통계분석
모든 실험의 값은 3회 실시 후 평균값을 기초로 하였으며, 평균 ± 표준편차(mean ± S.D.)로 표시하였다. 각 통계학적 비교분석은 GraphPad PRISM statistical package(GraphPad PRISM statistical package(ver 2.00), GraphPad software inc., USA)를 이용하였고, p<0.05일 경우 유의한 것으로 판정하 였다.
Results
세포독성분석
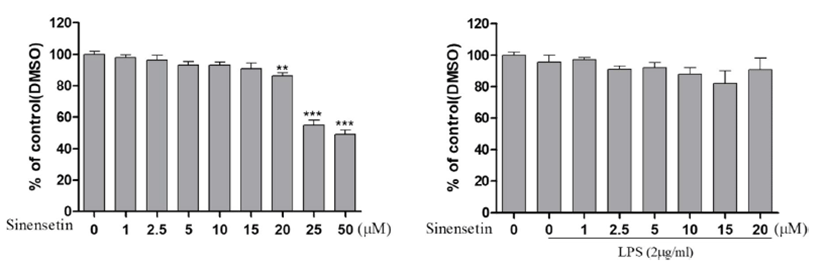
본 연구에 앞서 skeletal muscle cell인 L6 세포에 시넨세 틴이 독성을 나타내는지 알아보기 위해 Cell viability assay 를 수행하였다. 세포증식과 독성을 측정하기 위해 3-(3,4- dimethyl-thiazolyl-2)-2,5-diphenyl tetrazolium bromide(MTT) assay를 실시하였다. L6 세포를 10% FBS와 1% P/S가 포함 된 배지를 사용하여 48 well plate에 5 × 104 cells/well로 분 주하고, 37℃, 5% CO2 항온기에서 24시간 동안 배양하였다. 배양한 L6 세포는 동일한 새 배지로 교체한 후 시넨세틴을 0, 1, 2.5, 5, 10, 15, 20, 25, 50 μM의 다양한 농도로 처리하 여 24시간 배양하였다. MTT assay에 의한 세포생존율 측 정법에서는 50 μM의 농도를 처리하였을 때, 세포생존율이 50% 미만으로 급격하게 감소하는 것을 확인할 수 있었다 (Fig. 1). 같은 방법으로 2 μg LPS를 1시간 전처리 후, 시넨 세틴을 0, 1, 2.5, 5, 10, 15, 20, 25, 50 μM의 다양한 농도로 처리하여 24시간 배양하였다. 그 결과, 모든 농도에서 세포 생존율이 80% 이상으로 확인되었다(Fig. 1). 따라서 5, 15 μM 농도의 시넨세틴과 2 μg 농도의 LPS를 추후 실험에 서 진행하였다. Fig. 1에서 각각의 수치는 평균 ± 표준편차 (mean ± S.D.)로 표시했으며, p<0.05일 경우 유의한 것으로 판정하였다.
Fig. 1.
Effect of cell viability in LPS-induced L6 skeletal muscle cells. L6 skeletal muscle cells were incubated with the indicated concentrations of sinensetin in the absence or presence of LPS (2 μg/mL) for 24 h. The L6 cell viability was assayed using MTT. Results represent the mean ± S.D. of three independent experiments. **p<0.01 vs. control group, ***p<0.001 vs. control group. LPS, lipopolysaccharide; MTT, 3-(4,5-dimethylthiazol-2-yl)-2,5 diphenyltetrazoleum; DMSO, dimethyl sulfoxide.
Download Original Figure
iNOS, COX-2 발현에 미치는 시넨세틴의 효과
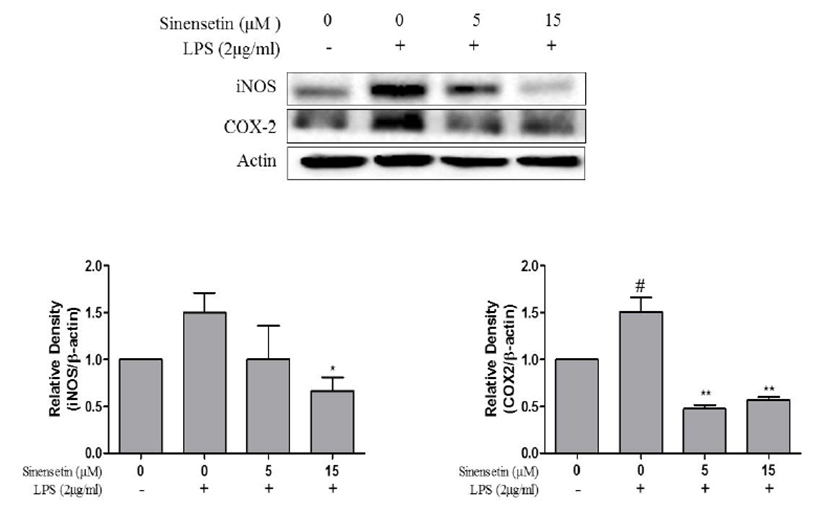
iNOS와 COX-2는 염증 매개물질인 NO를 생성하는데 중 요한 역할을 하는 효소이다. iNOS와 COX-2 단백질의 발현 억제와 항염증효과 간의 상관관계를 조사하기 위하여 Western blot을 수행하였다. L6 세포에 LPS를 처리하였을 때 iNOS 와 COX-2 단백질의 발현이 증가되었고, 5, 15 μM 농도의 시넨세틴 처리에 의해 두 단백질의 발현이 모두 감소하였다 (Fig. 2). 이러한 결과를 통해 시넨세틴에 의해 염증 매개물 인 iNOS와 COX-2의 발현을 유의한 수준에서 억제시킴을 확인하였고, 동시에 항염증의 효과가 있음을 시사한다. Fig. 2에서 각각의 수치는 평균 ± 표준편차(mean ± S.D.)로 표시 했으며, p<0.05일 경우 유의한 것으로 판정하였다.
Fig. 2.
Inhibition effects of sinensetin on the expression of iNOS and COX-2 in LPS-stimulated L6 skeletal muscle cells. L6 cells were pretreated with LPS (2 μg/mL) for 1 h and incubated with 5, 15 μM sinensetin for 24 h. The protein (iNOS and COX-2) expression were identified by SDS-PAGE and quantified using ImageJ software. Results represent the mean ± S.D. of three independent experiments. #p<0.05 vs. control group, **p<0.01 vs. LPS group. iNOS, inducible nitrous oxide; COX-2, cyclooxygenase; LPS, lipopolysaccharide.
Download Original Figure
IκB 발현에 미치는 시넨세틴의 효과
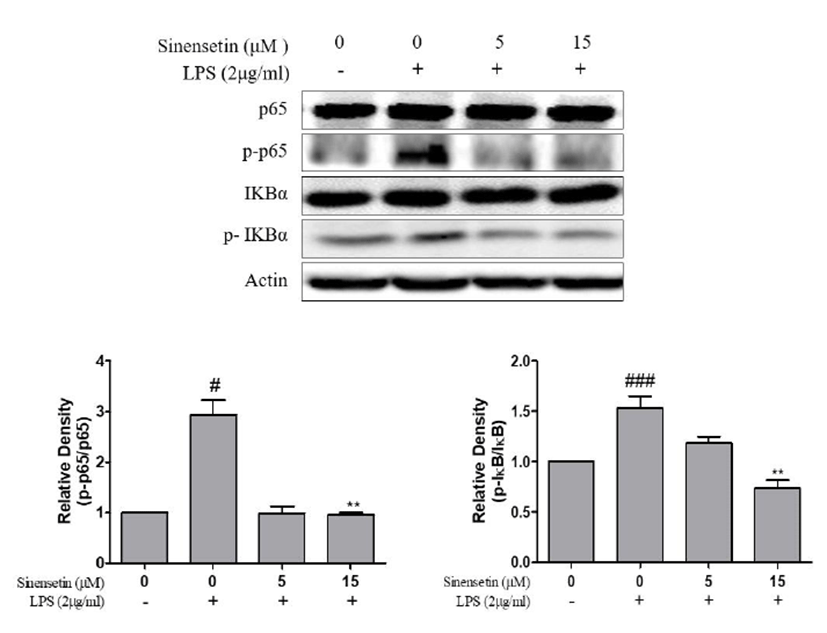
염증 반응에 있어서 NF-κB는 iNOS와 COX-2의 발현을 조 절하는 것으로 알려져 있다. 따라서 시넨세틴이 NF-κB의 발 현에 미치는 영향을 조사하기 위하여 Western blot을 수행하 였다. L6 세포에 LPS를 처리하였을 때 IκB와 phospho-IκB, p65와 phospho-p65 단백질의 발현이 증가되었고, 5, 15 μM 농도의 시넨세틴처리에 의해 발현을 유의적으로 억제시켰다 (Fig. 3). 따라서 이러한 결과를 통해 시넨세틴이 L6 세포에 서 LPS에 의해 활성화 되는 NF-κB signaling을 억제할 수 있음을 시사한다. Fig. 3에서 각각의 수치는 평균 ± 표준편차 (mean ± S.D.)로 표시했으며, p<0.05일 경우 유의한 것으로 판정하였다.
Fig. 3.
Inhibition effects of sinensetin on the expression of NF-κB signaling pathway in LPS-stimulated L6 skeletal muscle cells. L6 cells were pretreated with LPS (2 μg/mL) for 1 h and incubated with 5, 15 μM sinensetin for 24 h. The protein (p65, phospho-p65, I-κB, phospho-IκB) expression were identified by SDS-PAGE and quantified using ImageJ software. Results represent the mean ± S.D. of three independent experiments (*p<0.05). #p<0.05 vs. control group, ###p<0.001 vs. control group, **p<0.01 vs. LPS group, LPS, lipopolysaccharide.
Download Original Figure
Discussion
동물에서 균체 내 독소(endotoxin) 즉 LPS로 인해 근육 조직 내에서 대사성 변화가 나타나고, 이러한 변화로서 근육 단백질 결합이 감소되며, 근육단백질 분해가 증가됨을 보인 다[24]. LPS 유발된 쥐의 근육에서 염증을 일으키는 사이토 카인 유발 효소와 iNOS의 감소는 근육의 염증에 대한 저항 성을 나타낸다[25].
NOS는 산화질소를 생성하여 병리학적 작용들을 나타내 고, 특히 iNOS는 혈관내피세포, 대식세포를 포함한 다양한 조직에서 LPS에 의해 다량의 산화질소를 생성하여 염증작 용 등의 유해작용을 나타내는 것으로 보고되었다[26]. 폴리 페놀이 함유된 배초향은 iNOS 발현을 억제하여 산화질소 생성을 억제하였고, 염증매개인자의 발현의 억제됨을 보고 하였다[27]. 본 연구의 시넨세틴이 iNOS 활성을 감소하여 염증반응에 대한 억제 효과가 나타났으며, 시넨세틴이 골격 근의 항염증 물질로서의 가능성을 보여준다고 할 수 있다.
다양한 신호전달체계를 통해 염증유발물질 중 cytokine 이나 COX-2와 같은 물질들을 유도하여 염증반응 및 알레르 기 반응 등 여러 질병을 유발하게 된다[28]. 플라보노이드 가 함유된 사과 과피 추출물에 의해 체내 항상성 유지와 관 련된 효소인 COX-1은 고농도에서만 저해효과를 나타내어 거 의 영향을 주지 않았으며, 염증 반응에 효과적 완화를 위한 COX-2는 모든 농도에서 활성이 억제됨을 보였다[29, 30].
근육에서 LPS 증가로 인해 TLR-4 매커니즘이 활성화 되 고, 이를 통해 iNOS, COX-2, TNF-α 등 사이토카인 인자를 증가시킨다[31]. 플라보노이드가 포함된 포도가지 추출물 처리 시 iNOS, COX-2 단백질 발현 억제를 통해 산화질소 (nitric oxide, NO) 및 프로스타글란딘 E2(prostaglandin E2) 의 생성억제로 이어져 염증반응을 제어하는데 효과적이었다 [32]. 본 연구에서도 LPS에 의해 유도된 골격근세포에서 염 증 유발 인자인 iNOS, COX-2 단백질 발현을 효과적으로 억 제시켜 시넨세틴이 근육염증 감소에 효과적임을 확인하였다.
NF-κB는 항염증 기전에서 주요한 인자로서 만성 염증 질환의 염증 반응을 변형시키는데 매우 중요한 작용을 한 다. 유도성 전사 인자로서 모든 세포에서 발현되는 NF-κB 는 염증 반응이 일어날 때 세포의 신호전달기전에서 발생되 는 대표적인 물질로서 세포의 외부자극에 대한 방어 작용과 면역세포의 활성화를 일으켜 염증 반응과 관련된 다양한 유 전자 발현을 조절하는 것으로 알려져 있다[33-35].
IκB(inhibitor of κB)의 인산화(phosphorylation)와 분해 (degradation)가 전사요소인 NF-κB의 활성화를 유도한다[36]. NF-κB가 활성화 되면 I-κB가 분해되면서 NF-κB가 핵 내로 이동하여 COX-2, iNOS 등의 전사를 유도한다[37]. NF-κB p65의 인산화와 전사 활성으로 핵으로 전좌(이동, translocation) 가 일어난다[38]. NF-κB의 p65는 LPS 처리한 경우 증가하였으며, 플라보노이드 처리시 농도 의존적으로 발현 이 감소하여 NF-κB의 활성화를 감소시켜 함염증 효과를 확 인하였다[35].
L6 세포에서 H2O2로 유도된 산화적 스트레스가 NF-κB 핵으로의 전사이동뿐만 아니라, TNF-α를 활성화시키고, 이 를 플라보노이드가 내부의 산화방지 매커니즘을 통해 TNF- α와 NF-κB의 핵으로의 이동이 감소함을 보였다[39, 40]. 본 연구에서 NF-κB의 subunit인 p65 감소로 인해 시넨세틴이 NF-κB의 감소 및 COX-2, iNOS 전사를 억제하여 항염증 반응에 효과적임을 유추할 수 있었다.
현재 시넨세틴으로 골격근세포에서 항염증 효과를 조사 한 연구가 거의 없으며, 본 연구결과, 시넨세틴이 COX-2, Inos 활성을 저해하여 염증을 억제함으로써 항염증을 이룰 수 있 음을 확인하였다. 향후 시넨세틴을 이용한 골격근세포의 항 염 활성 및 항염을 통한 근감소증 효과에 대한 추가 연구가 필요할 것으로 사료된다.
Conclusion
본 연구는 시넨세틴이 L6 세포에 LPS로 유도된 염증 반 응에 미치는 영향에 대하여 연구를 수행하였다. 시넨세틴을 L6 세포에 2 μg 농도의 LPS와 함께 0, 5, 15 μM의 농도로 처리하여 세포를 배양한 후, 실험을 진행하였다. 그 결과, L6 세포에서 LPS에 의해 유도된 iNOS, COX-2의 단백질이 유 의하게 억제되었으며, iNOS와 COX-2의 발현 조절 인자인 NF-κB 또한 현저히 억제되었다. 현재 시넨세틴으로 항염증 효과를 연구한 논문이 거의 없고, 낮은 농도에서 시넨세틴 의 항염증 효과가 탁월한 점을 보았을 때, 시넨세틴은 뛰어 난 항염증 효과를 가진 단일물질이라고 사료된다. 따라서 위의 결과는 시넨세틴이 골격근 세포에서 항염증 효과뿐만 아니라, 항염을 통한 근감소증을 치료하는 효과에 대한 추 가 연구가 기대된다.
Acknowledgements
본 연구는 2018년도 정부(과학기술정보통신부)의 재원으 로 한국연구재단(No. NRF-2017R1C1B5077027)의 지원에 의하여 수행된 연구입니다.
References
Nair KS. Aging muscle. Am J Clin Nutr 2005;81:953-963.

Bastard JP, Maachi M, Lagathu C, Kim MJ, Caron M, Vidal H, Capeau J, Feve B. Recent advances in the relationship between obesity, inflammation, and insulin resistance. Eur Cytokine Netw 2006;17:4-12.
Ahn NY, Kim KJ. Effects of exercise training on the immune function & TLR4/SOCS3 signal pathway mechanism in aging. J Korean Phys Edu Assoc Girls Women 2016;30: 253-269.

Staples WH, Heitzman J, Kegelmeyer DA, Goehring M. Geriatric physical therapy: a case study approach. New York: Mc Graw Hill Education; 2016.
Schrager MA, Metter EJ, Simonsick E, Ble A, Bandinelli S, Lauretani F, Ferrucci L. Sarcopenic obesity and inflammation in the In CHIANTI study. J Appl Physiol 2007;102:919-925.

Kim YD, Ko WJ, Koh KS, Jeon YJ, Kim SH. Composition of flavonoids and antioxidative activity from juice of Jeju native citrus fruits during maturation. Korean J Nutr 2009;42: 278-290.

Lin N, Sato T, Takayama Y, Mimaki Y, Sashida Y, Yano M, Ito A. Novel anti-inflammatory actions of nobiletin, a citrus polymethoxy flavonoid, on human synovial fibroblasts and mouse macrophages. Biochem Pharmacol 2003;65:2065-2071.

El-Shafae AM. Bioactive polymethoxyflavones and flavanone glycosides from the peels of Citrus deliciosa. Chin Pharm J 2002;54:199-206.
Li S, Pan MH, Lo CY, Tan D, Wang Y, Shahidi F, Ho CT. Chemistry and health effects of polymethoxyflavones and hydroxylated polymethoxy flavones. J Funct Foods 2009;1:2-12.

Kim JW, Kim MC, Nam KC, Lee SC. Effect of electronbeam irradiation on polymethoxylated flavones content of Citrus unshiu pomaces. J Food Sci Nutr 2009;14:362-366.

Tracey KJ. The inflammatory reflex. Nature 2002;420:853-859.

Shin HS, Kang SI, Yoon SA, Ko HC, Kim SJ. Sinensetin attenuates LPS-induced inflammation by regulating the protein level of IκB-α. Biosci Biotechnol Biochem 2012;76: 847-849.

Garatachea N, Lucia A. Genes and the ageing muscle: a review on genetic association studies. Age (Dordr) 2013;35: 207-233.

Park JH, Chung EJ, Kwon HJ, Im SS, Lim JG, Song DK. Protective effect of melatonin on TNF-α-induced muscle atrophy in L6 myotubes. J Pineal Res 2013;54:417-425.

Hilton TN, Tuttle LJ, Bohnert KL, Mueller MJ, Sinacore DR. Excessive adipose tissue infiltration in skeletal muscle in individuals with obesity, diabetes mellitus, and peripheral neuropathy: association with performance and function. Phys Ther 2008;88:1336-1344.

Medzhitov R. Toll-like receptors and innate immunity. Nat Rev Immunol 2001;1:135-145.

Lee MJ, Do EK, Kim JH. Role of LPS-activated macrophages in the differentiation of mesenchymal stem cells into smooth muscle cells. J Life Sci 2013;23:137-142.

Lee JY, Sohn KH, Rhee SH, Hwang D. Saturated fatty acids, but not unsaturated fatty acids, induce the expression of cyclooxygenase-2 mediated through toll-like receptor 4. J Biol Chem 2001;276:16683-16689.

Hussey SE, Liang H, Costfford SR, Klip A, DeFronzo RA, Avila AS, Ely B, Musi N. TAK-242, a small-molecule inhibitor of toll-like receptor 4 signalling, unveils similarities and differences in lipopolysaccharide- and lipid induced inflammation and insulin resistance in muscle cells. Biosci Rep 2013;33:37-48.

Kim JA, Arulkumar N, Park HS, Saralamma VVG, Hong GE, Yumnam S, Lee HJ, Raha S, Kim EH, Young PS, Kim GS. Proteome profiling of lipopolysaccharide induced L6 rat skeletal muscle cells response to flavonoids from Scutellaria baicalensis Georgi. BMC Complement Altern Med 2014;14:379-389.

Kim DH, Hwang EY, Son JH. Anti-inflammatory activity of Carthamus tinctorious seed extracts in raw 264.7 cells. J Life Sci 2013;23:55-62.

Yun HY, Dawson VL, Dawson TM. Neurobiology of nitric oxide. Crit Rev Neurobiol 1996;10:291-316.

Masferrer JL, Zweifel BS, Manning PT, Hauser SD, Leahy KM, Smith WG, Isakson PC, Seibert K. Selective inhibition of inducible cyclooxygenase 2 in vivo is antiinflammatory and nonulcerogenic. Proc Natl Acad Sci USA 1994;91:3228-3232.

Goodman MN. Tumor necrosis factor induces skeletal muscle protein breakdown in rats. Am J Physiol Endocrinol Metab 1991;260:727-730.

Pilon G, Charbonneau A, White PJ, Dallaire P, Perreault M, Kapur S, Marette A. Endotoxin mediated-iNOS induction causes insulin resistance via ONOO-induced tyrosine nitration of IRS-1 in skeletal muscle. PLoS ONE 2010;5: 15912.

Geller DA, Billiar TR. Molecular biology of nitric oxide synthases. Cancer Metastasis Rev 1998;17:7-23.

Kim B, Han YE, Lee HJ. Antioxidant and anti-inflammatory effects of the ethyl acetate fraction of the Agastache rugosa extract. Korean J Food Sci Technol 2017;49:331-337.
Rhee SH, Hwang D. Murine toll-like receptor 4 confers lipopolysaccharide responsiveness as determined by activation of NF-κB and expression of the inducible cyclooxygenase. J Biol Chem 2000;275:34035-34040.

Charlier C, Michaux C. Dual inhibition of cyclooxygenase-2 (COX-2) and 5-lipoxygenase (5-LOX) as a new strategy to provide safer non-steroidal anti-inflammatory drugs. Eur J Med Chem 2003;38:645-659.

Kim IR. Inhibitory effects of apple peel extract on inflammatory enzymes. Korean J Food Sci Technol 2015;474:534-538.

Frost RA, Nystrom GJ, Lang CH. Lipopolysaccharide regulates proinflammatory cytokine expression in mouse myoblastsand skeletal muscle. Am J Physiol Regul Integr Comp Physiol 2002;283:698-709.

Cho BO, Yin HH, Che DN, Kim SJ, Ryu C, Jang SI. Antioxidant, anti-inflammatory, and anti-pruritic effects of grape branch extract. Korean J Food Sci Technol 2016;48:590-596.

Ghosh G, Wang VY, Huang DB, Fusco A. NF-κB regulation: lessons from structures. Immunol Rev 2012;246:36-58.

Kim HN, Park SB, Park GH, Eo HJ, Song JH, Kwon HY, Jeong JB. Anti-inflammatory effect of the root extracts from Hibiscus syriacus in LPS-stimulated RAW264.7 cells. Korean J Plant Res 2018;31:211-217.
Woo HS, Lee SM, Heo JD, Lee MS, Kim YS, Kim DW. Anti-inflammatory activity of extracts of Hovenia dulcis on lipopolysaccharides-stimulated RAW264.7 cells. Korean J Plant Res 2018;31:466-477.
Youn HS. Anti-inflammatory effects of phytochemicals having Michael addition acceptors by the modulation of toll-like receptor signaling pathways. Korean J Food Sci Technol 2009;41:477-482.
Kim DH, Chung JH , Yoon JS, Ha YM, Bae S, Lee EK, Jung KJ, Kim MS, Kim YJ, Kim MK, Chung HY. Ginsenoside Rd inhibits the expressions of iNOS and COX-2 by suppressing NF-κB in LPS-stimulated RAW264.7 cells and mouse liver. J Ginseng Res 2013;37:54-63.

Wang D, Baldwin, Jr AS. Activation of nuclear factor-κBdependent transcription by tumor necrosis factor-α is mediated through phosphorylation of RelA/p65 on serine 529. J Biol Chem 1998;273:29411-29416.

Favero G, Rodella LF, Nardo L, Giugno L, Cocchi MA, Borsani E, Reiter RJ, Rezzani R. A comparison of melatonin and α-lipoic acid in the induction of antioxidant defences in L6 rat skeletal muscle cells. AGE 2015;37:83.

Aoi W, Naito Y, Takanami Y, Kawai Y, Sakuma K, Ichikawa H, Yoshida N, Yoshikawa T. Oxidative stress and delayed-onset muscle damage after exercise. Free Radic Biol Med 2004;37:480-487.