Original Article
The effect of Puerariae Radix on ovariectomy-induced bone loss in C3H/HeN mice
Byungsu Ahn1, Sueun Lee1, Sohi Kang1, Changjong Moon1, Jong-Choon Kim1, Jong-Sik Jang2, Sung-Ho Kim1
,*

1College of Veterinary Medicine, Chonnam National University, Gwangju 61186, Korea
2College of Ecology and Environmental Science, Kyungpook National University, Sangju 37224, Korea
*Corresponding author: Sung-Ho Kim College of Veterinary Medicine, Chonnam National University, Gwangju 61186, Korea Tel: +82-62-530-2837, E-mail:
shokim@jnu.ac.kr
© Research Institute of Veterinary Medicine, Chungbuk National University. All rights reserved.
Received: Aug 17, 2018; Accepted: Nov 8, 2018
Abstract
Osteoporosis is a major worldwide public health problem that poses a great economic burden to society. Puerariae Radix, the dried root of Pueraria lobata (Wild.) Ohwi, has been widely used in Asia. This study investigated the effects of Puerariae Radix (PR) on bone loss in ovariectomized (OVX) mice. C3H/HeN mice (10 weeks old) were divided into sham and OVX groups. The OVX mice were treated with vehicle, 17β-estradiol (E2), PR (oral administration, 250 mg/kg/day) or PR (intraperitoneal administration, 50 mg/kg/every other day) for 6 weeks. Grip strength, uterus weight, serum alkaline phosphatase (ALP), estradiol concentration and osteoclast surface levels were measured. Tibiae were analyzed using microcomputed tomography. There were no significant differences in the degree of grip strength, body weight and uterine weight between OVX group and PR-treated group. As compared with the OVX group, the serum estradiol levels were significantly increased in the PR-treated group. PR (i.p.) significantly preserved trabecular bone volume, trabecular bone number, structure model index and bone mineral density of proximal tibiae metaphysic. The administration of PR lowered serum ALP and osteoclast surface levels in OVX mice, suggesting that PR can reduce the bone turnover rate in mice. The results indicate that the supply of PR can prevent OVX-induced bone loss in mice.
Keywords: Puerariae Radix; ovariectomy; osteoporosis; microcomputed tomography; C3H/HeN mouse
Introduction
골다공증은 뼈량의 감소와 뼈 조직의 미세구조 결함에 따라 뼈의 취약성이 증가하고, 골절의 가능성이 증가하는 전신적 골격질환으로서, 골밀도(bone mineral density)를 기준으로, 젊은이의 평균에서 표준편차 범위내의 수치일 경우 정상, 표준편차의 1 - 2 . 5 배 감소 수치일 경우 골감소증( o s t e o p e n i a ) , 표준편차의 2 . 5배 이상 감소 수치일 경우를 골다공증(osteoporosis)으로 정의하였으며, 취약골절(fragility fracture)의 뼈 상태로 표현하였다. 취약골절은 골다공증의 특징이며, 전신 골격의 어디에서나 발생하나, 특히 척추, 엉덩부위 및 상완골 원위부의 골절이 일반적이다[1, 2]. 뼈 건강에 좋은 요인으로는 칼슘, 구리, 아연, 불소, 마그네슘, 인, 칼륨, 비타민 C, D, K 및 B 복합체, n-3 지방산, 식물에스트로겐(phytoestrogen) 등이며, 위해 요인은 과도한 알코올, 카페인, 염분, 불소, 인 및 n-6 과불포화 지방산이며, 과도하거나 불충분한 단백질 및 비타민 A 등이다[2].
에스트로겐의 부족은 골다공증 발생의 주요 요인 중 하나이며, 호르몬대체치료( h o r m o n e r e p l a c e m e n t therapy, HRT)가 폐경기 여성에서 뼈 소실 예방을 위한 방법으로 알려져 있다[ 3 ] . 그러나 H R T의 영향으로 악성종양 발생 증가를 비롯한 부작용들은 물론, HRT 제제의 흡수 저하 등에 따라 HRT의 대체 또는 부가제로서 식이성 식물에스트로겐이 관심의 대상이 되고 있다[4, 5]. 식물에스트로겐은 식물유래 식품 특히 콩과 식물을 비롯한 식품에 존재하는 비스테로이드성 물질이며, 에스트로겐과 구조적으로 유사하고 에스트로겐 수용체에 경쟁적으로 결합하는 물질이다[5, 6]. 폐경초기 여성에서 콩 유래의 isoflavone의 뼈대사 및 골밀도 개선효과에 관한 역학적 보고[7] 등이 있으나, 식물에스트로겐의 뼈 개선 효과에 대한 여러 평가에서 개선 효과의 결론적 제시가 미흡하며, 따라서 골다공증 예방에 대한 더 많은 연구가 필요하다고 하였다[2, 8].
정량적 미세 단층촬영(microcomputed tomography, μCT) 방법은 소형실험동물의 뼈를 마이크로 단위로 단층 촬영하여 뼈의 총량 및 구조를 나타내는 뼈의 량(bone volume/tissue volume, BV/TV), 잔기둥 두께(trabecular thickness, Tb. Th.), 분리 정도(trabecular separation, Tb. Sp.), 잔기둥 수(trabecular number, Tb. N.), 뼈의 량에 무관하게 연결도와 복잡성을 평가하는 지표인 trabecular bone pattern factor(Tb.Pf.) 그리고 구조적 모델 계수(structural model index, SMI)를 비롯한 3차원 및 2 차원 뼈 상태 평가 지표를 측정하고, 이상의 지표 분석을 통하여 뼈의 량, 잔기둥의 구조 및 연결도 등을 평가한다. BMD의 측정도 2개의 phantom을 측정하고, CT analyzer software를 적용하여 상대분석함으로써 기존 방법에 비해 보다 객관적이고 정확한 평가가 가능하다[9]. 일부 인체 역학연구에서 악력(grip strength)이 뼈 질의 변화와 상관관계를 나타내는 지표로 적용 가능하다는 보고가 있다[10].
본 연구에서는 식물성에스트로겐을 함유한 생약으로 알려진[11] 갈근(Puerariae Radix, PR) 물추출물의 호르몬성 뼈 소실에 미치는 영향을 형태적 평가, 지표 효소 분석 및 악력 측정 등의 방법을 적용하여 평가하였다.
Materials and Methods
실험동물 및 난소 절제술 실시
1 0 주 령 C 3 H / H e N 암 컷 마 우 스 ( 오 리 엔 트 바 이 오 , 성남, 한국)를 사용하였다. 동물의 사육은 온도 22 ± 2℃, 상대습도 50 ± 10%, 조명시간은 12시간(오전 8시 점등-오후 8시 소등) 및 조도 200-300 Lux로 설 정 된 시 설 에 서 사 육 하 였 다 . 순 화 기 간 을 거 쳐 polycarbonate 사육상자에 3마리씩 수용하고, 실험동물용 고형사료(삼양사료, 원주, 한국)와 정수장치를 통과한 수 도 수 를 자 유 롭 게 섭 취 하 도 록 하 였 다 . 실 험 동 물 은 Institute of Laboratory Animal Resources의 ‘Guide for the Care and Use of Laboratory Animal’(1996, USA)에 준하여 취급하였으며, 동물실험은 전남대학교 동물실험윤리위원회의 승인(CNU-YB-2015-16)하에 수행하였다. 마취는 Xylazine HCl(바이엘코리아, 서울, 한국, 23.32 mg/mL)과 Zoletil 50(버박코리아, 서울, 한국, 0.1 mL/100 g)을 혼합하여 복강 내 주사 마취하고 동물을 등쪽으로 고정한 후 정중등쪽의 피부를 절개해 핀셋으로 근육을 관통하여 좌우측 난소를 각각 노출시키고 적출하였다. 대조군은 난소 적출군과 동일한 방법으로 난소를 노출시켰다가 원위치로 원상회복하였으며, 각각의 수술 후 절개부위는 봉합하였다. 수술의 성공 여부는 부검 시 난소의 부재를 관찰하여 확인하였다.
시험물질 제조 및 투여
갈근(Pueraria lobata Ohwi의 뿌리, Puerariae Radix, P R ) 은 보령당한약방(광주, 한국)에서 구입하였으며, 세 절 하 여 건 조 중 량 1 0 0 g 당 증 류 수 1 , 0 0 0 m L 의 비율로 혼합하고 8 0 ℃ 수조에서 8시간 중탕 추출한 뒤 고형분을 제 거 한 현탁액을 1 , 0 0 0 g에서 3 0분간 원심분리시키고 상층액을 여과하여 감압농축하고 동결 건조시켰다. 실험군의 분류는 정상대조군, 난소절제대조군 (ovariectomy, OVX), OVX 및 17β-estradiol 투여 양성대조군, OVX 및 PR 경구투여군, OVX 및 PR 복강 내 투여군으로 하였으며, 실험군당 6마리를 사용하였다. 시료 경구투여군은 OVX 다음날부터 체중 kg당 250 mg의 양으로 매일 투여하였으며, 복강 내 투여군에서는 OVX 다음 날부터 체중 kg당 50 mg을 2일에 1회씩 주사하였다. 양성 대조군으로 17β-estradiol(E2, water soluble, Sigma-Aldrich, St. Louis, MO, USA)은 마우스 마리당 0.03 μg을 매일 피하주사하였다. 실험동물은 OVX 후 6주에 에테르 마취 상태에서 혈액을 채취하고 추가 방혈 안락사 하였다.
악력(grasping strength), 현미경적 관찰, 혈청 alkaline phosphatase 및 에스트로겐 측정
투여기간 중 정기적으로 일반 임상증상을 관찰하며 투여 전 및 부검 시 각각 체중을 측정하였다. 악력시험은 M e y e r 등[ 1 2 ]의 시험방법에 준하여 실시하였으며, 안락사 직전에 인장력측정기(Iwoo-G-500, IWOOSystems 이우과학, 서울, 한국)를 이용하여 측정하였다. 먼저 측정눈금을 영점으로 하고, 측정봉에 양쪽 앞발을 잡게 한 다음, 꼬리를 서서히 안정되게 잡아당겨 앞발이 측정봉에서 떨어질 때의 최대 악력을 측정하였고, 3회 실시하여 평균값을 산출하였다. 실험동물은 OVX 후 6주에 안락사 후 부검을 시행하고 정강뼈 및 자궁의 무게를 측정하였으며 좌측 정강뼈를 미세단층촬영( m i c r o - computed tomogrphy, μCT) 시까지 70% 에탄올에 보관하였다. 촬영 후 탈회하고 통상적인 방법에 따라 파라핀 포매 절편을 제작한 다음 hematoxylin-eosin염색 및 뼈파괴세포의 활성 관찰을 위해 Gao 등[13]의 방법에 따라 tartrate-resistant acid phosphatase(TRAP) 염색을 실시하고, 활성면은 전체 해면뼈면에 대한 양성부위의 상대면적(osteoclast surface/total trabecular bone s u r f a c e , O c . S / B S )으로 구하였다. 부검 시 동물의 후대정맥에서 혈액을 채취하고 혈청을 분리한 후, alkaline phosphatase(ALP)의 수치를 혈액생화학분석기(FDC 3500s, Fuji film, Japan)를 사용하여 분석하였고, 혈청 내 에스트로겐의 양은 방사면역측정키트(Estradiol Coat-Acount, Diagnostic Products Corp., Los Angeles, CA, USA) 및 감마카운터(EG & G, 20 Wallace, Finland)를 사용하여 분석하였다.
미세 전산화 단층 촬영(microcomputed tomogrphy, μCT)
시료의 단층 영상은 μCT(Skyscan 1172; Skyscan, Kontich, Belgium)를 이용하여 Yang 등[14]의 방법에 따라 수행하였다. 간단히 설명하면, 해상도( s p a t i a l r e s o l u t i o n )는 1 7 μm로 조절하였고 채득된 영상은 150개의 2 차원 횡단면으로 재구성되었으며 각 단면간의 거리는 8 0 μm로 설정하였다. 정강뼈의 미세구조는 2차원적으로 채득된 영상의 뼈 영역만을 적용하여 CTan 소프트웨어(Skyscan, Belgium)로 분석하였다. 해면뼈 성장판 아래에서 1.5 mm를 측정 대상으로 하였으며, 재구성된 2 차원 이미지로부터 치밀뼈(cortical bone)와 해면뼈를 구분하여 원형의 관심영역(region of interest)을 설정한 후, 지표 분석을 통하여 뼈의 양, 잔기둥 구조 및 연결도 등을 평가하였다. BMD는 2 개의 hydroxyapatite standard phantom에 대한 Hounsfield unit(HU) 값을 얻은 후, 측정하고자 하는 시편의 H U 값을 계산식에 대응시켜 구하였다. 치밀뼈는 해면뼈 소실 부위 아래부터 1.0 mm를 측정대상으로 하였으며, 뼈의 양 등의 값을 측정하였다.
자료통계 및 분석(statistical analysis)
모든 실험에서 얻어진 자료는 one-way ANOVA(the p o s t - h o c S t u d e n t - N e w m a n - K e u l s )의 방법으로 유의성 검사하고, 그들의 수치는 평균 ± 표준편차(mean ± S.D.)의 값으로 나타냈다. p값이 0.05보다 작을 때 유의성이 있는 값으로 정하였다.
Results
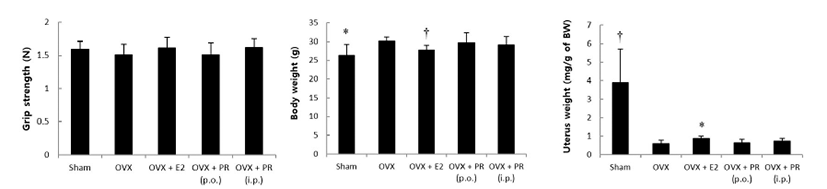
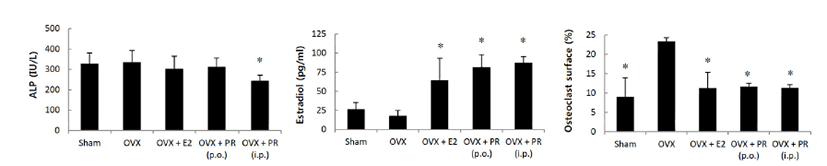
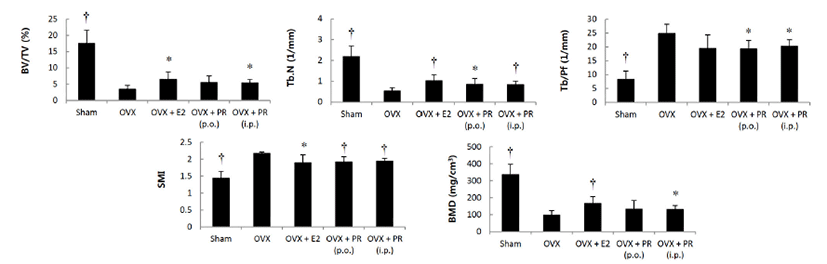
OVX군에 비해 PR투여군에서 악력, 체중 및 자궁 무게는 차이를 보이지 않았다(Fig. 1). 혈청 생화학적 지표의 변화는 Fig. 2와 같다. OVX군과 비교하여 PR투여군에서, 혈청 에스트로겐의 수치는 높게 나타났고, ALP 수치는 복강 내 주사군에서 감소하였으며, TRAP 양성 부위 분포는 유의성 있게 낮았다(Fig. 3). 각 군을 대표하는 μCT 정강뼈 이미지는 Fig. 4에 정리하였다. 영상을 분석한 결과 OVX에 따라 해면뼈의 양은 정상대조군에 비해 약 80% 감소하였으며, OVX군에 비해 PR투여군에서 BV/TV, Tb.N 및 BMD는 증가하였다. 경구투여의 경우 BV/TV 및 BMD 평균치에서 증가의 경향이나 개체 차로 인해 유의성은 없었다. Tb.Pf와 SMI는 PR투여군에서 감소하였다(Fig. 5). 치밀뼈의 양은 PR투여군에서도 변화는 관찰되지 않았다.
Fig. 1.
Effect of Puerariae Radix (PR) on grip strength, body weight and uterine weight in OVX mice. C3H/HeN mice were treated with vehicle, 17 β-estradiol (E2, 0.03 μg/head/day, s.c.) or PR (250 mg/kg/day, p.o., or 50 mg/kg/every other day, i.p.) for 6 weeks. Data are expressed as means ± S.D. (n = 6). *p< 0.05, †p<0.01 vs. OVX group at corresponding parameters.
Download Original Figure
Fig. 2.
Effect of Puerariae Radix (PR) on serum alkaline phosphatase (ALP), estradiol and osteoclast surface levels in OVX mice. Data are expressed as means ± S.D. (n = 6). *p<0.05 vs. OVX group at corresponding parameters.
Download Original Figure
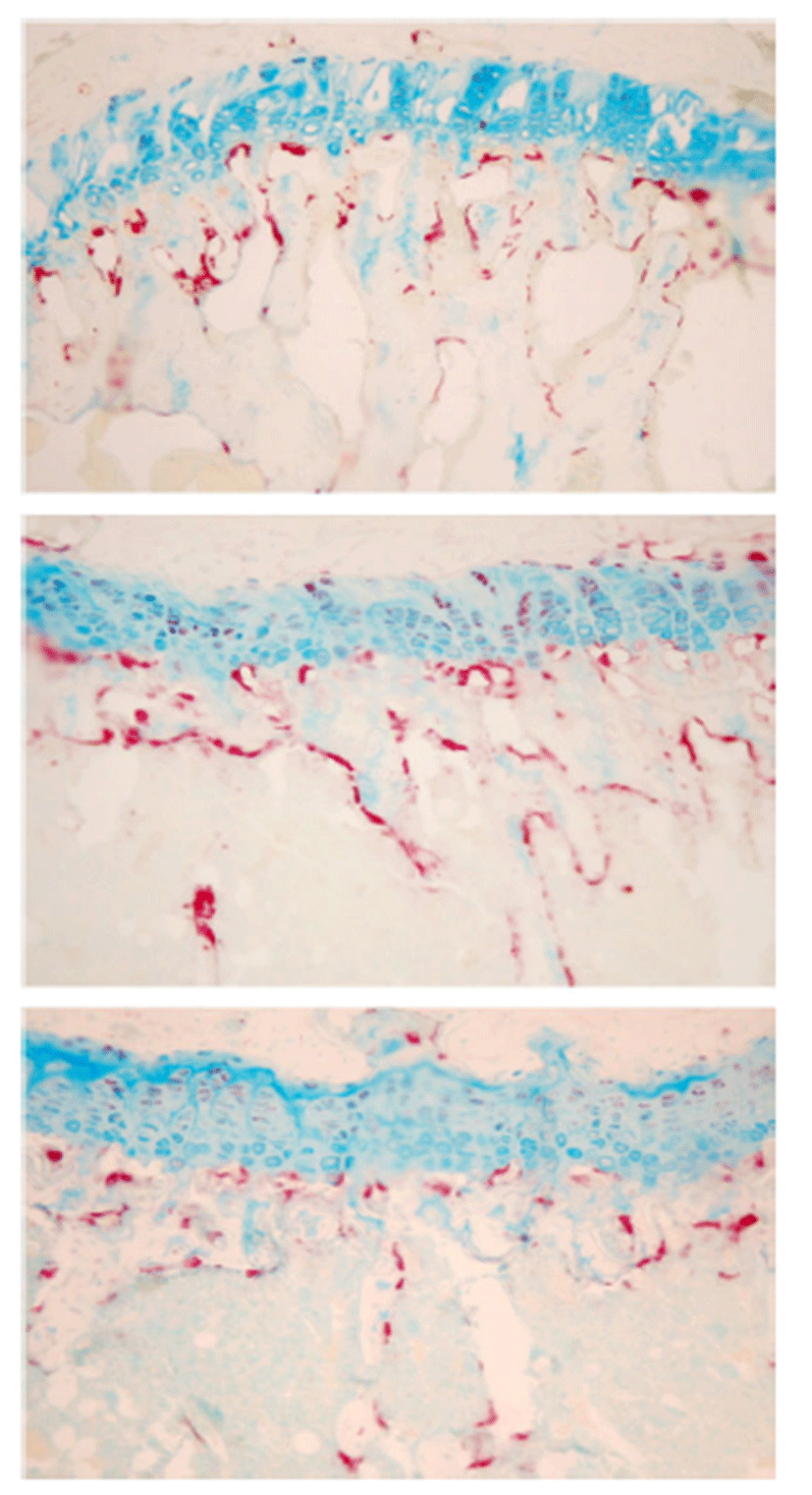
Fig. 3.
Representative tartrate-resistant acid phosphatase (TRAP) stain images of trabecular architecture of tibia in sham (top), OVX (middle) and Puerariae Radix (bottom)-treated group.
Download Original Figure
Fig. 4.
Representative micro-CT three-dimensional images of trabecular architecture of tibia in sham (top), OVX (middle) and Puerariae Radix (bottom)-treated group.
Download Original Figure
Fig. 5.
Effect of Puerariae Radix (PR) on trabecular bone properties of tibia in OVX mice. BV/TV: bone volume/tissue volume; Tb.N: trabecular number; Tb/Pf: trabecular bone pattern factor; SMI: structure model index; BMD: trabecular volumetric mineral density. Data are expressed as means ± S.D. (n = 6). *p< 0.05, †p<0.01 vs. OVX group at corresponding parameters.
Download Original Figure
Discussion
식물에스트로겐은 심혈관 질환, 골다공증, 당뇨, 비만, 폐경기 증상, 신장질환 및 각종 암에 대한 예방 및 치료 효과 가능성으로 인하여 관심의 대상이 되고 있다[5]. 이들 물질은 충분한 양이 섭취되었을 때 건강에 도움이 되는 효과를 나타내지만, 반대로 환경문제를 일으킬 수 있는 내분비 장해물질로 분류되어 있고 생식기계에 유해한 효과를 나타내기도 한다[15]. 덩굴콩과식물 Pueraria labata Ohwi의 뿌리인 갈근(Puerariae Radix)은 한국, 중국 및 일본 등에서 오랫 동안 각종 질환 치료에 적용되어온 생약이다. 갈근은 주로 인플루엔자 감염, 손목 및 어깨 경직 완화 또는 알코올섭취 거부제( a n t i d i p s o t r o p i c agent)로 적용되어 왔고, 과거 수년간 중국에서 고혈압 및 협심증 치료에도 효과가 있다고 보고되었으며[16], 또한 에스트로겐 결핍에 의한 뼈 소실을 방지하는 것으로 알려진 daidzein 및 genistein과 같은 isoflavonoid를 다량 함유하고 있다고 알려져 있다[11, 17].
본 연구에 적용된 실험모델과 갈근 투여용량에서 뼈 소실 억제 효과는 공히 혈청 ALP 감소와 TRAP 양성부위 감소와 연관되는 결과를 보였다. 혈청 내 뼈재형성(bone turnover) 지표의 수치가 높은 것은 뼈 형성의 비율 증가를 반영하며, 골다공증 발생에서 빠른 뼈 소실과의 연관성을 나타낸다[18]. 뼈 재형성 지표의 수치가 높게 나타나고, BMD의 수치가 낮게 나타나는 것은 특히 골절 위험도의 증가를 암시하는 것이며, 이러한 뼈 재형성 지표는 골다공증 환자에서 치료제의 효능 검증을 위해 임상적으로 사용되고 있고, 뼈 소실율과 골절 위험도의 간접적 판단기준으로 적용되고 있다[18, 19]. 본 연구에서 PR을 투여한 결과, 복강 내 주사군을 중심으로 혈청 내 A L P의 수치 및 Oc.S/BS가 유의성 있게 감소하였으며, 이는 PR투여의 효과가 OVX의 결과, 유도되는 뼈 재형성 증가를 억제하는 효과가 있음을 나타낸다. 또한 BV/TV, Tb.N 및 BMD 수치를 증가시키고 Tb.Pf와 SMI를 감소시켰다. 이러한 뼈 소실 억제효과는 여러 연구에서 보고되었던 에스트로겐의 효과와 유사하다[20]. 본 연구에서 PR의 뼈에 대한 효과는 에스트로겐과 유사하나, 체중 및 자궁 중량에 대한 효과는 차이를 나타냈다. 즉, PR투여군에서 자궁의 무게 증가가 에스트로겐 투여에 비해 경미한 것은 PR이 생식기계 조직의 증식과 같은 부작용이 적으면서 뼈에 대한 보호효과가 있을 가능성을 나타낸다. 갈근 투여 후 ALP와 TRAP의 변화는 몇몇 연구에서 상반된 결과로 보고되었다[21-24]. 본 연구에서 혈청 ALP 농도와 TRAP 양성 면적은 공히 감소하는 것으로 나타나 Yuan 등[21] 및 Ok 등[22]의 연구결과와 일치하였으며, 뼈 재형성의 억제를 통한 뼈 소실의 감소를 나타내는 것으로 사료된다.
식물에스트로겐은 저용량에서 뼈 형성을 자극하고, 고용량에서 반대로 뼈 형성을 억제하는 용량의존적 양면성을 나타내기도 한다. 투여 용량, 기간 및 실험모델에 따른 다른 반응 등으로 뼈 보호 효과를 보이거나, 반대의 반응을 나타내는 상반된 결과가 도출될 수 있다[ 25] . 따라서 다양한 동물실험모델에서 뼈 보호 효과를 나타내는 적정용량을 밝히는 것이 필요하다. 본 연구에서 PR 복강 내 주사의 경우, 에스트로겐의 효과와 유사한 수준의 해면뼈 소실 예방효과를 나타냈으나, 경구투여의 경우, 각종 뼈 평가 지표에서 개체 차로 인해 유의성 있는 효과가 관찰되지 않은 것은 적용된 경구투여 용량이 적정용량이 아닐 가능성이 있는 것으로 사료된다. 따라서 경구투여에 대한 효과 평가는 보다 면밀한 추가 연구가 요구된다. Aydin 등[10]의 연구에서 악력과 BMD 간에 상호 연관관계가 있다고 보고되었으나, 본 연구에서는 이와 같은 결과는 관찰되지 않았다.
결론적으로 요약하면, 식물에스트로겐 성분을 함유하고 있는 생약으로 알려진 PR이 OVX 마우스에서 난소절제에 의한 뼈 재형성 증가를 억제하여 해면뼈 소실을 방지하는 효 과 를 나 타 냈 으 며 , P R 이 에 스 트 로 겐 감 소 에 따 른 골다공증의 발생을 예방할 수 있는 가능성을 제시하였으나, 효과물질로 개발되기 위해서는 적용량, 유효성분 탐색, 효과에 대한 세포수준 및 분자생물학적 기전에 대한 추가 연구가 요구된다.
Acknowledgements
이 논문의 동물실험은 전남대학교 동물의학연구소의 지원협조를 받았고 이에 감사 드립니다.
References
Cauley JA. Osteoporosis: fracture epidemiology update 2016. Curr Opin Rheumatol 2017;29:150-156.


Cashman KD. Diet, nutrition, and bone health. J Nutr 2007;137:2507S-2512S.


Gallagher JC. Role of estrogens in the management of postmenopausal bone loss. Rheum Dis Clin North Am 2001;27:143-162.

Khan M, Cheung AM, Khan AA. Drug-related adverse events of osteoporosis therapy. Endocrinol Metab ClinNorth Am. 2017;46:181-192.


Sirotkin AV, Harrath AH. Phytoestrogens and their effects. Eur J Pharmacol. 2014;741:230-236.


Cotter A, Cashman KD. Genistein appears to prevent early postmenopausal bone loss as effectively as hormone replacement therapy. Nutr Rev 2003;61:346-351.


Morabito N, Crisafulli A, Vergara C, Gaudio A, Lasco A, Frisina N, D’Anna R, Corrado F, Pizzoleo MA, Cincotta M, Altavilla D, Ientile R, Squadrito F. Effects of genistein and hormone-replacement therapy on bone loss in early postmenopausal women: a randomized double-blind placebo-controlled study. J Bone Miner Res 2002;17:1904-1912.


Cassidy A, Albertazzi P, Lise NI, Hall W, Williamson G, Tetens I, Atkins S, Cross H, Manios Y. Critical review of health effects of soyabean phyto-oestrogens in postmenopausal women. Proc Nutr Soc 2006;65:76-92.


Chen H, Zhou X, Emura S, Shoumura S. Site-specific bone loss in senescence-accelerated mouse (SAMP6): a murine model for senile osteoporosis. Exp Gerontol 2009;44:792-798.


Aydin G, Atalar E, Keleş I, Tosun A, Zöğ G, Keleş H, Orkun S. Predictive value of grip strength for bone mineral density in males: site specific or systemic? Rheumatol Int 2006;27:125-129.


Kim IG, Kang SC, Kim KC, Choung ES, Zee OP. Screening of estrogenic and antiestrogenic activities from medicinal plants. Environ Toxicol Pharmacol 2008;25:75-82.


Meyer OA, Tilson HA, Byrd WC, Riley MT. A method for the routine assessment of fore- and hindlimb grip strength of rats and mice. Neurobehav Toxicol 1979;1:233-236.

Gao J, Tiwari-Pandey R, Samadfam R, Yang Y, Miao D, Karaplis AC, Sairam MR, Goltzman D. Altered ovarian function affects skeletal homeostasis independent of the action of follicle-stimulating hormone. Endocrinology 2007;148:2613-2621.


Yang M, Jang H, Lee HJ, Moon C, Kim JC, Jang JS, Jung U, Jo SK, Kim SH. Evaluation of effect of red ginseng on ovariectomy-induced bone loss in C3H/HeN mice. J Biomed Res 2014;15:12-18.

Kanno J, Kato H, Iwata T, Inoue T. Phytoestrogen-low diet for endocrine disruptor studies. J Agric Food Chem 2002;50:3883-3885.


Fan LL, O’Keefe DD, Powell WWJr. Pharmacologic studies on radix puerariae: effect of puerarin on regional myocardial blood flow and cardiac hemodynamics in dogs with acute myocardial ischemia. Chin Med J 1985;98:821-832.
Wang X, Wu J, Chiba H, Umegaki K, Yamada K, Ishimi Y. Puerariae radix prevents bone loss in ovariectomized mice. J Bone Miner Metab 2003;21:268-275.


Hannon RA, Eastell R. Biochemical markers of bone turnover and fracture prediction. J Br Menopause Soc 2003;9:10-15.
Garnero P, Hausherr E, Chapuy MC, Marcelli C, Grandjean H, Muller C, Cormier C, Breart G, Meunier PJ, Delmas PD. Markers of bone resorption predict hip fracture in elderly women: the EPIDOS prospective study. J Bone Miner Res 1996;11:1531-1538.


Shen Y, Gray DL, Martinez DS. Combined pharmacologic therapy in postmenopausal osteoporosis. Endocrinol Metab Clin North Am 2017;46:193-206.


Yuan SY, Sheng T, Liu LQ, Zhang YL, Liu XM, Ma T, Zheng H, Yan Y, Ishimi Y, Wang XX. Puerarin prevents bone loss in ovariectomized mice and inhibits osteoclast formation in vitro. Chin J Nat Med 2016;14:265-269.

Ok HM, Gebreamanuel MR, Oh SA, Jeon H, Lee WJ, Kwon O. A root-based combination supplement containing Pueraria lobata and Rehmannia glutinosa and exercise preserve bone mass in ovariectomized rats fed a high-fat diet. Calcif Tissue Int 2015;97:624-633.


Lv H, Che T, Tang X, Liu L, Cheng J. Puerarin enhances proliferation and osteoblastic differentiation of human bone marrow stromal cells via a nitric oxide/cyclic guanosine monophosphate signaling pathway. Mol Med Rep 2015;12:2283-2290.


Li H, Chen B, Pang G, Chen J, Xie J, Huang H. Anti-osteoporotic activity of puerarin 6”-O-xyloside on ovariectomized mice and its potential mechanism. Pharm Biol 2016;54:111-117.


Cassidy A. Dietary phytoestrogens and bone health. J Br Menopause Soc 2003;9:17-21.