Introduction
p21 - activated kinase (PAK) 은 세린/쓰레오닌 인산화효소로서 Rho GTPase인 Cdc42/Rac1과 결합하여 활성화된다[1]. PAK은 그룹-I (PAK1~3)과 그룹- II (PAK4~6)로 구성된 6개의 아이소폼이 존재한다[2]. PAK의 주요 기능은 세포골격의 형성과 유지, 세포의 운동성, 세포의 주 기 , 세포의 생존 및 세포의 사멸을 조절한다[3]. 구조적으로 PAK은 N-말단 부위의 조절 도메인(regulatory domain)과 C-말단 부위의 효소활성을 지닌 촉매 도메인( c a t a l y t i c d oma i n )으로 구성되어 있 다 [ 4 ] . PAK1의 N-말단 부위에는 R h o G T P a s e 단백질인 Cdc42와 Rac이 결합하는 p21-binding domain (PBD)이 있다[2]. PAK1의 PBD (67-113 아미노산)는 Cdc42와 Rac이 결합하는 최소한의 자리인 Cdc42 and Rac Interactive Binding (CRIB, 75-90 아미노산)이라는 아주 짧은 서열을 갖고 있다[5]. PAK1이 활성이 없을 때에는 PAK1의 조절 도메인과 촉매 도메인이 역으로 결합하고 있는 형태의 homodimer를 이루고 있는 것으로 추정된다[5, 6]. 비활성성형의 PAK1에 Rho GTPase가 결합하면 homodimer가 monomer로 분리되고, 쓰레오닌 423 (T423) 부위의 인산화에 이은 N-말단 부위의 다중 인산화에 의해 PAK1은 완전히 활성화된 형태로 바뀐다[7, 8].
뿐만 아니라 PAK은 암 발생, 암세포의 생존 및 사멸과 밀접한 관 계 를 갖 고 있 다 [ 9 , 1 0 ] . 특 히 , P A K 1 은 유 방 암 ( b r e a s t c a n c e r ) , 결 장 암 ( c o l o n c a n c e r ) , 자궁암(ovarian cancer) 및 방광암(bladder cancer)에서 과발현 되어 있고[9], 과발현에 의한 PAK1의 활성 증가가 발암에서 중요한 역할을 한다고 보고되었다[11]. 따라서 PAK은 암을 치료할 수 있는 주요 표적으로 인식되었고, PAK의 효소 활성을 조절할 수 있는 약물개발에 많은 연구가 진행되고 있다[12-14].
그룹-I PAK의 대표적인 저해제인 IPA-3는 PAK2의 세 린 192/197 잔기의 인산화를 저해함으로써 PAK2의 활성 을 억제하는 것으로 보고되었다[15]. IPA-3는 PAK 그 룹-I의 조절 도메인에 결합하여 PAK 그룹-I에 대해 특이 적인 강한 저해효과를 보인다. PAK1에 대해 95%, PAK2 에 대해 70% 및 PAK3에 대해 60%의 활성 억제 효과를 나 타내는 저분자 물질(small molecule)로, 그룹-II PAK에는 영향을 주지 않는 것으로 알려졌다[13]. 또한, PAK18이라 는 PAK1의 인산화를 억제하고, Ras에 의한 암 성장을 억제 할 수 있는 펩타이드 제재가 보고되어 있다[16].
본 연구자는 그룹-I PAK의 조절 도메인에 있는 Cdc42/ Rac이 결합하는 PBD 부위에 결합하여 PAK의 효소활성을 억제하는 다른 부위 저해제(allosteric inhibitor)를 발굴하 는 ELISA 방법을 고안하였고, 1,4-naphthoquinone 계열 의 화합물을 검색하여 PAK1과 PAK3에 대해 특이적으로 작용하는 저해제를 발굴하였다[17]. 본 연구는 1,2-naphthoquinone (1,2-NQ) 계열의 화합물을 이용하여 PAK에 대한 저해 효과를 검증하고자 하였다. 1,2-NQ 유도체들 중 rhinacanthone, beta-lapachone 및 mansonones 등은 자 연계에서도 발견되는 물질들이고 세포독성을 가지고 있는 물질로 알려졌다[18-20]. 암세포를 죽이는 신규 후보 물질 로 주목 받고 있다. 특히, 최근 1,2-NQ 유도체들이 Hep- G2, MG-63 및 MCF-7등의 다양한 암세포주에 대해 세포 독성을 가진다는 것이 알려지면서 항암제로의 개발 가능성 을 검증하기 위한 연구가 진행되고 있다[21]. 본 연구에서는 1,4-NQ 유도체에 대한 선행 연구결과를 바탕으로, 5종의 1,2-NQ 계열 화합물에 PAK1에 대한 저해 효과를 검증하 고, 이에 따른 생물학적 활성 조절 효과를 관찰함으로써 NQ 화합물의 PAK1 저해 효과를 검증하고자 하였다.
Materials and Methods
5종의 4-benzene-1,2-NQ 화합물은 한국화학연구원에 서 분양 받아 사용하였다. Carbonate-bicarbonate buffer, phosphate-citrate buffer with sodium perborate, bovine serum albumin (BSA), bicarbonate buffer, 2,2'-azino-bis (3-ethylben zthiazoline-6-sulphonic acid (ABTS), anti-GST-horseradish peroxidase (HRP) conjugated antibody, XTT kit 및 myelin basic protein (MBP)는 Sigma Aldrich 제품을 사용하였다. 세 포배양에 사용한 배양액 및 fetal bovine serum (FBS) 은 Thermo Fisher Scientific 제품을 사용하였다. Myc과 GFP에 대한 항체는 Santa Cruz Biotechnology에서 구매 하였다. 정제된 GST-PAK1-wild type (WT) 단백질은 Abcam에서 구매하였고, 활성형인 GST-PAK1 (T423E) 단백질은 본 연구실에서 발현 정제하여 사용하였다. [γ-32P] ATP는 Perkin-Elmer 제품을 사용하였다.
LB 배양액에서 배양한 GST-Cdc42균은 1mM IPTG를 넣고 6시간 추가 배양하여 단백질 발현을 유도하였다. 단백 질 발현 후 세포를 모아 초음파분쇄기에 처리하여 대장균으 로부터 단백질을 용출하였다. 용출된 단백질은 glutathione affinity chromatography를 실시하여 GST-Cdc42 단백질 만을 취하였다. PBD-His 균도 위와 같은 과정을 통해 단 백질을 발현시킨 후 NTA-Ni affinity chromatography를 실시하여 PBD-His 단백질을 정제하였다. 정제한 단백질은 Lowry 방법을 이용해 단백질을 정량 하였고, 정제한 단백질 은 SDS-PAGE를 실시하여 확인하였다.
293T 세포는 Dulbecco's Modified Eagle's Medium (DMEM) (Thermo Fisher Scientific, USA)에 10% FBS 와 1 × antibiotic-antimycotic solution이 섞인 배지에서 배양하였고, NIH3T3 세포는 DMEM 배양액에 10% calf serum과 1 × antibiotic-antimycotic solution이 섞인 배 지에서 배양하였다. HeLa 세포는 minimum essential medium (MEM) 배양액에 10% calf serum 과 1 × antibiotic- antimycotic solution이 섞인 배지에서 배양하였다. 상 기 세포는 모두 37℃, 5% CO2 농도의 세포배양기에서 배 양하였다.
96 well plate에 30 ng PBD-His를 carbonate-bicarbonate buffer와 함께 섞은 후 각 well에 50 μL씩 넣고 4℃ 에서 16 시간 동안 결합시켰다. 결합 시킨 후 PBS-T (0.1% Tween20 in PBS) 200 μL를 넣어 3번 세척하였다. 블로킹 을 위해 1.5% BSA 용액을 넣고 37℃에서 1시간 반응시킨 후 200 μL PBS-T로 3번 세척하였다. GST-Cdc42 단백질 은 Tris-HCl (pH7.4)용액에 1 μg/mL 농도로 희석하여 준 비하였다. 이 조건에서 100 μM의 NQ 화합물을 혼합한 후 각 well에 분주하였다. 반응은 37℃ 배양기에서 1시간 동안 유 도하였고, 반응 후 PBS-T 용액 200 μL로 3번 세척하였다. Anti-GST-HRP conjugated antibody (Sigma-Aldrich, St. Louis, USA)는 1:5000으로 희석한 후에 각 well에 50 μL씩 넣고 37℃에서 1 시간 반응시켰다. 반응 후 PBS-T 용액으로 3번 세척하였고, 발색시약 2,2'-azino-bis(3- ethylben zthiazoline-6-sulphonic acid (ABTS)(Sigma- Aldrich, St. Louis, USA)을 각 well에 넣은 후 37℃에 서 20분간 처리하여 발색을 유도하였다. 결과는 Microplate reader (SpectraMax M2, Molecular Devices, Sunyvale, USA)로 405 nm에서 흡광도를 측정하여 관찰하였다.
정제된 GST-Cdc42 단백질(2 μg)과 GTPγS (100 μM) 를 미리 결합시킨 후, GST-PAK1-WT 및 T423E 단백 질 각 200 ng과, 기질로 사용되는 MBP 2.5 μg를 취해 1 × kinase buffer, 1 × ATP, [γ-32P]ATP (5 μCi)를 추가하 여 혼합하였다. 이 조건에서 각 NQ 화합물 20 μM를 섞어준 후 30℃에서 30분 동안 인산화 반응을 유도하였다. 인산화 반응은 SDS loading 용액을 첨가한 후 100℃에서 5분간 끓 여 반응을 멈추게 하였다. 반응시료는 12% sodium dodecyl sulfated-polyacrylamide gel electrophoresis (SDS PAGE)를 실시한 후 polyvinylidene fluoride (PVDF) membrane으로 이동시켰다. 인산화 단백질을 관찰하기 위 해 PVDF membrane은 X-ray 필름을 이용해 -70℃에서 16시간 동안 방치 후 현상하였다. 첨가된 단백질은 GST 및 MBP 항체를 이용해 면역블롯을 실시하였다.
293T 세포는 트란스펙션 하루 전에 배양접시에 깔아 놓 았다. 트란스펙션에 사용하는 plasmid DNA 1 μg과 500 μL OPTI-MEM 배양액(Thermo Fisher Scientific, Waltham, USA)을 섞고, 4 μL Lipofectamine 2000 (Thermo Fisher Scientific, Waltham, USA)과 500 μL OPTI-MEM 배양액을 섞은 2개의 튜브를 각각 준비한 후 2 튜브를 다시 섞어서 상온에 20분간 방치하였다. 준비한 세 포는 무혈청 배지로 1회 세척한 후 준비한 혼합액을 세포에 추가하여 4시간 배양하였다. 4시간 후 정상적인 세포배양액 으로 교체하고, 24시간 추가 배양하여 트란스펙션한 DNA가 세포에서 단백질로 발현되도록 유도하였다. 단백질 발현은 적절한 항체를 이용한 면역블롯을 통해 확인하였다.
NIH3T3 세포는 6 well plate에 충분히 꽉 차도록 깔았 다(6 × 105/well). 배양한 세포는 yellow tip끝을 이용해 상처를 내어 움직인 부분만큼의 세포를 제거하여 빈 공간 을 만들고, 세포를 무혈청 배지로 1회 세척한 후 0.5% calf serum을 포함한 DMEM를 추가하였다. 이 조건에서 25 ng/ mL PDGF와 NQ 화합물을 농도별(0, 5, 10, 20 μM)로 첨 가한 후 24시간 동안 세포배양기에서 배양하며 세포이동 저 해효과를 관찰하였다. NQ 화합물은 각각 3 well씩 준비하여 실험하였다. 세포 이동 유도 전후의 빈 공간의 길이 변화를 측정하여 세포이동거리를 분석하였고, 세포이동은 Cooled CCD 카메라(Cascade 512B, Photometrics, Tucson, USA)가 부착된 역위상차 현미경(Olympus IX81-ZDC, Japan)을 이용해 촬영하였고, 이동거리 분석은 MetaMorph software, version 7.1.7(Molecular Devices, Sunyvale, USA)를 이용하였다.
차가운 세포용출액(50 mM HEPES, pH 7.5; 150 mM NaCl, 10% glycerol, 1% Triton X-100, 500 μM EDTA, 200 μM sodium-pyruvate, and 50 mM β-glycerolphosphate) 에 처리하여 세포를 용해시킨 후 단백질 용출액 을 준비하였다. 면역침전을 위해서 단백질 용출액 1 mg을 면역침전하고자 하는 일차항체 1 μg을 넣고 4℃에서 16시 간 동안 반응시킨 후 protein G-agarose (GE Healthcare, Little Chalfont Bucks, UK)와 결합시켰다. 항체와 결합한 단백질은 PBS로 3회 세척한 후 SDS-PAGE를 실시하였 다. 전기영동 후 단백질은 PVDF membrane으로 이동시킨 후 면역블롯을 실시하였다. 면역블롯은 PVDF membrane 을 3% 무지방 우유 용액에 30분간 처리하여 블로킹하였다. 일차 항체는 3% BSA 용액에서 1:1000으로 희석한 후 상 온에서 1시간동안 반응시켰다. PBS-T 용액에서 3회 세척 한 후 HRP-conjugated 2차 항체를 희석한 용액에서 1시 간 처리하고 3회 세척하였다. 면역블롯의 결과는 enhanced chemiluminescence (ECL) 시약을 처리에 반응을 유도한 후 Luminescent 영상 분석 장비 (LAS-3000, Fuji Photo Film Co., Tokyo, Japan)를 이용해 관찰하였다.
Results
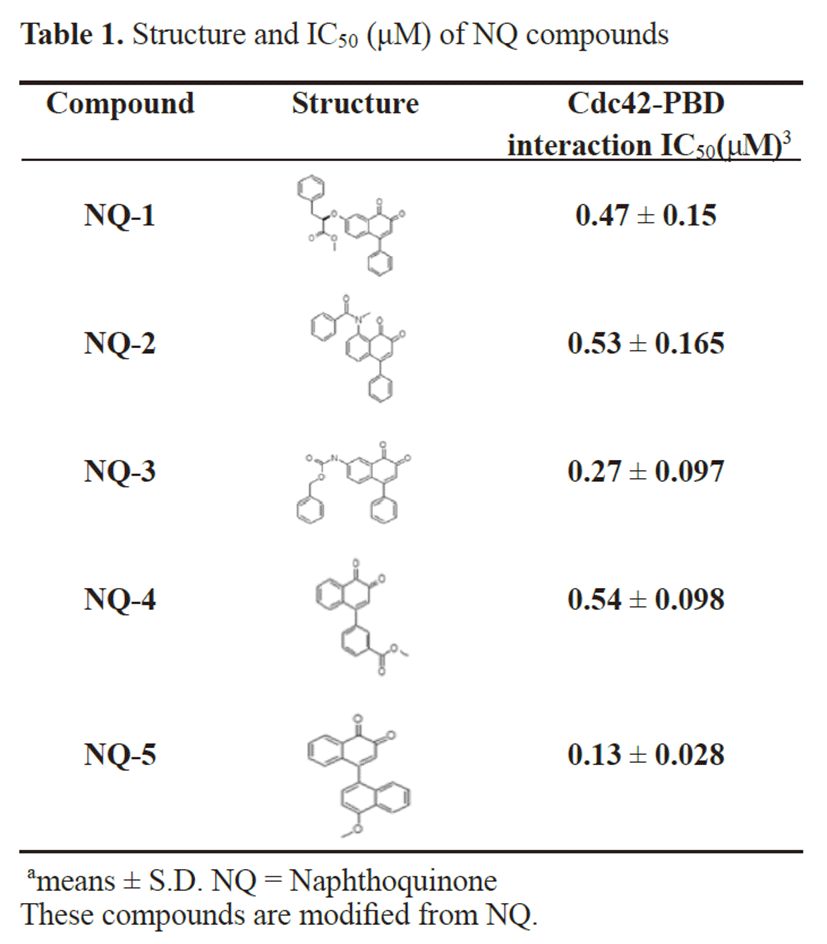
PAK1의 PBD에 활성형인 GTP-Cdc42가 결합하면 PAK1은 인산화되며, 이는 곧 PAK1의 활성화를 의미한다. 이런 특성을 이용하여 PBD와 Cdc42간의 결합을 억제할 수 있는 물질을 개발함으로써 PAK1의 활성 저해제를 발굴하 고자 하였다. 본 연구팀은 선행연구에서 이와 같은 방법으로 1,4-NQ 유도체를 이용하여 PAK1의 저해제를 개발하여 보 고 하였다[17]. 본 연구는 이를 변형한 5개의 1,2-NQ 유도 체 화합물을 이용하여 PAK1의 PBD와 Cdc42 사이의 결합 을 억제할 수 있는 가를 관찰하였다(Fig. 1). 박테리아에서 발현 및 정제한 PBD-His와 GST-Cdc42 단백질을 이용 하여 NQ 화합물이 두 단백질간의 결합을 억제할 수 있는지 ELISA 방법으로 분석하였다. 5종의 NQ 화합물 모두 PBD와 Cdc42 사이의 결합을 처리한 농도(0, 0.032, 0.16, 0.8, 4, 20, 100 μM)에 비례하여 억제함을 관찰할 수 있었다(Fig. 1 & Table 1).
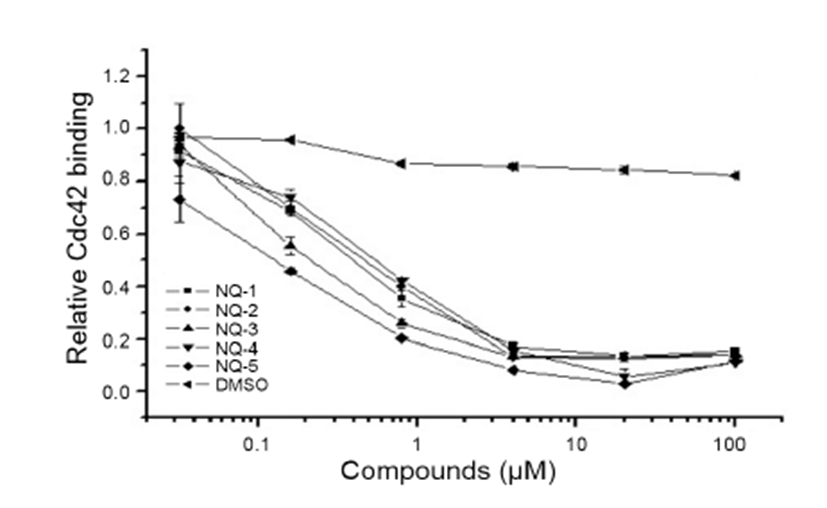
5종의 NQ 화합물을 이용하여 GTP-Cdc42에 의해 유도 되는 GST-PAK1의 활성화와 활성화된 돌연변이 GSTPAK1 (T423E)의 효소활성 조절 여부를 in vitro kinase 활 성조사를 통해 확인하였다(Fig. 2). 이때 PAK1의 활성화는 [γ-32P] ATP가 있는 조건에서 기질로 사용한 myelin basic protein (MBP)의 인산화 정도를 autoradiography로 분 석함으로써 확인하였다. Cdc42에 의해 활성화되는 GSTPAK1- WT는 20 μM 농도로 NQ 화합물을 처리하였을 때 5종 모두 뚜렷하게 MBP의 인산화를 억제하는 것을 관찰할 수 있었다(Fig. 2A). NQ 화합물이 GTP-Cdc42와 PAK1 안에 있는 PBD 부위와의 결합을 특이적으로 저해함으로써 PAK1의 인산화 효소 활성을 억제함을 의미한다. 뿐만 아니 라 이 화합물들은 활성형의 GST-PAK1 (T423E)이 MBP 를 인산화시키는 것도 억제하였다(Fig. 2B). 즉, NQ 화합물 은 이미 활성화된 PAK1에 대해서도 저해효과를 나타냄을 의미한다. 그러나, NQ 화합물들은 활성형인 GST-PAK1 (T423E)을 억제하는 것 보다 GTP-Cdc42에 의해 유도되 는 GST-PAK1-WT의 활성화를 억제하는 데 보다 효과적 임을 알 수 있었다(Fig. 2A). 이러한 연구결과를 바탕으로 본 연구는 5종의 NQ 화합물 중에 두 가지 조건 모두에서 가 장 강한 저해 효과를 나타내는 NQ-5 화합물을 선택하여 농 도에 따른 PAK1에 대한 활성 저해효과를 보다 구체적으로 확인하였다.
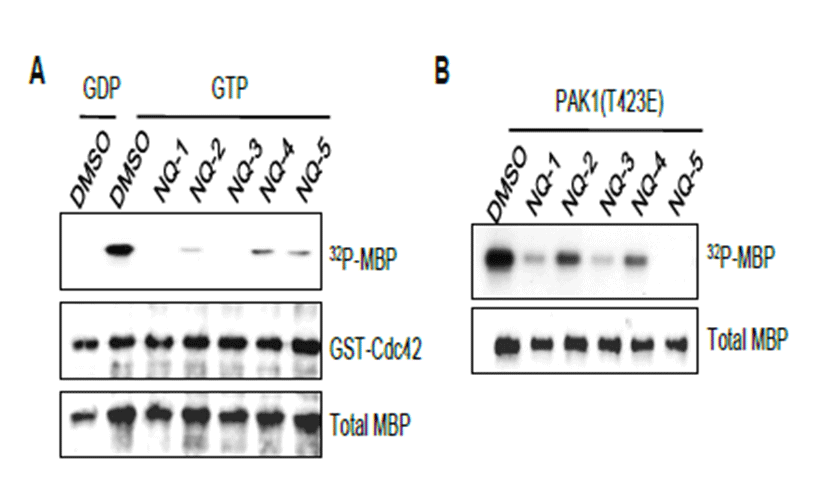
농도에 따른 NQ-5의 PAK1 활성 저해효과를 in vitro kinase assay를 통해 확인하였다(Fig. 3). GST-PAK1-WT 단백질과 GTP가 결합된 GST-Cdc42-GTP 단백질을 이 용하여 0, 5, 10, 25, 50 μM 농도의 NQ-5를 처리한 후 기질 인 MBP의 인산화 정도를 비교하였다. 처리한 NQ-5의 농도 가 5 μM일때부터 현저하게 PAK1의 활성이 억제되어 MBP 의 인산화가 감소됨을 관찰할 수 있었다(Fig. 3A). 또한 대장 균에서 발현 정제한 활성형의 GST-PAK1 (T423E)에 대 해 같은 실험을 수행하였을 때도 5 μM의 농도에서부터 뚜렷 하게 MBP 인산화 억제효과를 관찰 할 수 있었다(Fig. 3B). 본 결과로부터 NQ-5는 5~10 μM 농도에서 PAK1의 인산 화효소 활성을 매우 효과적으로 억제할 수 있음을 알 수 있 었다.
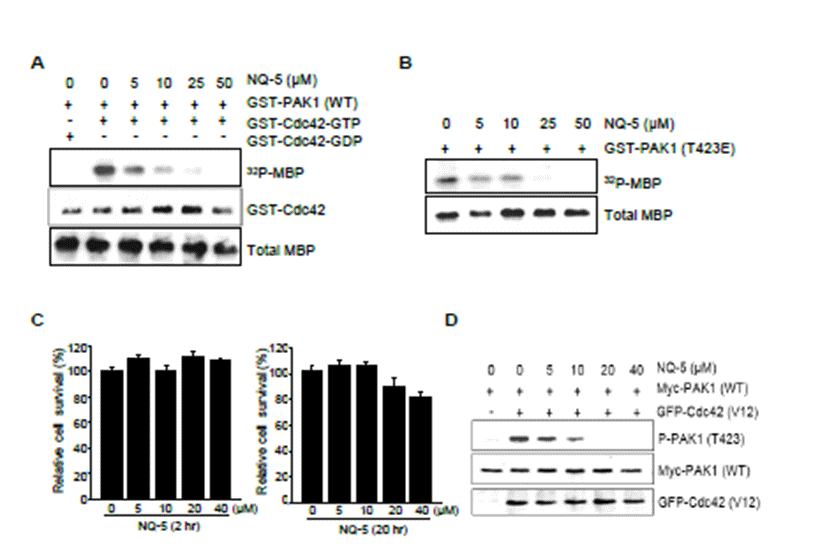
in vitro kinase assay에서 NQ-5는 농도 의존적으로 PAK1의 효소 활성을 억제하였다. 그러므로 NQ-5가 실 질적으로 세포 내에서도 PAK1의 활성을 억제할 수 있는가 를 알아보았다. NQ-5의 세포 내에서 처리한 농도 의존적으 로 PAK1의 활성을 억제할 수 있는가를 알아보기 위해 먼저 NQ-5의 세포 독성 여부를 검증하여야 하였다. NQ-5를 0, 5, 10, 20, 40 μM 농도로 각각 2시간(Fig. 3C, left)과 20 시간 처리(Fig. 3C, right)한 세포에 대한 독성을 XTT 활성 측정법으로 관찰하였다. 그 결과 NQ-5를 2시간 처리하였을 때 모든 농도에서 세포독성은 나타나지 않았고, 20시간 처리 시 저농도에서는 거의 세포독성이 나타나지 않았으나 20 μM 과 40 μM 농도에서 약 10~20%의 세포가 죽는 것이 관찰되 었다(Fig. 3C). 293T 세포에 pCMV-Myc-PAK1 (WT) 과 활성형의 GFP-Cdc42(V12) 유전자를 트란스펙션하여 24시간동안 발현 시킨 후 NQ-5를 0, 5, 10, 20, 40 μM 농 도로 2시간 처리하였다. 이 과정을 통해 얻은 세포 용출액을 전기영동한 후 발현시킨 Myc-PAK1의 쓰레오닌 432번 아 미노산(T423) 잔기의 인산화를 PAK1의 T423의 인산화 특이적인 항체[P-PAK1(T423)]를 이용해 면역블롯을 실 시하였다(Fig. 3D). PAK1의 T423 인산화는 곧 PAK1의 활성화를 확인하는 대표적인 방법이다. NQ-5의 처리한 농 도 의존적으로 세포 내 PAK1의 인산화를 현저하게 억제하 는 것을 관찰하였다(Fig. 3D). 그러므로 NQ-5가 세포 내 에서도 PAK1 활성을 저해할 수 있다는 것을 알 수 있었다.
외부 자극에 의한 PAK1의 활성화를 이 화합물이 억제할 수 있는가 알아보기 위해 platelet-derived growth factor (PDGF)에 의한 PAK1의 활성화를 유도하였다. NIH3T3 세 포에 PDGF를 처리하면 PAK1 활성화된다[3]. PDGF에 의 해 활성화되는 PAK1의 하부 신호전달과정이 NQ-5에 의해 조절되는지 관찰하였다(Fig. 4). NIH3T3 세포에 pCMVMyc- PAK1 (wild type) 유전자를 트란스펙션하여 Myc- PAK1을 과발현 시킨 후 40 μM NQ-5를 2시간 처리한 후 PDGF를 30분간 처리 하였다(Fig. 4A). 이 조건에서 과발 현 된 Myc-PAK1의 인산화가 현저히 감소하는 것을 관찰하 였다. 뿐만 아니라 NIH3T3 세포에 NQ-5를 각각 20 μM과 40 μM를 각각 2시간 처리한 후 PDGF를 30분간 처리하여, PDGF 자극에 대한 NQ-5가 세포 내에 존재하는 endogenous PAK1의 T423 아미노산의 인산화를 뚜렷하게 억제 하는 것을 관찰하였다(Fig. 4B). 이는 NQ-5가 세포 내에서 PDGF 자극에 의한 PAK1의 활성화 기전을 효과적으로 저해 할 수 있음을 시사하는 결과이다.
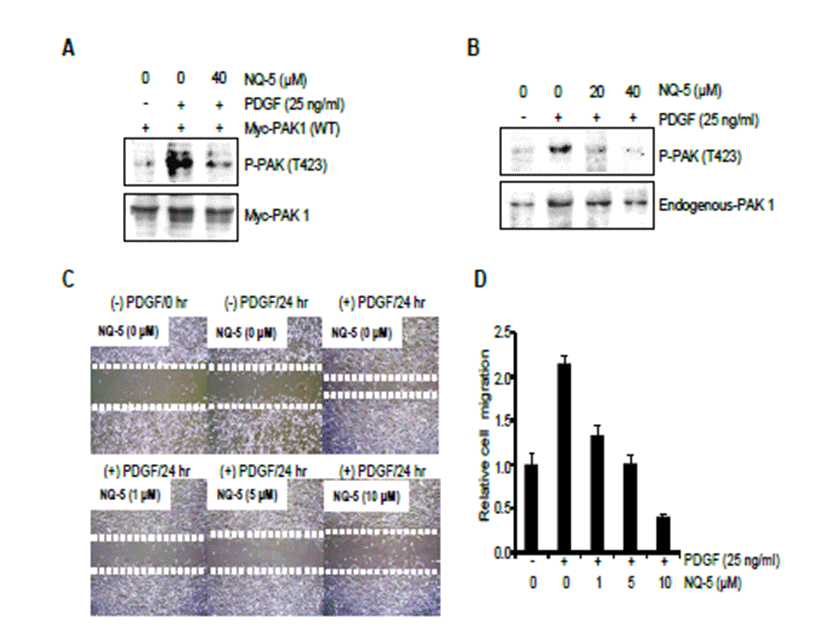
NQ-5 화합물이 PAK1의 활성을 억제함을 확인하였으므 로 PAK1에 의해 조절되는 생물학적 기능을 조절하는지 알 아보고자 하였다. PDGF는 PAK1을 활성화시키고 이는 세 포의 이동성을 조절한다[22]. 그러므로 이를 검증하기 위해 NQ-5를 이용하여 PDGF에 의해 유도되는 wound migration assay를 실시하였다. NIH3T3 세포는 yellow tip으로 상처(wound)를 만든 후 25 ng/mL PDGF를 24시간 동안 처리하여 세포이동을 유도한다. 이때 각각 0, 1, 5, 10 μM의 NQ-5를 함께 처리하여 이 화합물이 세포이동에 미치는 영 향을 조사하였다. PDGF를 처리하지 않은 조건과 PDGF만을 처리한 조건을 비교하면 PDGF에 의해 약 2 배 세포이동이 증가 하였다(Fig. 4C). 그러나 NQ-5를 처리한 경우 처리한 농도에 비례하여 세포이동이 점진적으로 감소하는 것을 관찰 할 수 있다(Fig. 4D). 이상의 결과로부터 NQ-5는 PDGF에 의한 PAK1의 활성을 저해함으로 PDGF에 의해 세포이동을 억제할 수 있다는 것을 관찰하였다.
Discussion
단백질 인산화효소의 과발현 혹은 돌연변이 등에 의한 활 성의 변화는 다양한 질병과 연관이 있고, 특히 암에서 중요 한 역할을 한다. 1990년대 후반부터 개발된 Trastuzumab, Gefitinib, Cetuximab 등은 세포 표면의 수용체에 연결된 타 이로신(tyrosine) 인산화효소의 활성을 억제하는 암 치료제 이다[23]. 골수성 백혈병 치료제인 Imatinib의 출현 이후, 인산화효소를 표적으로 하는 신약개발이 본격화 되었다[24, 25]. 인산화효소 저해제에 대한 관심은 새로운 표적단백질 의 발굴과 인산화효소 활성 저해제를 검색하는 방법의 개발 로 이어지고 있다. 최근 들어 저비용으로 대용량의 라이브러 리를 신속하고 정확하게 검색하는 방법의 개발은 신약 개발 에 있어 해결해야 할 중요한 과제 중의 하나라고 할 수 있다. 근래에 인산화효소에 대한 선택성을 높이기 위하여, ATP 결 합자리가 아닌 기질의 결합자리나 조절 도메인의 결합자리 에 작동하는 다른자리(allosteric) 저해 물질의 발굴에 관심 이 집중되고 있다[24].
PAK1은 PAK family 중에서 가장 많이 연구되었으며, PAK1의 발현 및 활성 증가가 대장암, 유방암, 자궁암 등 다 양한 암에서 보고 되어 있다[2, 11]. 6개의 아소자임을 가지 는 PAKs은 C-말단에 아미노산 서열이 매우 유사한 인산화 효소 도메인을 가진다. 특히 그룹 안에서 인산화효소 도메인 뿐만 아니라 N-말단 부위의 조절 도메인도 매우 유사한 구 조를 가진다. ATP 결합 부위를 표적으로 사용할 경우, 저해 효과는 강하지만 인산화효소 간의 구조적 유사성으로 인해 특이성이 부족한 경우가 많다. 그래서 인산화효소 도메인이 아닌 조절 도메인에 작용하는 저해제를 발굴하고자 하지만 쉽지 않다. 그 예로, PAK1의 활성 저해제로 개발된 IPA-3 는 PAK1의 조절 도메인에 결합하는 다른자리 저해제이며, 종양의 활성을 억제하는 것으로 보고되었다[26]. IPA-3는 PAK1의 다른자리 저해제로 개발되었지만 PAK1뿐만 아니 라 그룹 I에 속하는 PAK2와 PAK3에 대해서도 유사한 저해 효과를 보이는 것으로 알려졌다[14]. 이러한 예는 특이적인 PAK 활성 저해제 개발이 어렵다는 것을 시사한다.
본 연구자는 PAK1에 대해 특이적인 활성 저해제를 개발하 기 위해 PAK1의 N-말단 부위에 위치한 조절 도메인 중 활 성형 Cdc42와 Rac이 결합하는 부위인 PBD 부분을 이용하 였다. 즉, PBD 부위와 활성화된 Cdc42의 결합을 억제시키 는 물질을 ELISA방법으로 검색하였고, 두 단백질의 결합을 억제시키는 물질이 PAK1의 활성을 저해할 수 있는가를 다 양한 방법으로 관찰하여 보고하였다[17]. PAK1의 PBD 부 위에 활성화된 Cdc42의 결합이 일어나서 PAK1의 인산화 효소 도메인의 구조가 변화되어야 PAK1이 정상적으로 활 성화 될 수 있기 때문에 두 단백질 사이의 결합을 억제한다 는 것은 PAK1의 활성을 저해할 가능성을 강하게 시사하는 것이다. 본 연구에서 사용한 4-benzene-1,2-NQ 화합물 5종은 Cdc42에 의한 PAK1의 활성화 및 활성화된 PAK1 에 대해 효소활성을 억제하였다. 특히, NQ-5는 NIH3T3 세 포에서 PDGF 자극에 의한 PAK1의 활성 및 PDGF 자극에 의해 유도되는 세포이동을 효과적으로 저해하였다. PDGF 는 PAK1을 활성화시키고, PAK1의 조절 도메인의 NCK domain에 활성화를 일으켜 PAK1을 인산화시키고 Cdc42 의 활성에도 영향을 주어 세포의 운동성을 조절한다는 보고 가 있다[22, 27]. NQ-5는 PDGF에 의해 증가하는 세포 운 동성을 저해하기에 PDGF 자극에 의한 NCK와 Cdc42의 활 성 억제에 영향을 미치는 것이라 유추해 볼 수 있다. NQ-5 의 PAK1에 대한 저해효과를 보다 구체적으로 확인하기 위 해서는 PAK의 6종 아이소자임에 대한 저해효과를 비교하거 나 기존의 다른 인산화효소들에 대한 저해효과를 알아본다 면 PAK1에 대해 특이적으로 작용하는지를 구분할 수 있을 것이다. 본 연구는 NQ 화합물 5종이 유사하게 PAK1에 대해 저해효과를 나타내고, NQ-5가 NIH3T3 세포에서 PDGF 자극에 의해 PAK1의 인산화가 감소하여 활성이 억제됨을 확인하였고, 또한 PDGF 자극에 의한 세포이동을 억제함을 관찰할 수 있었다.
본 연구는 5 종의 NQ 화합물 유도체가 PAK1의 PBD 부위 와 GTP-Cdc42 사이의 결합을 억제함으로써 in vitro에서 PAK1에 대한 인산화효소 저해효과가 있음을 확인하였다. 그 중에 NQ-5 화합물은 세포 내에서도 PAK1의 활성을 억 제할 뿐만 아니라 PDGF 자극에 의한 PAK1의 활성화 억제 및 세포이동 억제에 효과적임을 확인하였다. 그러나 NQ-5 를 PAK1에 대한 효과적인 저해제로 개발하기 위해서는 몇 가지 추가적으로 확인해야 할 연구가 남아있다. 즉, NQ-5의 PAK1 저해효과의 특이성을 관찰하기 위해 그룹 I의 PAK 아이소자임인 PAK1, PAK2 및 PAK3에 대한 저해효과를 비교 관찰해야 할 것이다. 또한 NQ-5를 이용하여 기존의 다른 인산화효소들에 대한 저해효과를 알아보기 위하여 주 요 인산화효소들에 대한 활성 저해 효과를 비교해야 할 것이 다. 뿐만 아니라 본 연구결과에서는 NQ-5를 포함한 5개의 NQ 화합물이 PBD 부위에 결합하는 것이지, 혹은 Cdc42에 직접 결합하는 것인지 분명하게 확인하지 못했다. 단지 두 단 백질 사이의 결합을 저해하고, 결합 저해가 PAK1의 효소 활 성을 억제한다는 것을 확인한 것이다. 이를 PAK1에 대한 저 해 약물로 개발하기 위해서는 NQ 화합물과 두 단백질간의 결합 특성에 대한 연구가 더 필요할 것으로 생각한다. 이상 과 같은 아직 해결해야 할 문제들이 남아 있지만 현 단계에 서는 NQ-5를 포함한 5 종의 NQ 화합물 유도체들은 PAK1 의 활성 저해제로의 가능성을 강하게 가지고 있기 때문에 지 속적인 연구 수행이 필요한 PAK1 활성 저해 후보물질로 분 류할 수 있을 것이다.