Original Article
Immunomodulatory effects of mixed Weissella cibaria JW15 with water extract of black soybean and burdock on Listeriamonocytogenes infection in mice.
Ho-Eun Park, Wan-Kyu Lee*

College of Veterinary Medicine, Chungbuk National University, Cheongju 28644, Korea
*Corresponding author: Wan-kyu Lee, College of Veterinary Medicine, Chungbuk National University, Cheongju 28644, Korea +82-43-261-2960,
wklee@cbnu.ac.kr
© Research Institute of Veterinary Medicine, Chungbuk National University. All rights reserved.
Received: Feb 16, 2017; Revised: Mar 15, 2017; Accepted: Mar 15, 2017
Abstract
The objective of this study is to assess immunomodulatory effects of mixed Weissella (W.) cibaria JW15 strain with water extract of black soybean (Glycine max) and burdock (Arctium lappa) on Listeria (L.) monocytogenes infection in mice. Female 7-9 week old BALB/c mice were given a daily dose of 1 × 109 CFU of viable JW15 and JW15 mixed with black soybean (BS) and burdock (BD) in 200 μL PBS for 2 weeks. The nomal control group (NC) and positive control group (PC) were given 200 μL PBS. After 2 weeks, mice were infected with L. monocytogenes (1.0 × 105 CFU/mouse) via the tail vein. The NC was injected with 100 μL PBS without L. monocytogenes. After 2 days, mice were euthanized and their body weights were determined. In addition, their livers and spleens were weighed, and serum were analyzed for cytokine (Interleukin-1β (IL-1β) and Tumor necrosis factor-α (TNF-α)) production. The survival rate was monitored using 5 mice in each group in the same way above until the mice died. Two days after infection with L. monocytogenes, mean spleen weight per body weight (g/kg) of JW15 (5.4 ± 0.88 g/kg), JW15 + BS (6.0 ± 0.64 g/kg), and JW15 + BD (5.3 ± 0.38 g/kg) group were significantly lower than that of the PC (6.8 ± 0.57 g/kg). The level of IL-1β in the serum of JW15 + BD (113.6 ± 31.03 pg/mL) was significantly higher than that of the JW15 (67.9 ± 15.15 pg/mL). Collectively, combination W. cibaria JW15 and water extract of BD and BD have ability to induce synergistic immunomodulative effects and are suitable for consideration as a functional food for humans and functional feed additives for companion animals.
Keywords: Weissella cibaria JW15; immunomodulatory effect; Listeriamonocytogenes; black soybean; burdock
Introduction
생균제(probiotics)는 장내미생물총의 균형을 개선시키고 숙주동물에게 유익한 작용을 하는 살아있는 미생물로 Fuller에 의해 정의되었다[1]. 많은 미생물들이 생균제로 이용 되고 있지만, 사람과 동물의 생균제로는 유산균(Lactic acid bacteria)이 일반적으로 가장 많이 사용되고 있다. 현재까지 유산균은 장내 병원성균 증식 억제[2], 혈중 콜레스테롤 저 하[3], 소화기능 증진[4], 장내 면역기능 개선[5] 등 생체 내에서 유용한 많은 효과를 나타내는 것으로 보고되고 있다. 최근 유산균으로 포함된 Weissella 속 세균은 그람 양성 무 포자 형성균으로 카탈라아제 음성이며 이상유산발효경로 (heterolactic fermentation)를 통해 포도당을 유산과 이 산화탄소로 발효시킨다[6]. Weissella 속에 포함되는 Weissella cibaria 는 김치와 같은 발효음식에서 우점종으로 분리 되고, 2002년 Björkroth 등에 의해서 분류학 연구를 통해 처음 분류 되었다 [7]. Weissella cibaria는 weissellicin과 같 은 항균물질을 생성하고 항바이러스효과 및 면역효과를 지 니는 것으로 보고되고 있으며[8], 김치에서 분리된 Weissella cibaria JW15 (JW15) 는 대식세포에서의 Nitric Oxide (NO), Nuclear factor (NF)-κB, Interleukin (IL)-1β 및 Tumor necrosis factor (TNF)-α 생성을 증가시켜 면역력 을 증진시키는 우수한 효과가 있는 것으로 확인되었다[9].
검은콩은(Glycine max Merr) 한국의 다소비 식품소재로 써 건강식품과 전통 한방 재료로 많이 사용되고 있다. 무기 질, 비타민, 식이섬유, 안토시아닌, 이소플라본, 사포닌, 생 리활성단백질 펩타이드 등이 다량으로 함유 되어있는 콩은 항콜레스테롤혈증, 항암, 항산화, 고지혈증 예방, 면역증강 등 여러 생리활성 효과가 보고되고 있다[10]. 우엉(Arctium lappa)은 약용과 식용으로 재배되고 있는 야생초로 섬유질이 풍부하며 많은 약리효과를 지니며, 항암/항종양, 항당뇨, 항 바이러스 및 항염증 효과와 같은 광대한 범위에서 임상적으 로 사용이 가능하다고 알려져 있다[11].
그람 양성세균인 Listeria (L.) monocytogenes는 면역력이 저 하된 임산부, 신생아, 노인에게 리스테리아증으로 알려진 심 각한 패혈증, 뇌수막염, 식중독 등을 일으키며, 반추동물에 서는 선회병, 뇌수막염, 패혈증, 유산 등을 일으키는 세포 내 병원성 균으로 세균 감염에 대한 숙주의 면역반응을 연구하 는 동물 실험 모델 감염균으로 널리 사용되고 있다[12]. L. monocytogenes 는 Peyer's patch 경로를 통해 점막장벽을 걸 쳐 통과하여 장간막 림프절을 통해 간장과 비장으로 전파될 수 있다고 보고된 바 있다[13].
IL-1β와 TNF-α 같은 Pro-inflammatory cytokine은 숙 주의 면역체계에서 중요한 역할을 한다. IL-1β는 감염 및 염증에 대한 면역반응을 유도하여 초기 급성 반응에서 중요 한 매개물질로 작용하며, TNF-α, IL-6와 같은 cytokine 과 chemokine의 분비를 유도한다[14, 15]. TNF-α는 세 포 내에서 병원체를 억제하고 염증과정을 조절함으로써 숙 주면역체계에서 감염에 대한 저항성을 갖는다[16]. 이와 같 이 병원체들의 침입을 막고 숙주세포 면역에 기여하는 cytokine 들의 조절로 암 환자나 바이러스 질환환자들이 치료 되기도 한다[17].
본 연구는 아직까지 광범위하게 다루어지지 않은 식물추출 물과 유산균을 혼합하였을 때 나타나는 면역조절효과를 평 가하기 위해 실시하였다. 식물추출물로는 검은콩에 속하는 흑태와 우엉 물 추출물을 사용하였으며, 유산균은 선행연구 에서 내산성, 내담즙성, 내열성, 장내정착능 및 병원성억제 능 등 probiotics로서의 특성을 지니며 면역조절능이 검증된 JW15균주를 사용하였다[9]. JW15 균주는 흑태 물 추출물 과 혼합하여 Raw 264.7 cells에서의 NO, NF-κB, IL-1β 와 TNF-α 생성을 촉진을 시켜 면역증강 시너지 효과를 지 니는 것으로 확인 되었으나 동물실험에서의 효과는 아직 검 증되지 않은 상태이다[18]. 따라서, 본 실험에서는 마우스에 대한 L. monocytogenes 감염모델 실험을 통해 흑태 및 우엉 물 추출물과 JW15 유산균 혼합의 면역조절효과를 검증할 목적 으로 실험을 진행하였다.
Materials and Methods
유산균 배양
김치에서 분리한 Weissella cibaria JW15 (KACC 91811) 균주는 De Man Rogosa and Sharpe (MRS) broth (Difco, MI, USA) 에서 37℃, 24시간 배양한 후, MRS plate를 이 용하여 균수를 측정하였다. 또한 배양액 전체를 4℃에서 12,000 rpm으로 10분간 원심 분리하여 상층액은 버리고 균체만을 멸균된 1 × phosphate buffered saline (PBS; pH 7.2) 으로 2회 세척 후 1.0 × 109 CFU/mL이 되도록 희 석하여 실험동물에 경구투여 하였다[9].
흑태 및 우영 물 추출물 준비
흑태 및 우엉 물 추출물은 금산국제인삼약초연구소(International Ginseng & Herb Research Institute, Geumsan, Korea)에서 제공받아 본 실험에 사용하였다. 흑태 [Glycine max, Black soybean(BS)]와 우엉[Arctium lappa, Burdock(BD)]은 증류수 40 mL에 동결건조 분말 2 g을 가 해 200 rpm으로 25℃에서 24시간동안 교반 추출을 하였고 Whatman No. 3로 여과 후 회전진공농축기(40℃)를 이용 하여 용매를 제거하였다. 건조된 분말은 -80℃에서 보관하 여 실험에 사용하였다.
실험동물
실험동물은 7주령의 female BALB/c 마우스를 나라바이오 텍(Nara Biotech, Seoul, Korea)에서 구입하여 사용하였 다. 모든 동물실험은 충북대학교 실험동물 윤리위원회로부 터 승인을 받았으며(CBNUA-744-14-01), 충북대학교 실험동물지원센터의 사육 조건에 따라서 항온(21 ± 2℃), 항습(50 ± 20%), 12시간 간격(08:00~20:00)의 광주기 로 일정한 조건에서 사육을 진행하였다. 실험군은 무처치군 인 음성대조군(Normal control; NC), 양성대조군 (Positive control; PC), Weissella cibaria JW15 투여군 (JW15), JW15와 흑태 물 추출물 혼합투여군 (JW15 + BS), JW15 와 우엉 물 추출물 혼합투여군(JW15 + BD)의 총 5개군으 로 나누어 군당 5마리씩 25마리를 사용하였다. NC와 PC군 에는 PBS를 투여하고 JW15투여군에는 10% skim milk로 희석한 1.0 × 109 CFU의 JW15균주 200 μL를 투여하였 다. 흑태와 우엉은 성인(체중 60 kg)이 1일간 평균적으로 섭 취하는 양의 2배를 동물(체중 20 g) 섭취량으로 환산하여 마우스 1마리당 검은콩 11.14 mg/20g, 우엉 51.2 mg/20 g 농도로 경구투여 하였다. 2주간 각 물질들을 투여한 후 NC 를 제외한 나머지 군에 마리당 L. monocytogenes BA00092 (National Veterinary Research and Quarantine Service of Korea, Seoul, Korea)를 1.0 × 105 CFU 농도로 미정 맥을 통해 감염시켰다[19].
마우스 체중 및 장기무게 측정
L. monocytogenes를 감염시킨 2일 후, 마우스를 안락사 시 켜 무균적으로 간장 및 비장을 적출하고 무게는 상대무게 (g/kg)로 산출하여 장기의 무게도 함께 측정하였다. 각 군별 로 체중에 대한 장기의 상대무게(g/kg)를 측정하였다[19]
마우스 간장에서의 Listeria monocytogenes 균수 측정
L. monocytogenes 감염 2일 후, 무균적으로 적출한 간장 을 3000 rpm에서 5분동안 homogenizer (Tokken Inc., Chiba, Japan)를 이용하여 균질화시켜 간장 내에 L. monocytogenes의 균수를 BHI agar (BD, USA) 에서 측정하였다 [19].
마우스 혈청에서의 cytokine 측정
마우스 복대정맥의 혈액을 BD Microtainer SST tube (BD, USA)에 채취하고 3,000 rpm 10분간 원심분리를 통해 혈 청을 수집하였다. 수집한 혈청의 IL-1β와 TNF-α의 농도 는 ELISA kits (eBioscience, San Diego, USA)를 이용 하여 측정하였다. IL-1β와 TNF-α의 capture antibodies 100 μL를 4℃에서 하루 동안 코팅한 96-well plate에 비 특이적인 단백질 결합을 막기 위해 1시간 동안 blocking 하 였다. 0.05% (v/v)의 Tween 20 (Bioshop, Canada)을 포 함하는 PBS (PBST) 로 5번 세척 후, IL-1β와 TNF-α의 standard와 혈청액 100 μL를 넣고 2시간 동안 실온에서 배 양하였다. 모든 standard와 sample은 3반복씩 실시하였다. IL-1β와 TNF-α의 detection antibodies 100 μL를 1시간 동안 실온에서 방치시킨 후, Avidin-HRP를 30분간 실온에 서 반응시켰다. 마지막으로 Tetramethylbenzidine(TMB) 로 암실에서 15분 발색시키고 50 μL의 2N H2SO4로 반응을 멈추게 하였다. 반응이 끝난 plate를 450 nm에서 측정하고 흡광도값을 standard (0~1,000 pg/mL; IL-1β, TNF-α) 표준곡선을 이용하여 계산하였다[9].
Listeria monocytogenes 감염 마우스에서의 생존율 측정
각 군의 마우스에 PBS, JW15 그리고 JW15와 흑태 및 우 엉 물 추출물의 혼합을 2주간 투여하고 L. monocytogenes를 정맥주사로 감염시킨 후, 모든 개체가 사망할 때까지 3시간 간격으로 동물의 생존율을 측정하였다[19].
통계분석 및 유의성 검정
통계처리는 SPSS (Window ver. 12.0; SPSS, USA)를 이 용하였으며 그룹간의 유의성 검정은 ANOVA 후 Duncan's tests로 사후검정을 사용하였다 (p<0.05).
Results
마우스 체중 및 장기상대무게변화
각 군의 마우스에 2주간 시료를 경구투여하고, L. monocytogenes 정맥 감염 후 2일 째에 측정한 체중에서 PC군의 마우 스 체중은 17.5 ± 0.75 g로 NC군에(19.1 ± 0.88 g) 비 해 유의적으로 감소하였고, JW15 + BD를 투여한 마우스군 의 체중이(18.2 ± 1.67 g) PC군보다 증가하였으나, 각 투 여군간의 유의적인 체중변화는 관찰할 수 없었다(Table 1). 체중 당 간장의 상대적 무게측정 결과 NC군의 41.5 ± 2.08 g/kg 에 비해 PC군은 61.8 ± 5.98 g/로 유의적으로 증가하 여 L. monocytogenes 감염이 장기무게에 영향을 미친 것을 확 인 할 수 있었다. 체중 당 비장의 상대적 무게 측정 결과에서 도 PC군의 비장무게가 NC군보다 2배이상 유의적으로 증가 하였고 JW15, JW15 + BS, JW15 + BD 투여군의 비장무 게가 비대해진 PC군(6.8 ± 0.57 g/kg)의 비장무게보다 유 의적으로 감소한 것을 확인 할 수 있었다(Table 1).
Table 1.
Effect on the body weight and relative liver and spleen weights of mice after oral administration of Weissella cibaria JW15 and water extracts of BS and BD
|
Group |
Body weight (g) |
Liver/BW (g/kg) |
Spleen/BW (g/kg) |
|
NC |
19.1 ± 0.88b
|
41.5 ± 2.08a
|
3.3 ± 0.45a
|
|
PC |
17.5 ± 0.75a
|
61.8 ± 5.98b
|
6.8 ± 0.57c
|
|
JW15 |
17.2 ± 1.02a
|
64.6 ± 2.93b
|
5.4 ± 0.88b
|
|
JW15 + BS |
17.5 ± 0.77a
|
61.3 ± 1.10b
|
6.0 ± 0.64b
|
|
JW15 + BD |
18.2 ± 1.67ab
|
62.8 ± 5.62b
|
5.3 ± 0.38b
|
Download Excel Table
마우스 간장에서의 L. monocytogenes 감염 균수 측정 결과
L. monocytogenes 정맥주사 후 간장으로 이행한 생균수를 측 정한 결과, Table 2에서와 같이 NC 군에서는 L. monocytogenes가 검출되지 않았지만, PC군에서는 8.54 ± 0.45 (log cfu/g) 의 균수가 검출되었다. 그러나 투여군 모두 PC군과 의 유의적인 균수변화는 관찰되지 않았다.
Table 2.
Viable cell counts of Listeria monocytogenes in liver of mice after Listeria monocytogenes challenge
|
Group |
Listeria monocytogenes in liver (log cfu/g) |
|
NC |
- |
|
PC |
8.54 ± 0.45a
|
|
JW15 |
8.94 ± 0.46a
|
|
JW15 + BS |
8.32 ± 0.40a
|
|
JW15 + BD |
8.57 ± 0.39a
|
Download Excel Table
마우스 혈청에서의 IL-1 β 및 TNF- α 측정결과
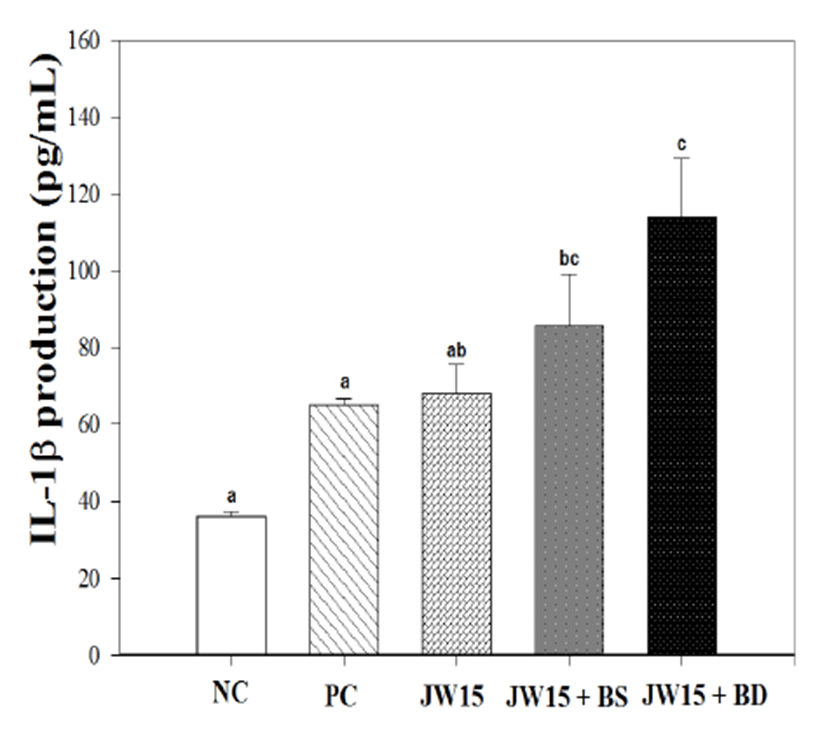
L. monocytogenes 정맥주사 후 마우스 혈청 내 IL-1β 측정결 과, PC군의 65.0 ± 3.57 pg/mL 생성량에 비해, JW15 + BS군과 JW15 + BD군에서 각 각 85.6 ± 26.75 pg/mL, 113.6 ± 31.03 pg/mL로 유의적으로 IL-1 β 생성을 증가 시켰다. 또한 JW15 + BD 투여군이 JW15 단독투여군의 67.9 ± 15.15 pg/mL 보다 유의적인 증가결과를 나타내 단 독투여군보다 더 높은 IL-1 β 를 생성하는 것을 확인 할 수 있었다(Fig. 1).
Fig. 1.
Interleukin (IL)-1β production in BALB/c mice sera in the Listeria monocytogenes challenge model. Data represent the mean ± SD of five mice in each group. NC; normal control group (no probiotic-feeding and no L. monocytogenes infection), PC; positive control group (no probiotic-feeding and infected with L. monocytogenes), JW15; Weissella cibaria JW15-fed and infected with L. monocytogenes, JW15 + BS; combination JW15 and black soybean-fed and infected with L. monocytogenes, JW15 + BD; combination JW15 and burdockfed and infected with L. monocytogenes group. Different superscript letters (a, b and c) indicate the statistical differences determined by ANOVA (p<0.05).
Download Original Figure
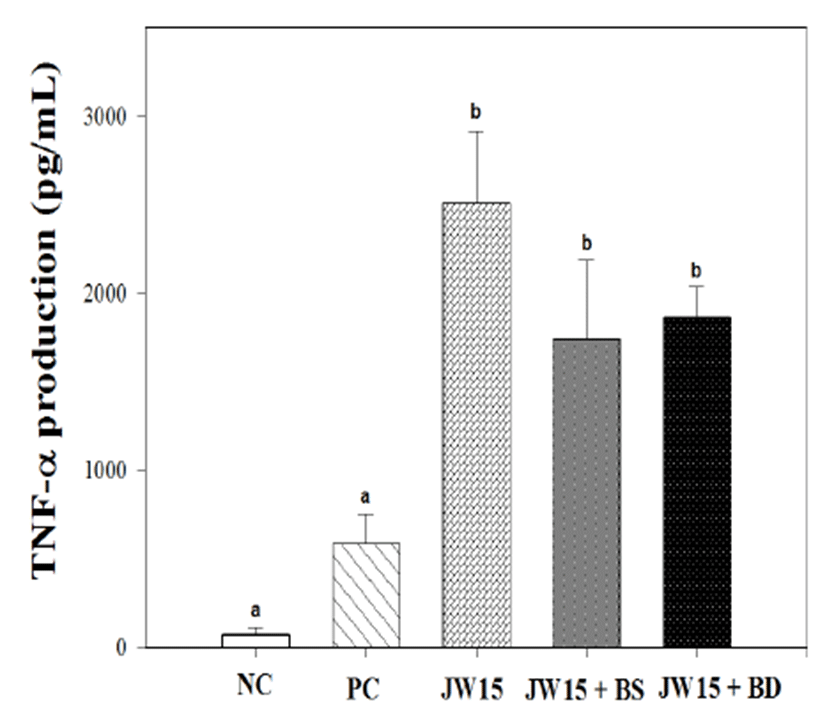
혈청 내 TNF-α 측정결과, JW15 (2200.0 ± 339.03 pg/ mL), JW15 + BS (1741.3 ± 445.56 pg/mL), JW15 + BD (1860.6 ± 175.30 pg/mL) 투여군 모두 PC군 (589.4 ± 165.37 pg/mL)에 비해 유의적으로 TNF- α 생성을 증 가시켰다 (Fig. 2).
Fig. 2.
Tumor necrosis factor-α (TNF-α) production in BALB/c mice sera in the Listeria monocytogenes challenge model. Data represent the mean ± SD of five mice in each group. NC; normal control group (no probiotic-feeding and no L. monocytogenes infection), PC; positive control group (no probiotic-feeding and infected with L. monocytogenes), JW15; Weissella cibaria JW15-fed and infected with L. monocytogenes, JW15 + BS; combination JW15 and black soybean-fed and infected with L. monocytogenes, JW15 + BD; combination JW15 and burdockfed and infected with L. monocytogenes group. Different superscript letters (a, and b) indicate the statistical differences determined by ANOVA (p<0.05).
Download Original Figure
L. monocytogenes 정맥주사감염에 의한 마우스의 생존율
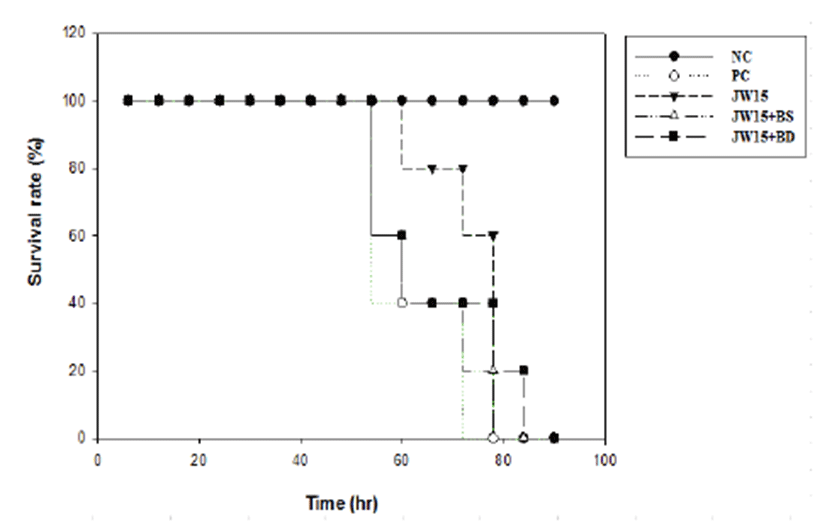
2주간 각 물질들을 경구투여하고 L. monocytogenes를 미정맥 감염시킨 후 마우스의 생존율을 측정한 결과, 감염되지 않은 NC군은 사망개체 없이 모두 생존하였고 JW15 군, JW15 + BS, JW15 + BD 군은 각각 76.80 ± 6.46, 68.20 ± 9.01 그리고 72.80 ± 15.58 시간 동안 생존하여 PC군(66.60 ± 9.10) 보다 오래 생존하였으나 유의적인 차이는 관찰되 지 않았다(Fig. 3.).
Fig. 3.
Mean survival times of mice after being infected with Listeria monocytogenes. NC; normal control group (no probiotic-feeding and no L. monocytogenes infection), PC; positive control group (no probiotic-feeding and infected with L. monocytogenes), JW15; Weissella cibaria JW15-fed and infected with L. monocytogenes, JW15 + BS; combination JW15 and black soybean-fed and infected with L. monocytogenes, JW15 + BD; combination JW15 and burdock-fed and infected with L. monocytogenes group.
Download Original Figure
Discussion
본 실험에서 사용된 흑태와 우엉은 우리나라 다빈도식품 중 면역활성을 보유하고 있는 식품소재로써 이미 면역활성 이 우수하다고 알려진 Weissella cibaria JW15와의 면역시너 지효과를 확인하기 위하여 JW15와의 혼합물로 선정하였다. 흑태와 우엉은 항산화능, 항바이러스 및 항염증과 같은 효 과를 지니며 다양하게 임상적으로 사용이 가능하다고 보고 되고 있지만[10, 11], 아직까지 면역조절에 관한 연구는 부 족한 상황이다. 또한 JW15 균주와 검은콩과의 혼합이 in vitro 상에서는 NO, NF-κB와 cytokine 생산을 증가시켜 면역반응을 증진시키는 것을 선행연구를 통해 확인하였지만 [18], 동물실험을 통한 면역활성효과는 확인되지 않은 상황 이다. 따라서 본 실험에서는 BALB/c 마우스 Listeria monocytogenes 감염 모델을 이용하여 유산균과 흑태와 우엉 물 추 출물의 혼합 투여 시 나타나는 면역증진효과를 확인하는 실 험을 진행하였다.
동물감염 실험에 사용한 Listeria monocytogenes 균은 면역 결 핍환자 및 임산부에 감염되어 심한 패혈증 및 수막염을 일 으키기 때문에 숙주 면역반응을 연구하는 세균감염모델로 서 사용되고 있다[12]. 또한 TNF-α, IFN-γ와 같은 cytokine의 분비가 Listeria monocytogenes 감염에 저항하는 중 요한 역할을 한다는 많은 연구결과가 발표된 바 있기 때문 에[20, 21], in vitro 실험을 통해 TNF-α 와 IL-1β 생성 을 증가시키는 것으로 확인된 JW15균주가 Listeria monocytogenes 감염실험에서 방어효과를 보일 것으로 예상하고 Listeria monocytogenes 감염모델을 본 실험에서 사용하였다.
BALB/c 마우스는 Listeria monocytogenes 감염에 있어서 가 장 민감한 것으로 알려져 있으며 본 연구에서 감염모델의 마 우스로 사용하였고, Puertollano 등 여러 연구자들은 유산 균의 면역반응을 평가하기 위하여 BALB/c 마우스를 사용 하였다[22, 23]. 이번 연구에서 Listeria monocytogenes를 미 정맥으로 감염시킨 결과, 감염 후 Listeria monocytogenes만 을 접종한 PC군의 마우스 체중당 비장의 상대 무게가 증가 하는 것을 알 수 있었다. JW15, JW15 + BS 그리고 JW15 + BD 군의 상대적인 spleen 무게는 PC 군에 비해 유의적 으로 감소하였는데, 이 결과는 유산균과 흑태 및 우엉 물 추 출물의 혼합에 의한 숙주의 면역활성으로 인한 보호 효과 로 추측된다. Puertollanoe 등은 Lactobacillus plantarum 투 여로 Listeria monocytogenes 감염 마우스에서 비장의 무게가 정상 수준으로 회복하였으며, 생존율이 증가하였다는 연구 결과를 발표한 바가 있으며[23], Choi 등 또한, Enterococcus faecium JWS 833을 경구투여 시 Listeria monocytogenes 감염 에 의해 증가한 비장의 무게를 감소시켰다는 연구 결과를 발 표하였다[19].
JW15와 흑태 및 우엉 물 추출물 혼합 투여군의 마우스에서 혈청 내 cytokine (IL-1β, TNF-α)이 PC군에 비해 증가된 것을 볼 수 있었다. Nishikawa 등의 L. monocytogenes 감염실 험에서 TNF-α 및 IFN-γ 가 부족한 마우스의 경우 감염 에 대한 감수성이 더 높은 것으로 확인이 되었고, L. monocytogenes 감염에 저항하기 위해서 필수적인 역할을 하는 cytokine임이 발표된 바가 있기 때문에 JW15와 흑태 및 우엉 물 추출물에 의한 pro-inflammatory cytokine의 증가가 L. monocytogenes 감염에 대한 저항성을 증가시킨 것으로 보인 다[24]. 또한 Liliane 등도 Lactobacillus delbrueckii를 투여하 고 L. monocytogenes를 감염한 마우스 혈청에서 TNF-α 생성 량이 유의적으로 증가하여 유산균이 L. monocytogenes 에 대 해 방어효과를 지닌다는 연구를 보고한 바가 있다[25]. 이러 한 염증 cytokine (IL-1β, TNF-α)의 증가는 숙주의 면역 체계내의 균형을 유지시키며, 병원성세균에 감염된 숙주 면 역체계 내에서 감염에 대한 방어를 돕는 것으로 알려지고 있 다[26, 27]. 따라서 본 실험에서 확인된 JW15균주와 흑태 및 우엉 물 추출물의 혼합투여가 면역활성 능력을 나타내는 기전은 이와 같은 cytokine 활성변화에 기인한 것으로도 추 측할 수 있다. 그러나 이번 실험에 사용한 L. monocytogenes 감 염모델은 급성패혈증을 유발하는 동물모델이었기 때문에 향 후 병원성을 저하시킨 동물모델에서의 추가 확인 실험이 필 요할 것으로 판단된다.
흑태에 높은 함량으로 존재하는 polysaccharides와 우엉의 뿌리를 구성하는 Lignans, polyphenols, Fructose등과 같 은 구성물질들이 면역체계를 개선시키는 것으로 보고 되고 있다[28, 29]. 흑태와 우엉에 존재하는 면역력을 강화시키 는 구성성분들이 L. monocytogenes 감염모델에서 마우스의 면 역력을 강화하는데 기여한 것으로 생각된다. 유산균(Lactic acid bacteria)은 면역계에서 병원균을 감지하는 대식세포 를 활성화하여 세균이나 바이러스를 신속하게 감지하고 혈액 내 항체인 IgA 생성을 증가시키거나 Interferon (IFN)-γ, IL-1β 그리고 TNF-α와 같은 cytokine 생성량을 증가시켜 면역력을 증진하여 병원균과 같은 외부물질의 침입에 대응 한다고 알려져 있다[2]. 본 실험에서도 JW15 + BS, JW15 + BD 혼합물의 투여가 혈청에서의 IL-1β 및 TNF-α 생성 을 증가시켰기 때문에 JW15와 흑태 및 우엉 추출물의 혼합 이 L. monocytogenes 감염모델에서 면역증강효과를 나타낸 것 으로 보인다.
L. monocytogenes를 미정맥으로 감염시키고 실시한 survival test에서 JW15, JW15와 검은콩 그리고 JW15와 우엉의 혼 합물 투여군은 PC군보다 더 오랫동안 생존함을 확인할 수 있었다. 각 군간의 생존시간에 대한 통계적인 유의적인 차이 는 나타나지 않았으나 향후 L. monocytogenes의 접종 농도를 낮춰서 감염시험을 진행한다면 각 군간의 생존시간에 있어 유의적인 차이를 확인할 수 있을 것으로 예상된다.
이상의 결과를 종합해 보았을 때, JW15 흑태 및 우엉 물 추출물을 혼합하여 투여한 마우스 동물실험에서 L. monocytogenes 감염에 대한 숙주의 면역 체계가 활성화되어 체내에 존재하는 L. monocytogenes 수를 감소시키는 등 면역 방어효 과를 나타낸 것으로 판단된다. 따라서 이번 결과를 바탕으로 향후 면역활성이 뛰어난 Weissella cibaria JW15 균주와 흑태 및 우엉의 혼합물을 면역력이 저하된 사람 및 동물의 건강기 능성 식품소재로 활용한다면 산업적인 가치가 매우 높을 것 으로 기대하며, 나아가 새로운 면역조절 기능성 생균제 개발 에도 이용될 수 있을 것으로 생각된다.
Acknowledgements
이 논문은 2014년도 충북대학교 학술연구지원사업의 연구비 지원에 의하여 연구되었음(Th i s w o r k w a s supported by the research grant of Chungbuk National University in 2014).
References
Fuller R. Probiotics in man and animals.. Journal of Applied Bacteriology. 66(5) 1989; :365-378


Tsai Y. T., Cheng P. C., Pan T. M. The immunomodulatory effects of lactic acid bacteria for improving immune functions and benefits.. Applied Microbiology and Biotechnology. 96(4) 2012; :853-862


Song M., Park S., Lee H., Min B., Jung S., Park S., Kim E., Oh S. Effect of Lactobacillus acidophilus NS1 on plasma cholesterol levels in diet-induced obese mice.. Journal of Dairy Science. 98(3) 2015; :1492-1501


Strowski M. Z., Wiedenmann B. Probiotic carbohydrates reduce intestinal permeability and inflammation in metabolic diseases.. Gut. 58(8) 2009; :1044-1045


Rolfe R. D. The role of probiotic cultures in the control of gastrointestinal health.. Journal of Nutrition. 130 2000; :396-402.

De Bruyne K., Camu N., De Vuyst L., Vandamme P. Weissella fabaria sp. nov., from a Ghanaian cocoa fermentation.. International Journal of Systematic and Evolutionary Microbiology. 60(9) 2010; :1999-2005


Bjorkroth K. J., Schillinger U., Geisen R., Weiss N., Hoste B., Holzapfel W. H., et al. Taxonomic study of Weissella confusa and description of Weissella cibaria sp. nov., detected in food and clinical samples.. International Journal of Systematic and Evolutionary Microbiology. 52(1) 2002; :141-148


Kang M. S., Lim H. S., Kim S. M., Lee H. C., Oh J. S. Effect of Weissella cibaria on Fusobacterium nucleatum-induced Interleukin-6 and Interleukin-8 Production in KB Cells.. Journal of Bacteriology and Virology. 41(1) 2011; :9-18


Ahn S. B., Park H. E., Lee S. M., Kim S. Y., Shon M. Y., Lee W. K. Characteristics and immuno-modulatory effects of Weissella cibaria JW15 isolated from Kimchi, Korea traditional fermented food, for probiotic use.. Journal of Biomedical Research. 14(4) 2013; :206-211


Nizamutdinova I. T., Kim Y. M., Chung J. I., Shin S. C., Jeong Y. K., Seo H. G., Lee J. H., Chang K. C., Kim H. J. Anthocyanins from black soybean seed coats stimulate wound healing in fibroblasts and keratinocytes and prevent inflammation in endothelial cells.. Food and Chemical Toxicology. 47(11) 2009; :2806-2828


Chan Y. S., Cheng L. N., Wu J. H., Chan E., Kwan Y. W., Lee S. M., Leung G. P.-H., Yu P. H.-F., Chan S.-W. A review of the pharmacological effects of Arctium lappa (burdock).. Inflammopharmacology. 19(5) 2011; :245-254


Allerberger F., Wagner M. Listeriosis: A resurgent foodborne infection.. Clinical Microbiology and Infection. 16(1) 2010; :16-23


Pron B., Boumaila C., Jaubert F., Sarnacki S., Monnet J. P., Berche P., et al. Comprehensive study of the intestinal stage of listeriosis in a rat ligated ileal loop system.. Infection and Immunity. 66 1998; :747-755.

Dinarello C. A. Biologic basis for interleukin-1 in disease.. Blood. 87 1996; :2095-2147.

Introna M, Breviario F, d'Aniello EM, Golay J, Dejana E, Mantovani A. IL-1 inducible genes in human umbilical vein endothelial cells.. Eur Heart J . 1993; 14 Suppl p. 8-81
Derouich-Guergour D., Brenier-Pinchart M. P., Ambroise-Thomas P., Pelloux H. Tumour necrosis factor alpha receptors: Role in the physiopathology of protozoan parasite infections.. International Journal for Parasitology. 31(8) 2001; :763-769


Capuron L., Hauser P., Hinze-Selch D., Miller A. H., Neveu P. J. Treatment of cytokine-induced depression.. Brain, Behavior, and Immunity. 16(5) 2002; :575-580


Park H. E., Jang Y. J., Lee W. K. Immunomodulatory effects mixed with Weissella cibaria JW15 and Black soybean (Glycine max (L.) Merr.) Extract.. J Biomed Transl Res. 17(1) 2016; :20-25


Choi H. J., Shin M. S., Lee S. M., Lee W. K. Immuno-modulatory properties of Enterococcus faecium JWS 833 isolated from duck intestinal tract and suppression of Listeria monocytogenes infection.. Microbiology and Immunology. 56(9) 2012; :613-620


Dunn P. L., North R. J. Early gamma interferon production by natural killer cells is important in defense against murine listeriosis.. Infection and Immunity. 59 1991; :2892-2900.

Rothe J., Lesslauer W., Lotscher H., Lang Y., Koebel P., Kontgen F., Althage A., Zinkernagel R., Steinmetz M., Bluethmann H. Mice lacking the tumour necrosis factor receptor 1 are resistant to TNF-mediated toxicity but highly susceptible to infection by Listeria monocytogenes.. Nature. 364(6440) 1993; :798-802


Cheers C., McKenzie I. F., Pavlov H., Waid C., York J. Resistance and susceptibility of mice to bacterial infection: Course of listeriosis in resistant or susceptible mice.. Infection and Immunity. 19 1978; :763-770.

Puertollano E., Puertollano M. A., Cruz-Chamorro L., Alvarez de Cienfuegos G., Ruiz-Bravo A., de Pablo M. A. Orally administered Lactobacillus plantarum reduces pro-inflammatory interleukin secretion in sera from Listeria monocytogenes infected mice.. British Journal of Nutrition. 99(04) 2008; :819-825


Nishikawa S., Miura T., Sasaki S., Nakane A. The protective role of endogenous cytokines in host resistance against an intragastric infection with Listeria monocytogenes in mice.. FEMS Immunology and Medical Microbiology. 16(3-4) 1996; :291-298


dos Santos L. M., Santos M. M., de Souza Silva H. P., Arantes R. M., Nicoli J. R., Vieira L. Q. Monoassociation with probiotic Lactobacillus delbrueckii UFV-H2b20 stimulates the immune system and protects germfree mice against Listeria monocytogenes infection.. Medical Microbiology and Immunology. 200(1) 2011; :29-38


Park S. Y., Ji G. E., Ko Y. T., Jung H. K., Ustunol Z., Pestka J. J. Potentiation of hydrogen peroxide, nitric oxide, and cytokine production in RAW 264.7 macrophage cells exposed to human and commercial isolates of Bifidobacterium.. International Journal of Food Microbiology. 46(3) 1999; :231-241


Hunter C. A., Chizzonite R., Remington J. S. IL-1 beta is required for IL-12 to induce production of IFN-gamma by NK cells. A role for IL-1 beta in the T cell-independent mechanism of resistance against intracellular pathogens.. Journal of Immunology (Baltimore, Md.: 1950). 155 1995; :4347-4354.

Wu M. H., Lee Y. C., Tsai W. J., Yang W. B., Chen Y. C., Chuang K. A., Liao J.-F., Wang C.-C., Kuo Y.-C. Characterized polysaccharides from black soybean induce granulocyte colony-stimulated factor gene expression in a phosphoinositide 3-kinase-dependent manner.. Immunological Investigations. 40(1) 2011; :39-61


Lin S. C., Lin C. H., Lin C. C., Lin Y. H., Chen I. C., Chen C. F., et al. Hepatoprotective effects of Arctium lappa Linne on liver injuries induced by chronic ethanol consumption and potentiated by carbon tetrachloride.. Journal of Biomedical Science. 9 2002; :401-409.