Original Article
Immune enhancing effects of Weissella cibaria JW15 in C57BL/6J mice aged 28 months
Ho-Eun Park, Ho-Seong Ahn, Wan-Kyu Lee*

College of Veterinary Medicine, Chungbuk National University, Cheongju 28644, Korea
*Corresponding author: Wan-kyu Lee, College of Veterinary Medicine, Chungbuk National University, Cheongju 28644, Korea Tel: +82-43-261-2960,
wklee@cbnu.ac.kr
© Research Institute of Veterinary Medicine, Chungbuk National University. All rights reserved.
Received: Nov 28, 2016; Revised: Dec 15, 2016; Accepted: Dec 19, 2016
Abstract
Aging is a growing concern of age-associated aberrations in immune system or immunosenescence. Probiotics contain not only these general health advantages but also other the regulation of host immune function. Among those probiotics, the immunomodulatory effects of Weissella cibaria JW15 (JW15) strain has already been reported in our previous studies. The objective of this study is to assess improved immunity of JW15 strain in aged mice. In experiment, mice were divided into five groups. Twenty eight–month-old C57BL/6J mice were given a daily dose of 1×109 CFU/ mouse (JW15-H group) and 1×108 CFU/mouse (JW15-L group) of viable JW15. The young mice group (YM) and old mice group (OM) were given PBS. After four weeks of administration, mice were euthanized. Mice blood was collected and analyzed for complete blood cell count (CBC). Then, mice spleen was weighed and analyzed for splenocyte. Finally, we measured the concentration of cytokine secreted by splenocyte and serum. The results showed splenocyte proliferation of JW15-L group by the addition of LPS and concanavalin A was significantly higher than that of OM group. Splenocyte TNF-α production was significantly increased by JW15 intake. In particular, splenocyte TNF-α production of JW15-L group by the addition of LPS (5 μg/mL) was significantly greater than that other group. Splenocyte IL-6 production was also the highest in JW15-L group. Serum IFN-γ production of JW15-L (59.13 ± 16.13 pg/mL) group was significantly higher than that of OM group (39.71 ± 2.51 pg/mL). When compared to the OM group (32.22 ± 1.92 pg/mL), Serum TNF-α production was significantly increased by JW15-H intake (69.01± 26.51 pg/mL). In conclusion, JW15 enhanced immunomodulative effects. In particular, the effect was significantly excellent in JW15-L group (1 × 108 CFU/mouse). Therefore, Weissella cibaria JW15 would be suitable for consideration as a helpful functional food for companion animals and humans.
Keywords: Weissella cibaria JW15; C57BL/6J; aged mice; immune enhancing effect; cytokine
Introduction
노화 과정은 점진적으로 생리적인 능력이 감소하여, 궁극적 으로는 죽음에 이르게 되는 생물체의 다원적인 과정을 의미 한다[1]. 정상적인 노화 동물의 경우에도 노화와 관련된 면 역체계의 이상이나 면역력의 점차적인 감소를 초래하게 되 어, 궁극적으로는 감염의 반복, 만성적인 염증성 질병 발생 등이 나타나게 된다[2].
노화와 관련된 변화는 후천성 면역(adaptive immunity) 시스템에서 주로 발생하고 세포 매개성 T cell과 체액성 B cell 면역반응 모두 노화면역과 밀접한 관련이 있다. 특히 노 화에 따라 나타나는 T cell 기능의 감소는 면역력을 저하 시키는 주된 원인이며 동물과 사람을 대상으로 한 많은 연 구에서 입증된 바가 있다[3]. 노화동물의 경우 말초혈관에 서의 Naive T cell과 림프구 비율의 감소가 나타나며, 반 대로 memory T cell과 effector T cell의 경우에는 분화 된 비율이 증가하게 된다[4]. CD8 T cell의 비율은 증가 하면서 CD4 T cell의 비율은 감소하기 때문에, CD4:CD8 T cell의 비율은 감소하게 된다. B cell의 숫자는 노화와 함 께 증가하게 되며, 이것은 면역글로불린의 생산이 조절되지 않음으로써 생기는 현상으로 생각된다. 염증노화(inflammaging) 의 개념은 노화에 따른 만성 염증 상태를 의미하 며, 노화 동물의 경우 낮은 면역 활성도를 나타나게 되는데, IL-1β와 TNF-α와 같이 순환하는 cytokine과 연관이 있 다[2, 5]. IL-1β는 염증이나 감염과 같은 증상에 대해서 면 역반응을 유발하는 초기의 급성 반응에 중요한 매개물질이 다. TNF-α는 세균감염이 발생할 경우에 염증과정을 조절 하고, 또 세포 내 감염의 억제를 통하여 숙주의 면역계에서 광범위한 영향을 미치게 된다[6]. IFN-γ는 활성화 T림프 구와 대식세포에 의하여 생산이 되는 cytokine으로 바이러 스와 세균에 감염될 경우에 사용되며 항암제로도 사용된다. IFN-γ는 바이러스의 복제를 직접적으로 억제하며, 그 밖 에 면역을 자극하고 면역을 조절하는 능력을 갖고 있다[7].
생균제(probiotics)에 대한 일반적인 정의는 숙주 동물의 장내미생물총의 균형을 향상시켜 유익한 작용을 하는 살아 있는 미생물로 인식되고 있다[8]. 유산균(lactic acid bacteria) 은 생균제로 가장 많이 사용하고 있는 미생물로서, 대 부분 탄수화물을 에너지원으로 사용하기 때문에 최종 대사 산물로 유산을 생산하며, 대사과정, 내분비, 소화관의 기능증 진 및 면역조절 등 전반적으로 생체 내 유용 효과를 나타내 는 것으로 알려져 있다[9-11]. 특히 일부 유산균의 경우 면 역기능을 조절하고 증진시키는 것[12], 이외에도 노화동물 에서 면역기능을 증진시키며, 감염 예방의 효과 등이 보고되 고 있다 [13, 14].
Weissella 속 유산균은 1993년에 Colins등이 Leuconostoc 속 에서 다른 종들과 차이를 보이는 Leuconostoc paramesenteroides 1종과 Lactobacillus 속 5종을 새로운 속(Genus)으로 제 안함으로써 처음으로 분류되었다[15]. Weissella 속 세균은 그람 양성의 무포자 형성균으로 운동성이 없으며, 카탈라아 제 음성이며 젖산과 이산화탄소를 생성하는 이상발효(heterofermentation) 를 통하여 포도당을 유산과 이산화탄소 로 발효시킨다[16]. 김치에서 분리된 Weissella cibaria JW15 (JW15)는 병원성 억제능, 내산성, 내열성, 내담즙성과 같은 생균제로서의 특성을 갖고 있는 것으로 보고되었으며 macrophages cell에서의 NO, NF-κB, IL-1β 및 TNF-α 생성을 촉진시켜 면역조절 효과가 있는 것으로 확인되었다 [17]. 그러나 면역력이 저하된 노화동물에서의 면역조절 효 과에 대해서는 연구가 되어 있지 않은 상태이다.
따라서 본 연구에서는 자연적인 노화로 면역력이 저하된 28개월령의 C57BL/6J 노화 마우스를 대상으로, Weissella cibaria JW15 균주를 4주간 경구투여하고, 혈액 및 비장에서 다양한 면역지표들을 측정함으로써 JW15균주의 면역증진 효과를 평가함을 실험의 목적으로 진행하였다.
Materials and Methods
유산균 배양
김치에서 분리한 Weissella cibaria JW15 (JW15, KACC 91811)균주와 Lactobacillus rhamnosus GG (LGG, ATCC 53103)균주는 De Man Rogosa and Sharpe (MRS) broth (BD, USA)를 사용하여 37℃, 24시간 배양하였다. 배양된 유산균은 희석액A[18]로 십진 희석하여 MRS plate에 도말 하였고 48시간 배양 후 생균수를 측정하였다[19]. 또한 배 양액 전체를 10분간 4℃에서 12,000 rpm으로 원심 분리하 여 상층액은 버리고 균체만을 멸균된 phosphate buffered saline (PBS; pH 7.2)으로 2회 세척 후, 균수를 저농도투 여군은 1.0 × 108 CFU/mouse, 고농도투여군은 1 × 109 CFU/mouse 되도록 희석하여 실험동물에 경구 투여하였다 [20].
실험동물
실험동물은 한국기초과학지원연구원(KOREA BASIC SCIENCE INSTITUTE, Korea)의 C57BL/6J mouse 8주 령의 정상 동물과 28개월령의 노화동물을 구입하여 실험에 사용하였다. 모든 동물실험은 충북대학교 실험동물 윤리위 원회로부터 승인을 받았으며(CBNUA-978-16-01), 충 북대학교 실험동물지원센터의 사육 조건에 따라서 항온(21 ± 2℃), 항습(50 ± 20%), 12시간 간격(08:00~20:00)의 광주기로 일정한 조건에서 사육을 진행하였다. 실험군은 정 상군(young mouse group; YM, n=3), 노화군(old mouse group; OM, n=3), JW15 저농도 투여군(Weissella cibaria JW15-Low 1.0 × 108 CFU/mouse; JW15-L, n=3), JW15 고농도 투여군(Weissella cibaria JW15-High 1.0 × 109 CFU/mouse; JW15-H, n=3), LGG투여군(Lactobacillus rhamnosus GG 1.0 × 109 CFU/mouse; LGG, n=3)의 5개군으로 편성하였다. 유산균은 4주간 경구 투여하였으며, 8주령인 YM군과 28개월령인 OM군에는 유산균 대신 PBS 를 4주간 투여하였다[20].
혈액학적 검사
혈액분석을 위한 채혈은 투여 종료일인 28일째에 실시하 였다. 마우스는 채혈 14시간 전부터 절식시켰으며, 채혈 은 ethyl ether로 마우스를 마취시킨 후, 심장채혈을 통 해 진행하였다. 채혈한 혈액의 혈액학적 검사는 백혈구 (white blood cell, WBC), 적혈구(red blood cell, RBC), hemoglobin(HGB), 혈소판 농도(platelet, PLT), 혈구 hemoglobin 부피(mean corpuscular volume, MCV), 혈 구 hemoglobin 평균 농도(mean corpuscular hemoglobin concentration, MCHC), 혈구 hemoglobin 농도(mean corpuscular hemoglobin, MCH)등을 혈구분석기(Advia2120, USA) 이용하여 측정하였다.
마우스 비장세포 분리 및 세포 수 측정
4주간 투여 후 마우스를 안락사하여 혈액과 비장을 수집하 였다. 비장의 무게를 측정한 뒤, Cell strainer (SPL, Korea) 와 1× PBS 5mL를 이용하여 비장세포를 분리하였다. 분리된 비장세포는 10분간 4℃에서 1,500 rpm으로 원심 분리하여, 상층액은 버린 뒤, 1× RBC lysis buffer(0.154 M NH4Cl, 10 mM KHCO3, 0.1 mM ethylene diamine tetra-acetic acid (EDTA))를 2 mL 넣고 2분간 방치한 후 10분간 4℃에서 1,500 rpm으로 원심 분리하였다. 상 층액을 버린 뒤, 1× PBS 5 mL로 splenocyte를 희석 후 hemocytometer를 이용하여 비장의 세포 수를 측정하였다 [21].
마우스 비장세포증식능 측정
부검 시 마우스로부터 비장세포를 분리하여 5.0 × 105/ well로 96-well plate에 분주하였다. T 세포의 증식유도 를 위해 10 ㎍/mL의 concanavalin A(ConA; Sigma-Aldrich, USA)와 B 세포의 증식유도를 위한 5 ㎍/mL의 LPS (Sigma-Aldrich, USA)를 각각 첨가하고 48시간 배양하 였다. 배양 후, 10mM의 PMS (Sigma-Aldrich) 와 1 ㎎/ mL의 XTT (Sigma-Aldrich) 용액을 실험 직전에 혼합하 여, 위의 96-well plate에 분주하였다. 2시간 반응 후 450 nm에서 ELISA reader (Tecan, Austria)를 사용하여 측 정하였다[12].
마우스 Cytokine 생성능 측정
면역세포의 증식이 유도된 비장세포의 상층액을 회수하여 cytokine 생성을 측정하였다. IFN-γ, IL-6, TNF-α의 농도는 ELISA kits (eBioscience, USA)를 이용하여 측정 하였다. Sandwich ELISA 방법으로 측정하였으며, 각 시 료는 3회 반복으로 시행하였다. 각 1차 항체 원액을 coating 완충용액에 해당 농도가 되도록 희석하여, 96-well microplate에 분주 한 후, 4℃에서 하룻밤 반응시켰다. 비 특이적인 반응을 막기 위해 상온에서 1시간 차단 후, 시료 및 표준용액을 적당량 희석하여 분주하였고 2시간 후 희석 한 2차 항체를 처리하여 1시간 동안 실온에서 방치시켰다. 그 후, Avidin-HRP 용액을 30분간 상온에서 반응시킨 후 3,3'-5,5'tetramethylbenzidine (TMB) substrate용액을 분주하여 15분 동안 암실에서 발색시켰다. 2N H2SO4용액 을 첨가함으로써 반응을 완료하였으며 반응이 끝난 plate 를 450 nm에서 측정하고 흡광도 값을 standard (0~1,000 pg/mL; IFN-γ, IL-6, TNF-α) 표준곡선을 이용하여 계 산하였다[19].
통계분석 및 유의성 검정
통계처리는 SPSS (Window ver. 12.0; SPSS, USA)를 이 용하였으며 그룹간의 유의성 검정은 ANOVA와 Duncan's tests를 사용하였다(p < 0.05).
Results
혈액학적 분석
투여 4주 후에 실시한 혈액학적 분석 결과, 백혈구수(WBC) 는 YM군이 3.6 ×103/mm3, OM군이 2.7 × 103/mm3로 측 정되어 노화로 인한 WBC 감소 추세를 보였으며, JW15-L 군의 WBC는 3.9 × 103/mm3으로 OM군보다 높은 백혈구 수를 나타내었지만, 통계적인 유의적인 차이는 나타나지 않 았다 (data not shown). 나머지 혈액학적 분석에서도 항목 별 유의적인 차이는 관찰할 수 없었다(data not shown).
비장세포 증식능
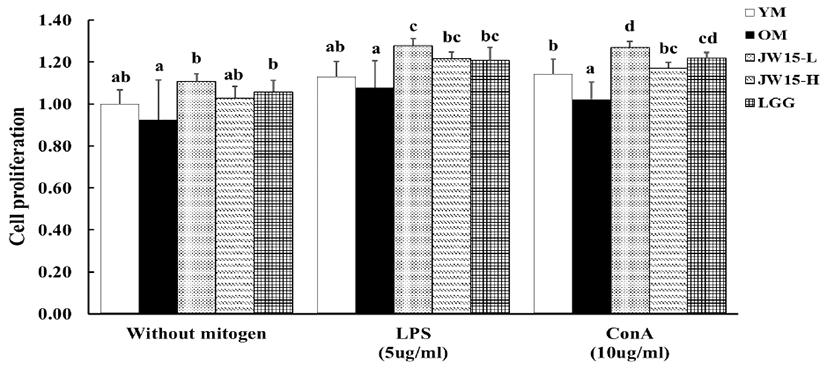
4주간 유산균의 경구투여를 진행한 마우스의 비장에서 세 포증식능을 측정하였다. Mitogen을 처리하지 않은 YM군의 흡광도를 1로 하여 비교한 실험결과를 Fig. 1에 나타내었다. Mitogen을 처리하지 않은 실험에서, OM군 (0.92 ± 0.19) 보다 JW15-L군(1.11 ± 0.04)과 LGG군 (1.06 ± 0.06) 이 세포증식을 유의적으로 증가시켰다. B cell의 mitogen인 LPS를 처리한 실험에서 JW15-L (1.28 ± 0.04), JW15- H (1.22 ± 0.03) 그리고 LGG투여군 (1.21 ± 0.06)모두 OM군 (1.08 ± 0.13)보다 유의적으로 높은 세포증식능을 나타내었다. 또한 T cell의 mitogen인 ConA를 처리한 실험 에서도 OM군보다 JW15-L, JW15-H 그리고 LGG군의 세 포증식능 모두 유의적으로 증가하였다.
Fig. 1.
Effects of Weissella cibaria JW15 on proliferation of splenocyte in C57BL/6J mice aged 28 months. Data represent the mean ± SD of three mice in each group. Different superscript letters (a and b) indicate the statistical differences determined by ANOVA (P<0.05). YM, young mice group (no probiotic-feeding); OM, old mice group (no probioticfeeding); JW15-L, Weissella cibaria JW15-Low group (1.0×108 CFU/mouse); JW15-H, Weissella cibaria JW15-High group (1.0×109 CFU/mouse); LGG, Lactobacillus rhamnosus GG group (1.0×109 CFU/mouse).
Download Original Figure
비장세포에서의 cytokine 생성능
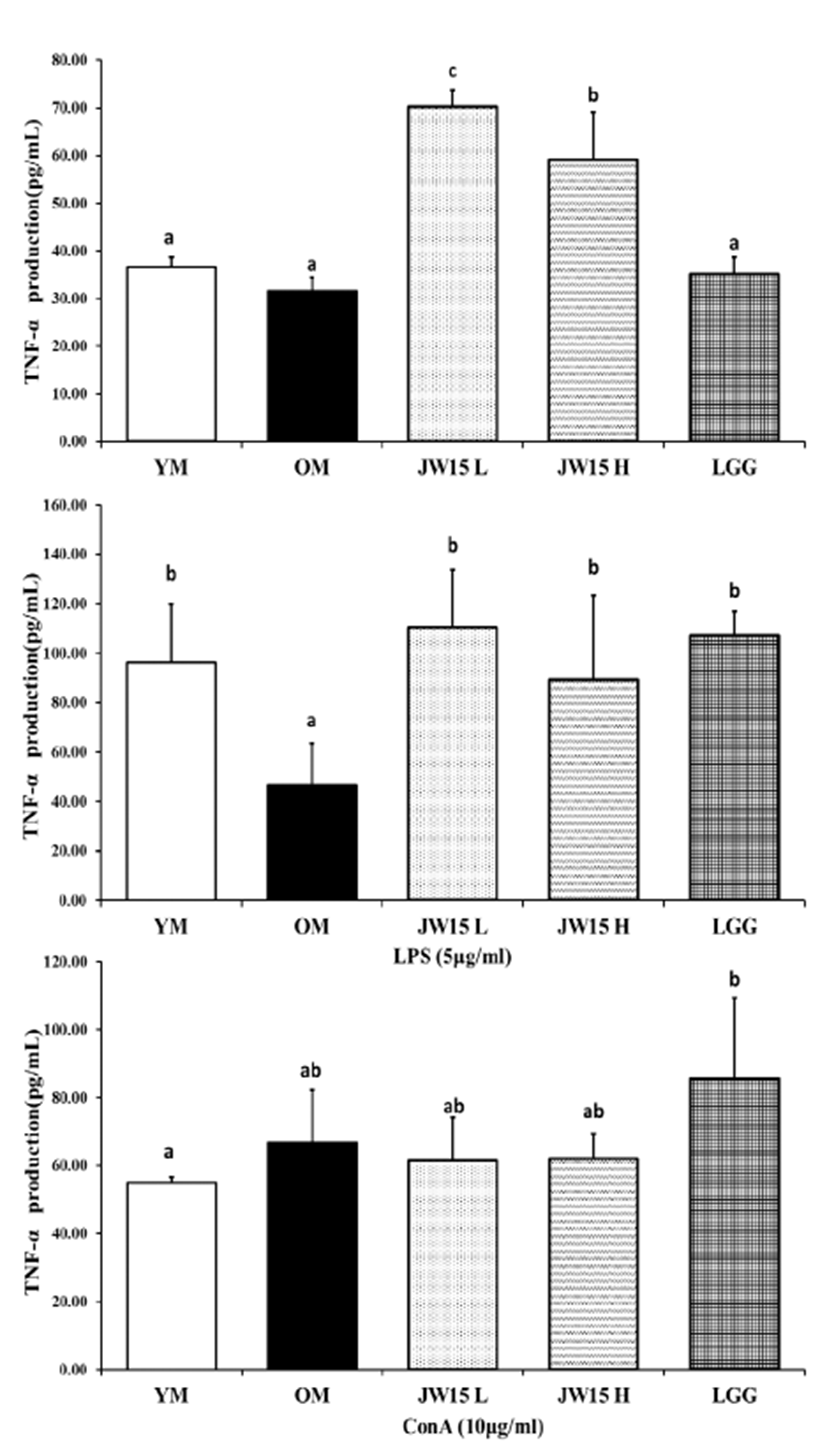
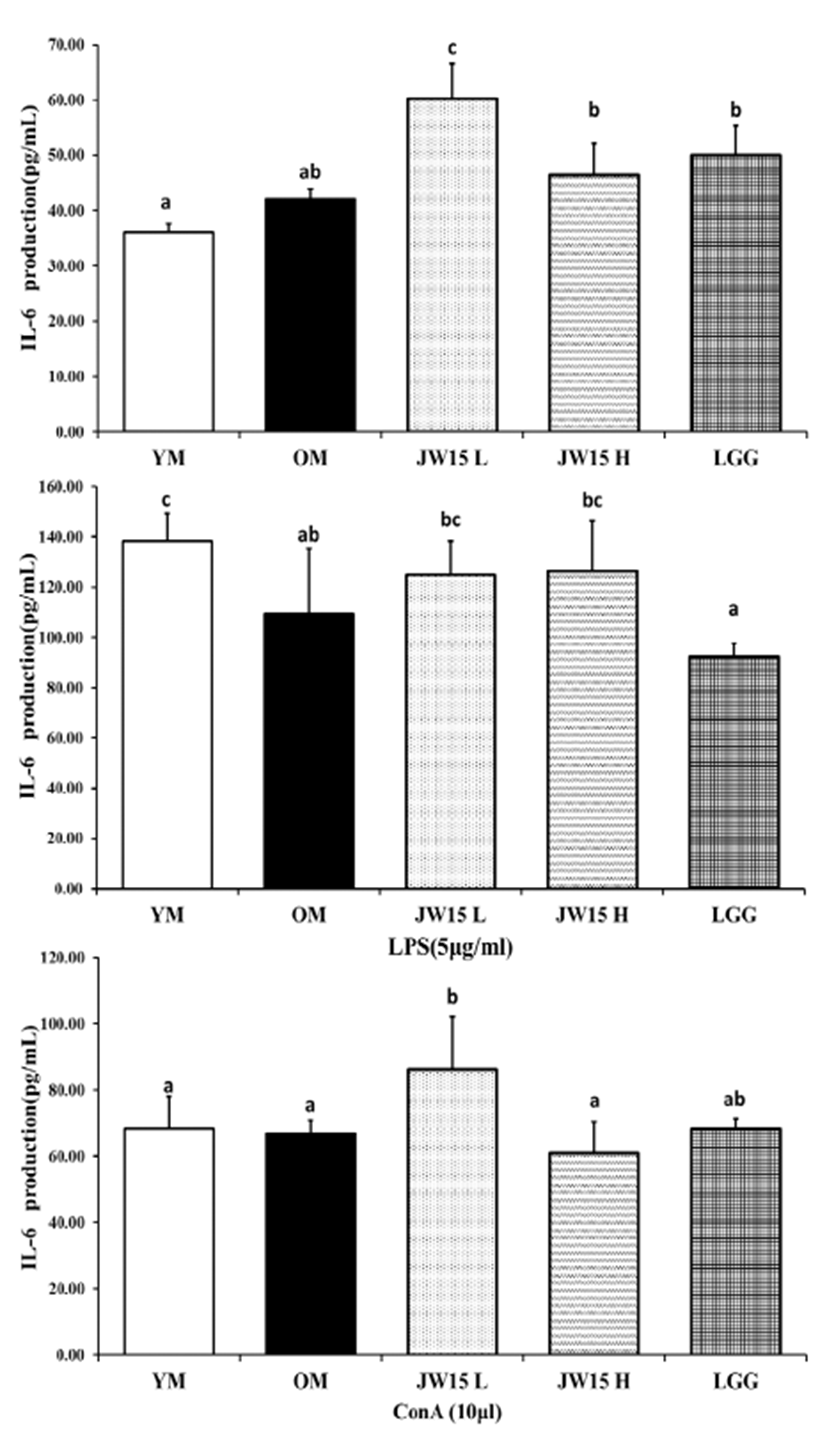
LPS와 ConA를 처리하여 마우스 비장세포에서의 TNF-α 와 IL-6의 생성량을 측정하였다. 어떤 mitogen도 처리하지 않았을 때, JW15-L군과 JW15-H군이 OM군보다 약 2배 정도 높은 TNF-α를 유의적으로 생성하였다. LPS를 반응 시킨 경우, OM군 (46.71 ± 16.80 pg/mL)에 비해 JW15- L (110.40 ± 23.38 pg/mL), JW15-H (89.10 ± 34.27 pg/mL) 그리고 LGG (106.95 ± 9.85 pg/mL)군 모두에서 TNF-α 생성량을 유의적으로 증가시켰다(Fig. 2). IL-6 의 경우, mitogen을 첨가하지 않은 실험에서 JW15-L군이 60.21 ± 6.33 pg/mL의 IL-6를 생성하여 42.02 ± 1.88 pg/mL를 생성한 OM 군보다 유의적으로 증가된 결과를 나 타내었다. 또한 ConA를 처리하였을 때에도 JW15-L군 (86.17 ± 15.95 pg/mL)이 OM군(66.88 ± 3.95pg/mL) 보다 유의적으로 높은 IL-6를 생성하였다(Fig. 3).
Fig. 2.
Tumor necrosis factor (TNF)-α production in splenocyte of C57BL/6J mice aged 28 months. Data represent the mean ± SD of three mice in each group. Different superscript letters (a, b and c) indicate the statistical differences determined by ANOVA (P<0.05). YM, young mice group (no probiotic-feeding); OM, old mice group (no probiotic-feeding); JW15-L, Weissella cibaria JW15-Low group (1.0×109 CFU/mouse); JW15-H, Weissella cibaria JW15-High group (1.0×109 CFU/mouse); LGG, Lactobacillus rhamnosus GG group (1.0×109 CFU/mouse).
Download Original Figure
Fig. 3.
Interleukin (IL)-6 production in splenocyte of C57BL/6J mice aged 28 months. Data represent the mean ± SD of three mice in each group. Different superscript letters (a, b and c) indicate the statistical differences determined by ANOVA (P<0.05). YM, young mice group (no probiotic-feeding); OM, old mice group (no probiotic-feeding); JW15-L, Weissella cibaria JW15- Low group (1.0×108 CFU/mouse); JW15-H, Weissella cibaria JW15-High group (1.0×109 CFU/mouse); LGG, Lactobacillus rhamnosus GG group (1.0×109 CFU/ mouse).
Download Original Figure
혈청에서의 cytokine 생성능
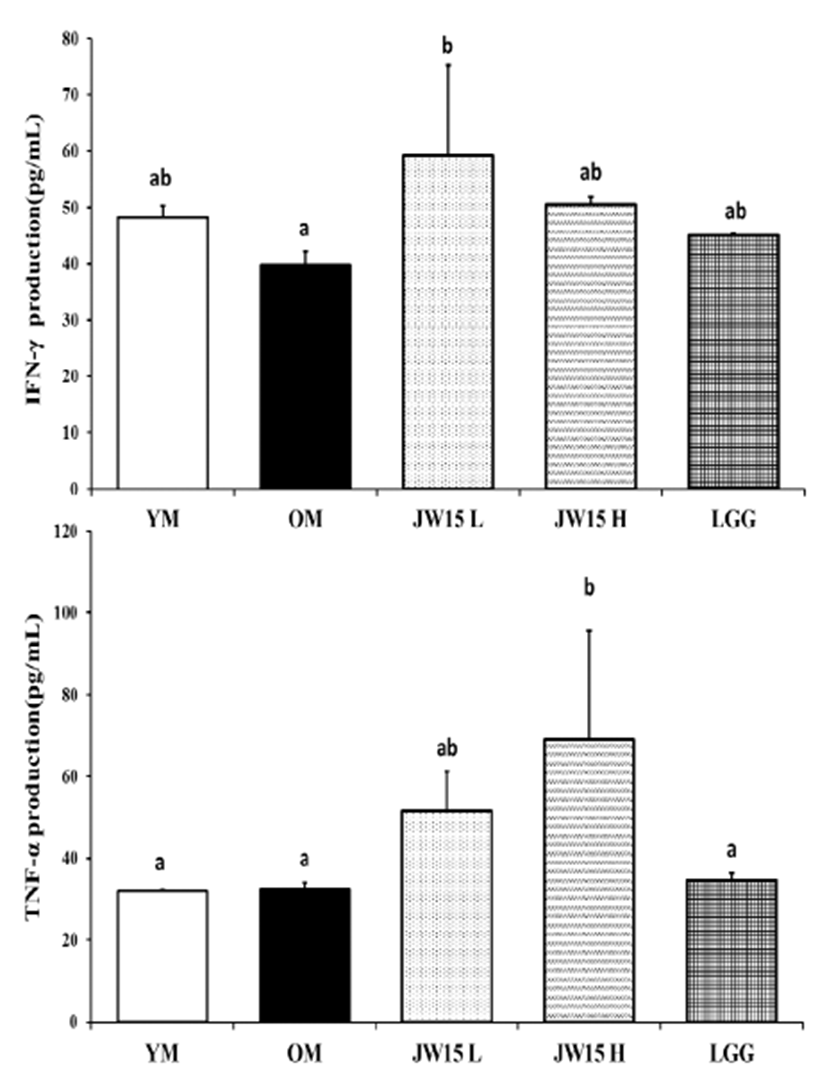
유산균 투여 4주 후 채혈한 혈청에서 IFN-γ와 TNF-α 의 생성 정도를 Fig. 4에 나타내었다. 그 결과 IFN-γ의 생 성 정도는 OM군 (39.71 ± 2.51 pg/mL)에 비해 JW15-L 군 (59.13 ± 16.13 pg/mL)이 약 30% 정도 유의적인 증 가 결과를 나타내었다. 또한 JW15-H군 (69.01 ± 26.51 pg/mL)이 OM군 (32.22 ± 1.92 pg/mL)보다 유의적으로 TNF-α생산량을 증가시켰다.
Fig. 4.
Interferon (IFN)-γ and Tumor necrosis factor (TNF)-α production in serum of C57BL/6J mice aged 28 months. Data represent the mean ± SD of three mice in each group. Different superscript letters (a and b) indicate the statistical differences determined by ANOVA (P<0.05). YM, young mice group (no probiotic-feeding); OM, old mice group (no probiotic-feeding); JW15-L, Weissella cibaria JW15-Low group (1.0×108 CFU/ mouse); JW15-H, Weissella cibaria JW15-High group (1.0×109 CFU/mouse); LGG, Lactobacillus rhamnosus GG group (1.0×109 CFU/mouse).
Download Original Figure
Discussion
김치에서 분리된 Weissella cibaria JW15 (JW15)는 내산성, 내담즙성, 내열성, 장정착능, 병원성 세균 억제능 등의 생균 제로서의 특성을 갖고 있으면서, RAW 264.7 macrophages 에서의 NO 생성능, IL-1β and TNF-α와 같은 cytokine 생성능이 상업용 균주인 Lactobacillus rhamnosus GG (LGG) 균주보다 우수한 유산균주임이 보고되어 있다[17]. Gill 등 과 Hentges의 보고에 의하면 유산균이 노화동물의 감염을 예방하고, 면역을 조절하여 유익한 효과를 나타내는 것으로 알려지고 있지만[13, 14], 28개월령의 초노화동물의 경우는 사육과정이 까다롭고, 유지관리에 비용이 많이 소요되어, 쉽 게 사용하기 어려운 동물로 알려져 있어 아직까지 많은 연구 는 이루어지지 않은 상태이다. 따라서 본 연구에서는 자연적 인 노화로 면역력이 저하된 28개월령의 C57BL/6J 노화 마 우스를 대상으로, Weissella cibaria JW15 균주를 4주간 경구 투여하고, 혈액학적 분석, 비장세포 증식능, 비장세포 및 혈 청에서의 cytokine 생성능(IFN-γ, IL-6, TNF-α)등의 다양한 면역지표들을 측정함으로써 JW15균주의 면역증진 효과를 평가함을 실험의 목적으로 진행하였다.
비장은 방어 면역 반응을 관리하는 대표적인 면역장기로서, B 세포 및 T 세포의 성숙과 항원 자극에 의해 림프구 분화가 일어나는 주요 림프 기관이므로 비장세포의 증식은 면역시 스템에서 상당히 중요한 의미를 가진다. 특히 비장세포의 크 기나 숫자가 직접적인 지표로 사용될 수 있어 많은 연구에서 대표적인 면역지표로 이용되고 있다[22]. Kaburagi 등의 연 구보고에 의하면 20개월령의 C57BL/6n 노화 mouse를 대 상으로 Lactobacillus johnsonii La1유산균주를 경구 투여하였 을 때 비장세포의 면역증식능을 상승시키는 것을 확인하였다 [12]. 본 연구에서도 JW15 균주와 LGG 균주 모두 OM 군보 다 비장세포의 증식능을 활성화시키는 결과를 얻을 수 있었 다. 특히 mitogen을 첨가한 조건에서 JW15-L군이 더 높은 면역증식능을 보였다. 따라서 JW15균주의 섭취는 노화동물 에서 비장세포의 증식을 활성화 시키는 것으로 판단되었다.
비장조직에는 B 세포, T 세포 및 대식세포와 같은 여러 면 역세포들이 밀집 분포되어 있으며, 세포증식이 활성화가 되 면 여러 면역반응을 조절하는 cytokine을 분비하기 때문 에 비장세포의 cytokine 생성에 대한 많은 면역활성 실험 들이 보고되고 있다[3]. 비장세포에서 분리되는 cytokine 중 IFN-γ과 TNF-α는 T 세포에서 생성되는 cytokine 이며, IL-6는 B 세포의 활성을 자극하는 염증성 cytokine 이다. Sharma 등의 연구에서 Lactobacillus rhamnosus의 투여 가 16개월령의 마우스 비장세포에서 IFN-γ 생산량을 증 가시켰음을 보고하고 있다[23]. Kaushal 등의 연구에서도 Lactobacillus acidophilus와 Bifidobacterium bifidum을 첨가해서 만든 probiotics 요구르트의 경구투여가 노화동물의 마우스 비장세포에서 IL-2 생성을 증가시켜 면역기능 향상에 기여 한다고 보고하였다[1]. 본 실험에서도 JW15의 투여가 노화 로 인해 감소한 Th1 cytokine인 TNF-α와 B 세포 활성을 유도하는 Th2 cytokine인 IL-6의 생산량을 유의적으로 증 가시켰다. 이와 같은 결과는 JW15균주는 T 세포와 B cell를 모두 활성화시키며, Th 1 세포성 면역반응을 상승시킨다고 추측할 수 있다. 따라서 JW15는 노화동물 마우스에서 T 세 포 및 B 세포에 관여하는 염증성 cytokine의 분비량을 증가 시켜 면역활성을 유도하는 것으로 판단된다.
IFN-γ는 비특이적 면역 반응에서 nature killer cell (NK cell)에 의해 생성되며 바이러스와 같은 병원균을 직접 억제 할 뿐만 아니라 면역자극과 면역조절능력을 갖고 있다고 알 려져 있다[24]. 선천면역체계에 있어서 T 세포의 경우 특 히 노화의 해로운 영향을 받기 쉬우며 IL-2와 IFN-γ는 T cell 기능을 확인할 수 있는 대표적인 지표로 알려져 있 다[25]. 따라서 노화가 진행됨에 따라 IL-2와 IFN-γ를 생산하는 능력을 상실하게 되고 면역력이 저하된다. Fu 등 의 연구결과에 따르면 Bifidobacterium bifidum이 노화동물의 혈청 내 IFN-γ 생성량을 증가시켜 면역력을 회복시킨 것 으로 보고되고 있다[26]. 본 실험에서도 JW15균주를 투여 한 노화 마우스에서 혈청 내 cytokine (IFN-γ, TNF-α) 이 OM군에 비해 유의적으로 증가되었음을 확인할 수 있었 다(Fig. 4). 이러한 결과는 JW15 유산균주가 면역노화를 유 의하게 지연시키고 면역계의 기능을 향상시킬 수 있음을 시 사한다고 생각된다.
본 연구에서 저농도(1.0 × 108 CFU/mouse)와 고농도 (1.0 × 109 CFU/mouse)의 유산균 투여 모두 면역 활성 능을 가지는 것으로 확인 되었으나 유산균의 저농도 투여가 고농도 투여보다 spleen cell proliferation과 splenocyte cytokine을 유의적으로 증가시키는 것을 확인하였다. 유산 균 면역효과를 확인한 많은 연구들에서 사용한 유산균 투여 농도는 2.0 × 108 CFU/mouse로 본 연구의 유산균 저농도 와 유사하였고[12, 23, 26], 이와 같은 결과는 JW15균주의 1.0 × 108 CFU/mouse 농도가 노화마우스의 면역력을 증 진시키는 적정농도일 것으로 판단된다.
이상의 결과를 종합해 보면, JW15균주는 노화동물의 비장 에서 면역세포증식능을 증가시키며, 비장세포와 혈청에서의 cytokine의 분비를 증가시키는 능력을 가지고 있는 것으로 확인되며, 이와 같은 결과를 바탕으로 JW15균주가 28개월 령 노화 마우스의 면역능력을 증진시켜준 것으로 판단된다. 따라서 Weissella cibaria JW15균주는 향후 추가적인 사람 및 동물에서의 임상적용 시험을 마친다면, 면역기능이 저하된 노약자나 점점 문제화되는 노령 반려동물의 건강기능식품 생 균제로서 사용이 가능할 것으로 판단된다. 또한 현재 면역증 진 상업용 균주로 잘 알려진 LGG균주를 대체 할 수 있는 균 주로 사용 가능할 것으로 기대된다.
Acknowledgements
본 논문은 농촌진흥청 연구사업(세부과제번호:PJ0108- 3502)의 지원에 의해 수행되었으며, 이에 감사드립니다.
References
Kaushal D., Kansal V.K. Probiotic Dahi containing Lactobacillus acidophilus and Bifidobacterium bifidum alleviates age-inflicted oxidative stress and improves expression of biomarkers of ageing in mice. Mol. Biol. Rep. 2012; 39:1791-1799.

Sharma R., Kapila R., Kapasiya M., Saliganti V., Dass G., Kapila S. Dietary supplementation of milk fermented with probiotic Lactobacillus fermentum enhances systemic immune response and antioxidant capacity in aging mice. Nutr. Res. 2014; 34:968-981.

Pae M., Meydani S.N., Wu D. The role of nutrition in enhancing immunity in aging. Aging Dis. 2012; 3:91-129.

Moro-Garcia MA, Alonso-Arias R, Baltadjieva M, Fernandez Benitez C, Fernandez Barrial MA, Diaz Ruisanchez E, Alonso Santos R, Alvarez Sanchez M, Saavedra Mijan J, Lopez-Larrea C. Oral supplementation with Lactobacillus delbrueckii subsp. bulgaricus 8481 enhances systemic immunity in elderly subjects. Age (Dor-dr). 2013; 35:1311-1326.

Le Couteur D.G., Tay S.S., Solon-Biet S., Bertolino P. Mc- Mahon AC, Cogger VC, Colakoglu F, Warren A, Holmes AJ, Pichaud N, Horan M, Correa C, Melvin RG, Turner N, Ballard JW, Ruohonen K, Raubenheimer D, Simpson SJ. The Influence of Macronutrients on Splanchnic and Hepatic Lymphocytes in Aging Mice. J. Gerontol. A Biol. Sci. Med. Sci. 2015; 70:1499-1507.

Dinarello C.A. Biologic basis for interleukin-1 in disease. Blood. 1996; 87:2095-2147.

Samuel C.E. Antiviral actions of interferons. Clin Microbiol Rev 2001; 14: 778-809, table of contents. 8. Fuller R. Probiotics in man and animals. J. Appl. Bacteriol. 1989; 66:365-378.

Fuller R. Probiotics in man and animals. J. Appl. Bacteriol. 1989; 66:365-378.

Shida K., Nanno M. Probiotics and immunology: separating the wheat from the chaff. Trends Immunol. 2008; 29:565-573.

Strowski M.Z., Wiedenmann B. Probiotic carbohydrates reduce intestinal permeability and inflammation in metabolic diseases. Gut. 2009; 58:1044-1045.

Lee J., Yang W., Hostetler A., Schultz N., Suckow M.A., Stewart K.L., Kim D.D., Kim H.S. Characterization of the anti-inflammatory Lactobacillus reuteri BM36301 and its probiotic benefits on aged mice. BMC Microbiol. 2016; 16:69.

Kaburagi T., Yamano T., Fukushima Y., Yoshino H., Mito N., Sato K. Effect of Lactobacillus johnsonii La1 on immune function and serum albumin in aged and malnourished aged mice. Nutrition. 2007; 23:342-350.

Gill H.S., Rutherfurd K.J., Cross M.L., Gopal P.K. Enhancement of immunity in the elderly by dietary supplementation with the probiotic Bifidobacterium lactis HN019. Am. J. Clin. Nutr. 2001; 74:833-839.

Hentges D.J. In: Fuller R, editor. Gut flora and disease resistance. Probiotics: the scientific basis. 1992; London: Chapman and Hall. p. 1987.

De Bruyne K., Camu N., De Vuyst L., Vandamme P. Weissella fabaria sp. nov., from a Ghanaian cocoa fermentation. Int. J. Syst. Evol. Microbiol. 2010; 60:1999-2005.

Padonou S.W., Schillinger U., Nielsen D.S., Franz C.M., Hansen M., Hounhouigan J.D., Nago M.C., Jakobsen M. Weissella beninensis sp. nov., a motile lactic acid bacterium from submerged cassava fermentations, and emended description of the genus Weissella. Int. J. Syst. Evol. Microbiol. 2010; 60:2193-2198.

Ahn S.B., Park H.E., Lee S.M., Kim S.Y., Shon M.Y., Lee W.K. Characteristics and immuno-modulatory effects of Weissella cibaria JW15 isolated from Kimchi, Korea traditional fermented food, for probiotic use. J. Biomed. Res. 2013; 14:206-211.

Mitsuoka T. The world of anaerobic bacteria: A color atlas of anaerobic bacteria. 1980; Tokyo: Sobun press. p. 13.

Park H.E., Jang Y.J., Lee W.K. Immunomodulatory effects mixed with Weissella cibaria JW15 and Black soybean (Glycine max (L.) Merr.) Extract. J Biomed Transl Res. 2016; 17:20-25.

Choi H.J., Shin M.S., Lee S.M., Lee W.K. Immunomodulatory properties of Enterococcus faecium JWS 833 isolated from duck intestinal tract and suppression of Listeria monocytogenes infection. Microbiol. Immunol. 2012; 56:613-620.

Jang S.E., Joh E.H., Ahn Y.T., Huh C.S., Han M.J., Kim D.H. Lactobacillus casei HY7213 ameliorates cyclophosphamide- induced immunosuppression in mice by activatingNK, cytotoxic T cells and macrophages. Immunopharmacol. Immunotoxicol. 2013; 35:396-402.

Cyster J.G. Chemokines and cell migration in secondary lymphoid organs. Science. 1999; 286:2098-2102.

Sharma R., Kapila R., Dass G., Kapila S. Improvement in Th1/Th2 immune homeostasis, antioxidative status and resistance to pathogenic E. coli on consumption of probiotic Lactobacillus rhamnosus fermented milk in aging mice. Age (Dordr.). 2014; 36:9686.

Beli E., Duriancik D.M., Clinthorne J.F., Lee T., Kim S., Gardner E.M. Natural killer cell development and maturation in aged mice. Mech. Ageing Dev. 2014; 135:33-40.

Maue A.C., Yager E.J., Swain S.L., Woodland D.L., Blackman M.A., Haynes L. T-cell immunosenescence: lessons learned from mouse models of aging. Trends Immunol. 2009; 30:301-305.

Fu Y.R., Yi Z.J., Pei J.L., Guan S. Effects of Bifidobacterium bifidum on adaptive immune senescence in aging mice. Microbiol. Immunol. 2010; 54:578-583.