Introduction
오늘날 현대인들은 경제 성장과 더불어 국민소득이 크게 향 상되면서 과거에 채식을 주로 하던 식습관에 비해 맛있고 풍 부한 음식을 섭취하고 있지만 반면 패스트푸드와 탄산음료, 밀가루 음식 등 고칼로리 식품, 고지방섭취, 식습관의 서구 화, 생활패턴, 운동 부족 등 다양한 주변 환경의 변화로 인하 여 성인병, 즉 생활습관 병이 많이 발생하고 있다[1,2]. 우리 나라는 1970년에 총 열량 외 7.3%에 불과하였던 지방 섭취 량이 1985년에는 13.7%, 1995년에는 18.8%로 급증하였고, 2005년에는 25%로 알려졌다[1]. 이와 같이 지방의 섭취 증 가로 인한 질병의 양상은 비만, 뇌졸중, 동맥경화, 고혈압, 당 뇨병 등의 각종 만성질환의 증가로 나타났고 특히, 심장 순환 계 질환의 증가는 우리나라의 주요 사인의 하나가 되었다[2].
중요한 심장순환계 질환 중 하나인 동맥 경화증의 원인으로 는 고지혈증, 고혈압, 비만, 흡연, 당뇨병 등이 있는데 그 중 고지혈증은 동맥 경화증의 가장 중요한 원인으로 혈중 콜레 스테롤이나 중성 지방이 많은 고콜레스테롤혈증, 고중성지방 혈증을 지칭하며 지질의 농도가 비정상적으로 상승된 상태를 말한다. 따라서 동맥 경화 예방을 위해서는 고지혈증의 예방 과 적절한 치료가 필요하다[3].
이러한 이유로 혈관 질환을 일으키는 고지혈증이 많은 주목 을 받게 되었고 최근 몇 년간 이에 관한 연구도 활발하게 진행 되고 있으며, 심맥관계 질환을 예방 치료하기 위해서 식이요 법과 약물요법을 통한 고지혈증의 예방 및 치료방법이 다양 하게 연구되고 있다[4]. 양방제제는 스타틴, 프로브콜, 니코틴 산 유도체, 피브린산 유도체 등 여러 가지 효과 좋은 치료제도 많이 개발되었으나 장기간 투여할 경우 약에 따라 피로, 수면 장애, 오심, 피부 발진, 근육통, 위장 장애, 두통, 소양증, 변비, 설사 등의 부작용도 보고되었다[4]. 지질 저하 효과가 좋은 생 약들을 찾아 연구하여 보다 안전하고 다양한 기전으로 치료 하는 방법을 찾아보는 것이 필요하다. 실제로 여러 질환에서 다양한 생약연구가 이루어졌고 천연물 신약이나 건강 기능식 품의 형태로 치료에 많은 도움을 주고 있다[5].
감귤(Citrus unshiu)의 껍질인 진피(陳皮)는 운향과에 속하 는 상록 소교목인 귤나무 및 같은 속 근연 식물의 성숙한 과실 의 열매 껍질을 건조한 것으로, 11월에 채취하여 햇볕에 건조 하여 사용한다. 진피는 예로부터 한약재로 사용되고 있는데 flavonoid류, carotenoid류, pectin 및 terpene류가 풍부하 게 함유되어 있으며, 나쁜 콜레스테롤로 알려진 LDL콜레스 테롤을 낮추고 좋은 콜레스테롤로 알려진 HDL콜레스테롤을 높이는 등 다양한 생리적 작용이 보고되었다[6, 7].
과라나(Paullinia cupana)는 브라질 아마존 원시림 정글에 서만 자라는 식물로서 약 10m까지 자라며, 껍질은 부드럽고, 털에 덮여 있으며 열매에는 1~2개의 씨앗이 있고, 아마존 원 주민들은 이를 기호 식품으로 씹어 먹거나 물에 끓여서 먹는 다[8]. 과라나 씨앗에는 사포닌, 전분, 검, 정유, 카페인, 탄 닌, 아데닌, 덱스-카테킨, 데오브로민, 데오필린 등을 함유하 고 있으며 이 중 카페인의 함량은 매우 높은 것으로 보고되고 있다[8]. 과라나 씨앗의 알칼로이드인 카페인, 데오브로민, 데 오필린은 과라나의 약리활성을 유발하는 것으로 알려져 있다 [9]. 과라나는 두뇌 활동 도움, 스트레스 해소 도움, 이뇨, 설 사, 동맥경화, 강장 강정, 신경안정, 혈관계 질환 치료 및 예 방에 도움, 건망증 예방에 도움, 소화에 도움 등의 효능을 얻 을 수 있다[10].
본 연구는 천연물 소재로서 지질 조절 기능성 효과가 우수 한 진피와 강장 효과로 주로 이용하는 과라나를 혼합하여 지 방생성 억제 효과가 뛰어난 최적의 조성물을 개발하고자 계 획되었다.
Materials and Methods
본 연구에 사용된 진피는 제주도 서귀포시 성산읍 신천리에 서 유기농으로 재배된 감귤의 껍질을 말려 제조한 것을 (주) 선일생약(서울, 한국)에서 구입하여 사용하였으며, 과라나는 원산지 브라질, 아마존 정글의 특수한 기후와 토양에서 재배 되어 준비된 재료를 Advanced Nutraceuticals, LLC (Colorado, USA)에서 가공한 것을 구입하여 사용하였다. 진피 및 과라나 시료는 분쇄한 후 표준체 No. 60을 통과시킨 후 각각 600 g, 300 g의 진피 및 과라나 분말과 4.2, 2.1L의 증류수를 환류추출기 (MISUNG S&I, Daejeon, Korea)를 사용하여 100°C, 3시간 추출하여 여과 후 회전식 evaporator (HAHN SHIN, Ansan, Korea)로 감압 농축 후 동결 건조하여 추출 분 말을 각각 150 g, 45 g을 얻었다.
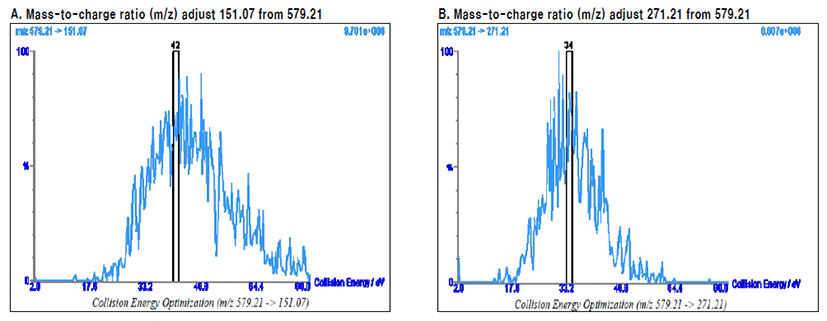
서본 연구에서 진피의 함량 분석을 위하여 Liquid chromatography- tandem mass spectrometry (LC-MS/MS)를 이 용하였다. 진피의 표준물은 naringin (Sigma Chemical Co, MO, USA)을 지표물질로 이용 하였으며, 메탄올 같은 추출 용매는 J.T. Baker(NJ, USA)에서 HPLC급을 사용하였다. UPLC 칼럼은 ACQUITY UPLC BEH C18 (2.1×100mm, 1.7μM)를 데이터 처리장치는 Mass Lynx software version 4.1 (Waters Co. Ltd, Milford, USA)를 사용하였으며, 피 크 검출은 triple-quadrupole mass spectrometry를 이용하 여 MRM(multiple reaction monitoring spectrometry) 방 법으로 검출하였고, ionization은 turbo ion spray를 이용 한 electrospray ionization ESI mode를 사용하였다. Cone voltage는 각각 42 V이고, ion source temperature는 380°C 로 설정하였다. 또한 MRM mode를 이용한 검출은 200 dwell time(ms.)으로 분석하였다. 또한 MRM mode를 이 용한 검출은 200 dwell time(ms.)으로 분석하였으며, 각각 Mass-to-charge ratio (m/z) 는 579.2에서 151.07, 579.2 에 서 271.2로 조정되었으며, collision energy는 각각 42 (eV), 34 (eV)로 설정하였다(Fig. 1).
Gas chromatography–mass spectrometry (GC-MS, GCMS- QP2010 Shimadzu, Kyoto, Japan) 분석은 Gas chromatography와 70 eV로 이온화 전압을 이용한 질량 분석기 를 사용하여 수행하였으며, Gas chromatography의 column (30m × 0.25mm × 0.25μm, film thickness. J&W Scientific, CA, USA) 사용과 temperature-programming mode에 서 실시하였다. 초기 column 온도 설정은 70°C/3분, 10°C/ min 상승시켜 300°C에 이르게 한 후 5분간 유지시켰다. Injection port 온도는 280°C이고 GC/MS interface 290°C로 유지시켰고 Carrier gas는 헬륨 (He)을 injection volume으 로 1 μL 주입하였다. GC-MS의 소프트웨어 (version 1.10 beta Shimadzu, Kyoto, Japan)의 NIST spectral library를 이용하여 분해 산물의 fragmentation pattern과 retention time을 확인하였다.
3T3-L1 adipocytes (ATCC, CL-173, VA, USA)는 10% BCS (GIBCO, MD, USA)를 넣은 DMEM 배지에서 5% CO2, 37°C 조건에서 배양 하였으며 배양액은 48시간 마 다 교환하였다. 세포가 70% confluent되었을 때 세포를 탈 락시켜 24-well plate에 well당 2×104 cells/mL의 3T3-L1 adipocytes를 2mL씩 넣고 48시간 배양한 후, 10% FBS (GIBCO, MD, USA)와 MDI (GIBCO, MD, USA) solution, 0.5 mM IBMX, 0.1 μM dexamethasone, 10 μg/mL insulin을 포함한 DMEM 배지를 사용하여 2일 동안 분화 유도 하였다. 시료의 처리는 지방 세포 분화에 미치는 영향 을 관찰하기 위해 분화 유도 배지 첨가 시점부터 시료 총 볼 륨 20μL/mL를 비율에 맞게 첨가하였다. 분화 유도 4일째 되 는 날에 10% FBS와 10 μg/mL insulin을 포함한 DMEM 배 지를 48시간 동안 처리하였다. 그 후 48시간에 한 번씩 10% FBS를 포함한 DMEM 배지로 교환하였으며 분화가 완성된 시점인 8일째에 지방세포 분화 정도를 관찰하였다.
앞의 과정을 거친 다음 배지를 제거해서 pH 7.4 PBS로 세 척하고 4% formaldehyde 용액으로 2시간 동안 세포를 고정 한 이후, 60% isopropanol로 세척하였다. 완전히 건조시킨 후 Oil red O (Sigma, MO, USA)로 20분간 염색액을 처리 하고, 염색액을 제거한 후 D.W.로 3회 세척하였다. 염색된 세 포는 Microscope (Olympus, Tokyo, Japan)을 이용하여 관 찰 하였다. 또한 정량적 분석을 위하여 100% isopropanol을 이용하여 지방을 추출한 후 96 well plate에 200 μL씩 옮겨 서 ELISA reader (Molecular Devices, CA, USA)로 540 nm에서 흡광도를 측정하였다. Oil red O 시약으로 지방 함량 은 대조군의 평균 흡광도에 상대적인 백분율로 나타내었다.
Results
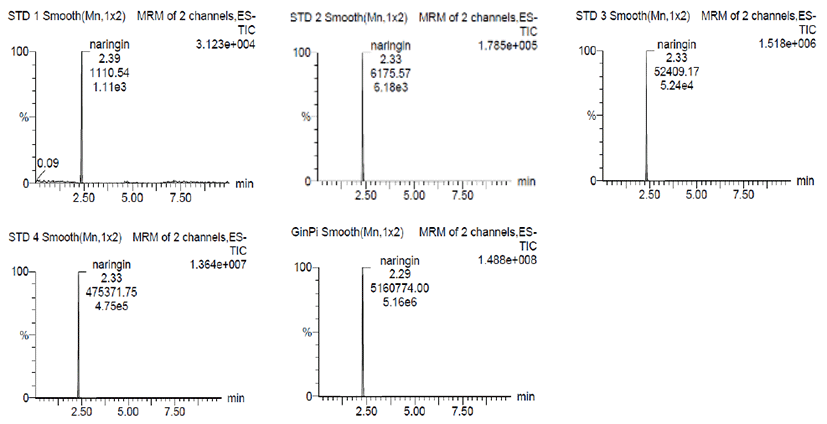
물질의 정량을 위해 표준물질 naringin의 표준 곡선을 작성 하였으며, 표준곡선의 상관계수 R2=0.999 이상으로 매우 양 호한 직선성을 나타냈다. LC-MS/MS 크로마토그램은 naringin의 표준용액 4가지 농도를 이용하여 진피 열수 추출물의 naringin 함량 0.275 mg/g을 확인하였다(Fig. 2).
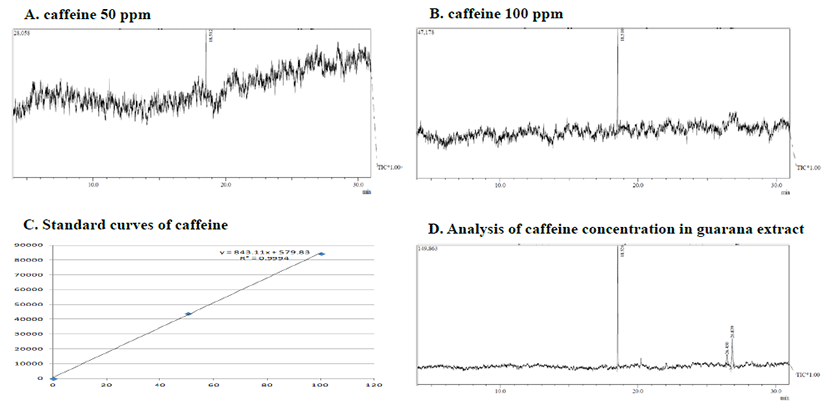
Caffeine 표준물질 caffeine의 chromatogram의 50 ppm 의 R. time 18.512분, I. Time 18.465분, F. Time 18.595 분이고, 100 ppm은 R. time 18.510분, I. Time 18.455 분, F. Time 18.570분이며, 과라나 열수 추출물의 R. Time 18.526분, I. Time 18.465분, F. Time 18.585분으로 확 인되었다(Fig. 3). Caffeine 표준물질 50 ppm에서 peak area는 43895, 100 ppm은 84311로 표준곡선의 상관계수 R2=0.999이상으로 매우 양호한 직선성을 나타내었고, 과라 나에 함유된 caffeine peak area는 281920으로 GC-MS 분 석을 통해 caffeine의 함량 334 mg/g을 확인하였다(Fig. 3).
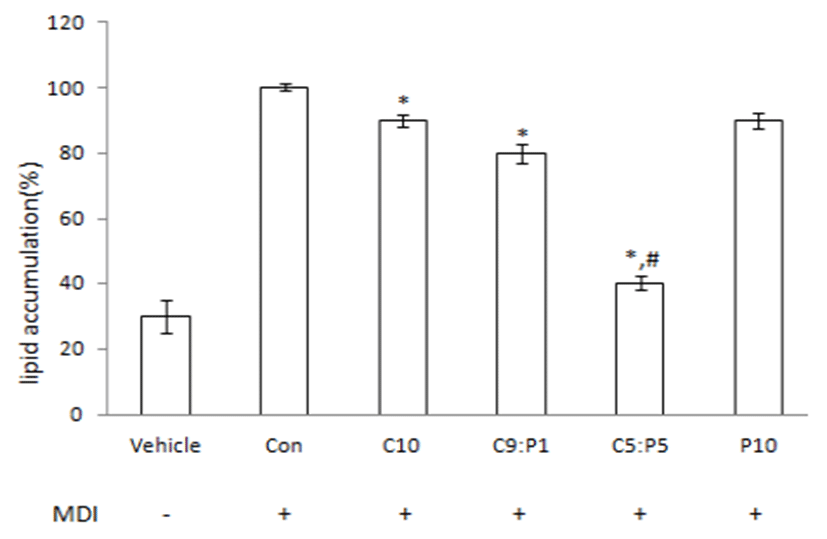
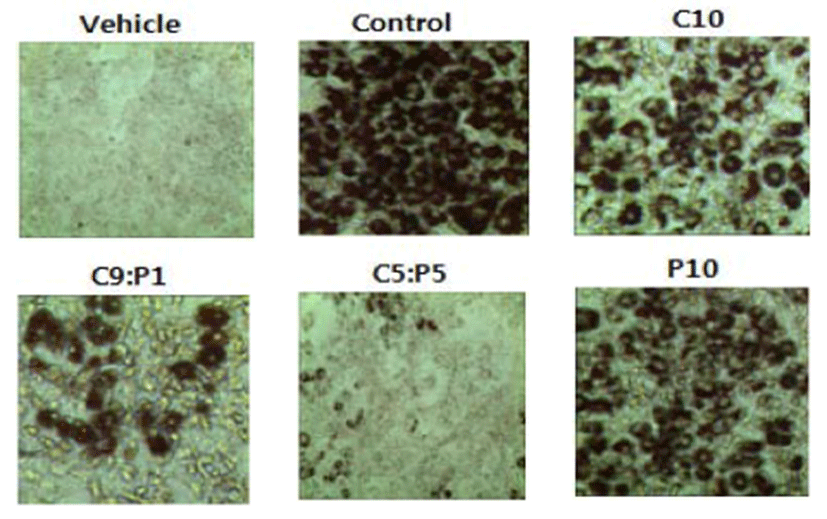
연구 결과 MDI 분화 유도제만 처리한 세포에서는 4일째부 터 지방구 형성이 관찰되었으며 Oil red O 염색에 의해 adipocyte에서 선명한 붉은색을 나타내어 세포의 분화가 정상적 으로 일어나 충분한 지방이 축적된 것을 확인할 수 있었다. 또 P10 군을 제외한 시험군에서 유의적으로 adipocyte에 비해 지방 축적이 감소된 것을 확인 하였고, C5:P5군에서 C5(10 μL/mL):P5(10 μL/mL) 농도에서 대조군인 preadipocyte와 유사하게 보일 정도로 지방 축적이 현저히 감소되었다. 이를 통해 복합물 C5:P5 군의 유의적인 세포 지방 축적 억제를 확 인하였다 (Fig. 4). 대조군인 adipocyte의 평균 흡광도 값을 기준으로 시료의 흡광도 값을 백분율로 나타내어 지방 축적율 을 계산해 본 결과, Fig. 5와 같이 지방 축적률을 확인할 수 있 었다. 진피 추출물만 투여한 C10(20 μL/mL)군은 대조군에 비해 유의성 있게 세포지방축적이 억제되었다. 그러나 억제 되는 정도는 10%에 불과하였다. 반면에 과라나 추출물만 투 여한 P10(20 μL/mL)군은 유의성 있는 영향을 주지 않았다. 비록 과라나 추출물은 유의성 있게 세포지방축적을 억제하지 는 못했지만, 진피추출물과 혼합하여 투여하였을때 진피 단 독 투여한 군보다 더 큰 억제반응을 보였다. 진피에 대한 과라 나의 혼합율이 증가할수록 세포지방축적이 억제 되었다. 진 피추출물에 과라나 혼합율이 0% (C10군), 10%(C9:P1군), 50% (C5:P5군)인 추출물을 투여하였을때 세포지방 축적이 감소되는 정도는 각각 12, 15, 58%였다.
Discussion
우리나라는 1970년대 이후 지속적인 경제성장과 국민 소득 의 증가로 식물성 식품의 섭취량은 감소한 반면 동물성 식품 의 섭취량은 크게 증가하였다. 그동안 우리나라의 식사 패턴 은 당질 섭취량이 많고 지방 섭취량이 적어 고지혈증 중에서 도 고중성지방혈증이 많은 것으로 나타났으나, 최근에는 육 류와 가공식품의 섭취증가로 고콜레스테롤증인 사람의 비율 이 증가하는 추세이다[1-3].
본 연구에 사용된 감귤껍질은 분류학상으로 Citrus 속에 해 당되는 귤류의 과피 또는 진피라고 부르며, flavonoid를 많이 함유하고 있다[11]. 그 중에서도 naringin은 귤과 포도의 껍 질에 분포되어 있는 성분으로서 몇몇 연구를 통해 항암효과와 간 보호 효과가 있다고 보고되었다[12]. 최근에는 화학적으로 naringin과 유사한 물질인 hesperidin이 혈중 콜레스테롤 수 치를 저하 시킨다고 보고되었다[11]. 과라나는 다량의 식물성 카페인을 함유하고 있으며 강장 효과와 피로회복에 대한 효과 가 주로 보고되고 있다[3, 8].
본 연구에서 진피의 정량을 위해 표준물질 naringin의 표 준 곡선을 작성하였으며, LC-MS/MS 크로마토그램은 naringin의 표준용액 4가지 농도를 이용하여 감귤껍질 열수 추 출물의 naringing 함량이 0.275 mg/g인 것을 확인하였다. 또 한, 과라나 열수 추출물의 정량을 위한 표준물질은 caffeine 은 GC-MS 분석을 통해 caffeine의 함량이 334 mg/g인 것 을 확인하였다.
비만은 preadipocyte가 adipocyte로 분화되는 지방세포의 이상 발달이라고도 하는데, 지방세포에 의한 지방의 축적은 지방세포 수의 증가나 지방세포 크기가 증가됨에 따라 증상 이 심해지는 것으로 알려져 있다[12, 13]. 인체에 지방을 축적 하는 세포는 hepatocyte (단기축적)와 adipocyte (장기축적) 로 알려져 있으나 비만과 관련이 있는 것은 주로 adipocyte로 알려져 있다[12, 13]. Preadipocyte는 적절한 환경이 되면 분 화되어 세포내 지방을 축적하는데 이때 adipocyte의 크기와 수의 증가가 비만의 정도를 결정짓는 요인 중 하나로 인식되 고 있다. 따라서 preadipocyte의 분화를 억제하는 물질은 비 만을 예방하는데 효과적이라고 알려져 있다[12, 13]. 유기농 감귤껍질 및 과라나 추출물의 지방세포 분화 억제능을 확인 하기 위해 preadipocyte 상태인 3T3-L1 세포를 adipocyte로 분화 시키면서 시료 20 μL/mL를 시험군 그룹 비율대로 세포 에 처리한 후, 지방 생성 억제 효과가 중성지방의 축적 정도와 도 관련이 있는지 알아보기 위하여 중성 지방만을 붉은색으 로 염색하는 Oil red O 염색법을 통해 중성지방의 양을 측정 하였다[12]. 본 연구 결과 감귤껍질인 진피 단독 또는 과라나 단독 처리군에 비교하여 진피와 과라나 혼합 조성물을 적용 하였을 때 보다 우수한 지방생성 억제 효과가 있는 것을 확인 하였다. 최적의 진피와 과라나 혼합비는 50% : 50%로 동량 을 혼합하는 것이 다른 혼합비에 비교하여 우수한 지방생성 억제 효과를 보여, 본 연구의 결과 지방생성 억제 효과가 가장 우수한 감귤 껍질과 과라나 추출물의 혼합 조성물 개발을 위 한 최적의 혼합비와 그에 따른 혼합 조성물을 개발할 수 있을 것으로 기대되었다.
본 연구는 천연물 소재로서 혈중 지질조절 효과가 알려진 진 피와 남미 지역에서 주로 강장 및 피로회복 효과로 사용되고 있는 과라나를 소재로 한 혼합 조성물을 개발하고자 유기농 감귤껍질과 과라나 추출물의 표준물질 함량 분석과 혼합비에 따른 항비만 효과를 확인하고자 수행된 것으로 본 연구 결과 과라나 단독으로는 억제효과가 없지만 진피와 혼합하여 투여 할 경우 진피의 세포지방축적 억제효과를 증가시키는 것으로 생각된다. 향후 제품화 연구를 통하여 혈중 지질 개선 치료제 로 진피 및 과라나 복합제가 개발 될 수 있을 것으로 판단된다.