Introduction
세포내 감염되는 포자원충에는 콕시디움(coccidium), 톡소포자충(toxoplasma) 및 말라리아 원충(plasmodium)이 있으며, 이들 원충에 의한 질환 중 톡소포자충(Toxoplasma gondii)은 사람을 비롯한 각종 포유동물 및 조류 등에 널리 감염되어 있는 대표적인 인수공통 기생충의 하나이다[1]. 이중 톡소포자충은 전 세계적으로 분포하는 인체 및 동물의 톡소포자충 감염증(Toxoplasmosis)의 원인 원충이다[2].
톡소포자충의 수평전이는 환경으로부터 감염된 접합자(oocysts)를 섭취하거나 다른 동물들의 내장이나 고기에 포함되어 있는 조직포낭(bradyzoite)이나 영양형(tachyzoite)을 섭취하는 세가지 생활주기를 포함한다[3]. 미국에서 최근 급성 톡소포자충이 인간에게서 일어나는 것은 환경으로부터 오염된 접합자(oocyst)와 관련이 있지만 한국에서의 발병은 조리하지 않은 돼지고기를 먹는 것과 관련이 있다[2, 4].
또한 톡소포자충은 가축 및 야생동물 조직에 감염될 수 있어 날고기 또는 조리가 덜된 육류를 먹었을 경우 감염되며, 건강한 사람이 톡소포자충에 감염되었을 때는 대부분은 무증상으로 지나거나 경미한 증상을 일으키는 것이 보통이나 임산부가 감염되었을 경우 태반 감염에 의한 신생아의 기형 또는 유산이 일어날 수 있다[5].
이러한 임상적인 중요성이 있음에도 지금까지 항톡소플라즈마 용도로 사용되는 약물인 sulphonamide 또는 pyrimethamine 등은 수년간 지속적으로 투여함으로써 내성은 계속 증가하고 있고, 감염형 원충(bradyzoite) 단계의 톡소플라즈마에 대한 효과도 별로 없다[6]. 임상에서 주로 이용되는 톡소포자충의 치료법은 정상 숙주에서 중추신경계, 심장, 간에 퍼져 있을 때 pyrimethamine과sulphonamide를 사용하며, 선천적 톡소포자충일 경우 pyrimethamine과 sulphonamide, 안구 톡소포자충일 경우 pyrimethamine과sulphonamide 및 스테로이드, 후천적 면역결핍증과 장기이식, 급성질환일 경우 pyrimethamine과 sulphonamide를 사용하고 있다[6]. 그러나 톡소포자충의 주요 치료제인 pyrimethamine과 sulphonamide는 자주 간염, 신장 손상, 빈혈, 백혈구감소증 등의 부작용이 보고되고 있는 실정이다[6].
백선(Dictamnus dasycarpus Turcz.)은 운향과(Rutaceae)에 속하며 한국 및 시베리아 원산으로 우리나라에서 관상용으로 재배 또는 자생하는 다년생 초본으로 잎은 호생하며 기수우상복엽으로 소엽이 9~13매로 구성되고, 여름에 가지 끝에 길이 20 cm 정도의 총상화서를 내어 백색 또는 담자색의 꽃 을 피운다[7, 8]. 줄기는 약 1 m 내외로 전체에 강렬한 향기가 있으며 기부는 목질화 되어 있고 뿌리는 육질로서 황색이다. 뿌리 껍질을 건조한 것인 백선피는 바깥면은 황백색에서 엷은 갈색이고 매끄러우며 안쪽 면은 엷은 황색으로 질은 부드럽고 쉽게 부러진다[7, 8]. 백선피는 한국 및 중국을 포함한 아시아 지역에서 오래 전부터 민간에서 피부가려움증, 옴, 피부습진이나 두드러기, 황달, 기침을 동반한 감기, 해열, 해독, 류마티즘 등에 널리 이용되어왔다[7-9]. 또한 백선피 70% 에탄올 추출물의 비수용성 분획물이 뇌세포 보호효과를 가지고 있음이 보고되고 있다[7]. 그러나 백선피의 톡소포자충 감염에 대한 치료 효과에 대한 연구는 수행되지 않았다.
본 연구에서는 백선피 추출물의 항톡소포자충에 대한 효과를 알아보고자 cervical cancer cell line인 HeLa세포를 이용한 항톡소 효과를 알아보고자 수행되었다.
Materials and Methods
본 실험에 사용한 백선피(Dictamnus dasycarpus Turcz.)는 2013년 7월 전라북도 익산시 신용동 소재 대학한약국에서 구입하여 사용하였다. 백선피 분말 시료 100 g을 70% 에탄올 수용액 600 mL에 100°C에서 2시간 동안 가온 환류추출하여 여과한 후, 회전감압농축기(N-1000, EYELA, Tokyo, Japan)로 감압농축 하여 16.86 g을 얻었다. 추출물은 실험 직전까지 4°C에 보관하여 사용하였다.
본 실험에서 사용된 백선피 에탄올 추출물 중에 함유된 지표물질을 확인하기 위해 Liquid chromatography–mass spectrometry (LC/MS)를 이용하여 3회 반복으로 분석하였다. 지표물질은 식품의약품안전처의 한약재 함량 분석예시에 따라 백선피의 활성물질 중 하나로 알려진 fraxinellone으로 하였다. LC/MS에 사용된 백선피의 지표물질인 fraxinellone은 한국한방산업진흥원 천연물물질은행(경산, 한국)에서 구입하여 사용하였다. 백선피 에탄올 추출물 2 mg을 Acetonitrile 1mL에 녹인 후 0.45 μm membrane 필터를 사용하여 정제한 용액을 LC/MS 시료로 사용하였다. LC/MS 분석에는 Agilent 1200 HPLC system (Agilent Technolgies, Santa Clara, CA, USA)을 사용하였으며, column은 Kinetex 2.6u C8 100A (50 × 2.10 mm) 사용 되었다. 시료의 이온화는 ESI (electron spray ionization) 방법을 사용하였다. Mass spectrometer는 positive 모드에서 Gas flow=11 L/min; Capillary=4000V; nebulizing gas pressure(N2)=15 psi; drying temperature=30°C 조건에서 분석되었다.
본 실험에 사용된 톡소포자충(RH strain of Toxoplasma gondii, ATCC, No.50174)의 영양형(tachyzoite)의 배양은 Song 등(2004)의 방법에 따라서 ICR mouse 암컷 마우스(female mouse)의 복강내 배양 방법을 실시하였다[10]. 1 × 105개의 톡소포자충의 영양형을 4주령 ICR mouse 암컷 마우스 복강에 주입한 뒤, 4일 후 마우스를 경추탈골 하였다. 그리고 2% fetal bovine serum (FBS) (GIBCO, USA)를 함유한 Dulbecco's Modified Eagle's Media (DMEM) (GIBCO, USA) 5 mL을 복강에 주입하고 1분 30초 동안 가볍게 마사지 해주었다. 다시 복수액을 10 mL짜리 주사기로 전부 뽑아내고 500 RPM에서 5분간 원심분리 후, 침전물은 버리고 상등액은 새로운 50 mL tube에 옮겨서 500 RPM에서 5분간 원심분리 하였다. 이렇게 얻은 상등액은 새로운 50 mL tube에 옮겨서 2400 RPM에서 10분간 원심분리 하였다. 원심분리법으로 얻은 순수한 톡소포자충의 영양형으로 실험에 사용하였다.
HeLa 세포(Korean Cell Line Bank, Republic of Korea)는 96 well에 9 × 103/mL 되게 접종하고 10% FBS가 함유된 DMEM 배지를 사용하여 37°C의 5% CO2 배양기에서 배양하였다. 6시간 후, 2%의 FBS가 함유된 배지로 교환 및 톡소포자충 영양형을 HeLa 세포주의 5배 되게 처리하였다. 그 후 24시간 동안 배양한 뒤, 배지를 교환함과 동시에 천연물을 농도별로 처리하였다. 이때 대조군으로서 설파다이아진(Sulfadiazine sodium salt, Sigma-Aldrich, MO, USA)을 사용하였다. 24시간 뒤 세포증식분석으로 EZ-Cytox Kit (Daeil Lab.Co., Korea)을 실시하고, 15분 후, 흡광광도계로 450 nm에서 흡광도(absorbance)를 측정하여, 톡소포자충의 증식을 억제하는 농도 IC50 (50% 세포증식억제농도)를 산출하였고, 항톡소플라즈마 효과에 대한 약효판정은 Park 등(2003)의 방법에 따라서 선택성(selectivity)을 구하여 보다 높은 선택성을 가진 물질이 항톡소플라즈마 효과가 있는 것으로 판정하였다[11]. 선택성을 구하는 식은 다음과 같았다. : 선택성(selectivity)=HeLa 세포에 대한 각 시료의 IC50값/T.gondii에 대한 각 시료의 IC50값.
항톡소포자충 효과를 확인하기 위하여 4주령 ICR 암컷 마우스를 Samtaco (Osan, Republic of Korea)에서 구입하여 원광대학교 동물사육시설에서 7일간 순화 사육하여 질병이 없고 외관상 건강한 암컷 마우스를 선별하여 군 구성을 하였다. 군구성은 Table 1과 같이, Group I은 정상군으로서 톡소플라즈마 감염 없이 백선피 추출물 급여도 없는 군이고, Group II는 음성대조군으로서 톡소플라즈마 감염만 있는 군, Group III은 양성대조군으로서 톡소플라즈마 감염 후 임상에서 실제 톡소포자충의 치료제로 사용되고 있는 설파다이아진 50 mg/kg 투여군, Group IV은 톡소플라즈마 감염 후 백선피 추출물을 30 mg/kg 투여한 군으로 5마리씩으로 분류하여 실험을 수행하였다.
| Group | T. gondii | Treatment | n |
|---|---|---|---|
|
|
|||
| I | Vehicle | 5 | |
| II | 1 × 105/mouse | Vehicle | 5 |
| III | 1 × 105/mouse | Sulfadiazine (50 mg/kg) | 5 |
| IV | 1 × 105/mouse | Dictamnus dasycarpus (30 mg/kg) | 5 |
Group I을 제외한 모든 군의 마우스에는 톡소포자충의 영양형 1 × 105/mL을 1 mL 복강에 투여하였다. 톡소포자충 감염 2시간 후, Group III에는 설파다이아진을 50 mg/kg 용량으로, Group IV에는 백선피 추출물을 30 mg/kg 용량으로 투여하고 이 후 1일 간격으로 4일간 경구 투여하였다. 이 후 4일째 되는 날 마우스를 경추탈구하여, 각 마우스 복강 내의 톡소포자충의 영양형을 모두 얻어 측정하였다. 실험 종료 후 투여물질들의 톡소포자충 억제율은 Park 등(2003)의 방법에 따라서 다음과 같은 수식으로 계산하여 구하였다[11]. : 톡소포자충 억제율(inhibition ratio of tachyzoites of T. gondii) = [(음성대조군의 톡소포자충 수 – 물질투여군의 톡소포자충 수)/음성대조군의 톡소포자충 수]×100.
실험 수행 기간 동안 실내 온도 24 ± 4°C의 온도와 동일한 환경이 적용될 수 있도록 하였고 원광대학교 동물실험윤리위원회의 실험계획 평가 후 승인 과정을 거쳤으며 실험과정 및 종료까지 원광대학교 동물실험윤리 지침을 준수하며 수행되었다(Approval No. WKU13-13).
Results
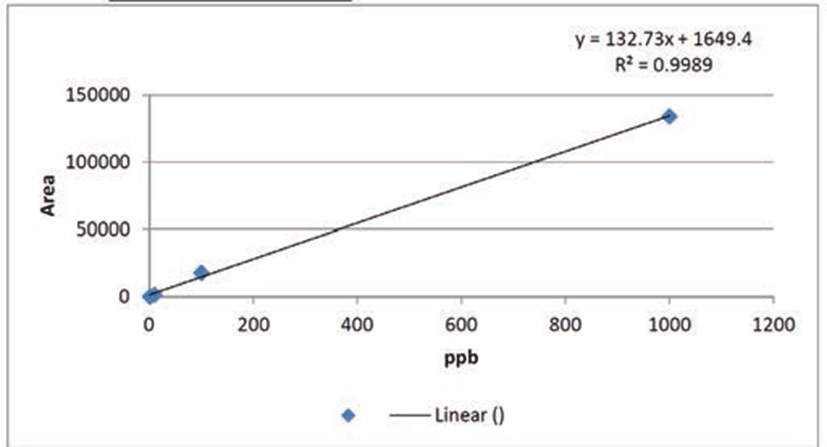
본 실험에서 사용된 백선피 에탄올 추출물의 지표물질을 확인하기 위해 LC/MS를 이용하여 3회 반복으로 분석하였다. LC/MS에 사용된 백선피의 표준물질인 fraxinellone은 1000, 100, 10 및 1 ppb으로 적용하였을 때 chromatography에서 retention time (Rt)은 9.667분에 peak를 확인하였으며, 백선피 에탄올 추출물은 2 mg/mL의 농도로 녹여 100 ppb으로 주입하였을 때, retention time (Rt)은 9.674 분에서 peak를 나타내고, 백선피 에탄올 추출물의 지표성분인 fraxinellone에서의 9.667분대와 비슷한 곳에서 peak를 보였다. 비교 실험 결과 백선피 에탄올 추출물에는 fraxinellone의 함량이 385 μg/mL이 함유되어 있음을 확인하였다.
Fraxinellone 표준물질 1 ppb에서 peak area는 233, 10 ppb에서 peak area는 1675, 100 ppb에서 peak area는 18074, 1000 ppb에서 peak area는 134080로 표준곡선의 상관계수 R=0.9989 이상으로 매우 양호한 직선성을 나타내나타내었다(Fig. 1). 백선피 에탄올 추출물에 함유된 fraxinellone peak area는 52744로 LC/MS 분석을 통해 fraxinellone의 함량 385 μg/mL을 확인했다. 이로부터 본 연구에 사용된 백선피 에탄올 추출물에 포함된 franxinellon의 상대함량 비율은 1.925%임을 알 수 있었다.
HeLa 세포에서 수행된 톡소포자충 감염과 천연물의 항톡소플라즈마 효과에 대난 판정은 Park 등(2003)의 방법에 따라서 EZ-Cytox Kit (Daeil Lab.Co., Korea)을 이용하여 세포증식분석을 실시하여 선택성을 산출하여 수행되었다.
HeLa 세포에 백선피 에탄올 추출물과 설파다이아진을 농도별로 처리했을 때 세포와 톡소포자충에서의 EC50 값을 산출하였다. 백선피 에탄올 추출물을 처리하였을 때 HeLa 세포에서의 IC50 값은 10619.6 μg/mL, 톡소포자충에서의 IC50 값은 1412.5 μg/mL으로 선택성은 7.52이었다. 설파다이아진 처리시 HeLa 세포에서의 IC50 값은 351.327 μg/mL, 톡소포자충에서의 IC50 값은 168.842 μg/mL으로 선택성은 2.08을 나타내었다(Table 2).
| Herbs | Hela cell IC50 (µg/mL) | T. gondii IC50 (µg/mL) | Selectivitya |
|---|---|---|---|
| Dictamnus dasycarpus | 10619.6 | 1412.5 | 7.52 |
| Sulfadiazine | 351.327 | 168.842 | 2.08 |
설파디아진 보다 4배의 선택성을 보인 백선피 에탄올 추출물을 가지고 항톡소포자충 효과를 확인하기 위해 ICR 암컷 마우스를 사용하여 in vivo 효능 평가 시험을 진행하였다. 백선피 에탄올 추출물은 30 μg/mL으로 4주령 ICR 암컷 마우스에 4일간 하루에 한 번씩 경구 투여하였다. 4일째, 복강내의 톡소포자충의 영양형을 모두 얻어 계량하였다. 실험 종료 후 각 군의 측정된 톡소포자충 수를 가지고 계산한 투여물질들의 톡소포자충 억제율은 양성 대조로 사용된 설파다이아진을 투여한 Group III군에서는 84.0 ± 9.62%이었고, 백선피 에탄올 추출물을 투여한 Group IV군은 79.2 ± 5.45%이었다. 이러한 결과로부터 백선피 에탄올 추출물은 톡소포자충의 치료제로 사용되고 있는 설파디아진의 톡소포자충 억제율과 비교하여 동등이상의 효과를 가지고 있는 것을 알 수 있었다(P<0.05).
Discussion
임상적으로 감염시 치명적인 뇌염이나 유산을 일으키는 병원체인 톡소포자충의 치료제로 주로 사용되고 있는 설파디아진이 사용되고 있으나, 이들 약물들은 부작용과 약물 내성에 의한 치료 실패 사례들이 자주 보고되고 있는 실정이다[12, 13]. 이러한 이유로 톡소포자충에 대한 새로운 치료제의 개발 필요성이 대두되고 있으며, 합성 화학약물들에 비교하여 부작용이 적고 안전성이 높은 천연물들을 원료로 한 톡소포자충의 치료가 모색되고 있다[14].
백선피는 flavonoid, limonoid, furoquinoline alkaloid, sesquiterpene, sesquiterpene glycoside, coumarin 계열의 화합물을 많이 함유하고 있으며, 그 가운데 alkaloid와 limonoid 계열이 주요한 활성을 갖는 것으로 알려져 있다[14-18]. 특히 limonoid 화합물은 항균작용 등이 보고 되었고, limonoid에 속한 fraxinellone은 항염증 효과가 보고 되었다[19]. 하지만 백선피 추출물에 따른 항톡소포자충 효과에 대한 연구는 보고된 바가 없다.
본 연구 결과, 백선피 에탄올 추출물은 톡소포자충의 치료제로 임상에서 실제 톡소포자충의 치료로 사용되고 있는 설파다이아진(Sulfadiazine sodium salt)의 톡소포자충 억제율과 비교하여 통계적으로 차이가 없는 효과를 가지고 있는 것을 알 수 있었다(P<0.05). 또한 설파다이아진(Sulfadiazine sodium salt)의 선택성 2.08 보다 백선피 에탄올 추출물의 선택성이 7.52로 매우 높은 것을 알 수 있었다. 선택성(selectivity)은 신약 개발을 위한 항약물 스크리닝에 사용하는 지표의 하나이다. 이 수치가 높으면 높을수록 의약품으로서 인체에 대한 효능과 안전성이 높아지는 것을 의미한다[20]. 이러한 결과로부터 백선피 에탄올 추출물은 톡소포자충의 치료제로서 효능과 안정성이 우수한 것을 알 수 있었다.
이러한 결과로, 백선피(Dictamnus dasycarpus Turcz)는 향후 톡소포자충 치료에 항원충제를 대체할 수 있는 내성이 없는 천연물 치료제를 위한 소재로 개발될 수 있을 것으로 판단되었다. 본 연구에서 백선피 에탄올 추출물의 항톡소포자충 효과가 백선피의 활성물질로 알려진 fraxinellone에 의한 것인지 또는 다른 활성 성분에 의한 것인지에 대한 규명은 이루어지지 못하였다. 향후 추가 연구를 통하여 백선피의 항톡소포자충 기전에 대한 규명을 수행할 계획이다.