Introduction
골절의 치유 시 골유합은 두 개 또는 여러 개의 골 가장자리가 서로 구조적으로 부착되는 것을 의미하며, 골유합 과정이 실패할 경우 지연유합이나 불유합의 상태로 진행되게 된다. 이러한 지연유합이나 불유합은 환자에서 통증을 유발하거나 기능의 상실을 일으키게 되므로 환자의 삶의 질 또한 떨어지게 된다[1]. 특히 최근 들어 노령인구가 급속히 증가하고 있으며, 노령의 환자들은 골절 시 정상적인 골유합 과정을 거치지 못하고 지연유합이나 불유합으로 진행될 가능성이 크다. 이러한 경우 현재까지 가장 좋은 치료법으로는 자가골 이식이 추천되고 있으나[2], 자가골 이식을 위해 수술을 실시한 부위의 이환, 통증, 감각이상, 입원 및 재활기간의 연장, 심부 감염의 위험성 증가, 혈종, 감염 및 운동 제한 등의 단점이 존재할 수 있다[3, 4]. 따라서 최근 골과 관련된 연구 중 가장 많이 수행되는 주제는 노령환자에서의 골절, 교통사고나 총상에 의해 골소실이 큰 골절 등에서 지연유합이나 불유합 없이 빠르게 치유되도록 골절 치유를 극대화시키는 물질이나 방법 등이 주를 이루고 있다.
골치유가 정상적으로 이루어지기 위해서는 골전도, 골유도 및 골형성이라는 세 가지 조건이 필요하다. 골전도는 골이 결손된 부위를 지지해주는 지지체로 3차원적 구조를 갖추고 있어 세포가 부착하여 자라고 분화하여 골재생이 될 때까지 임시적으로 공간을 채우는 역할을 한다[5]. 골유도는 골형성을 도와주는 성장인자들로 골형성단백질(bone morphogenetic protein, BMP) 2, 3, 4, 7, 9 및 전환성장인자 베타(transforming growth factor beta, TGF-β), 혈소판 유래 성장인자(platelet derived growth factor, PDGF), 혈관내피 성장인자(vascular endothelial growth factor, VEGF), 섬유모세포 성장인자(fibroblast growth factor, FGF), 인슐린유사 성장인자(insulin like growth factor, IGF) 등이 있다[6, 7]. 골형성은 살아있고 대사적으로 활성이 있는 세포가 계속적으로 기질을 합성하여 골결손 부위를 직접 채우는 것으로, 여기에 사용되는 세포로는 중간엽 줄기세포가 있다. 중간엽 줄기세포는 골모세포, 연골모세포, 지방세포 및 근육모세포로도 분화가 가능한 다능성(multipotential) 세포로 in vitro 상에서도 증식이 잘 되고 체내로 이식된 후 주변의 생물학적 및 물리적 환경에 반응하여 필요한 세포로 분화된 후 골이식을 증 강시키는 역할을 하며, 이러한 세포들은 골수, 지방 조직, 근육 및 말초 혈액에서 분리될 수 있다[8-10].
분리된 중간엽 줄기세포를 in vitro 상에서 계대배양시킨 후 체내로 이식하기 위해서는 이식할 지지체에 중간엽 줄기세포를 seeding 시켜 이식하거나 직접 골결손부위에 운반체와 함께 주사하는 방법이 있다[11]. 지지체에 중간엽 줄기세포를 seeding하는 방법은 세포의 생존력을 높일 수는 있으나 지지체와 줄기세포를 몇 주간 함께 배양해야 되므로 실제 임상에 사용하기는 어려울 수 있다[12]. 또한 중간엽 줄기세포 및 성장인자를 이식하기 위해서는 운반체가 필요하며 운반체로 사용되는 물질은 type I collagen, fibrin, alginate, basement membrane gel과 같은 천연 또는 합성 hydrogel, 무기물질인 calcium phosphate, bioglass 등이 있다[13, 14]. 천연 hydrogel 중 하나인 basement membrane gel은 세포가 실제 조직의 물리적, 생화학적 측면과 유사한 미세환경에서 자라게 해주는 3차원적 구조를 가지고 있으며, 생리적으로 세포와 세포, 세포와 기질간의 상호작용을 만들어주어 원래 조직 기능과 항상성을 유지하게 할 수 있다는 장점을 지니고 있다[15].
따라서 본 연구는 실제 임상에 적용하기 위해 basement membrane gel인 matrigel 기반 bioceramic/polymer 지지체와 함께 골형성인자, 혈관형성인자 및 중간엽 줄기세포를 직접 골결손부위에 투여하여 골형성 정도를 평가하고자 하였다. 이를 위해 basement membrane gel 중 하나인 matrigel에 BMP-2와 VEGF를 포함시켜 HA/PCL에 주사한 후 방출속도를 in vitro상에서 비교 및 측정하였고, in vivo 연구에서 랫드의 대퇴골결손 모델 형성 후 matrigel 기반 HA/PCL [Hydroxyapatite/Poly (ε-carprolactone)] 지지체와 함께 BMP-2, VEGF 및 중간엽 줄기세포를 함께 투여하여 골형성 정도를 평가하였다.
Materials and Methods
Poly (ε-carprolactone) (PCL; ME 65,000; Sigma-Aldrich, St. Louis, USA)을 40°C에서 chloroform에 용해시킨 후 working PCL 용액을 준비하였다. 그 후 HA/PCL 혼합 paste를 만들기 위해 hydroxyapatite (HA; 53 μm; Sigma-Aldrich, St. Louis, USA)를 PCL 용액(HA:PCL, 3:2, w/w의 혼합 비율)에 혼합하였다. Paste를 주사기에 넣고 robotic layer manufacturing 기계를 사용하여 층층이 쌓아주어 높이 5 mm, 직경 4 mm인 3차원의 지지체를 만들었다. 이러한 지지체는 에탄올에 20분 침지 후 PBS에서 20분간 수세하는 과정을 3번 반복하였고, 남아있는 용매를 완전히 제거하기 위하여 72시간동안 동결건조하였다. Matrigel은 EHS 종양의 unfractionated high-salt/urea extract로부터 준비하여 –20°C에 저장하였고, 사용 전 4°C에서 녹인 후 보관하였다.
HA/PCL 지지체당 25 μL의 matrigel을 준비한 후 matrigel만 포함한 군, matrigel에 BMP-2 (recombinant human bone morphogenetic protein, Genoss, Korea) 1.5 μg을 포함한 군, BMP-2 1.5 μg과 VEGF (recombinant rat VEGF165, Peprotech, USA) 5 μg을 포함한 군으로 나누어 성장인자의 방출실험을 실시하였다. HA/PCL지지체에 각각의 성장인자를 포함한 matrigel 25 μL를 주사하여 37°C의 oven에서 3시간 동안 안정화시킨 후 4°C에서 그 다음날까지 보관하였다. 10 mL의 PBS를 넣은 후 37°C에서 계속적으로 교반하였으며, 2 및 12시간, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 15, 18, 21, 24, 27 및 30일째에 1 mL의 상층액을 추출하여 분석 전까지 –20°C에 보관하였고, falcon tube의 PBS는 매일 교환하였다.
각각의 matrigel 기반 HA/PCL 지지체에서 BMP-2와 VEGF 수치는 Quantikine rhBMP-2, VEGF ELISA Kit (R&D Systems, Minneapolis, USA)를 사용하여 분석하였으며, 분석은 제조회사의 가이드라인에 따라 실시하였다.
체중 250~280 g의 건강한 10주령 수컷 Sprague-Dawley 랫드(Samtaco, Osan, Korea) 36마리를 온도 23 ± 2°C, 상대습도 60 ± 10%로 유지하고 12시간의 명암주기가 유지되는 실내에서 사료와 식수를 자유로이 공급하며 사육하였다. 실험에 앞서 군당 6마리씩 나누었으며, 랫드의 대퇴골에 5 mm의 골결손부 형성 후 아무 것도 이식하지 않은 군(Control), 성장인자를 넣지 않은 matrigel 70 μL를 이식한 군(Matrigel), HA/PCL 지지체에 BMP-2 (recombinant human bone morphogenetic protein, Genoss, Korea) 1.5 μg을 포함한 70 μL의 matrigel을 함께 이식한 군(M + B), HA/PCL 지지체에 BMP-2 1.5 μg과 5 μg의 VEGF (recombinant rat VEGF165, Peprotech, USA)를 포함한 70 μL의 matrigel을 함께 이식한 군(M + B + V), HA/PCL 지지체에 BMP-2 1.5 μg 및 5 μg의 VEGF와 1 × 106개의 랫드 골수 유래 중간엽 줄기세포 10 μL를 포함한 70 μL의 matrigel과 함께 이식한 군(MSC)으로 나누었다.
Ketamine (Ketamine50®, Yuhan Co., Seoul, Korea) 40 mg/kg과 xylazine (Rompun®, Bayerkorea, Seoul, Korea) 10 mg/kg을 복강주사하여 전신마취한 후 랫드의 오른쪽 뒷다리를 전모하고, 포비돈으로 소독하였다. 뒷다리의 대퇴골 윗부분을 절개한 후 둔성분리를 통해 근육을 젖히고 대퇴골을 노출시켰다. 골막을 제거한 후 생리식염수 관주 하에 oscillating saw를 이용하여 대퇴골간에 5 mm 결손부를 형성하였고, 1.2 mm plate와 screw를 사용하여 대퇴골을 고정시켰다.
이식 후 지지체가 움직이지 않게 주변의 근육을 단순결절봉합 한 다음 대퇴근막을 흡수성 봉합사로 연속봉합하였고, 피부는 비흡수성 봉합사로 단순결절봉합 하였다.
수술 후 4주 및 8주째에 랫드를 희생하여 골이식부가 포함되도록 대퇴골을 채취한 후 Skyscan 1172 Desktop X-ray microtomograph (Skyscan, Aartselaar, Belgium)를 이용하여 50 kVp의 관전압과 201 μA의 노출 조건으로 컴퓨터 단층촬영하여 결손부 영상을 얻었다. 촬영된 영상 파일은 Skyscan CT Analyzer software를 이용하여 두개결손부의 골이식부위가 포함되도록 관심영역(region of interest)을 설정한 후 골부피와 골밀도를 측정하였다. Micro CT 상에서 측 정된 4주 및 8주차의 골부피와 골밀도의 군 간 분석을 위해 one-way ANOVA (SPSS version 21.0.0.0)를 사용하였으며, Bonferroni 검정법을 이용하여 5% 유의수준(P<0.05)에서 유의성을 검증하였다.
수술 후 4주 및 8주째에 채취된 골조직을 10% 중성 포르말린에 고정시킨 후 Calci-Clear™ Rapid (National diagnostics, Atlanta, USA)로 탈회시켰다. 그 후 에탄올 농도 상승 순으로 탈수하여 paraplast (Sherwood Medical Industries, St. Louis, USA)에 포매하였다. 포매된 조직은 microtome (Reichet-Jung 820)으로 5 μm 두께의 절편을 제작한 다음 hematoxylin and eosin (H&E) 염색하여 골결손부에서의 신생골 형성을 관찰하였다.
Results
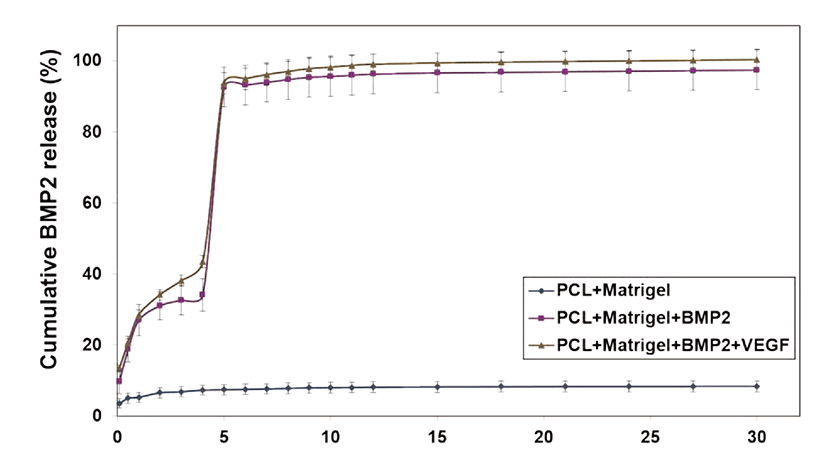
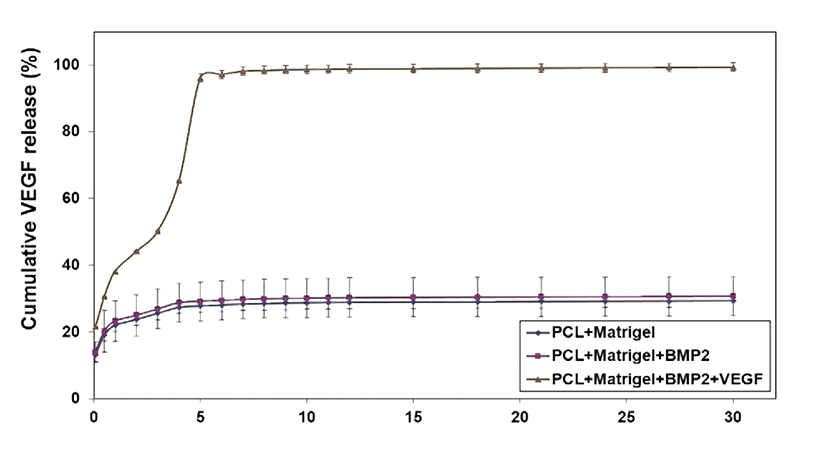
BMP-2의 방출은 2시간에서부터 측정되었고, Day 5에 방출이 폭발적으로 증가되었으며 Day 15에는 100%에 가까운 방출량을 나타내었고, Day 25 이후에 100%가 약간 넘는 방출량을 나타내었다(Fig. 1). VEGF의 방출은 2시간에서부터 측정되었고, 역시 Day 5에 방출이 폭발적으로 증가되었으며, Day 7에는 100%에 가까운 방출량을 나타내었고, 그 후로는 거의 방출이 되지 않는 것을 확인할 수 있었다. 또한 VEGF를 포함하지 않은 다른 두 군에서도 25% 정도의 방출량을 확인할 수 있었다(Fig. 2).
골이식 후 4주와 8주째에 랫드를 희생시키고 대퇴골을 채취하여 micro CT 분석을 실시하였다. 4주째에 골부피에서 는 대조군에 비해 Matrigel군과 M + B군에서 유의적으로 높은 골부피를 나타내었고(P<0.05), M + B + V군과 MSC군 역시 대조군에 비해 유의적으로 높은 골부피를 나타내었다(P<0.01). 또한 M + B + V군은 M + B군에 비해 유의적으로 높은 골부피를 나타내었다(P<0.05). 그리고 골밀도에서는 다른 모든 실험군에서 대조군에 비해 높은 골밀도를 나타내었다. M + B + V 군과 MSC군은 대조군에 비해 유의적으로 높은 골밀도를 나타내었으나(P<0.01)(P<0.05), Matrigel 군과 M + B군에서는 유의적인 차이를 확인할 수 없었다(Table 1, 2). 8주째에 골부피에서는 다른 모든 실험군에서 대조군보다 높은 골부피를 나타내었고, 특히 M + B + V와 MSC군은 대조군에 비해 유의적으로 높은 골부피를 나타내었다(P<0.05).
Control=no graft with 5 mm femoral segmental defect; Matrigel=grafting of matrigel based HA/PCL scaffold; M + B= grafting of matrigel based HA/PCL scaffold with BMP-2; M + B + V=grafting of matrigel based HA/PCL scaffold with BMP-2 and VEGF, MSC=grafting of matrigel based HA/PCL scaffold with BMP-2, VEGF and mesenchymal stem cell.
Control=no graft with 5 mm femoral segmental defect; Matrigel=grafting of matrigel based HA/PCL scaffold; M + B=grafting of matrigel based HA/PCL scaffold with BMP-2; M + B + V=grafting of matrigel based HA/PCL scaffold with BMP-2 and VEGF, MSC=grafting of matrigel based HA/PCL scaffold with BMP-2, VEGF and mesenchymal stem cell.
골밀도에서는 Matrigel군이 가장 높은 골밀도를 나타내었고 그 다음으로는 M + B + V군이 높은 골밀도를 나타내었으나 모든 실험군 간의 유의적인 차이는 확인할 수 없었다(Table 1, 2).
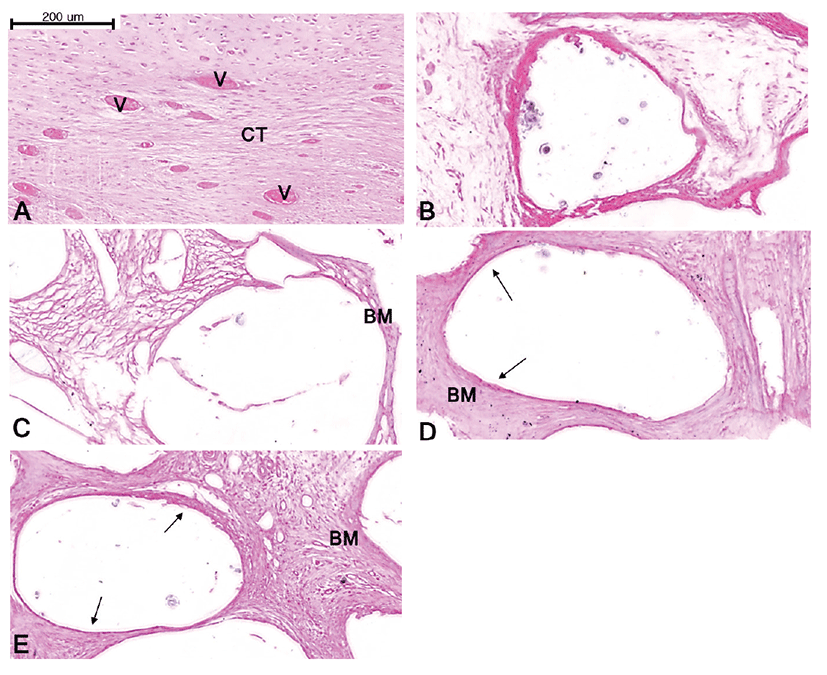
4주째의 골조직에서 대조군은 골결손부위의 중앙부에 섬유소성 결합조직으로만 채워져 있었다(Fig. 3). 대조군을 제외한 모든 실험군에서는 골결손부위의 변연부 뿐만 아니라 중앙부에서도 골이식재 주변에 골모세포의 배열이 보였으며 많은 양의 골유사기질(bone-like materials)과 치밀한 섬유소성 결합조직이 형성된 것을 관찰할 수 있었다. 그 중 M + B, M + B + V 및 MSC군들에서는 다른 실험군에 비해 더 많은 양의 골유사기질이 형성되었고, 혈관신생이 두드러짐을 확인할 수 있었다(Fig. 3).
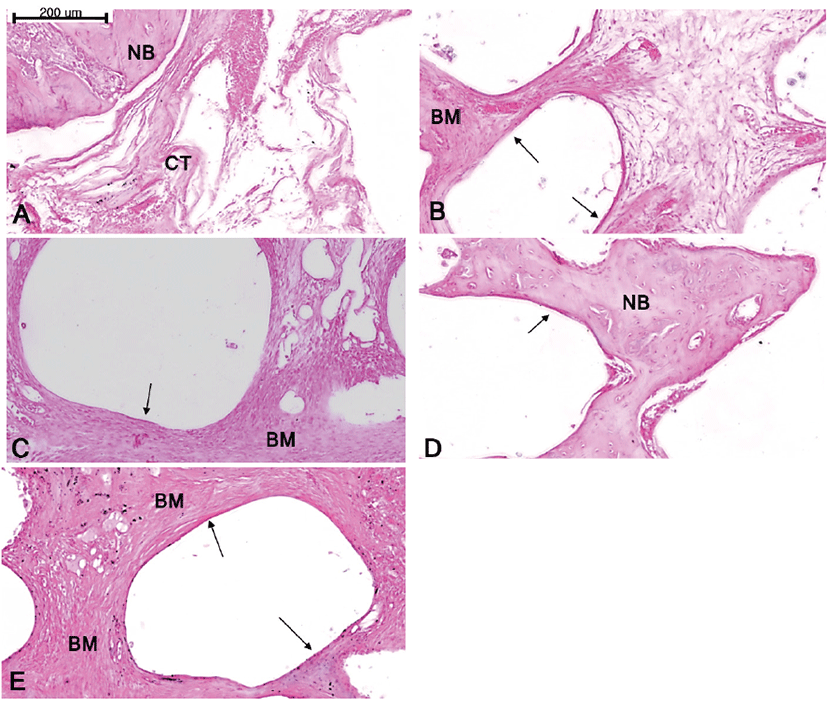
8주째의 골조직사진에서 대조군에서는 4주째에 비해 변연부에 더 많은 골유사기질이 형성되고 있었으며, 중앙부에는 골유사기질이 주변에 조금 형성되었고 혈관형성도 관찰되었으나 중심부위에서는 연부조직의 침습 외에 골형성소견은 보이지 않았다(Fig. 4). 대조군을 제외한 모든 다른 실험군에서 4주째에 비해 골결손부위의 변연부 및 중앙부위에 새로운 신생골이 형성되고 있음이 관찰되었다. 특히, M + B + V군에서는 지지체 내의 많은 신생골 형성이 관찰되었으며, MSC군에서는 지지체 내의 세포충실도(cellularity)가 가장 높은 것을 관찰할 수 있었다(Fig. 4).
Discussion
골절과 관련된 정상 생리학적 반응은 초기 염증기를 지난 후 부드러운 가골이 형성되어 단단한 가골이 형성되고 마지막으로 골재생이 일어나게 된다[16]. 그러나 정상적인 과정이 일어나지 않을 때 골은 지연유합이나 불유합의 상태에 빠지게 되고 특히 결손부위가 클 경우에는 이러한 가능성이 커진다. 또한 골절 시 골절 부위가 해부학적으로 수복된 후 단단하게 고정되어 있을 때 가골 형성 없이 빠르게 골유합이 이루어지는 일차 유합에 의해 골재생이 일어날 수 있으나 대부분의 골절에서는 특히, 골결손부위가 크거나 복합골절과 같은 경우에는 일차 유합이 아닌 이차 유합에 의해 골재생이 일어날 가능성이 크다[17]. 이차 유합의 경우 장골에서는 연골내 골화에 의해 골재생이 이루어지며, 이는 초기에 혈종이 형성된 후 염증기를 거쳐 혈관형성 및 연골의 형성 후 이 연골이 경화되고 경화된 연골이 다시 골로 대체되는 과정을 거친다[17]. 이러한 일련의 과정을 더욱 빠르게 도와주기 위해 현재 골조직공학(bone tissue engineering)이라는 분야가 부각되고 있으며, 이와 관련된 많은 연구가 시행되고 있다.
골조직공학에서는 골재생을 위해 필요한 조건을 크게 세 가지로 나누고 있다. 첫 번째로는 골전도로서 골결손부위를 물리적으로 지지해주며 골을 형성하는 세포가 부착하여 기질을 생성하여 신생골을 형성할 수 있도록 도와주는 지지체 또는 골이식재를 의미한다[5]. 본 연구에 사용된 고분자는 PCL로 이는 미생물, 생리학적 조건 하의 가수분해 및 효소에 의한 표면 부식에 의해 분해될 수 있는 물질이며 이 물질의 고분자량과 함께 높은 소수성과 느린 분해속도를 가지고 있어 골조직이 자라 들어오는데 유리한 조건을 가지고 있다. 그러나 골결손부에 단독으로 이식 시 종종 섬유조직에 둘러싸이거나 생활성이 부족하여 골에 잘 부착되지 않아 이물로 남을 가능성이 있다[18]. 따라서 이러한 단점을 극복하기 위해 HA와 함께 복합체를 형성하여 지지체를 제작하였다. 고분자 안의 HA 입자는 자연적 골의 mineral phase와 유사하여 골모세포가 골생성을 증진시키도록 도와줄 수 있으며 강도가 강해져 기계적 강도 및 골전도를 증강시킬 수 있는 장점이 있다[19].
두 번째 조건으로는 골유도로서 신생골의 생성을 유도하고 도와주는 성장인자들이 있다. 이러한 성장인자들은 골대사뿐 만 아니라 세포들의 분화, 증식 및 발현까지 조절해주는 역할을 수행하며, 그 중 대표적인 인자들로는 BMP, IGF, PDGF, FGF 및 VEGF 등이 있다[10]. 그 중 BMP는 최근에 가장 많은 연구가 이루어지고 있는 성장인자로 TGF-β superfamily에 속하는 다기능성 사이토카인이며 세포의 성장, 분화, 화학주성 및 세포자멸사에 관여한다. 본 연구에 사용된 BMP-2는 골전구세포의 분화와 증식을 촉진하여 간접적으로 혈관형성인자로 작용하여 골모세포로부터의 VEGF 분비 자극 및 혈관내피세포의 화학주성인자로서 작용한다[20].
VEGF는 강력한 혈관형성 인자로 혈관내피세포의 증식 및 이주를 도와주며, 골모세포의 화학주성과 분화를 촉진시키는 것으로 알려져 있다. 따라서 이 2 개의 성장인자를 골결손부위로 함께 이식 시 BMP-2의 골모세포 분화 및 증식 촉진 효과와 VEGF의 강력한 혈관형성 효과로 인한 신생혈관 형성이 중간엽 간엽세포 및 골모세포를 지지해주어 골재생을 더욱 촉진시켰다고 여러 연구에서 보고되고 있다[21].
골재생을 위한 세 번째 조건으로는 골형성이 있으며, 이는 골형성에 직접적으로 참여하는 골모세포로 분화될 수 있는 중간엽 줄기세포를 의미한다[5]. 이 중간엽 줄기세포는 다기능 세포로 골모세포, 연골모세포, 지방세포, 건세포 및 근육모세포로 분화할 수 있는 능력을 가지고 있다. 또한 중간엽 줄기세포는 골결손부에서 골모세포나 연골모세포로 분화되면 유골(osteoid)을 형성하고 골절부위의 가골을 형성하는 연골을 만드는 기질을 분비하게 된다[22].
지지체와 함께 성장인자를 이식하는 방법으로는 지지체 표면에 흡수시켜 방출하는 방법, 삼투압 펌프, 지지체로부터 방출되도록 하는 방법 및 운반체에 성장인자를 넣고 운반체와 지지체를 함께 이식해주는 방법 등이 있으나 본 연구에서는 운반체와 지지체를 함께 넣어주는 방법을 사용하였으며, 운반체로 주로 사용되는 hydrogel 중 본 연구에서는 basement membrane gel인 matrigel을 사용하였다. Matrigel은 EHS tumor로부터 유래된 basement membrane의 수용성 및 무균성의 추출물로 37°C에서 3D gel을 형성하며 세포의 형태형성, 분화를 도와주며, 특히 matrigel은 type IV 콜라겐 및 TGFβ, FGF, PDGF와 같은 성장인자를 자체적으로 포함하고 있다[23]. 또한 선행연구에서 살펴보았을 때, 전통적인 세포 배양 방법인 2D 배양 시 생체의 고유 환경에서 세포를 추출하여 비생리적 상태에서 배양하기 때문에 증식과 분화가 일반적이어서 원래의 조직과는 다른 세포로 분화되는 단점이 있다[23]. 그러나 3D gel에서는 세포를 원래의 조직과 기하학적, 물리적, 생화학적으로 유사한 환경에서 배양시킬 수 있다. 이는 생리학적으로 세포와 세포 및 세포와 기질 간의 상호관계를 설립하여 증식과 분화를 공간적 및 시간적으로 조절하는 방식으로, 기원조직의 기능과 항상성을 유지할 수 있게 한다는 장점이 있다[24]. 또한 이 matrigel은 보통 세포의 배양실험에 많이 사용되고 있으나, matrigel 자체를 in vivo 실험에서 운반체 자체로 사용한 연구는 많지 않은 실정이다. 따라서 본 연구는 실제 임상에서 적용하기 위해 지지체에 중간엽 줄기세포를 함께 배양하여 이식하는 방법이 아닌 basement membrane gel인 matrigel 기반 bioceramic/polymer 지지체와 함께 골형성인자, 혈관형성인자 및 중간엽 줄기세포를 직접 골결손부위에 투여하여 골형성 정도를 평가하고자 하였다. 이를 위해 basement membrane gel 중 하나인 matrigel에 BMP-2와 VEGF를 포함시켜 HA/PCL에 주사한 후 방출 속도를 in vitro 상에서 비교 및 측정하였고, in vivo 연구에서 랫드의 대퇴골결손 모델 형성 후 matrigel 기반 HA/PCL 지지체와 함께 rhBMP-2, VEGF 및 중간엽 줄기세포를 함께 투여하여 골형성 정도를 평가하였다.
Matrigel 내에서의 BMP-2와 VEGF의 방출속도 측정 실험에서 2시간부터 방출이 시작되었고, Day 5에 방출이 폭발적으로 증가되었다가 Day 15에는 100%에 가까운 방출량을 나타내었다. 따라서 matrigel의 분해가 이 시점에서 많이 일어남을 확인할 수 있었으며, BMP-2의 방출이 Day 25 이후에 100%가 넘는 이유로는 matrigel 자체에서의 BMP-2가 약 10% 정도 방출되기 때문이라 생각되며 이는 BMP-2를 포함하지 않은 군에서도 약 10% 정도의 방출량이 측정되는 것으로 확인해볼 수 있었다. 또한 VEGF를 포함하지 않은 군에서도 25% 정도의 VEGF의 방출량이 측정됨으로 성장인자를 포함하고 있는 matrigel 자체에서 방출되는 BMP-2와 VEGF를 확인할 수 있었다.
또한 in vivo 연구에서의 골형성인자, 혈관형성인자 그리고 중간엽 줄기세포 투여 시 골형성 효과를 평가하기 위해 랫드의 대퇴골결손 모델 형성 후 4주와 8주째 micro CT와 조직학적 검사를 통하여 골형성 정도를 평가하였다. 본 연구에서 사용된 VEGF와 관련된 in vivo 실험에서 VEGF는 혈관형성을 촉진시켰으며 골소실부에서 골재생을 촉진시켰다고 보고하고 있으며, 선행연구들에서 VEGF의 경우 2.5~100 μg/scaffold 및 BMP-2의 경우 2~10 μg/scaffold의 높은 농도로 첨가되어 있었다[25-27]. 이는 골이식 시 고용량의 골형성단백질 및 혈관형성인자를 사용하면 골형성 효과는 좋으나 혈관형성인자 또한 고가의 성장인자로 경제적인 측면에서 단점으로 작용할 수 있다. 그리고 본 연구에서 사용된 matrigel 내에는 여러 성장인자들이 포함되어 있으므로 성장인자들 사이의 상승작용으로 인해 소량의 골형성단백질 및 혈관형성인자만으로도 골형성 효과를 증진시킬 수 있으리라는 전제 하에 Patel 등[27]의 연구에서 사용된 용량보다 감소시켜 적용하였다. Patel 등의 연구에서는 VEGF가 지지체당 12 μg 포함되어 있었으며, rhBMP-2는 지지체당 2 μg이 포함되어 있었다. 본 연구에서는 VEGF는 33.3% 감소시켜 지지체당 5 μg을 포함시켰으며, rhBMP-2는 40% 감소시켜 지지체당 1.5 μg이 포함되도록 하였다. Micro CT를 이용한 평가 중 4주째의 골부피에서 모든 실험군이 대조군보다 높았고, 특히 M + B + V와 MSC군에서 유의적으로 가장 높은 골부피를 나타내었다. 따라서 matrigel에 골형성단백질만 포함된 군보다 혈관형성인자까지 포함된 군이 더 높은 골부피를 보이는 것으로 판단되며, 이는 M + B + V군의 골부피가 M + B군에 비해 유의적으로 높은 골부피를 보이는 것으로 확인할 수 있었다. 또한 M + B + V군보다 MSC군의 골부피가 약간 낮거나 비슷한 것으로 측정되었는데, 이는 투여된 MSC가 matrigel을 더 빨리 분해하면서 matrigel 자체의 성장인자 효과가 줄어들었기 때문으로 생각된다. 8주째에는 대조군에 비해 모든 실험군이 더 높은 골부피를 나타내었으나 M + B + V와 MSC군에서 대조군에 비해 유의적인 차이를 나타내었다. 또한 두 군사이의 유의적인 차이는 없었으나 4주째와는 달리 M + B + V군보다 MSC군에서의 골부피가 높은 것을 확인할 수 있었다. 골밀도에서는 4주째에 대조군에 비해 M + B + V와 MSC군에서 유의적인 증가를 나타내었고, 8주째에는 matrigel군과 M + B + V군에서 높은 골밀도를 나타내었으나 대조군과의 유의적인 차이는 확인할 수 없었다. 따라서 중간엽 줄기세포를 포함한 MSC군의 골형성효과를 알아보기 위해서는 2개월 이상의 장기간 추가실험이 필요할 것으로 생각된다.
조직학적인 평가에서도 대조군을 제외한 모든 실험군에서 골결손부위의 변연부 뿐만 아니라 중앙부에서도 골이식재 내부에 골유사 물질(bone-like material) 및 골이식재 주변의 골모세포성 경계(osteoblastic rimming)가 관찰되었다. 또한 치밀한 섬유소성 결합조직이 관찰되었으며, 4주째에 이어 8주째가 되면서 새로운 신생골이 형성되고 있음이 관찰되었다. 그 중 M + B + V군과 MSC군에서 골유사물질 및 신생골이 가장 많이 관찰되었으며, 8주째에는 M + B + V군에서 지지체 내의 신생골이 많이 관찰되었고, MSC군에서는 지지체 내의 세포충실도(cellularity)가 가장 높은 것을 관찰할 수 있었다.
본 연구를 통해 matrigel을 골형성단백질 및 혈관형성인자와 투여 시 matrigel 자체가 가지고 있는 성장인자와 함께 골부피 및 골밀도를 증가시키는 것을 확인할 수 있었고 또한 중간엽 줄기세포와 함께 투여하였을 때에도 골부피를 증가시켰으나 2달 이상의 추가적인 실험을 통해 골밀도 또한 증가시키는지에 대한 연구가 더 필요할 것으로 생각된다. 또한 실제 지연유합이 존재하는 증례들에서 골이식재와 함께 사용 시 신생골 형성을 촉진시킬 수 있는 유용한 방법이 될 수 있으리라 생각된다.