ARTICLE
Evaluation of effect of red ginseng on ovariectomy-induced bone loss in C3H/HeN mice
Miyoung Yang1, Hyosun Jang1, Hae-June Lee2, Changjong Moon1, Jong-Choon Kim1, Jong-Sik Jang3, Uhee Jung4, Sung-Kee Jo4, Sung-Ho Kim1,*
1College of Veterinary Medicine, Chonnam National University, Gwangju 500-757, Korea
2Korea Institute of Radiological & Medical Science, Seoul 139-240, Korea
3College of Animal Science, Kyungpook National University, Sangju 742-711, Korea
4Advanced Radiation Technology Institute, Korea Atomic Energy Research Institute, Jeongeup 580-185, Korea
*Corresponding Author : Sung-Ho Kim, College of Veterinary Medicine, Chonnam National University, Gwangju 500-757, Korea, Tel: +82-62-530-2837, Fax: +82-62-530-2841; E-mail:
shokim@jnu.ac.kr
© Research Institute of Veterinary Medicine, Chungbuk National University. All rights reserved. This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Feb 13, 2014; Revised: Mar 12, 2014; Accepted: Mar 13, 2014
Abstract
Panax ginseng, also known as Korean ginseng, has long been used as a broad tonic in Oriental medicine to augment vitality, health, and longevity, particularly in older people. This study investigated the effects of Korean red ginseng (RG) on bone loss in ovariectomized (OVX) mice. C3H/HeN mice (10-weeks-old) were divided into sham and OVX groups. OVX mice were treated with vehicle, 17β-estradiol (E2), RG (oral administration, 250 mg/kg/day), or RG (intraperitoneal administration, 50 mg/kg/every other day) for 6 weeks. Serum E2 concentration and alkaline phosphatase (ALP) activity were measured. Tibiae were analyzed using microcomputed tomography. Biomechanical properties and osteoclast surface level were measured. There was no significant difference in the degree of grip strength, body weight, uterine weight, mechanical property, tibiae length, or tibiae weight between the OVX and RG-treated groups. Compared with the OVX group, the serum ALP level was significantly lower in the RG-treated groups. Serum E2 levels and osteoclast surface levels did not change between the OVX and RG-treated groups. RG could not preserve trabecular bone volume, trabecular bone number, trabecular separation, trabecular thickness, structure model index, or bone mineral density of the proximal tibiae metaphysic. In conclusion, there was no definite effect of RG on OVX-induced bone loss in C3H/HeN mice.
Keywords: red ginseng; ovariectomy; osteoporosis; microcomputed tomography; C3H/HeN mouse
Introduction
골다공증은 골의 강도가 저하되어 골절 위험이 증가하는 질환이며 이는 골밀도와 골의 질적 차이에 따라 결정된다. 골다공증 유발에는 내분비 및 소화흡수장해, 영양소 부족, 식습관, 약물, 에스트로겐 부족, 노화 등이 관계되며, 노화와 관련된 골소실은 골다공증의 제 1요인으로 남녀 모두에서 발생된다[1]. 여성에서 골다공증의 주요인은 폐경이다. 에스트로겐은 골흡수를 촉진하는 cytokine의 산생을 억제하여 골소실을 억제한다. 따라서 폐경에 따른 에스트로겐의 감소는 뼈파괴세포에 의한 골흡수를 증가시켜 골다공증을 유발하는 것으로 알려져 있다[2].
골다공증의 진단은 방사선학적 진단, 골밀도 측정 및 생화학적 골표지자 등의 관찰이 시행되고 있으며, 사람임상에서 방사선학적 진단은 단순방사선 소견, 골주사검사(bone scan), 전산화단층촬영(computed tomography, CT), 자기공명영상(magnetic resonance imaging) 방법이 적용되고 있다. 골량을 정량적으로 측정하는 정량적 전산화단층촬영(quantitative CT)은 골다공증의 진단과 치료과정 중에 이용되며, 골음영의 감소, 골소주의 변화, 골절에 의한 변형 등을 관찰할 수 있다. 골밀도 측정에는 정량적 측정법으로 이중에너지 방사선흡수법 및 정량적 전산화단층촬영이 적용된다[3]. 생화학적 골표지자로서는 뼈파괴세포나 뼈모세포에서 분비하는 효소, 골흡수 및 골형성과정에서 유리되는 골의 기질성분 등을 혈액이나 소변에서 측정한다[4].
여성 골다공증은 유용한 동물모델을 적용하여 많은 연구가 진행되었으며, 랫드 난소절제 실험모델이 효과 약제 검사를 위한 전임상연구에 기준방법으로 적용되고 있다[5]. 골소실 평가 동물 모델은 난소 절제 후 뼈 상태를 평가하는 고전적 방법이 적용되고 있으나 효소분석, 세포수준의 활성도 측정을 비롯한 시험관내 시험, 광학현미경을 이용한 2차원적 형태 평가 등의 간접적이고 단편적인 평가가 수행되고 있어 실제 강 도 및 구조 등 3차원적 평가가 미흡한 실정이었다.
정량적 미세단층촬영(microcomputed tomography, μCT) 방법은 실험동물의 뼈를 마이크로 단위로 단층 촬영하여 골부피(bone volume, BV), 두께(trabecular thickness, Tb. Th.), 분리 정도(trabecular separation, Tb. Sp.), 골수(trabecular number, Tb. N.), 구조적 모델 계수(structural model index, SMI)를 비롯한 30여 가지의 3차원 및 2차원 골상태 평가 지표를 측정하고, 분석을 통하여 뼈의 량, 해면뼈구조 및 연결도 등을 평가한다. 이상의 관찰 지표 외에 치밀뼈의 평가도 가능하며, 골밀도(bone mineral density) 또한 상대분석 함으로서 고전적인 2차원 형태측정 방법에 비해 보다 객관적이고 정확한 평가가 가능하다[6].
임상적으로 적용되는 골다공증의 치료에는 칼슘, estrogen, calcitonin, bisphosphonate, selective estrogen receptor modulator, 골형성 자극제, 부갑상샘 호르몬 및 strontium 등이 적용되고 있으나 요로결석 유발, 심혈관계 질환 및 유방암 유발, 장기 사용시 내성 및 골질 불량화 등의 부작용이 수반된다[7-12]. 따라서 부작용이 적은 천연물에서 골소실 개선제 또는 예방제의 발굴 및 개발이 필요하다.
인삼의 골소실 개선 효과는 상반된 연구결과가 보고[13-18]되고 있으며 이들 연구에서 적용된 방법 및 연구의 범위가 다소 단편적인 결과이다. 따라서 다양한 골소실 평가 기법을 적용한 종합적이고 심도 있는 연구가 요구된다. 본 연구에서는 μCT를 이용한 3차원적 형태평가, 지표 효소 분석, 물리적 강도 평가 등을 적용하여 홍삼의 호르몬성 골소실에 대한 효과유무를 평가하였다.
Materials and Methods
실험동물 및 난소 절제술 실시
성숙(10주령) C3H/HeN 암컷 마우스를 사용하였으며 실험동물의 사육은 온도 22 ± 2°C, 상대습도 50 ± 10%, 조명시간은 12시간(오전 8시 점등-오후 8시 소등) 및 조도 200~300 lux로 설정된 시설에서 수행하였다. 순화기간을 거쳐 polycarbonate 사육상자에 3마리씩 수용하고 실험동물용 고형사료(삼양사료, 원주, 한국)와 정수장치를 통과한 수도수를 자유롭게 섭취하도록 하였다. 동물실험은 전남대학교 동물실험윤리위원회의 승인(CNU-YB-2013-1)하에 수행되었다. 난소는 Xylazine HCl (바이엘코리아, 서울, 한국, 0.02 mL/100 g)과 Zoletil 50 (버박코리아, 서울, 한국, 0.1 mL/100 g)을 혼합하여 복강내 주사 마취하고 등쪽으로 고정한 다음 정중등쪽의 피부를 절개한 후 핀셋으로 근육을 관통하고 좌우측 난소를 각각 노출시키고 절제하였다. 대조군은 난소 절제군과 동일한 방법으로 난소를 노출시켰다가 원위치로 원상회복하였으며 각각의 수술 후 봉합하였다. 수술의 성공여부는 부검시 난소의 부재 및 자궁의 위축 등을 관찰하여 판단하였다.
실험군의 분류 및 시험물질 투여
실험동물에 홍삼 및 양성 대조로 17β-estradiol (E2)을 투여하였다. 홍삼은 한국인삼공사(대전, 한국)에서 제공한 홍삼 엑기스를 사용하였다. 홍삼시료 중 ginsenoside 는 Rb1 (0.88%), Rb2 (0.32%), Rc (0.39%), Rd (0.11%), Re (0.26%), Rf (0.16%), Rg1 (0.20%), Rg2 (0.14%), Rg3 (0.01%), Rh1 (0.10%) 및 미량의 기타 ginsenosides로 구성 되어있다. 실험군의 분류는 정상대조군, 난소절제대조군, 난소절제 및 E2 투여 양성대조군, 난소절제 및 홍삼 복강내 투여군, 난소절제 및 홍삼 경구투여군으로 하였다. 적용 마우스는 실험군당 6마리로 하였으며 홍삼 복강내 투여군에서는 난소적출 다음 날부터 체중 kg당 50 mg을 2일에 1회씩 주사하고, 경구투여군은 난소적출 다음날부터 체중 kg 당 250 mg의 양으로 매일 투여하였다. 양성대조군에 적용될 E2 (water soluble, Sigma, MO, USA)는 마우스 마리당 0.03 μg을 매일 피하주사하였다.
악력(grasping power) 및 뼈굴절강도 분석(biomechanical analyses)
안락사 직전에 인장력측정기(Iwoo-G-500, 이우과학, 서울, 한국)를 이용하여 악력을 측정하였다. 측정눈금을 영점으로 하고, 측정봉에 양쪽 앞발을 잡게 한 다음 꼬리를 서서히 안정되게 잡아당겨 앞발이 측정봉에서 떨어질 때의 최대 악력을 측정하였으며 3회 실시하여 평균값을 산출하였다. 경골의 골강도를 측정하기 위하여 삼중점 굴곡 시험을 시행하였다. 부하는 14 mm 간격으로 떨어진 두 지지점의 중간 부위에 주고 원위부로부터 7 mm 되는 지점이 부하점이 되도록 경골을 배치하고 내외축(medial-lateral axis)을 기준으로 굴곡을 주었다. 부하-변위 곡선은 servo-hydraulic material testing machine (Instron LTD, Buckinghamshire, England)과 x-ray recorder (Hewlett Packard 7090A, Palo Alto, CA, USA)를 이용하여 1 mm/sec의 크로스헤드 속도로 측정된다. 최대부하는 하중이 걸렸을 때 경골이 골절되는 순간의 최대 응력을 말한다.
시료 채취, 혈청생화학 및 E2 측정
실험동물은 정기적으로 일반 임상증상을 관찰하였으며 투여 전 및 부검시 각각 체중을 측정하였다. 난소적출 후 6주에 안락사 후 부검을 시행하고 좌측 경골 및 자궁의 무게를 측정하였다. 좌측 경골은 관절융기에서 복사까지의 최대 길이를 측정한 후, 골밀도 및 전산화 단층촬영 시까지 70% 에탄올에 보관하고, 우측 경골은 강도 검사에 적용하였다. 경골은 μCT 촬영 후 탈회하고 통상적인 방법에 따라 파라핀 포매 절편을 제작한 후 hematoxilin-eosin 염색 및 뼈파괴세포의 활성 관찰을 위해 Kopp 등의 방법[19]에 따라 tartrate resistant acid phosphatase (TRAP) 염색을 실시하였다. 부검시 동물의 후대정맥에서 혈액을 채취하고 혈청을 분리하였으며, alkaline phosphatase (ALP)는 혈액생화학분석기(FDC 3500s, Fuji film, Japan)를 사용하여 분석하였고, 혈청내 E2의 양은 방사면역측정키트(Estradiol Coat-A-count, Diagnostic Products Corp., Los Angeles, CA, USA) 및 감마카운터(EG&G, Wallace, Finland)를 사용하여 분석하였다.
미세 전산화 단층 촬영술(microcomputed tomogrphy, μCT)
시료의 단층 영상은 μCT (Skyscan 1172; Skyscan, Kontich, Belgium)를 이용하여 다음과 같은 조건하에 채득하였다. 원추형 빔(cone beam) 방식의 x-ray source를 이용하여 50 κV, 200 μA 하에서 시료에 방사선을 조사 하였고, 이때 해상도(spatial resolution)는 17 μm로 조절하였다. 시료를 0.4도씩 회전시키면서 매회 1.2초간 방사선을 조사하였으며, 촬영은 포커스 스폿(focus spot)에서 방사된 빔이 시료 를 투과하여 charge-coupled devices (CCD) 카메라에 영상이 맺히는 원리를 이용하였다. 채득된 영상은 NRecon 소프트웨어(Skyscan, Kontich, Belgium)를 이용하여 150개의 2차원 횡단면으로 재구성되었고, 각 단면간의 거리는 80 μm로 설정하였다. 경골의 미세구조는 2차원적으로 채득된 영상의 뼈 영역만을 적용하여 CTan 소프트웨어(Skyscan, Kontich, Belgium)로 분석하였다. 해면뼈의 분석은 성장판 아래에서 1.5 mm를 측정 대상으로 하였다. 재구성된 2차원 이미지로부터 치밀뼈(cortical bone)와 해면뼈를 구분하여 관심영역(region of interest, ROI)을 설정한 후, 각 부분의 bone volume / tissue volume (BV/TV), trabecular thickness (Tb.Th), trabecular separation (Tb.Sp), trabecular number (Tb.N) 등의 양적 분석과 structure model index (SMI), trabecular bone pattern factor (Tb.Pf), degree of anisotropy (DA) 등의 구조적 파라미터(structural parameters) 값을 측정하였다. 해면뼈의 ROI의 설정은 해면뼈의 일부를 포함하는 원형 ROI를 설정하여 성적을 비교하였다. 골밀도(bone mineral density, BMD)는 0.25와 0.75 g/cm2의 hydroxyapatite standard phantom에 대한 Hounsfield unit (HU) 값을 얻은 후, 측정하고자 하는 시료편의 HU 값을 계산식에 대응시켜 구하였다. 치밀뼈는 해면뼈 소실 부위 아래부터 1.0 mm 를 측정대상으로 하였으며, bone volume (BV), percent porosity (Po), polar moment of inertia (pMOI) 등의 값을 측정하였다.
통계 처리
모든 실험에서 얻어진 자료는 one-way ANOVA (the post-hoc Student-Newman-Keuls)의 방법으로 유의성 검사하고, 그들의 수치는 평균 표준편차 means ± S.D.의 값으로 나타냈다. 또한 유의성은 P 값이 0.05보다 작을 때 그 값을 유의성 있는 값으로 정하였다.
Results
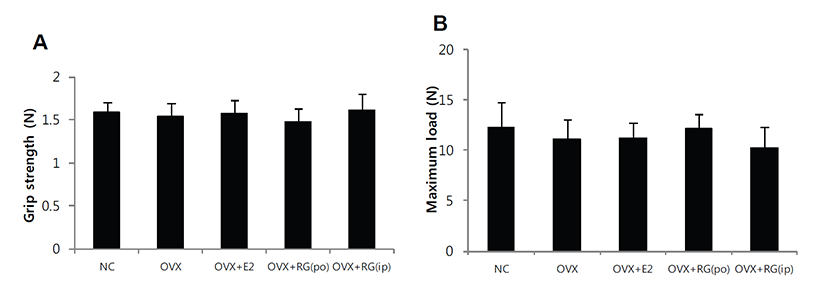
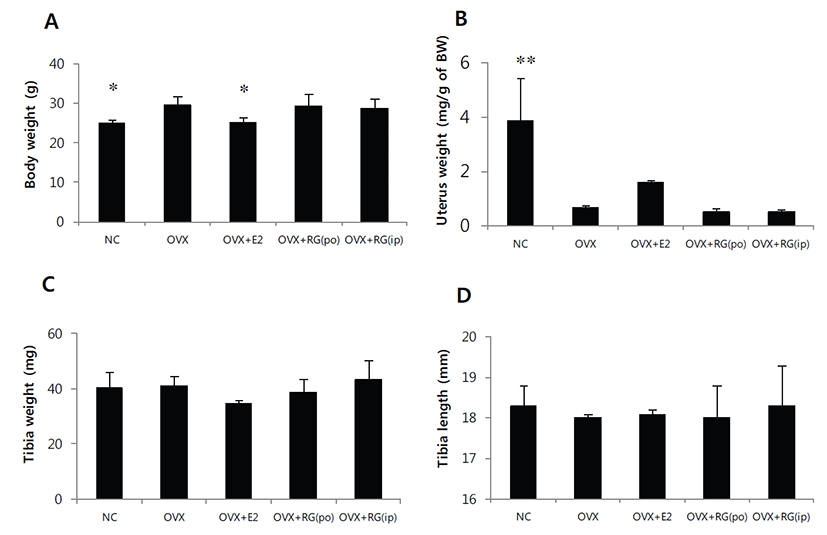
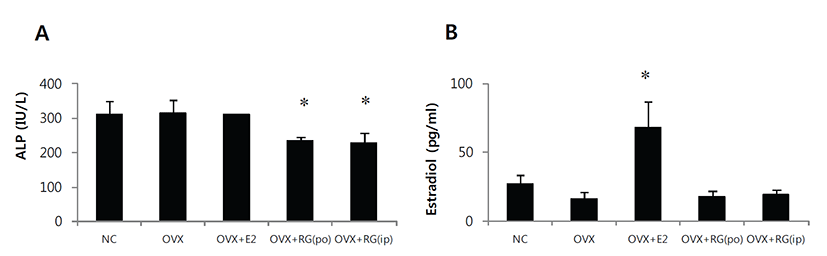
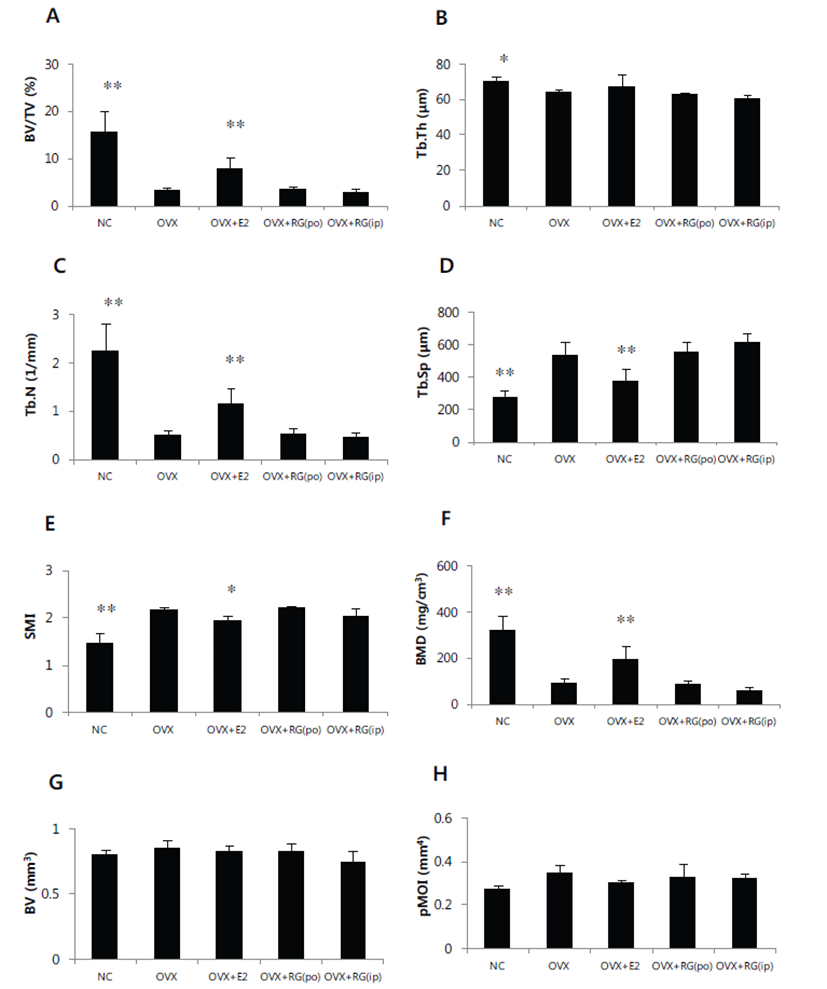
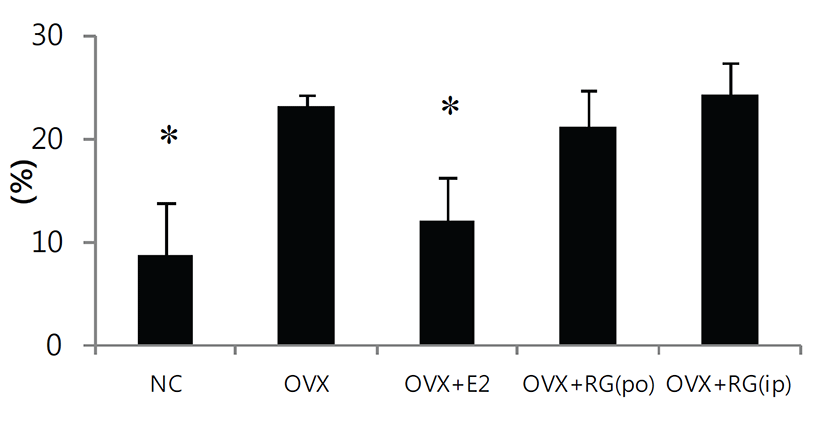
악력측정에서 정상대조군의 악력강도는 1.59 N이었으며, 모든 실험군간의 유의성있는 차이는 없었다. 경골의 삼중점 굴곡시험에서 정상대조군의 굴절강도는 12.3 N이었으며 모든 실험군간의 유의성 있는 차이는 없었다(Fig. 1). 체중은 정상대조군에 비해 난소절제군에서 증가하였으며 E2투여군에서 감소하였고 홍삼투여군에서는 난소절제군에 비해 차이는 없었다. 자궁의 무게는 난소절제군에서 급격한 감소를 보였으며 E2 투여군에서는 난소절제 대조군에 비해 다소 증가하였고, 홍삼투여에 의한 변화는 없었다. 경골의 무게 및 길이에서 의미 있는 변화는 없었다(Fig. 2). 혈청내 ALP의 양은 홍삼투여군에서 감소하였으며, E2의 양은 E2투여군에서 증가하였으나 홍삼투여에 의한 변화는 없었다(Fig. 3). 경골의 해면뼈 변화 관찰에서 정상대조군에 비해 난소절제 후 모든 관찰 지표에서 유의성 있는 뼈소실의 변화를 보였다. BV/TV는 난소절제에 따라 평균치를 기준으로 79.3% 감소하였으며, BMD는 72.0% 감소하였고, E2투여에 의해 난소절제 대조군 에 비해 각각 2.43배 및 2.19배 개선되었다(Figs. 4A&4F). 치밀뼈의 변화는 없었다(Figs. 4G&4H). 홍삼투여에 의한 변화는 모든 관찰 지표에서 관찰되지 않았다(Fig. 4). TRAP 염색 후 해면뼈에서 뼈표면당 TRAP 양성 면적의 변화관찰에서도 난소절제에 따라 증가하였으며 E2투여로 완화되었으나 홍삼투여에 의한 변화는 관찰되지 않았다(Fig. 5).
Fig. 1.
Effect of red ginseng (RG) on grip strength (A) and mechanical property (B) in OVX mice. They were treated with vehicle, E2 (0.03 μg/head/day, s.c.) or RG (250 mg/kg/day, p.o., or 50 mg/kg/every other day, i.p.) for 6 weeks. Data are expressed as means ± S.D. (n=6).
Download Original Figure
Fig. 2.
Effect of red ginseng (RG) on body weight (A), uterus weight (B), tibia weight (C) and tibia length (D) in OVX mice. They were treated with vehicle, E2 (0.03 μg/head/day, s.c.) or RG (250 mg/kg/day, p.o., or 50 mg/kg/every other day, i.p.) for 6 weeks. Data are expressed as means ± S.D. (n=6). *P<0.05, **P<0.01 vs OVX group at corresponding parameters.
Download Original Figure
Fig. 3.
Effect of red ginseng (RG) on serum alkaline phosphatase (ALP) and estradiol in OVX mice. They were treated with vehicle, E2 (0.03 μg/head/day, s.c.) or RG (250 mg/kg/day, p.o., or 50 mg/kg/every other day, i.p.) for 6 weeks. Data are expressed as means ± S.D. (n=6). *P<0.01 vs OVX group at corresponding parameters.
Download Original Figure
Fig. 4.
Effect of red ginseng (RG) on trabecular (A-F) and cortical (G, H) bone properties of tibia in OVX mice. They were treated with vehicle, E2 (0.03 μg/head/day, s.c.) or RG (250 mg/kg/day, p.o., or 50 mg/kg/every other day, i.p.) for 6 weeks. BV/TV: bone volume density (A); Tb.Th: trabecular thickness (B); Tb.N: trabecular number (C); Tb.Sp: trabecular separation (D); SMI: structure model index (E); BMD: trabecular volumetric mineral density (F); BV: cortical bone volume (G); pMOI: cortical polar moment of inertia (H). Data are expressed as means ± S.D. (n=6). *P<0.05, **P<0.01 vs OVX group at corresponding parameters.
Download Original Figure
Fig. 5.
Effect of red ginseng (RG) on osteoclast surface in OVX mice. They were treated with vehicle, E2 (0.03 μg/head/day, s.c.) or RG (250 mg/kg/day, p.o., or 50 mg/kg/every other day, i.p.) for 6 weeks. Data are expressed as means ± S.D. (n=6). *P<0.01 vs OVX group at corresponding parameters.
Download Original Figure
Discussion
방매일 체중 kg당 1,700 mg을 8주간 경구투여한 보고에서 인삼은 난소 절제 랫드에서 척추, 비골 및 경골의 골밀도 증가, 골조직의 칼슘 함량, 일부 효소의 변화 등에서 골소실 억제 효과가 인정되었으나 자궁의 무게, 일부 골관련 혈청 생화학 지표에서 유의한 변화가 없다고 하였으며[13], 홍삼사포닌의 뼈모세포에 미치는 영향에 관한 시험관내 연구에서 fetal bovine serum 결핍 배양액내의 뼈모세포의 분화 및 골형성은 증가시키는 효과가 보고되었다[14]. 난소 절제 동물에서 인삼 함유 추출물(4가지 천연물 혼합제에 인삼 포함)의 효과 평가는 골조직의 넓이, 수에서 증가의 효과를 보였으나, 효소 지표에서는 변화가 없었으며 혈청 E2의 수준은 증가되었다고 보고하였다[16]. 인삼이 식물에스트로겐의 작용을 보인다고 하였으며, ginsenoside Rg1 및 Re가 이에 해당됨이 보고되었고 E2 유사 효과 발현의 가능성을 제시하였으며[20, 21], 매일 체중 kg당 10~30 mg의 ginsenoside 투여가 난소 절제 동물에서 골밀도 를 증가시켰으며, 시험관내 배양에서Rg1이 골모세포의 수를 증가시켜 E2와 같은 항골다공증 효과를 보였다고 하였다[17]. 이와 반대로 E2와 체중 kg당 100 mg의 ginsenoside를 10주간 병행 경구투여 시 골다공증 예방효과를 보이지만, 각각 적용 시 효과가 없으며[18], 골다공증 환자를 대상으로 한 임상연구에서 골조직의 형태, 골밀도, 골관련 효소 등에서 차이가 없어 골다공증에 대한 홍삼의 확실한 효과를 규명할 수 없었다고 결론지었고[15], 이 외 폐경 관련 장애에서 인삼의 적용은 신중한 접근이 필요하다는 고찰도 있었다[22].
본 연구에서 μCT 촬영분석 결과, 해면뼈의 소실 지표에서 공히 홍삼투여 효과가 없었으며 BMD도 차이가 없었다. 뼈모세포의 활성도를 나타내는 혈중 ALP 수치도 증가의 변화가 없어 기존 연구 보고에서 골다공증 환자를 대상으로 한 연 구의 결과와 유사하였다[15]. 홍삼투여군에서 자궁의 무게 및 E2의 혈중농도변화가 관찰되지 않아 홍삼의 식물에스트로겐 작용은 인정되지 않았다. 난소 절제 동물에서 E2의 결핍은 뼈파괴세포의 활성을 촉진하여 골다공증을 유발한다[2]. 본 연구에서 뼈파괴세포의 활성을 관찰한 바 TRAP 활성도에서도 홍삼투여군에서 변화가 관찰되지 않아 뼈파괴세포의 활성 억제효과도 인정되지 않았다. 이상의 결과에서 홍삼의 투여는 호르몬성 골소실에 효과가 관찰되지 않았으며 이는 골다공증에 대한 홍삼의 확실한 효과를 규명할 수 없었다는 보고[15]와 유사하였다.
일부 인체 역학연구에서 악력이 골질의 변화와 상관관계를 나타낸다는 보고[23]에 따라 본 연구에서 적용한 바 실험군간에 차이가 인정되지 않아 동물실험에서의 지표로는 부적절하다고 판단되며, 물리적 강도 측정법도 차이가 없어, 치밀뼈에서의 차이가 인정되지 않은 결과와 같은 경향이었다.
결론적으로 난소 절제 마우스에서 홍삼의 골소실 억제 효과는 본 연구에서 적용된 실험기간 및 투여용량에서는 관찰되지 않았다. 홍삼의 호르몬성 골소실에 대한 효과 평가는 다양한 적용용량, 관찰시기 및 기전적 탐색 등의 추가 연구가 필요하다고 생각된다.
Acknowledgements
이 논문은 2012년도 전남대학교 학술연구비 지원에 의하여 연구되었으며, 동물실험은 전남대학교 동물의학연구소의 협조를 받았고 이에 감사드린다.
REFERENCES
Osteoporosis prevention, diagnosis, and therapy. JAMA. 2001; 285 p. 785-795.

Jilka RL, Hangoc G, Girasole G, Passeri G, Williams DC, Abrams JS, Boyce B, Broxmeyer H, Manolagas SC. Increased osteoclast development after estrogen loss: mediation by interleukin-6. Science. 1992; 257 p. 88-91.

Blake GM, Fogelman I. Bone densitometry and the diagnosis of osteoporosis. Semin Nucl Med. 2001; 31 p. 69-81.

Camozzi V, Tossi A, Simoni E, Pagani F, Francucci CM, Moro L. Role of biochemical markers of bone remodeling in clinical practice. J Endocrinol Invest. 2007; 30 p. 13-17.

Inada M, Matsumoto C, Miyaura C. Animal models for bone and joint disease. Ovariectomized and orchidectomized animals. Clin Calcium. 2011; 21 p. 164-170.

Chen H, Zhou X, Emura S, Shoumura S. Site-specific bone loss in senescence-accelerated mouse (SAMP6): a murine model for senile osteoporosis. Exp Gerontol. 2009; 44 p. 792-798.

Tang BM, Eslick GD, Nowson C, Smith C, Bensoussan A. Use of calcium or calcium in combination with vitamin D supplementation to prevent fractures and bone loss in people aged 50 years and older: a meta-analysis. Lancet. 2007; 370 p. 657-666.

Cauley JA, Robbins J, Chen Z, Cummings SR, Jackson RD, LaCroix AZ, LeBoff M, Lewis CE, McGowan J, Neuner J, Pettinger M, Stefanick ML, Wactawski-Wende J, Watts NB. Women's Health Initiative I. Effects of estrogen plus progestin on risk of fracture and bone mineral density: the Women's Health Initiative randomized trial. JAMA. 2003; 290 p. 1729-1738.

Chesnut CH, Silverman S, Andriano K, Genant H, Gimona A, Harris S, Kiel D, LeBoff M, Maricic M, Miller P, Moniz C, Peacock M, Richardson P, Watts N, Baylink D. A randomized trial of nasal spray salmon calcitonin in postmenopausal women with established osteoporosis: the prevent recurrence of osteoporotic fractures study. PROOF Study Group. Am J Med. 2000; 109 p. 267-276.

Woo SB, Hellstein JW, Kalmar JR. Systematic review: bisphosphonates and osteonecrosis of the jaws. Ann Intern Med. 2006; 144 p. 753-761.

Neer RM, Arnaud CD, Zanchetta JR, Prince R, Gaich GA, Reginster JY, Hodsman AB, Eriksen EF, Ish-Shalom S, Genant HK, Wang O, Mitlak BH. Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med. 2001; 344 p. 1434-1441.

Marie PJ. Optimizing bone metabolism in osteoporosis: insight into the pharmacologic profile of strontium ranelate. Osteoporos Int. 2003; 14 p. S9-S12.

Jung KY, Seo BI, Lee ES, Byun BH, Shin SS, Park JH. A efficacy of ginseng radix on prevention of osteoporosis in ovariectomized rats. Kor J Herbology. 2004; 19 p. 1-11.

Sung JH, Ryu JD, Kim SS, Kim HW, Han CH, Ko LH, Kim HM, Kim JY. Effect of ginseng saponin on cultured osteoblast. J of Korean Orthop Assoc. 1998; 33 p. 868-876.

Kim NH, Lee HM, Choi CH, Lim SK. Clinical effect of Korean red ginseng on osteoporosis. J Ginseng Res. 1998; 22 p. 114-121.

Kim HR, Cui Y, Hong SJ, Shin SJ, Kim DS, Kim NM, So SH, Lee SK, Kim EC, Chae SW, Chae HJ. Effect of ginseng mixture on osteoporosis in ovariectomized rats. Immunopharmacol Immunotoxicol. 2008; 30 p. 333-345.

Gong YS, Chen J, Zhang QZ, Zhang JT. Effect of 17beta-oestradiol and ginsenoside on osteoporosis in ovariectomised rats. J Asian Nat Prod Res. 2006; 8 p. 649-656.

Cui L, Wu T, Liu XQ, Liu YY, Li QN. Combination of ginsenosides with low dose estrogen showed synergetic effect on ovariectomy induced osteopenia in rats. Yao Xue Xue Bao. 2002; 37 p. 501-505.

Kopp HG, Hooper AT, Shmelkov SV, Rafii S. Beta-galactosidase staining on bone marrow. The osteoclast pitfall. Histol Histopathol. 2007; 22 p. 971-976.

Nakaya Y, Mawatari K, Takahashi A, Harada N, Hata A, Yasui S. The phytoestrogen ginsensoside Re activates potassium channels of vascular smooth muscle cells through PI3K/Akt and nitric oxide pathways. J Med Invest. 2007; 54 p. 381-384.

Chan RY, Chen WF, Dong A, Guo D, Wong MS. Estrogen-like activity of ginsenoside Rg1 derived from Panax notoginseng. J Clin Endocrinol Metab. 2002; 87 p. 3691-3695.

Lucero MA, McCloskey WW. Alternatives to estrogen for the treatment of hot flashes. Ann Pharmacother. 1997; 31 p. 915-917.

Di Monaco M, Di Monaco R, Manca M, Cavanna A. Handgrip strength is an independent predictor of distal radius bone mineral density in postmenopausal women. Clin Rheumatol. 2000; 19 p. 473-476.